修回日期: 2011-09-15
接受日期: 2011-09-25
在线出版日期: 2011-09-28
目的: 观察靶向作用于Plk1的siRNA对肝癌细胞系BCL-7402细胞中Plk1基因和p53基因表达及细胞凋亡的影响, 探求靶向该基因的治疗在肝癌基因治疗中的可行性及效应.
方法: 设计合成两对靶向作用于Plk1基因的双链siRNA序列, 分别命名为siRNA1和siRNA2, 应用脂质体法将其转入BCL-7402细胞中. 实验分为siRNA1、siRNA2、无关对照及空白对照4组. 通过RT-PCR检测各组细胞中Plk1 mRNA表达的变化; Western blot检测各组细胞中Plk1和P53蛋白表达的变化; 流式细胞仪检测细胞周期及细胞凋亡的改变; 透射电镜观察细胞超微结构的变化.
结果: 转染后24 h和48 h, Plk1 mRNA相对水平siRNA1组分别较无关对照组和空白对照组下降了50%、51%和60%、62%, siRNA2组分别较无关对照组和空白对照组下降了42% 、42%和54%、56%, siRNA1组、siRNA2组的Plk1 mRNA相对水平与无关对照组和空白对照组相比有统计学差异(P<0.01). Plk1蛋白表达的变化趋势与Plk1 mRNA的变化趋势相似, P53蛋白的表达随着Plk1表达的抑制而明显增加(P<0.01). 转染后24 h, 转染组中G2/M期的细胞数量明显增加(P<0.01). 转染后48 h, 转染组中出现大量的凋亡细胞, 透射电镜下可见凋亡早期及晚期形态学改变.
结论: 靶向作用于Plk1的siRNA能够抑制肝癌细胞系BCL-7402细胞中Plk1基因的表达, 同时增加p53基因的表达, 促进转染细胞的凋亡, 提示Plk1基因在对肝癌细胞的细胞周期及凋亡的调控中起重要作用.
引文著录: 孙威, 刘宝林, 陈爱山, 曹献馗, 苏琪. 靶向Plk1的siRNA对肝癌细胞凋亡的影响. 世界华人消化杂志 2011; 19(27): 2822-2828
Revised: September 15, 2011
Accepted: September 25, 2011
Published online: September 28, 2011
AIM: To investigate the effect of small interfering RNA (siRNA)-mediated Polo-like kinase 1 (Plk1) gene silencing on p53 expression and cell apoptosis in human hepatocellular carcinoma cell line BCL-7402, and to explore the feasibility of targeting the human Plk1 gene as a therapeutic strategy for hepatocellular carcinoma.
METHODS: Two siRNA sequences (siRNA1 and siRNA2) targeting the human Plk1 gene were designed and synthesized. BCL-7402 cells were transfected with blank control, negative control, siRNA1 or siRNA2 via lipofection. After transfection, reverse transcription-polymerase chain reaction (RT- PCR) was used to examine the expression of Plk1 mRNA , and Western blot was used to examine the expression of Plk1 and P53 proteins in transfected BCL-7402 cells. Cell cycle distribution and apoptosis of transfected cells were monitored by flow cytometry (FCM). The ultrastructural changes of transfected BCL-7402 cells were observed by transmission electron microscopy (TEM).
RESULTS: BCL-7402 cells transfected with low doses of siRNAs targeting the Plk1 gene showed greatly decreased levels of Plk1 mRNA and protein. In the siRNA1 group, Plk1 mRNA expression was reduced by 51% and 62% and Plk1 protein expression by 65% and 81% 24 and 48 h after transfection (all P < 0.01). In the siRNA2 group, Plk1 mRNA expression was reduced by 42% and 56% and Plk1 protein expression by 51% and 65% 24 and 48 h after transfection (all P < 0.01). P53 protein levels increased obviously with the decrease in Plk1 protein levels (P < 0.01). The percentage of cells at G2/M phase increased obviously 24 h after transfection (P < 0.01). Apoptosis rate increased remarkably and apoptotic phenotypes could be seen by TEM. in cells 48 h after transfection.
CONCLUSION: SiRNAs targeting the human Plk1 gene remarkably inhibited Plk1 expression, increased p53 gene expression, and promoted apoptosis, suggesting that the Plk1 gene plays important roles in cell cycle control and apoptosis of BCL-7402 cells.
- Citation: Sun W, Liu BL, Chen AS, Cao XK, Su Q. Small interfering RNA-mediated knockdown of polo-like kinase 1 promotes apoptosis in human hepatocellular carcinoma cell line BCL-7402. Shijie Huaren Xiaohua Zazhi 2011; 19(27): 2822-2828
- URL: https://www.wjgnet.com/1009-3079/full/v19/i27/2822.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i27.2822
肿瘤的形成是一个多基因参与的多步骤的过程, 包括多种肿瘤抑制基因的丢失及致癌基因的活化. 虽然人类不同肿瘤形成过程中基因损伤积累的方式不同, 但所有的肿瘤细胞均存在细胞增殖的失调控及凋亡障碍.
细胞分裂的过程受多种信号途径的促进与调控以保证基因的稳定, 在调控这些过程的调节酶类中, Plks(Polo-like kinases)被认为是最重要的. Plk1(Polo- like kinase 1)是哺乳动物Plks家族中最具特征性的成员, 强烈促进细胞有丝分裂过程, 是多个细胞周期相关事件的重要调节因子. Plk1通过对Cdc25C和cyclin B1的磷酸化促进G2/M期中心体的成熟[1]、纺锤体两极的形成[2]、染色体分离[3]、细胞成熟促进因子(maturation promoting factor, MPF)的激活、后期促进复合物(anaphase promoting compound, APC)的调节及胞质分裂的完成[4,5]. Plk1表达升高有助于肿瘤细胞逃脱检测点的监控, 从而有利于肿瘤形成[6,7]. 先前的研究中我们已经证实在人类肝细胞肝癌组织中存在Plk1基因的过表达, 为了进一步明确Plk1在肝癌细胞分裂增殖中的作用, 探求靶向该基因的治疗在肝癌基因治疗中的可行性及效应, 本研究利用小干扰RNA(small interfering RNA, siRNA)技术抑制Plk1基因的表达, 然后分析其对Plk1基因、p53基因、肝癌细胞周期及细胞凋亡的影响, 并对其机制作初步探讨.
肝癌细胞系BCL-7402为我校细胞生物教研室保存. RPIM-1640培养基为Gibco公司产品; 胎牛血清为Hyclone公司产品; 抗Plk1多克隆抗体为德国Merck公司产品; 抗P53多克隆抗体为Santa Cruz公司产品; TRIzal及LipofectamineTM 2 000为Invitrogen公司产品; RT-PCR试剂盒为Takala公司产品; 碘化丙啶(propidium iodide, PI)单染试剂盒及Annexin Ⅴ-FITC双染试剂盒为晶美生物公司产品.
1.2.1 靶向Plk1的siRNA的设计: 根据已发表的序列(NM 005030)及Plk1 mRNA的二级结构应用Prame Primer软件设计两对双链siRNA寡核苷酸序列, 分别命名为siRNA1和siRNA2. 其中siRNA1(作用位点1470-1490)上游引物: 5'- UGA AGA AGA UCA CCC UCC UdTdT- 3', 下游引物: 5'- AGG AGG GUG AUC UUC UUC AdTdT-3'; siRNA2(作用位点554-574), 上游引物: 5'- GCA CCG AAA CCG AGU UAU UdTdT-3', 下游引物: 5'- AAT AAC TCG GTT TCG GTG CdTdT-3'. 通过转染GFP质粒观察转染效率; 无关对照选择普适型无关对照siRNA, 命名为siRNA NC, 上游引物: 5'- UUC UCC GAA CGU GUC ACG UTT-3', 下游引物: 5'- ACG UGA CAC GUU CGG AGA ATT-3'. 以上双链siRNA寡核苷酸序列均由上海吉玛公司合成.
1.2.2 细胞培养和基因转染: 肝癌细胞系BCL-7402细胞生长于含10%胎牛血清的RPMI 1 640培养液(不加青霉素及链霉素), 置于50 mL/L CO2、饱和湿度、37 ℃培养箱中培养. 应用LipofectamineTM 2 000进行转染, 按厂家说明书操作. 细胞分为4组: 转染siRNA1的BCL-7402细胞为siRNA1组; 转染siRNA2的BCL-7402细胞为siRNA2组; 转染siRNA NC的BCL-7402细胞为无关对照组; 空白对照组加入与实验组等体积的DEPC水及LipofectamineTM 2000. 25 cm2培养瓶中按1×106/瓶的密度接种细胞, 培养24 h后用不含血清的RPMI 1640培养液清洗3次, 加入siRNA1、siRNA2及siRNA NC(终浓度均为50 nmol/L)进行转染. 6 h后倒掉转染培养液, 重新清洗细胞, 换以新鲜含10%胎牛血清的RPMI 1640培养液, 继续培养24 h和48 h后提取蛋白. 同时以相同方法转染GFP质粒, 36 h后倒置荧光显微镜下观察转染效率. 6孔板中按5×105/孔的密度接种细胞, 培养24 h后用不含血清的RPMI 1640培养液清洗3次, 加入siRNA1、siRNA2及siRNA NC(终浓度均为50 nmol/L)进行转染. 6 h后倒掉转染培养液, 重新清洗细胞, 换以新鲜含10%胎牛血清的RPMI 1640培养液, 继续培养24 h和48 h后提取细胞总RNA.
1.2.3 Western blot: 细胞用预冷PBS洗2遍, 离心保留细胞沉淀. 加入蛋白裂解液, 超声充分裂解后离心取上清, 蛋白定量. 取等量蛋白50 μg, 上样于10%聚丙烯酰胺凝胶, 再转移至硝酸纤维素膜上; 膜于含5%脱脂奶粉的TBST(50 mmol/L Tris-HCl, pH 7.6, 150 mmol/L NaCl, 0.1% Tween 20)中室温下封闭1 h, 分别加以封闭液稀释的抗Plk1多克隆抗体(1∶400)、抗P53抗体(1∶400)及抗β-actin抗体(1∶400), 4 ℃放置过夜; 次日用TBST洗膜3×15 min, 加封闭液稀释的HRP标记二抗(1∶5 000), 室温下1 h, TBST洗膜3×15 min, 加ECL试剂, X光胶片曝光, 洗片.
1.2.4 RT-PCR: 用TRIzol提取细胞总RNA, 按试剂盒内厂家说明书进行逆转录. 再取等体积RT产物进行PCR. Plk1引物序列: 上游引物5'-CTG CCT GCA TCC CCA TCT TC-3'; 下游引物5'-CAC CAT AGT GCG GGC GTA GC-3', 产物长度为554 bp. 扩增条件: 94 ℃ 40 s, 60 ℃ 40 s, 72 ℃ 60 s, 32个循环. 以β-actin为内参, 引物序列: 上游引物5'- GAG AAG AGC TAC GAG CTG CCT GA-3'; 下游引物5'- ATC TTC ATT GTG CTG GGT GCC-3', 产物长度为272 bp. 扩增条件: 94 ℃ 40 s, 57 ℃ 40 s, 72 ℃ 60 s, 32个循环. 产物在2%琼脂糖凝胶上分离, EB显色, 应用Scion Image软件完成定量分析.
1.2.5 流式细胞术: 6孔板中按5×105/孔的密度接种细胞, 培养24 h后加入siRNA1、siRNA NC(终浓度均为50 nmol/L)进行转染. 6 h后倒掉转染培养液, 换以新鲜含10%胎牛血清的RPMI 1640培养液, 继续培养24 h和48 h后收集细胞, 750 mL/L乙醇-20 ℃固定过夜. 次日离心收集细胞, 弃乙醇, 4 ℃预冷的PBS洗2遍, 加入0.5 mL PBS重悬, 再加入0.5 mL配制好的PI溶液, 4 ℃避光孵育30 min, 上机检测细胞周期. 离心收集转染后的BCL-7402细胞, 4 ℃预冷的PBS洗2遍, 用结合缓冲液重新悬浮细胞, 调节其浓度为1×106/mL, 取100 μL的细胞悬液, 加入5 μL Annexin Ⅴ-FITC和10 μL 20 μg/mL的PI溶液, 混匀后室温避光孵育15 min, 再加入400 μL PBS, 流式细胞仪分析细胞凋亡率.
1.2.6 透射电镜标本的制备: 收集转染后的BCL-7402细胞, 4 ℃预冷的PBS洗2遍, 离心去上清液, 加入2.5%戊二醛固定2 h. PBS漂洗, 1%锇酸后固定1 h, 常规酒精脱水, Epon812浸透包埋后制成70 nm厚度的超薄切片, 醋酸铀、柠檬酸铅染色, JEM-1200EX镜下观察.
统计学处理 所有的实验均重复3次, 所有数据均以mean±SD表示. 所得数据应用SPSS11.5软件采取单因素方差分析、卡方检验进行统计分析. 以P<0.05为有统计学差异.
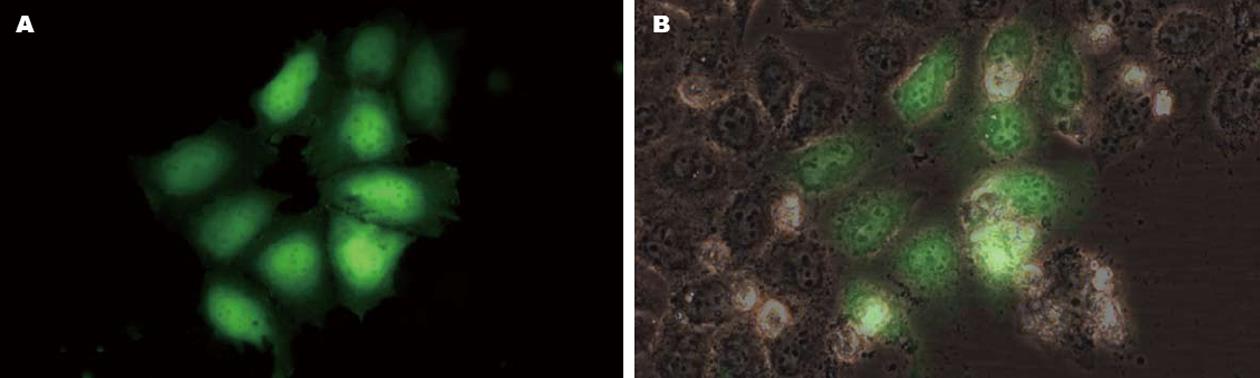
转染GFP质粒的阳性对照组细胞转染36 h后在倒置荧光显微镜下观察, 可见约25%-30%肝癌细胞内出现绿色荧光染色(图1). 因瞬时转染siRNA核苷酸片段的效率会远高于质粒转染效率, 间接表明应用以上转染方法可以获得较高的转染效率.
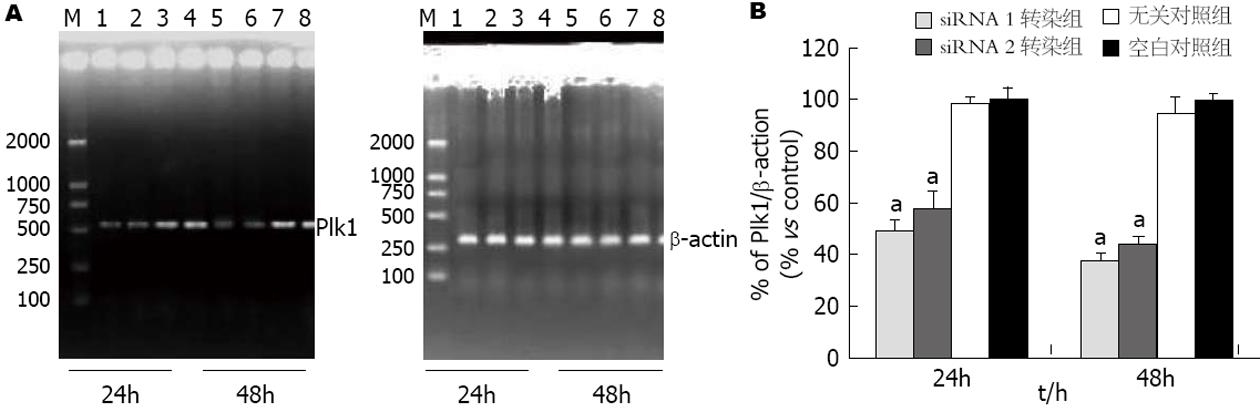
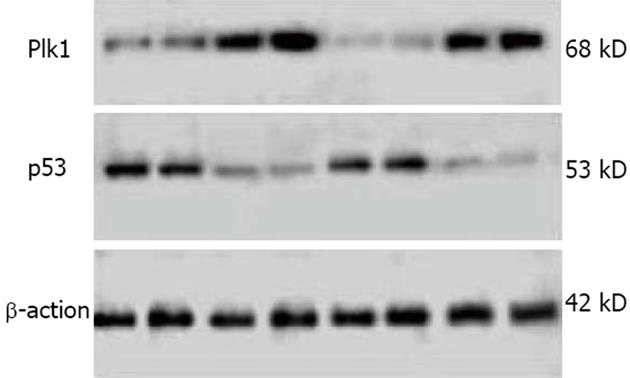
mRNA及蛋白和P53蛋白表达的影响 转染靶向作用于Plk1基因的siRNA后, Plk1 mRNA及蛋白质水平明显下降. RT-PCR 结果显示, 在转染24 h和48 h后, 平均Plk1 mRNA水平siRNA1组分别较无关对照组和空白对照组下降了50%、51%和60%、62%, siRNA2组分别较无关对照组和空白对照组下降了42% 、42%和54%、56%(图2). Plk1 mRNA的表达在siRNA1组、siRNA2组与无关对照组和空白对照组相比有显著性统计学差异(P<0.01), 无关对照组与空白对照组相比无统计学差异. Western blot结果显示, 在转染24 h及48 h后, 平均Plk1蛋白水平siRNA1组分别较无关对照组和空白对照组下降了64%、65%和78% 、81%, siRNA2组分别较无关对照组和空白对照组下降了50% 、51%和60%、65%. Plk1蛋白的表达在siRNA1组、siRNA2组与无关对照组和空白对照组相比有显著性统计学差异(P<0.01), 无关对照组与空白对照组之间无统计学差异. 提示Plk1的表达得到较有效的抑制. 而转染24 h及48 h后, 平均P53蛋白水平在siRNA1组、siRNA2 组较无关对照组和空白对照组明显增加(图3). P53蛋白的表达在siRNA1组、siRNA2组与无关对照组和空白对照组相比同样有统计学差异(P<0.01), 无关对照组与空白对照组相比无统计学差异.
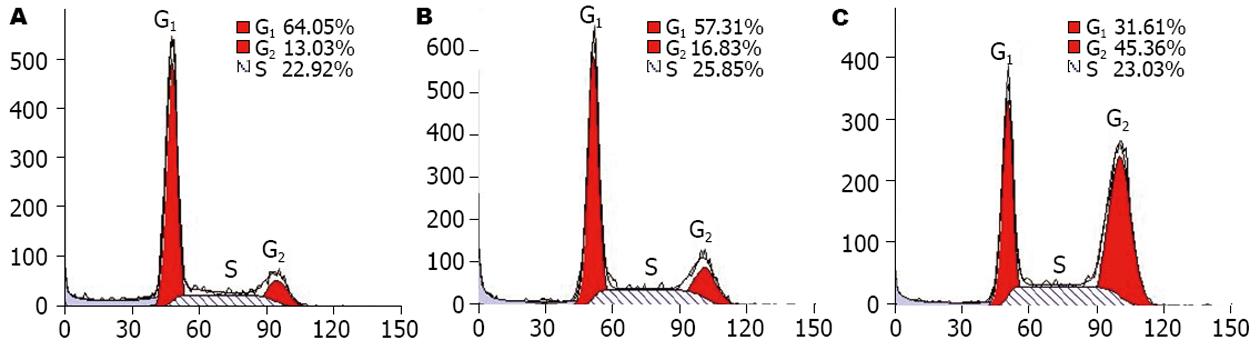
PI染色后流式细胞仪分析显示, 转染siRNA1 24 h后, BCL-7402细胞周期已出现明显改变, G2/M期细胞数量明显增加(由13.03%增至45.36%), G1期细胞数量减少(由64.05%减至31.61%), S期细胞数量无明显变化, 转染组G2/M期细胞百分率与无关对照组及空白对照组相比有显著性统计学差异(P<0.01)(图4).
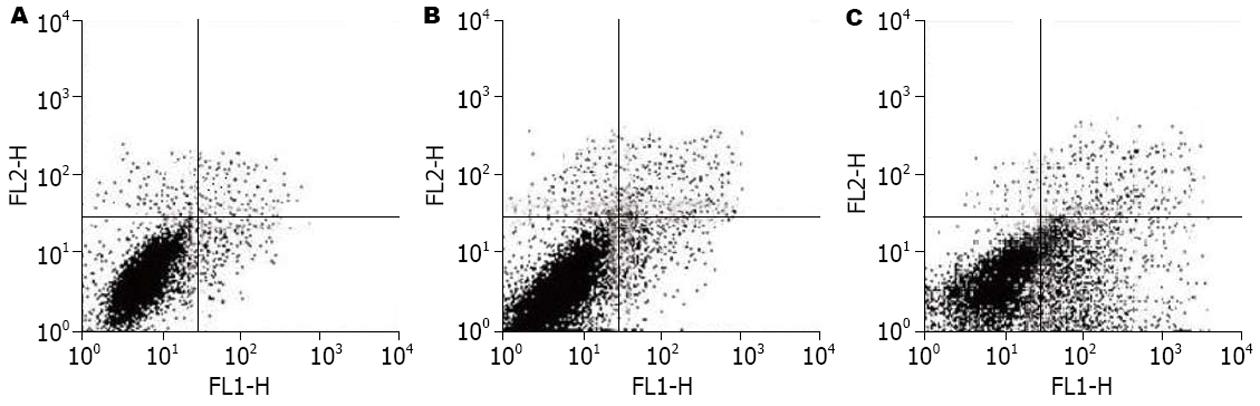
Annexin Ⅴ-FITC、PI双染显示, 转染siRNA1 24 h后凋亡细胞的百分率与空白对照组相比无统计学差异, 而转染48 h后则出现凋亡细胞的明显增多, 与无关对照组、空白对照组相比有显著性统计学差异(P<0.01)(图5)(表1).
| 分组 | 凋亡率(%) | |
| 转染24 h后 | 转染48 h后 | |
| 空白对照组 | 1.7 | 2.1 |
| 无关对照组 | 1.9 | 3.1 |
| siRNA1转染组 | 2.9 | 24.9a |
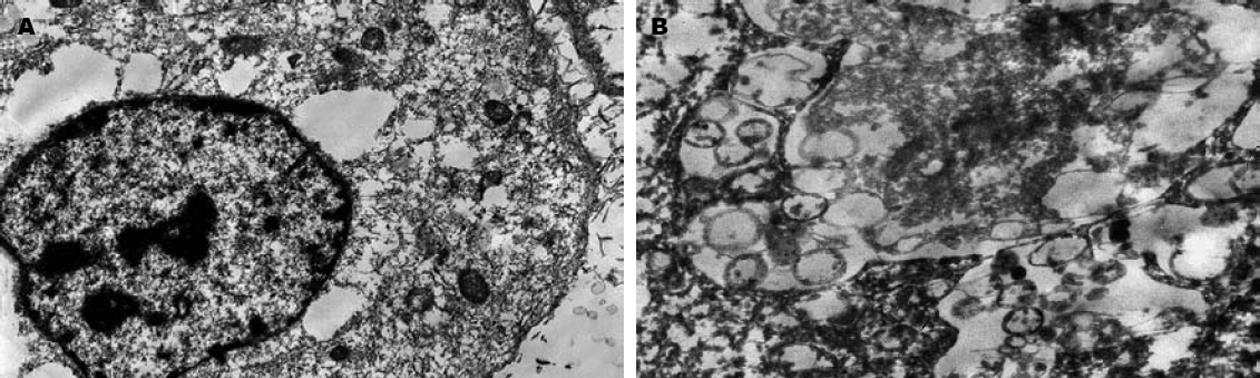
转染siRNA1 48 h后可见BCL-7402细胞表面出现绒毛样突起、细胞核畸形、核内异染色质凝聚并有部分边集等细胞凋亡早期形态学改变, 也可见到典型的细胞凋亡晚期形态学改变-凋亡小体(图6).
Plk1属于有丝分裂的丝氨酸/苏氨酸激酶家族, 在真核生物中具有高度保守性. Plk1的表达及活性在G0、G1及S期很低, G2期开始升高, 至M期达高峰, 在此期间参与多个有丝分裂过程的调控[8-10]. 已有研究表明, 在人类多种肿瘤中存在着PlK1的过表达. 目前已知非小细胞肺癌[11]、食管癌[12]、乳腺癌[13]、直肠癌[14]、胰腺癌[15]、甲状腺癌[16]、鼻咽癌[17]、子宫颈癌[18]、肝转移癌[4]、前列腺癌[19]等人类肿瘤中存在Plk1的过表达, 且与患者的预后密切相关, 显示了Plk1基因具有显著的癌基因的特征. 我们在先前的研究中发现, 在人类肝细胞肝癌组织中及细胞系细胞中存在着Plk1基因的过表达, 而正常肝脏组织中无明显表达, 提示PlK1基因的过表达可能与肝癌形成有关.
在本实验中, 我们应用靶向作用于Plk1基因的siRNA转染肝癌细胞系BCL- 7402细胞. RT-PCR的结果显示, 转染24 h后, Plk1 mRNA的表达明显下降, 转染48 h后, Plk1 mRNA表达的下降更为显著; 而Western blot的结果显示, Plk1蛋白水平在转染48 h后才出现明显下降, 这可能是与BCL-7402细胞中Plk1蛋白的表达量高及自身半衰期长短有关. 超过50%的人类癌症中包含编码p53基因的突变, 他是一个具有良好特征的肿瘤抑制基因[20,21]. Ando等[22]人的研究证实, 在哺乳动物培养细胞中Plk1实际上物理性的结合于肿瘤抑制基因P53的蛋白结合区域. 他们将外源性Plk1和P53导入P53缺失的肺癌H1299细胞中明显的降低P53与其顺式作用元件如p21WAF1、MDM2和BAX启动子区域的P53结合位点的结合, 从而抑制这些基因的表达; 然而激酶缺失的Plk1突变型失去降低P53转录活性的能力. Liu和Erikson[23]的研究中也证实的在Plk1缺失的细胞中P53的活性明显稳定, 提示Plk1与p53基因稳定性的调控从而调控其活性密切相关. 在本实验中我们发现, 随着Plk1基因表达的降低, p53基因的表达明显增高, 这与先前几项的研究结果相一致, 支持P53是Plk1其中一个关键的靶基因的论断. 最近的一项研究显示, 应用siRNA造成Plk1的缺失优先诱导P53缺失细胞系的细胞存活率的降低, 长期生存率的研究揭示P53促进Plk1缺失细胞的存活. 因此认为对Plk1的短期抑制可以杀伤肿瘤细胞同时允许正常细胞的存活[24-26]. Plk1介导的对P53的负性调节作用可能是Plk1在肿瘤形成中作用的根本的机制.
我们还应用流式细胞仪观察了抑制Plk1基因表达对肝癌细胞系BCL-7402细胞周期及凋亡的影响. 结果显示转染siRNA1仅24 h后, BCL-7402细胞周期已出现明显改变, G2期细胞明显增多, G1期细胞减少, S期细胞无变化, 但无明显的细胞凋亡出现; 转染48 h后则出现大量的凋亡细胞, 透射电镜下可见癌细胞表面出现绒毛样突起、细胞核畸形、核内异染色质凝聚并有部分边集及凋亡小体等细胞凋亡早、晚期形态学改变. Elez等[27]认为这种大量凋亡细胞的出现可能是由于肿瘤细胞失去正常G2/M检查点的调控, 不能长期维系在G2/M期而最终发生凋亡或死亡. 对于抑制Plk1基因表达诱导凋亡的机制, 我们认为可能部分的与Plk1表达抑制后出现的p53基因表达的上调有关. 抑制Plk1基因表达诱导肝癌细胞凋亡的途径有待进一步的研究.
在本实验中, 我们证明了应用靶向作用于Plk1的小干扰RNA抑制Plk1的表达可以促进体外培养肝癌细胞的凋亡. Lane和Nigg[1]的研究证实Plk1抗体的显微注射可诱导HeLa细胞有丝分裂的突变, 而在正常的人二倍体成纤维细胞Hs68中仅诱导细胞周期中G2期的短暂的停止. 这个结果支持抑制Plk1特异地靶向作用于癌细胞, 而无突变的有完整检测点途径的细胞很少受累. 此外, 通过腺病毒载体介导的显性负相Plk1(dnPlk1)的表达诱导到大多数肿瘤细胞的程序性死亡但不诱导正常人类乳腺上皮细胞(HMECs)的凋亡[28]. 应用靶向作用于Plk1的反义寡核苷酸(ASOs)在裸鼠A549异种移植物中显示了抗肿瘤活性, 而对原代细胞的生命力和生长无抑制作用[27,29]. 以上研究结果提示干扰Plk1的表达或功能似乎对肿瘤细胞比正常细胞更有害. 因此, 靶向作用于Plk1的治疗可能成为未来肝细胞肝癌基因治疗的一种重要手段.
细胞分裂的过程受多种信号途径的促进与调控以保证基因的稳定, 在调控这些过程的调节酶类中, Plks被认为是最重要的. Plk1是哺乳动物Plks家族中最具特征性的成员, 强烈促进细胞有丝分裂过程, 是多个细胞周期相关事件的重要调节因子.
范学工, 教授, 中南大学湘雅医院感染病科; 秦建民, 副教授, 上海中医药大学附属普陀医院肝胆外科; 季菊玲, 副教授, 南通大学医学院病理教研室
抑制Plk1基因表达诱导肝癌细胞凋亡的途径有待进一步的研究.
已有研究表明, 在人类多种肿瘤中存在着Plk1的过表达. 目前已知非小细胞肺癌、食管癌、乳腺癌、直肠癌、胰腺癌、甲状腺癌、鼻咽癌、子宫颈癌、肝转移癌、前列腺癌等人类肿瘤中存在Plk1的过表达, 且与患者的预后密切相关.
靶向作用于Plk1的治疗可能成为未来肝细胞肝癌基因治疗的一种重要手段.
本文采用siRNA干扰技术、分子生物学技术、流式细胞术和电镜技术观察抑制Plk1基因功能对肝癌细胞增殖影响, 对于研究Plk1基因在肝癌发生、发展中的生物学作用, 具有重要的理论价值.
编辑: 李军亮 电编:闫晋利
| 1. | Lane HA, Nigg EA. Antibody microinjection reveals an essential role for human polo-like kinase 1 (Plk1) in the functional maturation of mitotic centrosomes. J Cell Biol. 1996;135:1701-1713. [PubMed] [DOI] |
| 2. | Hamanaka R, Smith MR, O'Connor PM, Maloid S, Mihalic K, Spivak JL, Longo DL, Ferris DK. Polo-like kinase is a cell cycle-regulated kinase activated during mitosis. J Biol Chem. 1995;270:21086-21091. [PubMed] [DOI] |
| 3. | Lake RJ, Jelinek WR. Cell cycle- and terminal differentiation-associated regulation of the mouse mRNA encoding a conserved mitotic protein kinase. Mol Cell Biol. 1993;13:7793-7801. [PubMed] |
| 4. | Wang XQ, Zhu YQ, Lui KS, Cai Q, Lu P, Poon RT. Aberrant Polo-like kinase 1-Cdc25A pathway in metastatic hepatocellular carcinoma. Clin Cancer Res. 2008;14:6813-6820. [PubMed] [DOI] |
| 5. | Degenhardt Y, Lampkin T. Targeting Polo-like kinase in cancer therapy. Clin Cancer Res. 2010;16:384-389. [PubMed] [DOI] |
| 6. | Smits VA, Klompmaker R, Arnaud L, Rijksen G, Nigg EA, Medema RH. Polo-like kinase-1 is a target of the DNA damage checkpoint. Nat Cell Biol. 2000;2:672-676. [PubMed] [DOI] |
| 7. | Studach L, Wang WH, Weber G, Tang J, Hullinger RL, Malbrue R, Liu X, Andrisani O. Polo-like kinase 1 activated by the hepatitis B virus X protein attenuates both the DNA damage checkpoint and DNA repair resulting in partial polyploidy. J Biol Chem. 2010;285:30282-30293. [PubMed] [DOI] |
| 8. | Golsteyn RM, Schultz SJ, Bartek J, Ziemiecki A, Ried T, Nigg EA. Cell cycle analysis and chromosomal localization of human Plk1, a putative homologue of the mitotic kinases Drosophila polo and Saccharomyces cerevisiae Cdc5. J Cell Sci. 1994;107:1509-1517. [PubMed] |
| 9. | Barr FA, Silljé HH, Nigg EA. Polo-like kinases and the orchestration of cell division. Nat Rev Mol Cell Biol. 2004;5:429-440. [PubMed] [DOI] |
| 10. | Yim H, Erikson RL. Polo-like kinase 1 depletion induces DNA damage in early S prior to caspase activation. Mol Cell Biol. 2009;29:2609-2621. [PubMed] [DOI] |
| 11. | Zhou Q, Su Y, Bai M. Effect of antisense RNA targeting Polo-like kinase 1 on cell growth in A549 lung cancer cells. J Huazhong Univ Sci Technolog Med Sci. 2008;28:22-26. [PubMed] [DOI] |
| 12. | Feng YB, Lin DC, Shi ZZ, Wang XC, Shen XM, Zhang Y, Du XL, Luo ML, Xu X, Han YL. Overexpression of PLK1 is associated with poor survival by inhibiting apoptosis via enhancement of survivin level in esophageal squamous cell carcinoma. Int J Cancer. 2009;124:578-588. [PubMed] [DOI] |
| 13. | Steinhauser I, Langer K, Strebhardt K, Spänkuch B. Uptake of plasmid-loaded nanoparticles in breast cancer cells and effect on Plk1 expression. J Drug Target. 2009;17:627-637. [PubMed] [DOI] |
| 14. | Rödel F, Keppner S, Capalbo G, Bashary R, Kaufmann M, Rödel C, Strebhardt K, Spänkuch B. Polo-like kinase 1 as predictive marker and therapeutic target for radiotherapy in rectal cancer. Am J Pathol. 2010;177:918-929. [PubMed] [DOI] |
| 15. | Jimeno A, Rubio-Viqueira B, Rajeshkumar NV, Chan A, Solomon A, Hidalgo M. A fine-needle aspirate-based vulnerability assay identifies polo-like kinase 1 as a mediator of gemcitabine resistance in pancreatic cancer. Mol Cancer Ther. 2010;9:311-318. [PubMed] [DOI] |
| 16. | Salvatore G, Nappi TC, Salerno P, Jiang Y, Garbi C, Ugolini C, Miccoli P, Basolo F, Castellone MD, Cirafici AM. A cell proliferation and chromosomal instability signature in anaplastic thyroid carcinoma. Cancer Res. 2007;67:10148-10158. [PubMed] [DOI] |
| 17. | Shi W, Alajez NM, Bastianutto C, Hui AB, Mocanu JD, Ito E, Busson P, Lo KW, Ng R, Waldron J. Significance of Plk1 regulation by miR-100 in human nasopharyngeal cancer. Int J Cancer. 2010;126:2036-2048. [PubMed] |
| 18. | Saxena M, Singh S, Negi MP, Srivastava AK, Trivedi R, Singh U, Pant MC, Bhatt ML. Expression profiling of G/M phase regulatory proteins in normal, premalignant and malignant uterine cervix and their correlation with survival of patients. J Cancer Res Ther. 2010;6:167-171. [PubMed] [DOI] |
| 19. | Reagan-Shaw S, Ahmad N. Polo-like kinase (Plk) 1 as a target for prostate cancer management. IUBMB Life. 2005;57:677-682. [PubMed] [DOI] |
| 20. | Levine AJ. p53, the cellular gatekeeper for growth and division. Cell. 1997;88:323-331. [PubMed] [DOI] |
| 21. | McKenzie L, King S, Marcar L, Nicol S, Dias SS, Schumm K, Robertson P, Bourdon JC, Perkins N, Fuller-Pace F. p53-dependent repression of polo-like kinase-1 (PLK1). Cell Cycle. 2010;9:4200-4212. [PubMed] [DOI] |
| 22. | Ando K, Ozaki T, Yamamoto H, Furuya K, Hosoda M, Hayashi S, Fukuzawa M, Nakagawara A. Polo-like kinase 1 (Plk1) inhibits p53 function by physical interaction and phosphorylation. J Biol Chem. 2004;279:25549-25561. [PubMed] [DOI] |
| 23. | Liu X, Erikson RL. Polo-like kinase (Plk)1 depletion induces apoptosis in cancer cells. Proc Natl Acad Sci U S A. 2003;100:5789-5794. [PubMed] [DOI] |
| 24. | Guan R, Tapang P, Leverson JD, Albert D, Giranda VL, Luo Y. Small interfering RNA-mediated Polo-like kinase 1 depletion preferentially reduces the survival of p53-defective, oncogenic transformed cells and inhibits tumor growth in animals. Cancer Res. 2005;65:2698-2704. [PubMed] [DOI] |
| 25. | Tyagi S, Bhui K, Singh R, Singh M, Raisuddin S, Shukla Y. Polo-like kinase1 (Plk1) knockdown enhances cisplatin chemosensitivity via up-regulation of p73α in p53 mutant human epidermoid squamous carcinoma cells. Biochem Pharmacol. 2010;80:1326-1334. [PubMed] [DOI] |
| 26. | Ashihara E, Kawata E, Maekawa T. Future prospect of RNA interference for cancer therapies. Curr Drug Targets. 2010;11:345-360. [PubMed] [DOI] |
| 27. | Elez R, Piiper A, Giannini CD, Brendel M, Zeuzem S. Polo-like kinase1, a new target for antisense tumor therapy. Biochem Biophys Res Commun. 2000;269:352-356. [PubMed] [DOI] |
| 28. | Cogswell JP, Brown CE, Bisi JE, Neill SD. Dominant-negative polo-like kinase 1 induces mitotic catastrophe independent of cdc25C function. Cell Growth Differ. 2000;11:615-623. [PubMed] |