修回日期: 2011-09-15
接受日期: 2011-09-26
在线出版日期: 2011-09-28
目的: 研究构建靶向ING1基因的miR-622真核表达载体并验证其转染人胃癌细胞株MKN-45细胞后对ING1基因的干扰效果及其功能.
方法: 将外源性重组真核表达载体pSuper/miR-622转染到人胃癌细胞株MKN-45内, 经G418筛选并建立高表达miR-622的稳定转染胃癌细胞株. 稳定表达该miR-622的胃癌细胞为: MKN-45-pSuper/miR-622组, 转染空质粒细胞及未处理细胞为对照组(MKN-45-pSuper 组和MKN-45组), 采用实时荧光定量PCR验证miR-622在稳定转染细胞的表达, 蛋白印迹检测其对ING1基因表达的干扰效果, 通过细胞增殖和周期实验验证miR-622在胃癌细胞MKN-45中的功能.
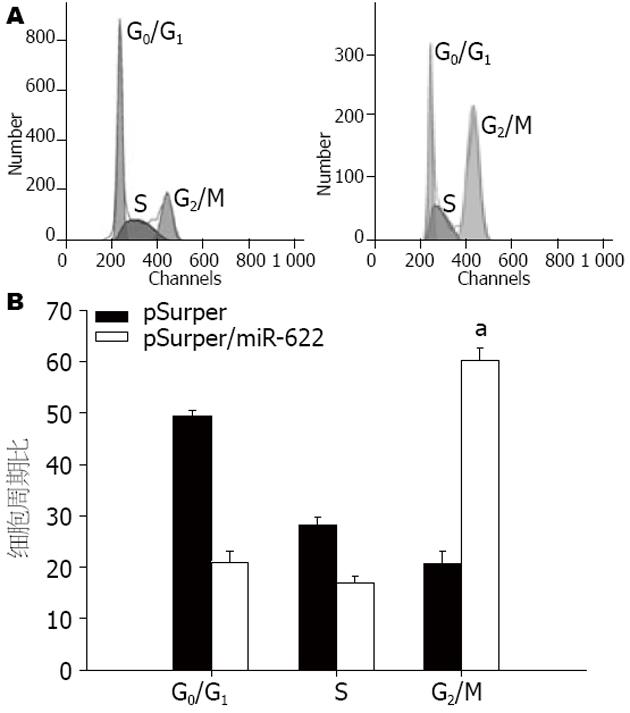
结果: 与pSuper空载体组相比, 转染了pSuper/miR-622高表达质粒的MKN-45细胞中ING1蛋白表达明显减少, 降低了4.63倍(1.83±0.86 vs 8.47±1.43, P<0.05); 与转染pSuper空载体的MKN-45细胞对照组相比, 转染了pSuper/miR-622高表达质粒的MKN-45细胞地促进了胃癌细胞增殖(P<0.05), 而转染了pSuper空载体的MKN-45细胞组与正常组组间无统计学意义(P>0.05). pSuper/miR-622组在胃癌细胞G0/ G1期为21.45±0.16而pSuper空载体组48.21±0.34; pSuper/miR-622组在胃癌细胞G2/M期为53.67±0.41而pSuper空载体组20.27±0.18, 与pSuper空载体组细胞相比较, miR-622的高表达促进了胃癌细胞周期的演化.
结论: miR-622真核表达载体构建和稳定表达胃癌细胞筛选成功, 为继续深入的研究miR-622在胃癌中的功能奠定了基础.
引文著录: 王凯, 李乐平, 郭琼行, 苗瑞政, 程力, 靖昌庆, 王金申. 靶向ING1基因的miR-622真核表达载体在胃癌细胞MKN-45中的鉴定及其功能. 世界华人消化杂志 2011; 19(27): 2810-2815
Revised: September 15, 2011
Accepted: September 26, 2011
Published online: September 28, 2011
AIM: To investigate the function of miR-622 in human gastric cancer cell line MKN-45 by constructing a miR-622 eukaryotic expression vector targeting the ING1 gene and to explore the potential role of miR-622 in gastric carcinogenesis.
METHODS: A recombinant plasmid carrying miR-622 (pSuper/miR-622) was transfected into MKN-45 cells using lipofectin-mediated method. Cells stably expressing miR-622 were selected using G418. MKN-45 cells untransfected and those transfected with empty pSuper plasmid were used as controls. The expression levels of miR-622 were detected by TaqMan real-time PCR in stably transfected MKN-45 cells, and Western blot was used to detect the expression of ING1 protein.
RESULTS: Compared to untransfected MKN-45 cells, the expression of ING1 protein showed an average 4.63-fold decrease (1.83 ± 0.86 vs 8.47 ± 1.43, P < 0.05). MKN-45 cells tranfected with pSuper/miR-622 showed higher cell growth activity than control cells (P < 0.05). Over-expression of miR-622 in MKN-45 cells promoted cell cycle progression (G0/G1 phase: 21.45 ± 0.16 vs 48.21 ± 0.34; G2 / M phase: 53.67 ± 0.41 vs 20.27 ±0.18) compared to cells transfected with pSuper empty vector.
CONCLUSION: A MiR-622 eukaryotic expression vector that can stably express miR-622 in MKN-45 cells has been successfully constructed and can be used to study the functions of miR-622 in human gastric cancer.
- Citation: Wang K, Li LP, Guo QX, Miao RZ, Cheng L, Jing CQ, Wang JS. Identification and functional analysis of a miR-622 eukaryotic expression vector targeting the ING1 gene in human gastric cancer cell line MKN-45. Shijie Huaren Xiaohua Zazhi 2011; 19(27): 2810-2815
- URL: https://www.wjgnet.com/1009-3079/full/v19/i27/2810.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i27.2810
近年来, microRNA 的相关研究属研究领域的热点问题, 人的miR-622(MI0003636)定位于13号染色体长臂q31.3, 位于90881436-90885531位点, miR-622前体长度为: 96 bp, 在对miR-622的研究发现miR-622直接靶向细胞周期相关基因ING1, miR-622在胃癌组织中表达下调, miR-622跟胃癌组织的分化和淋巴结转移相关, 体内裸鼠和体外细胞实验证实上调miR-622的表达具有抑制胃癌细胞侵袭和肿瘤形成、转移的能力[1]. 本研究首先通过PCR技术扩增miR-622前体462 bp扩增后, 定向克隆到microRNA真核表达载体pSUPER.neo+GFP上, 并将其转染至MKN-45细胞株中, 筛选稳定表达miR-622胃癌细胞株MKN-45细胞后. 采用实时荧光定量PCR和Western blot检测其对ING1基因表达的干扰效果和MKN-45细胞的功能. 以初步探讨miR-622在胃癌细胞的作用, 为今后深入研究microRNA在胃癌发生发展中的作用奠定基础.
人胃癌细胞株MKN-45购自中国科学院上海生物化学和细胞生物学研究所细胞库. 反转录酶、限制性内切酶、LA-Taq DNA聚合酶购自TaKaRa公司; Transwell小室、Taq DNA聚合酶购自Promega公司; T4连接酶购自天根公司; 小量质粒抽提试剂盒购自上海申能博采公司; 大量质粒抽提试剂盒购自Qiagen公司; 低分子量标准蛋白质购自华美公司; DNA Marker、琼脂糖购自Gibco BRL公司; 蛋白Marker购自天根公司; Lipofectamine脂质体购自Invitrogen公司; microRNA抽提、逆转、定量分析购自Qiagen公司, miR-622前体引物试剂均购自Ambion公司; ING1、GAPDH蛋白单克隆抗体购自Abcam公司; pSuper.gfp/neo空载体由本实验室保存.
1.2.1 miR-622真核表达载体构建: 以人胃癌细胞株MKN-45基因组为模板扩增miR-622前体. 引物设计Pre-microRNA-622(上海生工公司合成)上游引物5'-GCGAGATCT GAGGAAGTAAAAGGCTTACAAG-3'. 下游引物5'-GCGCTCGAG GCTTGACCTTGATGTTCAGCAGG-3'. 其中引入Bgl Ⅱ和XhoⅠ两个酶切位点. PCR 扩增条件94 ℃预变性5 min, 95 ℃变性30 s, 58 ℃退火30 s, 72 ℃延伸30 s, 35个循环, 最后72 ℃延长10 min. 凝胶电泳鉴定可见约462 bp目的条带. 用上海申能博采公司纯化试剂盒纯化PCR 产物. Bgl Ⅱ和XhoⅠ(购于TaKaRa公司)双酶切后再次纯化得到miR-622前体目的片段. pSuper.gfp/neo载体用Bgl Ⅱ和XhoⅠ双酶切并纯化后, 插入miR-622前体目的片段, 载体构建成功后即pSuper/miR-622送博尚生物有限公司测序鉴定.
1.2.2 稳定转染胃癌细胞MKN-45筛选: 胃癌细胞MKN-45用RPMI 1640(10% HYCLONE血清)培养, 转染前1 d 种6孔板, 每孔细胞数为1×105个, 细胞生长至90%融合时用Lipofectamine2000脂质体进行转染. 将pSuper.gfp/neo空载体和pSuper/miR-622载体转染胃癌细胞MKN-45转染24 h后, 加入含G418(1 g/L)的培养液筛选稳定转染细胞株, 3-4 wk克隆形成后, 荧光显微镜下观察克隆的荧光显示情况, 若克隆集中显示荧光, 则挑出克隆继续扩群培养, G418改为400 mg/L的维持浓度. 最后通过定量PCR验证miR-622的表达情况.
1.2.3 Western blot检测ING1蛋白水平表达: 提取细胞总蛋白, 定量, 与上样缓冲液按比例混匀, 100 ℃煮5 min, 8% SDS-PAGE电泳后电转移至PVDF膜上, 5%脱脂牛奶室温封闭1 h, 加入一抗, 4 ℃孵育过夜, TBST洗涤3次, 每10 min换液1次. 加入二抗, 37 ℃孵育45 min, TBST洗涤3次, 每15 min换液1次, 在暗室中压片, 然后显影、定影. 图像应用AlphaImager 2200软件进行分析. 以GAPDH(单抗工作浓度为1∶4 000)为内参照.
1.2.4 CCK-8细胞增殖实验: 96 孔板中培养细胞, 每孔103个细胞, 每种处理方式的细胞接种5个复孔. 1(细胞已贴壁)、2、3、4、5 d加入CCK-8 10 μL. 培养4 h, 酶标仪设置波长570 nm 测定吸光度, 得到4个时间点的吸光度平均值后绘制细胞增殖曲线.
1.2.5 流式细胞仪检测: 取胃癌细胞106个细胞计数, 接种到培养瓶中, 对照组加等体积PBS缓冲液, 胰酶消化细胞, 加入预先 -20 ℃冰冷的无水乙醇, 过滤到流式细胞计数管, 加50 μL(0.1 g/L PI, 2 g/L RNA酶的PBS 溶液)染色液混匀, 流式细胞技术计数, 以Flowjo 8.5软件分析细胞周期.
统计学处理 采用医用SPSS15.0统计软件进行分析、处理. 数据以mean±SD表示. 组间均数的比较采用单因素方差分析. 行×列表资料的率差别采用χ2检验. P<0.05为差异有统计学意义.
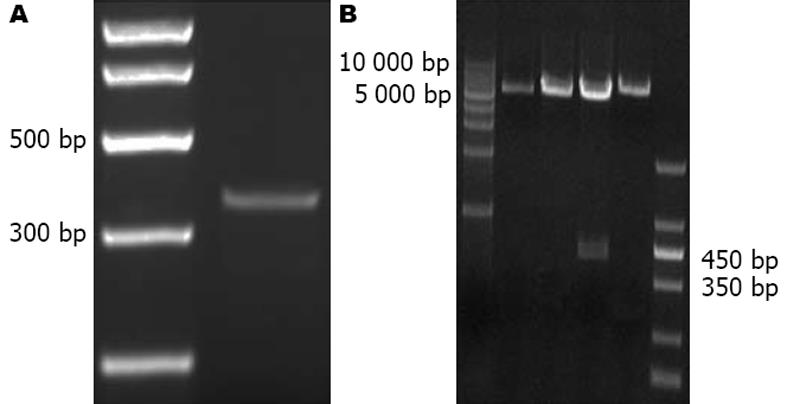
以人胃癌细胞株MKN-45基因组为模板扩增miR-622前体, 可得到约462 bp目的条带(图1A). 将目的条带纯化后并经过Bgl Ⅱ和XhoⅠ双酶切克隆入microRNA表达载体pSuper.gfp/neo载体, 挑选阳性克隆鉴定(图1B), DNA 测序表明miR-622真核表达载体构建成功.
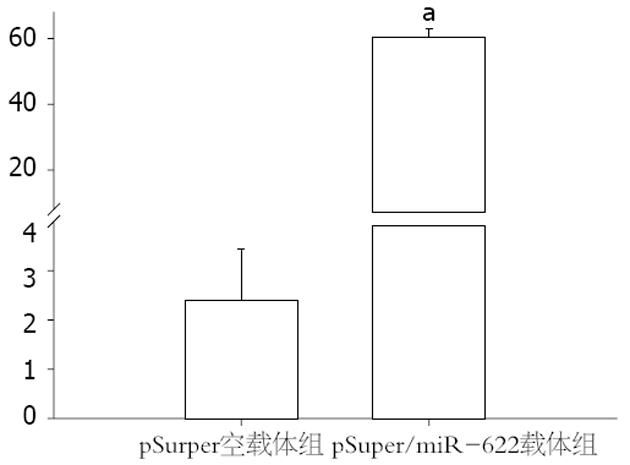
在转染pSuper空载体组和转染pSuper/miR-622载体组定量值分别是: 2.47±1.042和61.24±2.86, 与pSuper空载体组相比较, 转染了pSuper/miR-622载体组miR-622表达量具有显著差异(P<0.05, 图2), 表明稳转细胞筛选成功.
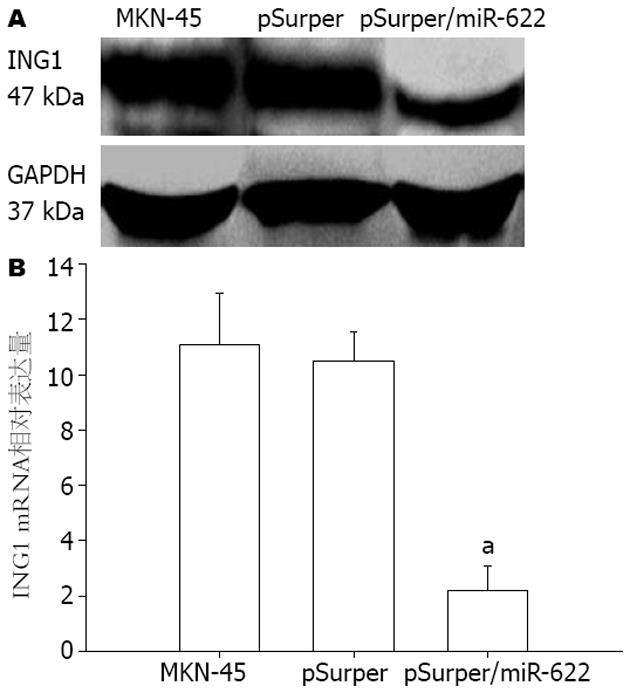
与pSuper空载体组相比, 转染了pSuper/miR-622高表达质粒的MKN-45细胞中ING1蛋白表达明显减少, 降低了4.58倍(2.32±0.31 vs 10.62±1.04, P<0.05). 结果表明转染了miR-622的MKN-45细胞ING1蛋白的表达水平明显减少(图3). 实验结果表明ING1蛋白是miR-622靶向之一.
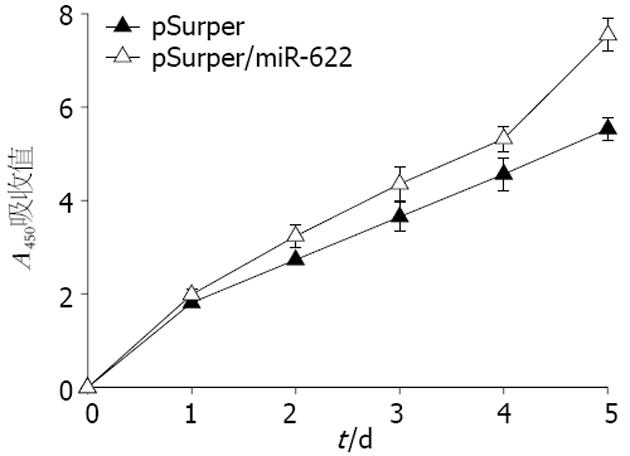
pSuper/miR-622载体组组较pSuper空载体组细胞增殖数量明显增加(P = 0.000, 图4), miR-622的高表达促进了胃癌细胞的增殖.
pSuper/miR-622组在胃癌细胞G0/G1期为21.45±0.16而pSuper空载体组48.21±0.34; pSuper/miR-622组在胃癌细胞G2/M期为53.67±0.41而pSuper空载体组20.27±0.18, 与pSuper空载体组细胞相比较, miR-622的高表达促进了胃癌细胞周期的演化(图5).
胃癌是全球高发的恶性肿瘤之一, 但目前我们对胃癌的发病机制尚缺乏全面和深入的了解. 已有研究报道, 胃癌中也存在广泛的microRNA表达失调[2]. miRNA是近年才被发现的一类小分子单链RNA, 长度通常21-25 nt, 具有发夹样茎-环二级结构, 他主要通过与成熟mRNA的3'-UTR序列相结合, 抑制mRNA的翻译或使mRNA降解, 从而抑制基因的表达[3-6]. 成熟microRNA通过与靶基因完全(植物内)或不完全(动物内)互补结合, 促进靶基因mRNA降解或者抑制翻译, 调控基因表达, 广泛参与生命过程中一系列重要进程, 包括早期发育、细胞增殖、细胞凋亡、脂肪代谢和细胞分化[3,4,7]. 据估计microRNA种类在动植物体内多达上千种, 至少调控机体内10%-30%基因表达, 其在生命活动中的重要性可见一斑. 目前, 对于microRNA功能研究主要通过真核表达载体、体外转录以及直接合成3种方法为主. 由于RNA本身容易收RNA酶污染而降解, 合成价格昂贵、使用次数有限, 使得后两种方法的应用有限, 而采用真核表达载体, 却有独特的优势[8].
在本研究中我们首先通过生物信息学的方法分析了miR-622, 人的miR-622(MI0003636)定位于13号染色体长臂q31.3, 位于90881436- 90885531位点, miR-622前体长度为96 bp, 我们前期在对miR-622的研究发现miR-622直接靶向细胞周期相关基因ING1, miR-622在胃癌组织中表达下调, miR-622跟胃癌组织的分化和淋巴结转移相关, 体内裸鼠和体外细胞实验证实上调miR-622的表达具有抑制胃癌细胞侵袭和肿瘤形成、转移的能力[1]. 为了更好研究miR-622在胃癌中的作用, 本研究采用microRNA表达载体 pSuper.gfp/neo载体, 此载体具有H1型启动子和绿色荧光蛋白, 当microRNA插入此载体多克隆位点时被宿主细胞Dicer酶切割, 成为成熟的microRNA. 构建的miR-622真核表达载体转染到MKN-45细胞, 该细胞本身低表达miR-622[1], 转染进的miR-622前体能被宿主细胞Dicer酶切割, 成为成熟的miR-622, 本实验为构建microRNA表达载体提出新的思路与方法. 其次, 构建的质粒转染入细胞后可整合到细胞基因组中, 稳定表达并与绿色荧光蛋白融合表达, 绿色荧光蛋白的表达可以间接反映microRNA表达情况, 并可以衡量质粒导入细胞过程中的转染效率以及表达情况.
越来越多的证据显示, 人类的一些恶性肿瘤组织中microRNAs基因的表达发生改变, 如肺癌[4,9]、肝癌[10]、结肠癌[11]、乳腺癌[12]、食管癌[13,14]. microRNA在胃癌中的调节作用也被越来越多的实验证实, Wan等[15]发现miR-9在人类胃癌中下调, 过表达的miR-9抑制人胃癌MGC-803细胞的生长, miR-9打靶NFkappaB1, 并且调节胃癌细胞的生长. miR-150在胃癌细胞系和组织中高表达, 异位表达的miR-150促进肿瘤和胃癌细胞扩散. 荧光素酶报告基因分析表明, EGR2是miR-150的直接靶位点[16]. 人类结肠癌细胞系中, miR-200b表达上调, 加入5-氟尿嘧啶处理之后miR-200b表达下调. miR-200b抑制络氨酸磷酸酶蛋白-PTPN12, 从而使c-Abl、Src和Ras等癌基因失活[17]. 为了更好阐明miR-622在胃癌发生发展中的作用, 我们通过Western blot实验显示miR-622高表达抑制细胞周期相关基因ING1的表达, INGl基因是1996年Garkavtsev等采用改良的cDNA消减杂交方法(substractive hybridization)和体内选择技术(in vivo selection assay), 克隆到的一个新的肿瘤抑制基因, 主要编码蛋白p33ING1b, 细胞核内表达, 主要与p53共同参与基因调控、DNA修复、细胞周期调控、诱导凋亡以及衰老. 体内、体外和动物等实验也证实了p33ING1b蛋白的过量表达能够减缓细胞生长, 诱导细胞凋亡及促进损伤修复, 其低表达则可刺激克隆的形成, 促使细胞的恶性转化, 导致肿瘤的发生[18-22]. 目前认为, 胃癌是一类渐进性细胞周期调控机制破坏的疾病, 表现为细胞周期失调、信号传导途径异常. 生物进化过程中, 细胞建立了一系列的调控机制, 以确保细胞周期各时相严格有序地进行. 不受控制的细胞增殖是恶性肿瘤的最重要特征: 多数恶性肿瘤的发生、发展均与细胞周期调控功能紊乱有关. 因此, 对细胞周期调控机制和肿瘤细胞周期调控改变的深入研究, 小仅有助于认识肿瘤发生和演进, 还将为肿瘤治疗开辟崭新的思路[23-26]. 本课题通过胃癌细胞增殖和细胞周期实验对其进行了初步探讨, 我们使用流式细胞仪对稳定转染胃癌细胞MKN-45进行了细胞周期分析, 实验结果表明, pSuper/miR-622组在胃癌细胞G0/G1期为21.45±0.16明显低于pSuper空载体组48.21±0.34; pSuper/miR-622组在胃癌细胞G2/M期为53.67±0.41显著高于pSuper空载体组20.27±0.18, 与pSuper空载体组细胞相比较, 两组之间比较具有明显的统计学差异, miR-622的高表达促进了胃癌细胞周期的演化(P = 0.000).
目前, 虽然已经鉴定出了大量的miRNA, 但其作用机制以及许多miRNA的生理功能还不是很清楚. 本实验构建了pSuper/miR-622真核表达载体, 通过实验证明其可在胃癌MKN-45细胞中有效表达并转变为成熟的miR-622发挥生物学作用, 表明真核表达载体pSuper/miR-622转染细胞可用于其功能研究. 此结果为进一步研究miR-622在胃癌发生发展中的作用提供了实验基础.
胃癌在世界范围内仍是引起高死亡率的肿瘤之一, 其发生发展非常复杂, 涉及多种免疫与分子机制, 与多种基因有关, 包括癌基因激活和抑癌基因失活. 迄今, 有关胃癌的发生与发展的机制尚未取得突破性的进展.
张国梁, 主任医师, 天津第一中心医院消化内科; 姜相君, 主任医师, 青岛市市立医院消化内科
胃癌是全球高发的恶性肿瘤之一, 但目前我们对胃癌的发病机制尚缺乏全面和深入的了解. 已有研究报道, 胃癌中也存在广泛的microRNA表达失调.
越来越多的证据显示, 人类的一些恶性肿瘤组织中microRNAs基因的表达发生改变, 如肺癌、肝癌、结肠癌、乳腺癌、食管癌.
本文构建了pSuper/miR-622真核表达载体, 通过实验证明其可在胃癌MKN-45细胞中有效表达并转变为成熟的miR-331发挥生物学作用.
本文讨论条理分明, 有系统的理论分析和有价值的科学结论.
编辑: 李军亮 电编:何基才
| 1. | Guo XB, Jing CQ, Li LP, Zhang L, Shi YL, Wang JS, Liu JL, Li CS. Down-regulation of miR-622 in gastric cancer promotes cellular invasion and tumor metastasis by targeting ING1 gene. World J Gastroenterol. 2011;17:1895-1902. [PubMed] |
| 2. | Petrocca F, Visone R, Onelli MR, Shah MH, Nicoloso MS, de Martino I, Iliopoulos D, Pilozzi E, Liu CG, Negrini M. E2F1-regulated microRNAs impair TGFbeta-dependent cell-cycle arrest and apoptosis in gastric cancer. Cancer Cell. 2008;13:272-286. [PubMed] [DOI] |
| 3. | Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell. 2004;116:281-297. [PubMed] [DOI] |
| 4. | Hayashita Y, Osada H, Tatematsu Y, Yamada H, Yanagisawa K, Tomida S, Yatabe Y, Kawahara K, Sekido Y, Takahashi T. A polycistronic microRNA cluster, miR-17-92, is overexpressed in human lung cancers and enhances cell proliferation. Cancer Res. 2005;65:9628-9632. [PubMed] [DOI] |
| 5. | Jovanovic M, Hengartner MO. miRNAs and apoptosis: RNAs to die for. Oncogene. 2006;25:6176-6187. [PubMed] [DOI] |
| 6. | Zhang B, Pan X, Anderson TA. MicroRNA: a new player in stem cells. J Cell Physiol. 2006;209:266-269. [PubMed] [DOI] |
| 7. | Davis-Dusenbery BN, Hata A. Mechanisms of control of microRNA biogenesis. J Biochem. 2010;148:381-392. [PubMed] |
| 8. | 严 辉, 陈 卫昌, 岑 建农, 沈 宏杰, 郭 凌川, 顾 冬梅, 谢 学顺. 转染gklf基因对人胃癌细胞MKN-45裸鼠移植瘤的抑制作用. 世界华人消化杂志. 2011;19:7-12. [DOI] |
| 9. | Lebanony D, Benjamin H, Gilad S, Ezagouri M, Dov A, Ashkenazi K, Gefen N, Izraeli S, Rechavi G, Pass H. Diagnostic assay based on hsa-miR-205 expression distinguishes squamous from nonsquamous non-small-cell lung carcinoma. J Clin Oncol. 2009;27:2030-2037. [PubMed] [DOI] |
| 10. | Su H, Yang JR, Xu T, Huang J, Xu L, Yuan Y, Zhuang SM. MicroRNA-101, down-regulated in hepatocellular carcinoma, promotes apoptosis and suppresses tumorigenicity. Cancer Res. 2009;69:1135-1142. [PubMed] [DOI] |
| 11. | Michael MZ, O' Connor SM, van Holst Pellekaan NG, Young GP, James RJ. Reduced accumulation of specific microRNAs in colorectal neoplasia. Mol Cancer Res. 2003;1:882-891. [PubMed] |
| 12. | Kondo N, Toyama T, Sugiura H, Fujii Y, Yamashita H. miR-206 Expression is down-regulated in estrogen receptor alpha-positive human breast cancer. Cancer Res. 2008;68:5004-5008. [PubMed] [DOI] |
| 13. | Zhou SL, Wang LD. Circulating microRNAs: novel biomarkers for esophageal cancer. World J Gastroenterol. 2010;16:2348-2354. [PubMed] [DOI] |
| 14. | Feber A, Xi L, Luketich JD, Pennathur A, Landreneau RJ, Wu M, Swanson SJ, Godfrey TE, Litle VR. MicroRNA expression profiles of esophageal cancer. J Thorac Cardiovasc Surg. 2008;135:255-260; discussion 260. [PubMed] [DOI] |
| 15. | Wan HY, Guo LM, Liu T, Liu M, Li X, Tang H. Regulation of the transcription factor NF-kappaB1 by microRNA-9 in human gastric adenocarcinoma. Mol Cancer. 2010;9:16. [PubMed] [DOI] |
| 16. | Wu Q, Jin H, Yang Z, Luo G, Lu Y, Li K, Ren G, Su T, Pan Y, Feng B. MiR-150 promotes gastric cancer proliferation by negatively regulating the pro-apoptotic gene EGR2. Biochem Biophys Res Commun. 2010;392:340-345. [PubMed] [DOI] |
| 17. | Rossi L, Bonmassar E, Faraoni I. Modification of miR gene expression pattern in human colon cancer cells following exposure to 5-fluorouracil in vitro. Pharmacol Res. 2007;56:248-253. [PubMed] [DOI] |
| 18. | Gómez-Cabello D, Callejas S, Benguría A, Moreno A, Alonso J, Palmero I. Regulation of the microRNA processor DGCR8 by the tumor suppressor ING1. Cancer Res. 2010;70:1866-1874. [PubMed] [DOI] |
| 19. | Liu J, Lin Y, Yang H, Deng Q, Chen G, He J. The expression of p33(ING1), p53, and autophagy-related gene Beclin1 in patients with non-small cell lung cancer. Tumour Biol. 2011; Jul 22. [Epub ahead of print]. [PubMed] |
| 20. | Tallen G, Farhangi S, Tamannai M, Holtkamp N, Mangoldt D, Shah S, Suzuki K, Truss M, Henze G, Riabowol K. The inhibitor of growth 1 (ING1) proteins suppress angiogenesis and differentially regulate angiopoietin expression in glioblastoma cells. Oncol Res. 2009;18:95-105. [PubMed] [DOI] |
| 21. | Tamannai M, Farhangi S, Truss M, Sinn B, Wurm R, Bose P, Henze G, Riabowol K, von Deimling A, Tallen G. The inhibitor of growth 1 (ING1) is involved in trichostatin A-induced apoptosis and caspase 3 signaling in p53-deficient glioblastoma cells. Oncol Res. 2010;18:469-480. [PubMed] [DOI] |
| 22. | Wagner MJ, Helbing CC. Multiple variants of the ING1 and ING2 tumor suppressors are differentially expressed and thyroid hormone-responsive in Xenopus laevis. Gen Comp Endocrinol. 2005;144:38-50. [PubMed] [DOI] |
| 23. | 李 乐平, 程 力, 张 黎, 靖 昌庆, 徐 韬, 李 辰生, 郭 晓波. 胃癌中靶向E2F1基因的miR-331真核表达载体的构建及功能. 世界华人消化杂志. 2011;19:1451-1456. [DOI] |
| 24. | Foster DA, Yellen P, Xu L, Saqcena M. Regulation of G1 Cell Cycle Progression: Distinguishing the Restriction Point from a Nutrient-Sensing Cell Growth Checkpoint(s). Genes Cancer. 2010;1:1124-1131. [PubMed] [DOI] |
| 25. | Jin X, Tang S, Chen Q, Zou J, Zhang T, Liu F, Zhang S, Sun C, Xiao X. Furazolidone induced oxidative DNA damage via up-regulating ROS that caused cell cycle arrest in human hepatoma G2 cells. Toxicol Lett. 2011;201:205-212. [PubMed] [DOI] |
| 26. | Méndez J. Cyclin E goes nuts: a cell cycle regulator affects male fertility. Cell Cycle. 2010;9:4782. [PubMed] [DOI] |