修回日期: 2011-06-21
接受日期: 2011-06-28
在线出版日期: 2011-09-18
目的: 构建重组p21-activated kinase-1(PAK1)基因绿色荧光蛋白表达载体pEGFP-C1/PAK1, 并转染入结直肠癌细胞SW480中表达.
方法: 在南方医科大学附属南方医院消化研究所实验室, 从人类结直肠癌细胞株SW620细胞提取总RNA, 经逆转录聚合酶链式反应获得人PAK1 cDNA片段, 经过限制性内切酶进行酶切, T4连接酶进行连接, 将目的基因克隆至真核绿色荧光蛋白表达载体pEGFP-C1上, 然后转染结直肠癌细胞株SW480, 观察其在细胞中表达.
结果: 重组载体经限制性内切酶酶切鉴定和DNA序列分析验证, 显示插入载体的序列与目的基因一致, 而且该重组载体能够在SW480细胞中表达.
结论: 成功构建了真核绿色荧光蛋白表达载体pEGFP-C1/PAK1, 为研究PAK1在结直肠癌中的生物学功能奠定了基础.
引文著录: 武金宝, 党彤, 陈学清, 张振书, 张宏权, 宋于刚. 真核绿色荧光蛋白表达载体pEGFP-C1/PAK-1的构建及其在结直肠癌SW480细胞内的表达. 世界华人消化杂志 2011; 19(26): 2730-2734
Revised: June 21, 2011
Accepted: June 28, 2011
Published online: September 18, 2011
AIM: To construct a recombinant eukaryotic fluorescent expression plasmid containing the coding region of p21-activated kinase-1 (PAK-1) gene and to detect its expression in SW480 cells.
METHODS: Total RNA was extracted from human colorectal carcinoma cell line SW620 and used to amplify the PAK1 gene fragment by reverse transcription-polymerase chain reaction (RT-PCR). The resulting PCR product was inserted into the plasmid pEGFP-C1 after restriction endonuclease digestion and ligation. After verifying the correct insertion of the DNA fragment by endonuclease digestion and direct sequencing, the recombinant plasmid was transfected into SW480 cells to detect its expression in vitro.
RESULTS: The sequence of the recombinant plasmid was verified by restriction digestion and DNA sequence analysis, and the target protein expression was detected in the cell cytoplasm of SW480 cells.
CONCLUSION: A recombinant eukaryotic fluorescent expression vector carrying the PAK-1 gene (pEGFP-C1/PAK1) has been constructed successfully and provides a potent tool to investigate the role of PAK-1 in colorectal carcinoma.
- Citation: Wu JB, Dang T, Chen XQ, Zhang ZS, Zhang HQ, Song YG. Construction of a eukaryotic green fluorescent protein expression vector carrying the PAK-1 gene (pEGFP-C1/PAK1) and its expression in SW480 cells. Shijie Huaren Xiaohua Zazhi 2011; 19(26): 2730-2734
- URL: https://www.wjgnet.com/1009-3079/full/v19/i26/2730.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i26.2730
PAK1(p21-activated kinase1)是保守的丝氨酸/苏氨酸蛋白激酶之一, 为Rho家族小鸟苷三磷酸酶(Rho-GTPase) Cdc42和Rac下游重要的靶基因, 参与许多重要的细胞活动[1-3]. 近年研究发现, 在肿瘤发生发展过程中存在异常的PAK1信号转导途径, 尤其在乳腺癌、卵巢癌和膀胱癌等肿瘤的发展和转移过程中起着关键作用[4-8], 国内外学者研究证实PAK1在胃肠道肿瘤中高表达, 而且可能可能与这些肿瘤的发生、转移密切相关[9-12]. 因此, 研究PAK1在结直肠癌发生发展中的作用机制,为干预PAK1信号转导途径, 抑制结直肠癌细胞的增殖、浸润及转移, 具有重要的临床应用价值. 本研究应用基因重组技术构建PAK1真核表达载体, 并将携带活细胞探针绿色荧光蛋白(GFP)的外源性PAK1基因通过脂质体法转入人结直肠癌SW480细胞中, 观察PAK1在细胞内的表达和定位, 为进一步探索PAK1基因在结直肠癌细胞中的生物学特性及其研究其信号转导通路奠定基础.
SW620和SW480细胞株引自美国典型培养物保藏中心(American type culture collection, ATCC, 编号分别为CCL-227和CCL-228), 由南方医院消化研究所实验室保存; 绿色荧光真核表达载体pEGFP-C1为BD Clontech公司产品, 由瑞典Karolinska研究所张宏权教授惠赠;大肠杆菌DH5α菌株本实验室留存. 限制性内切酶BamHⅠ、HindⅢ、Pfu聚合酶、T4 DNA连接酶、DL2000 Marker购自大连TaKaRa公司; TRIzol试剂和LipofectamineTM 2000转染试剂购自Invitrogen公司; M-MuLV ReverseTranscriptase 系NEB公司产品, 胶回收试剂盒、质粒小提试剂盒购自安徽优晶生物工程有限公司, 质粒大提试剂盒购自Qiagen公司, RPMI 1640培养基均为美国Gibco BRL公司产品, 胎牛血清为Hyclone公司产品, Tubulin和PAK1兔抗人多克隆抗体购自美国Abcam公司.
1.2.1 细胞培养: 结直肠癌细胞用含100 mL/L胎牛血清的RPMI 1640培养基置于50 mL/L CO2, 37 ℃条件下培养传代, 细胞密度达到70%-80%时用于下一步实验.
1.2.2 引物设计: 根据基因克隆的原则, 在Genebank查找和分析人PAK1 mRNA和蛋白序列, 根据人PAK1 mRNA(GenBank No: NM_002576)的编码区(code sequence, CDS)序列特点和内切酶分布, 比对载体上多克隆位点的内切酶位点, 设计克隆PAK1 PCR引物如下: 引物F: 5'-cccg/aattcatgtcaaataacggcctagac-3', 中间下划线部分为EcoRⅠ酶切位点; 引物R: 5'-acatggatc/cttagtgattgttctttgttgc-3', 下划线部分为 BamHⅠ酶切位点, 引物由上海生工生物工程公司合成.
1.2.3 总RNA提取及cDNA合成: SW620细胞总RNA的提取按照TRIzol试剂盒说明书进行操作, 对所提取总RNA用紫外分光光度法进行测定. 20 μL逆转录反应体系包含总RNA 1.0 μg, 0.5 g/L Oligo(dT)18 primer 1 μL, DEPC处理的灭菌去离子水12 μL, 70 ℃加热5 min后立即冰浴, 加RNA酶抑制剂1 μL, 5×Buffer 4 μL, 10 mmol/L dNTP 2 μL, 37 ℃孵育5 min, 再加入200 kU/L的M-MuLV逆转录酶1 μL, 42 ℃反应1 h, 70 ℃反应10 min.
1.2.4 PCR扩增及电泳结果判定: 以逆转录获得的cDNA为模板, 利用PCR技术对PAK1进行扩增. 反应条件分别为: 94 ℃ 3 min后, 94 ℃ 30 s, 60 ℃ 1 min, 72 ℃ 3 min, 循环30次, 最后于72 ℃延伸10 min. PCR产物经1%琼脂糖凝胶电泳检测, 与预期结果一致的片段切胶回收, 按凝胶回收试剂盒说明书回收和纯化PCR产物.
1.2.5 重组质粒pEGFP-C1/PAK1的构建: 用限制性内切酶EcoRⅠ和BamHⅠ对PAK1 PCR纯化产物和pEGFP-C1分别在37 ℃进行酶切, 目的产物纯化后以T4 DNA连接酶于16 ℃连接16 h. 以标准热休克方法, 用50 mL E.coli DH5α感受态细胞转化5 μL连接产物, 冰浴3 min后, 加新鲜LB培养基400 μL, 37 ℃ 180 r/min复苏45 min; 取100 μL产物涂布含卡那霉素的LB琼脂培养板, 37 ℃培养12 h. 挑取典型的阳性菌落, 接种于5 mL含卡那霉素的LB液体培养基中, 37 ℃、180 r/min震荡培养12 h, 用质粒提取试剂盒按照说明书提取质粒.
1.2.6 重组质粒酶切鉴定及插入片段测序鉴定: 重组质粒酶切鉴定, 并将与预期结果一致的炎性克隆菌液送上海生工生物技术公司测序鉴定.
1.2.7 重组质粒pEGFP-C1/PAK1转染SW480细胞及在SW480的表达: 将重组质粒pEGFP-C1/PAK1和空质粒pEGFP-C1通过脂质体法导入人结直肠癌SW480细胞系中, 转染48 h后通过共焦激光显微镜观察PAK1 在细胞内的定位; 并以SW480细胞作为空白对照, pEGFP-C1转染组作为阴性对照, 用免疫印迹方法检测pEGFP-C1/PAK1转染组SW480细胞PAK1的表达.
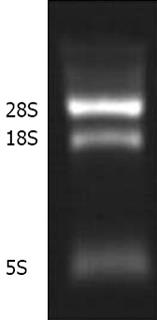
按照TRIzol试剂盒说明书进行操作提取SW620细胞总RNA提取结果见图1, 经过紫外分光光度法进行测定, 其A260/A280为1.86, 说明提取的总RNA完整性较好, 符合实验要求.
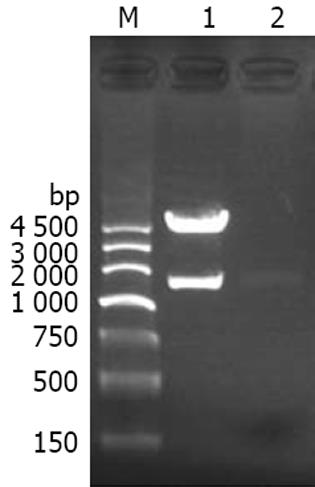
RT-PCR反应扩增目的基因的产物经1%琼脂糖凝胶电泳分析, 可见约1.7 kb大小的特异性片段(图2), 片段大小与预期的PAK1基因片段大小相同. 将重组pEGFP-C1/PAK1质粒用EcoRⅠ联合BamHⅠ进行消化, 经1%琼脂糖凝胶检测可见分别约为4.7 kb和1.7 kb的两个片段, 长度与pEGFP载体和PAK1预期片段大小一致(图2), 重组质粒经序列测定证明, 重组PAK1基因与GenBank中PAK1编码区序列(GenBank No: NM_002576)比对, 结果完全一致, 提示重组质粒构建成功.
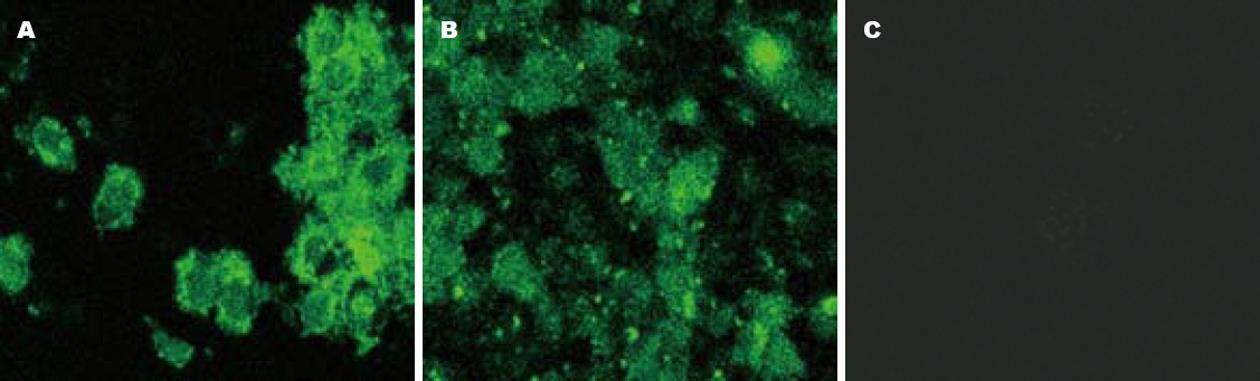
pEGFP-C1/PAK1真核表达载体通过脂质体法转入人结直肠癌细胞SW480中, 转染率大于70%. 用共焦激光扫描显微镜方法观察PAK1在SW480细胞内的定位. 镜下可观察到, 在pEGFP-C1空白质粒转染对照组中, 绿色荧光遍布整个SW480细胞, 且分布比较均匀(图3B); 而在pEGFP-C1/PAK1重组质粒转染组中, 绿色荧光布满细胞胞质, 但核内无绿色荧光图, 提示转入的重组质粒已在SW480细胞中表达出PAK1-C1-GFP融合蛋白, PAK1主要在胞质表达(图3A); 在SW480空白对照组中, 未激发出绿色荧光(图3C).
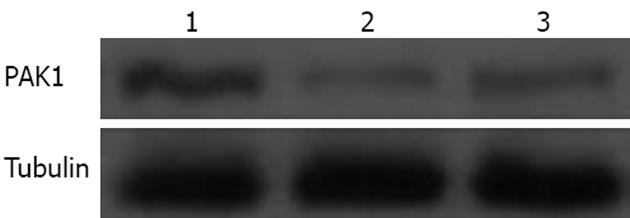
Western blot分析显示: 与SW480空白对照组比较, pEGFP-C1空载体对照组PAK1蛋白表达未发生明显变化, pEGFP-C1/PAK1实验组PAK1蛋白表达明显增加(图4).
绿色荧光真核表达载体pEGFP-C1的一个重要特点就是含有增强的绿色荧光蛋白GFP. 绿色荧光蛋白(green fluorescent protein, GFP)来源于海洋生物水母, 是近年来在分子生物学中应用最广泛的标记性蛋白质之一[13-15]. GFP的cDNA约740 bp, 他编码238个氨基酸残基. 在合适波长的激发光下, GFP肤链内部第65-67位的丝氨酸一酪氨酸-甘氨酸通过自身环化和氧化形成一个发色基团, 可以发射易于观察荧光. 而且GFP具有: (1)无需引入其他物质, 导入到活细胞内的GFP蛋白通过显微镜就能清晰地观察到所发的荧光; (2)分子量较小, 易与其他基因形成融合蛋白且不影响自身和目的基因产物的空间构象和功能; (3)GFP蛋白稳定, 能耐受甲醛固定、pH改变、65 ℃以下高温及一些酶作用而不改变其活性; (4)GFP对细胞无毒性. 目前作为标记基因应用较多的是GFP的两个突变体, S65T(即65位丝氨酸-苏氨酸)和EGFP(即64位苯丙氨酸-亮氨酸), 他们的激发峰波长可偏移到488 nm, 发射出的荧光强度要比野生型大6倍以上. 这主要是突变型的蛋白表达量增加及有效的蛋白折叠, 使他能很快形成发色基团构型, pEGFP-C1载体含有后一种变体, 因而pEGFP-C1比野生型GFP的载体更易于观测和研究目的基因的表达、调控及其目的蛋白在生物体内定位和信号传导等[15-19].
PAK1是最早被克隆的丝氨酸/苏氨酸蛋白激酶, 包含N末端调节区和C末端激酶区; N末端调节区含GTP酶结合域(GTPase binding domain, GBD), 可介导PAK1与Rac和Cdc42的结合[1,20,21]. 最近许多研究显示, PAK1参与多种肿瘤细胞生长、侵袭和转移过程[13,22-27], 国外学者近期研究提示PAK1可以通过ERK/AKT信号途径促进结肠癌细胞的生长、迁移和侵袭[28,29], 本课题组早期研究提示, 具有高侵袭潜能的结肠癌细胞株细胞表达PAK1亦增强[30], 因此在体外克隆和建立重组PAK1表达系统对了解PAK1在肿瘤细胞内定位和深入研究PAK1的生物学特性及功能有重要的科研和临床意义. 本实验成功构建了绿色荧光蛋白表达载体pEGFP-C1/PAK1, 并经脂质体转染结直肠癌细胞后, 通过对绿色荧光蛋白的检测证实了目的基因可以在结直肠癌细胞SW480细胞质中表达, 为观察目的基因转染结直肠癌细胞后, 对结直肠癌细胞生物学特性的影响奠定了实验基础.
结直肠癌是西方国家常见的恶性肿瘤之一. 近年随着我国经济的发展, 人民生活水平的提高和饮食习惯的改变, 结直肠癌发病率及死亡率在我国呈快速上升趋势, 因而研究结直肠癌的发生和发展机制, 寻找有效防治方法和途径, 是目前临床、科研所迫切需要解决的难题.
肖恩华, 教授, 中南大学湘雅二医院放射教研室; 杨柏霖, 副主任医师, 南京中医药大学附属医院结直肠外科
结直肠癌发病率逐年升高, 虽然发病机制至今尚未清楚, 但现在一般认为结直肠癌发生、发展、局部侵袭和远处转移是有序的生物学过程, 与结直肠癌细胞的微环境和上皮-间质转化(EMT)密切相关, 而这个过程涉及许多基因变化, 近年来研究发现PAK1基因参与卵巢癌、乳腺癌等多种肿瘤的发生、发展过程, PAK1及其相关信号通路介导调控结直肠癌细胞侵袭转移有待进一步的研究.
PAK1是PAK家族最早克隆和鉴定成员, 不仅参与许多重要的细胞生理活动, 也是影响肿瘤转移及侵袭能力的重要因素, 且其表达与肿瘤侵袭转移能力成明显正相关.
PAK1参与多条肿瘤信号同路, 可能是这些信号同路的节点, 因而PAK1有可能成为防治结直肠癌的基因靶点.
本文立意新, 创新性佳, 研究设计的科学性严谨, 结果客观, 可信.
编辑: 李军亮 电编:何基才
| 1. | Webb BA, Zhou S, Eves R, Shen L, Jia L, Mak AS. Phosphorylation of cortactin by p21-activated kinase. Arch Biochem Biophys. 2006;456:183-193. [PubMed] [DOI] |
| 2. | Ong CC, Jubb AM, Zhou W, Haverty PM, Harris AL, Belvin M, Friedman LS, Koeppen H, Hoeflich KP. p21-activated kinase 1: PAK'ed with potential. Oncotarget. 2011;2:491-496. [PubMed] |
| 3. | Akinmade D, Talukder AH, Zhang Y, Luo WM, Kumar R, Hamburger AW. Phosphorylation of the ErbB3 binding protein Ebp1 by p21-activated kinase 1 in breast cancer cells. Br J Cancer. 2008;98:1132-1140. [PubMed] [DOI] |
| 4. | Neumann M, Foryst-Ludwig A, Klar S, Schweitzer K, Naumann M. The PAK1 autoregulatory domain is required for interaction with NIK in Helicobacter pylori-induced NF-kappaB activation. Biol Chem. 2006;387:79-86. [PubMed] [DOI] |
| 5. | Rayala SK, Kumar R. Sliding p21-activated kinase 1 to nucleus impacts tamoxifen sensitivity. Biomed Pharmacother. 2007;61:408-411. [PubMed] [DOI] |
| 6. | Li Q, Mullins SR, Sloane BF, Mattingly RR. p21-Activated kinase 1 coordinates aberrant cell survival and pericellular proteolysis in a three-dimensional culture model for premalignant progression of human breast cancer. Neoplasia. 2008;10:314-329. [PubMed] |
| 7. | Ito M, Nishiyama H, Kawanishi H, Matsui S, Guilford P, Reeve A, Ogawa O. P21-activated kinase 1: a new molecular marker for intravesical recurrence after transurethral resection of bladder cancer. J Urol. 2007;178:1073-1079. [PubMed] [DOI] |
| 8. | Ching YP, Leong VY, Lee MF, Xu HT, Jin DY, Ng IO. P21-activated protein kinase is overexpressed in hepatocellular carcinoma and enhances cancer metastasis involving c-Jun NH2-terminal kinase activation and paxillin phosphorylation. Cancer Res. 2007;67:3601-3608. [PubMed] [DOI] |
| 9. | Carter JH, Douglass LE, Deddens JA, Colligan BM, Bhatt TR, Pemberton JO, Konicek S, Hom J, Marshall M, Graff JR. Pak-1 expression increases with progression of colorectal carcinomas to metastasis. Clin Cancer Res. 2004;10:3448-3456. [PubMed] [DOI] |
| 10. | Liu F, Li X, Wang C, Cai X, Du Z, Xu H, Li F. Downregulation of p21-activated kinase-1 inhibits the growth of gastric cancer cells involving cyclin B1. Int J Cancer. 2009;125:2511-2519. [PubMed] [DOI] |
| 11. | Zhang M, Siedow M, Saia G, Chakravarti A. Inhibition of p21-activated kinase 6 (PAK6) increases radiosensitivity of prostate cancer cells. Prostate. 2010;70:807-816. [PubMed] |
| 12. | Siu MK, Yeung MC, Zhang H, Kong DS, Ho JW, Ngan HY, Chan DC, Cheung AN. p21-Activated kinase-1 promotes aggressive phenotype, cell proliferation, and invasion in gestational trophoblastic disease. Am J Pathol. 2010;176:3015-3022. [PubMed] [DOI] |
| 13. | Yin HY, Zhou X, Wu HF, Li B, Zhang YF. Baculovirus vector-mediated transfer of NIS gene into colon tumor cells for radionuclide therapy. World J Gastroenterol. 2010;16:5367-5374. [PubMed] [DOI] |
| 14. | Ou XL, Chen HJ, Sun WH, Hang C, Yang L, Guan YY, Yan F, Chen BA. Effects of angiopoietin-1 on attachment and metastasis of human gastric cancer cell line BGC-823. World J Gastroenterol. 2009;15:5432-5441. [PubMed] [DOI] |
| 15. | Wang M, Boenicke L, Howard BD, Vogel I, Kalthoff H. Gene transfer and expression of enhanced green fluorescent protein in variant HT-29c cells. World J Gastroenterol. 2003;9:2083-2087. [PubMed] |
| 16. | Close DM, Hahn RE, Patterson SS, Baek SJ, Ripp SA, Sayler GS. Comparison of human optimized bacterial luciferase, firefly luciferase, and green fluorescent protein for continuous imaging of cell culture and animal models. J Biomed Opt. 2011;16:047003. [PubMed] [DOI] |
| 17. | Leroch M, Mernke D, Koppenhoefer D, Schneider P, Mosbach A, Doehlemann G, Hahn M. Living colors in the gray mold pathogen Botrytis cinerea: codon-optimized genes encoding green fluorescent protein and mCherry, which exhibit bright fluorescence. Appl Environ Microbiol. 2011;77:2887-2897. [PubMed] [DOI] |
| 18. | Royant A, Noirclerc-Savoye M. Stabilizing role of glutamic acid 222 in the structure of Enhanced Green Fluorescent Protein. J Struct Biol. 2011;174:385-390. [PubMed] [DOI] |
| 19. | Baldridge A, Samanta SR, Jayaraj N, Ramamurthy V, Tolbert LM. Steric and electronic effects in capsule-confined green fluorescent protein chromophores. J Am Chem Soc. 2011;133:712-715. [PubMed] [DOI] |
| 20. | De la Mota-Peynado A, Chernoff J, Beeser A. Identification of the atypical MAPK Erk3 as a novel substrate for p21-activated kinase (Pak) activity. J Biol Chem. 2011;286:13603-13611. [PubMed] [DOI] |
| 21. | Strochlic TI, Viaud J, Rennefahrt UE, Anastassiadis T, Peterson JR. Phosphoinositides are essential coactivators for p21-activated kinase 1. Mol Cell. 2010;40:493-500. [PubMed] [DOI] |
| 22. | Ong CC, Jubb AM, Haverty PM, Zhou W, Tran V, Truong T, Turley H, O'Brien T, Vucic D, Harris AL. Targeting p21-activated kinase 1 (PAK1) to induce apoptosis of tumor cells. Proc Natl Acad Sci U S A. 2011;108:7177-7182. [PubMed] [DOI] |
| 23. | Yuan L, Santi M, Rushing EJ, Cornelison R, MacDonald TJ. ERK activation of p21 activated kinase-1 (Pak1) is critical for medulloblastoma cell migration. Clin Exp Metastasis. 2010;27:481-491. [PubMed] [DOI] |
| 24. | Heckman CA, Demuth JG, Deters D, Malwade SR, Cayer ML, Monfries C, Mamais A. Relationship of p21-activated kinase (PAK) and filopodia to persistence and oncogenic transformation. J Cell Physiol. 2009;220:576-585. [PubMed] [DOI] |
| 25. | Nagel M, Luu O, Bisson N, Macanovic B, Moss T, Winklbauer R. Role of p21-activated kinase in cell polarity and directional mesendoderm migration in the Xenopus gastrula. Dev Dyn. 2009;238:1709-1726. [PubMed] [DOI] |
| 26. | Zhou L, Yan C, Gieling RG, Kida Y, Garner W, Li W, Han YP. Tumor necrosis factor-alpha induced expression of matrix metalloproteinase-9 through p21-activated kinase-1. BMC Immunol. 2009;10:15. [PubMed] [DOI] |
| 27. | Bostner J, Skoog L, Fornander T, Nordenskjöld B, Stål O. Estrogen receptor-alpha phosphorylation at serine 305, nuclear p21-activated kinase 1 expression, and response to tamoxifen in postmenopausal breast cancer. Clin Cancer Res. 2010;16:1624-1633. [PubMed] [DOI] |
| 28. | Huynh N, Liu KH, Baldwin GS, He H. P21-activated kinase 1 stimulates colon cancer cell growth and migration/invasion via ERK- and AKT-dependent pathways. Biochim Biophys Acta. 2010;1803:1106-1113. [PubMed] |
| 29. | Li LH, Zheng MH, Luo Q, Ye Q, Feng B, Lu AG, Wang ML, Chen XH, Su LP, Liu BY. P21-activated protein kinase 1 induces colorectal cancer metastasis involving ERK activation and phosphorylation of FAK at Ser-910. Int J Oncol. 2010;37:951-962. [PubMed] |