修回日期: 2011-08-25
接受日期: 2011-09-16
在线出版日期: 2011-09-18
目的: 研究全反式维甲酸(ATRA)对低分化食管鳞癌细胞系KYSE-70的分化诱导作用及对光动力学疗法(photodynamic therapy, PDT)的应答敏感程度.
方法: 以高分化食管鳞癌细胞KYSE-450和低分化食管鳞癌细胞KYSE-70为研究对象, 用1 µmol/L ATRA为诱导剂, 诱导KYSE-70细胞从低分化状态向高分化状态分化, 通过细胞形态学、增殖实验来验证; 细胞以1 mmol/L ALA 处理, 不同剂量的450 nm蓝光照射, MTT法测定PDT对细胞的光毒毒性; 流式细胞法测定PDT诱导的凋亡水平, Hoechst 33342染色后观察凋亡细胞的胞核形态.
结果: 经ATRA处理后, 诱导组与对照组相比, 细胞变扁平、体积增大、胞质密度减低、核变大、核密度亦减低、细胞生长缓慢. 高分化KYSE-450、分化诱导后的KYSE-70细胞和未诱导KYSE-70细胞用ALA处理后进行蓝光PDT, MTT结果显示高分化KYSE-450和分化诱导后KYSE-70的细胞存活率明显高于未诱导细胞, 而高分化KYSE-450细胞敏感性略微低于分化诱导后的KYSE-70细胞. 当光剂量为225 mJ/cm2时, 诱导前后细胞存活率分别为36.23%±7.43%和54.28%±3.64%, 有极显著差异(P<0.001); 分化诱导后的KYSE-70细胞凋亡率(18.1%)亦低于未诱导的细胞(33.3%).
结论: 经分化诱导后的食管鳞癌细胞PDT敏感性明显差于未诱导的食管鳞癌细胞, 提示细胞分化诱导疗法不仅不能增强PDT效应, 反而降低疗效; 细胞分化诱导对PDT效果的影响部分通过抑制凋亡而实现.
引文著录: 孙蕾, 李懿, 石雨, 刘喜龙, 杨观瑞, 赵立群, 杨小静, 裘一兵, 张亚冰, 汲翔, 康巧珍, 汲振余. 食管鳞癌细胞KYSE-70的分化诱导对光动力学应答敏感性的抑制. 世界华人消化杂志 2011; 19(26): 2709-2716
Revised: August 25, 2011
Accepted: September 16, 2011
Published online: September 18, 2011
AIM: To investigate the impact of all-trans retinoic acid (ATRA)-induced cell differentiation on photodynamic sensitivity of human esophageal cancer cell line KYSE-70.
METHODS: Both well and poorly differentiated KYSE-450 cell lines were used in this study. KYSE-70 differentiation was induced with 1 µmol/L ATRA and evidenced by cell morphology and proliferation. Phototoxicity after photodynamic therapy (PDT, 450 nm) was detected by MTT assay. Apoptosis was measured by flow cytometry, and morphology of apoptotic cells was visualized after Hoechst 33342 staining.
RESULTS: Cells after ATRA treatment exhibited increased size, reduced cytoplasmic and nuclear density, and nuclear enlargement. Cell growth was inhibited compared to control cells. After PDT treatment, the survival of well differentiated KYSE-450 cells and ATRA-treated KYSE-70 cells were reduced compared to poorly differentiated KYSE-70 cells. Cell viability differed significantly between ATRA-treated and non-treated KYSE-70 cells after PDT treatment (54.28% ± 3.64% vs 36.23% ± 7.43%, P < 0.001). The percentage of apoptotic cells in ATRA-induced KYSE-70 cells was less than that in non-treated KYSE-70 cells (18.1% vs 33.3%, P < 0.05).
CONCLUSION: ATRA-induced cell differentiation decreases photodynamic sensitivity of esophageal cancer KYSE-70 cells possibly by inducing resistance to apoptosis.
- Citation: Sun L, Li Y, Shi Y, Liu XL, Yang GR, Zhao LQ, Yang XJ, Qiu YB, Zhang YB, Ji X, Kang QZ, Ji ZY. Photodynamic sensitivity of esophageal cancer KYSE-70 cells is attenuated by all-trans retinoic acid-induced differentiation. Shijie Huaren Xiaohua Zazhi 2011; 19(26): 2709-2716
- URL: https://www.wjgnet.com/1009-3079/full/v19/i26/2709.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i26.2709
光动力学疗法(Photodynamic therapy, PDT)是近20多年来应用于浅表肿瘤临床治疗的一种非手术替代疗法[1]. 选择性存积于肿瘤细胞内的光敏剂经特定波长的光照射激发后, 发生光物理化学反应, 产生活性氧等[1-3], 导致肿瘤细胞凋亡或坏死[4]; 或通过破坏肿瘤组织内的微血管循环系统, 使肿瘤细胞缺氧或营养匮乏而衰竭. 虽然以ALA为光敏剂的PDT(ALA-PDT)已经用于食管癌变的治疗[5], 但其具体杀伤机制还不十分清楚, 而且许多因素能影响PDT的效果[7-11]. 我们前期实验初步发现食管癌不同分化状态具有不同细胞内光敏剂合成蓄积能力并呈现PDT敏感性的差异[6], 为进一步验证食管癌细胞分化对PDT疗效的影响, 本研究利用公认的分化诱导剂全反式维甲酸对低分化的食管鳞癌KYSE-70细胞进行分化诱导, 并观察诱导分化后细胞对PDT处理的敏感性变化, 以期为临床提供理论指导.
高分化食管鳞癌细胞KYSE-450和低分化食管鳞癌细胞KYSE-70由美国ATCC提供. 5-ALA由PhotoCure ASA(挪威)提供. Bradford BCA蛋白质测定试剂盒购自Pierce公司. 流式双染试剂盒购自Biovision公司, 流式细胞仪为EPICS XL-MCL(Beckman Coulter公司, 美国). 荧光显微镜为Nikon TS100. MTT为Promega产品, RPMI 1640培养液购自Solarbio, 全反式维甲酸(ATRA)及其他试剂均购自Sigma.
1.2.1分化诱导的细胞增殖实验: 生长至80%左右融合的KYSE-70细胞用胰蛋白酶-EDTA消化, 按1.6×104个细胞/孔接种到96孔培养板, 37 ℃ 50 mL/L CO2培养箱培养过夜, 使细胞充分贴壁. 次日用含0.1 µmol/L、1.0 µmol/L、10.0 µmol/L、50.0 µmol/L ATRA的无血清RPMI 1640液孵育细胞, 并设血清组和无ATRA空白对照, 分别孵育24 h、48 h、72 h、96 h后, 每孔加入20 µL MTT液, 37 ℃ 4 h, 测定490 nm处的光吸收值. 所有试验均设5个平行孔, 至少重复2次. 以血清组对照孔设置为100%, 其他试验孔以此为对照计算细胞存活率(%).
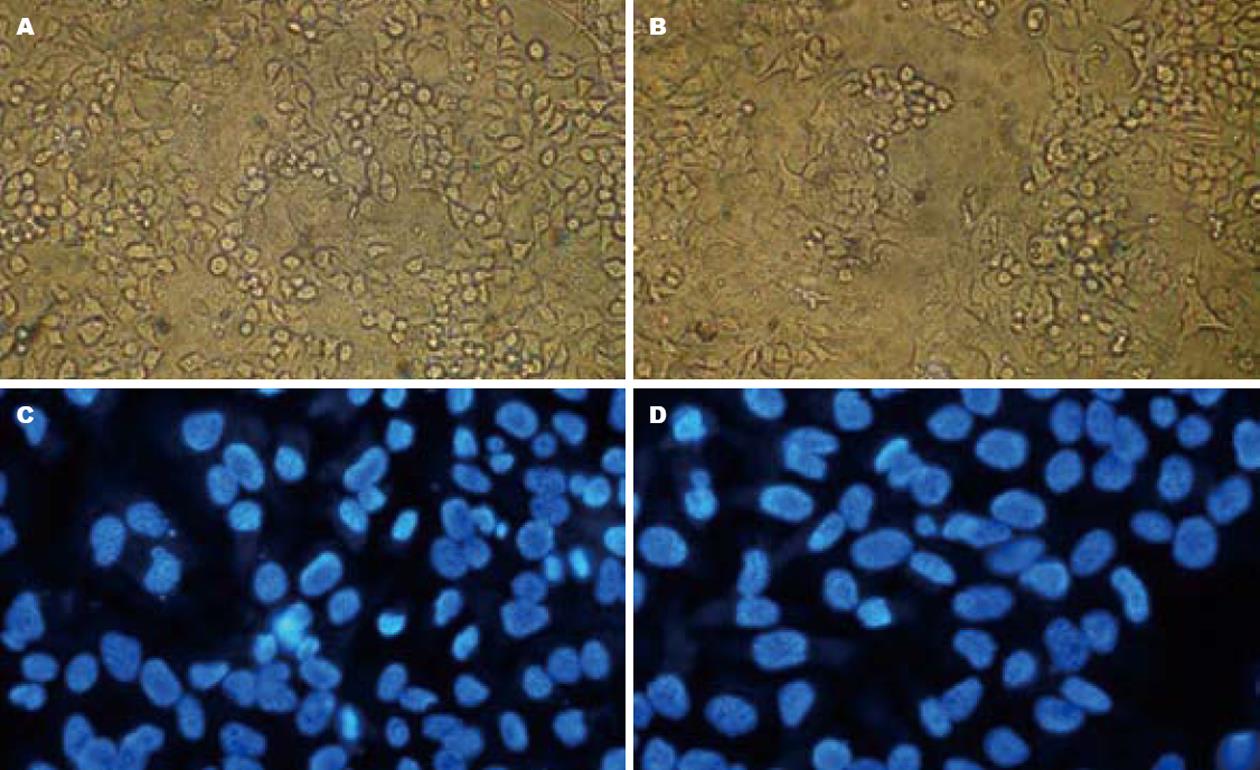
1.2.2 分化形态学鉴定: 生长至80%左右融合的KYSE-70细胞用胰蛋白酶-EDTA消化, 接种4×105个细胞至6孔培养板, 37 ℃ 50 mL/L CO2培养箱培养过夜, 使细胞充分贴壁. 次日用含1 µmol/L ATRA的无血清RPMI 1640液孵育72 h, 隔天换液, 在倒置显微镜下仔细观察并拍照, 记录细胞状态. 之后利用Hoechst 33342染色, 工作浓度4 µg/mL, 染色时间10 min, 收获细胞, PBS洗涤一次后荧光显微镜观察. 以上操作须在弱光下进行, 所有试验均设3个平行孔, 至少2次重复试验.
1.2.3 PDT处理及细胞存活率测定: KYSE-70、KYSE-450细胞按1.6×104个细胞/孔接种到96孔培养板, 次日用含1 µmol/L ATRA的无血清RPMI 1640液孵育细胞72 h后, 吸去ATRA诱导液, 用含1 mmol/L ALA的无血清RPMI 1640液孵育4 h后, 立即PDT处理. 采用可见蓝光(波长450 nm)照射, 光照剂量设定7.5 mJ/cm2, 75 mJ/cm2, 150 mJ/cm2, 225 mJ/cm2, 300 mJ/cm2, 并设无光照射和无ALA空白对照. 处理完毕立即更换新鲜含10%小牛血清的培养液, 37 ℃ 50 mL/L CO2培养箱孵育24 h. 然后每孔加入20 µL MTT液, 37 ℃ 4 h, 测定490 nm处的光吸收值. 所有试验均设6个平行孔, 至少重复2次. 以无ALA但用相同光剂量处理的对照孔设置为100%, 其他试验孔以此为对照计算细胞存活率(%)并绘图.
1.2.4 细胞凋亡染色鉴定: 生长至80%左右融合的KYSE-70细胞用胰蛋白酶-EDTA消化, 接种4×105个细胞至6孔培养板, 37 ℃ 50 mL/L CO2培养箱培养过夜, 使细胞充分贴壁. 次日用含不同浓度ATRA的无血清RPMI 1640液孵育72 h, 隔天换液, 并设KYSE-70和KYSE-450对照组, 孵育72 h后用含1 mmol/L ALA的无血清RPMI 1640液孵育4 h后, 立即PDT处理. 采用可见蓝光(波长450 nm)照射, 光照剂量为225 mJ/cm2和270 mJ/cm2(细胞杀伤率均为75%), 倒置显微镜观察并拍照, 记录细胞状态. 之后利用Hoechst 33342染色, 工作浓度4 µg/mL, 染色时间10 min, 收获细胞, PBS洗涤1次后荧光显微镜观察并拍照. 以上操作须在弱光下进行, 所有试验均设3个平行孔, 至少2次重复试验.
1.2.5 细胞凋亡流式检测: AnnexinV-FITC/PI流式法检测细胞凋亡率. 接种4×105个细胞至6孔培养板, 1 µmol/L ATRA的无血清RPMI 1640液孵育细胞72 h后, 1 mmol/L ALA处理4 h, 蓝光光照, 光剂量分别为180 mJ/cm2, 225 mJ/cm2和270 mJ/cm2(杀伤率均为75%的光剂量). 收获细胞, 加入500 µL的BindingBuffer悬浮细胞; 加入5 µL AnnexinV-FITC混匀后, 加入10 µL Propidium Iodide, 混匀, 室温避光反应10 min, 于1 h内流式细胞仪检测细胞凋亡率.
ATRA诱导72 h后的细胞变扁平, 体积增大, 胞质密度减低, 核变大, 核密度亦减低, 细胞间隙加宽(图1).
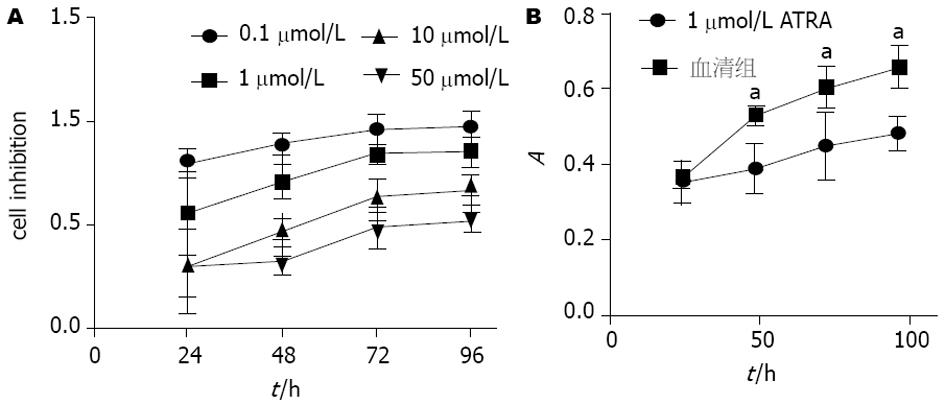
KYSE-70细胞用不同浓度的ATRA处理, 分别诱导24 h、48 h、72 h、96 h后测得的细胞存活率曲线见图2A, 各组的A值和抑制率相比差异分别有统计学意义(P<0.05), 药物浓度越高、作用时间越长, 其抑制作用越强. 1 µmol/L ATRA作用72 h时, 抑制率为0.85±0.05, 利于后续实验的检测. 其后曲线趋于平缓, l µmol/L ATRA作用96 h后, 抑制率为0.86±0.07, 与72 h时的抑制率基本一致, 抑制率达到最大. 以1 µmol/L的ATRA作用KYSE-70细胞后的MTT结果显示能显著抑制细胞增殖, 细胞生长缓慢(图2B). 后续实验均采用l µmol/L的ATRA浓度, 作用时间为72 h.
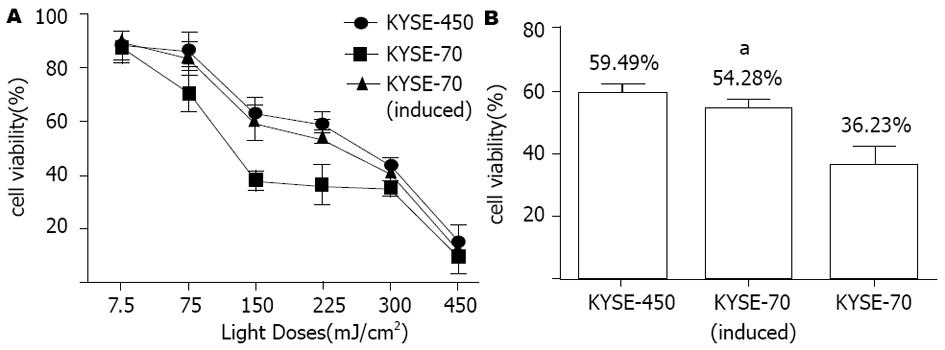
高分化KYSE450、分化诱导后的KYSE-70细胞和未诱导KYSE-70细胞用ALA处理后进行蓝光PDT, MTT结果显示高分化KYSE-450和分化诱导后KYSE-70的细胞存活率明显高于未诱导细胞(图3A), 而高分化KYSE-450细胞敏感性略微低于分化诱导后的KYSE-70细胞. 当光剂量为225 mJ/cm2时, 诱导前后细胞存活率分别为36.23%±7.43%和54.28%±3.64%, 有极显著差异(P<0.001, 图3B). 结果显示肿瘤细胞的不同分化状态影响了PDT效果, 细胞分化诱导后增强了对PDT的抵御能力.
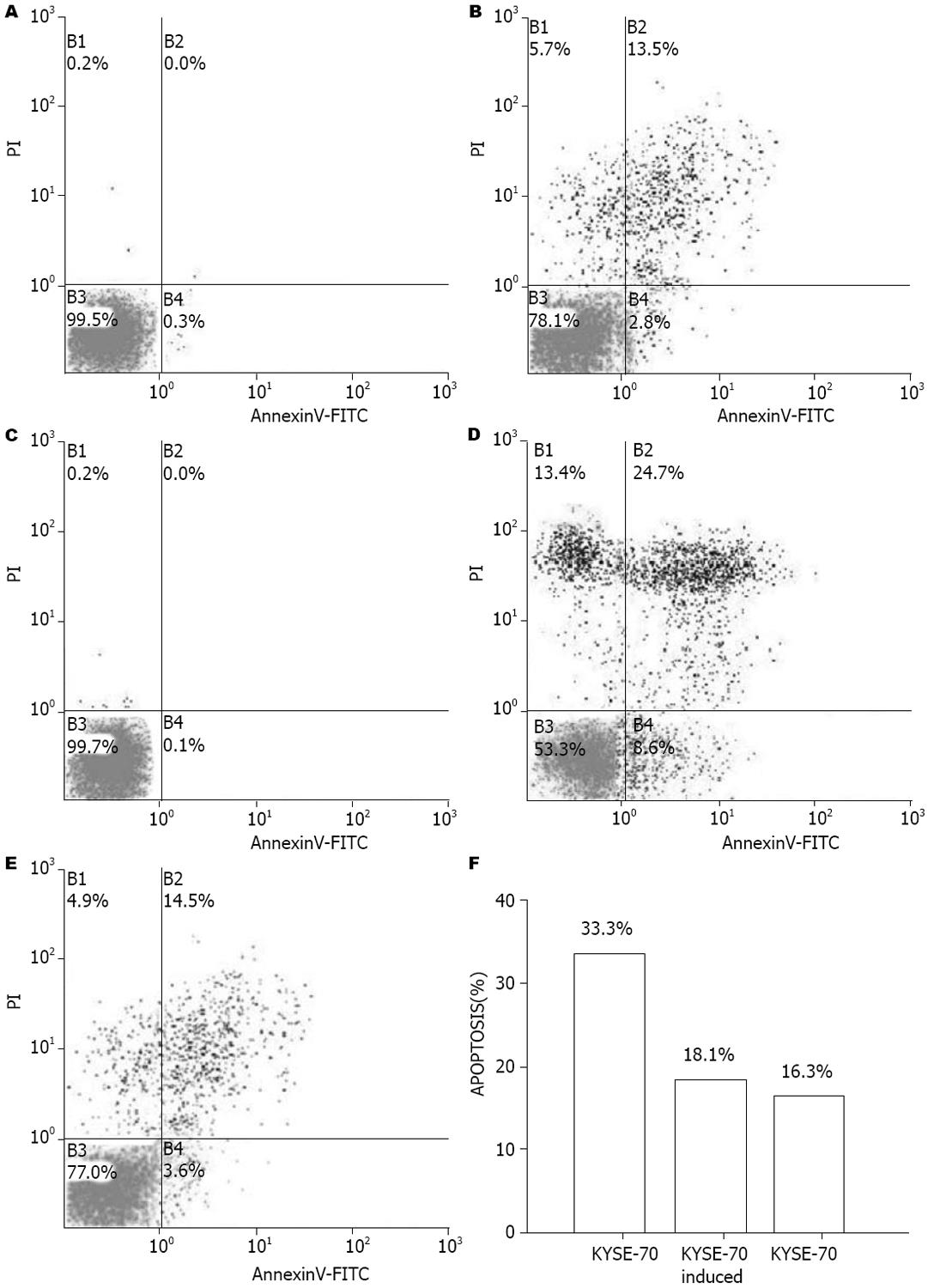
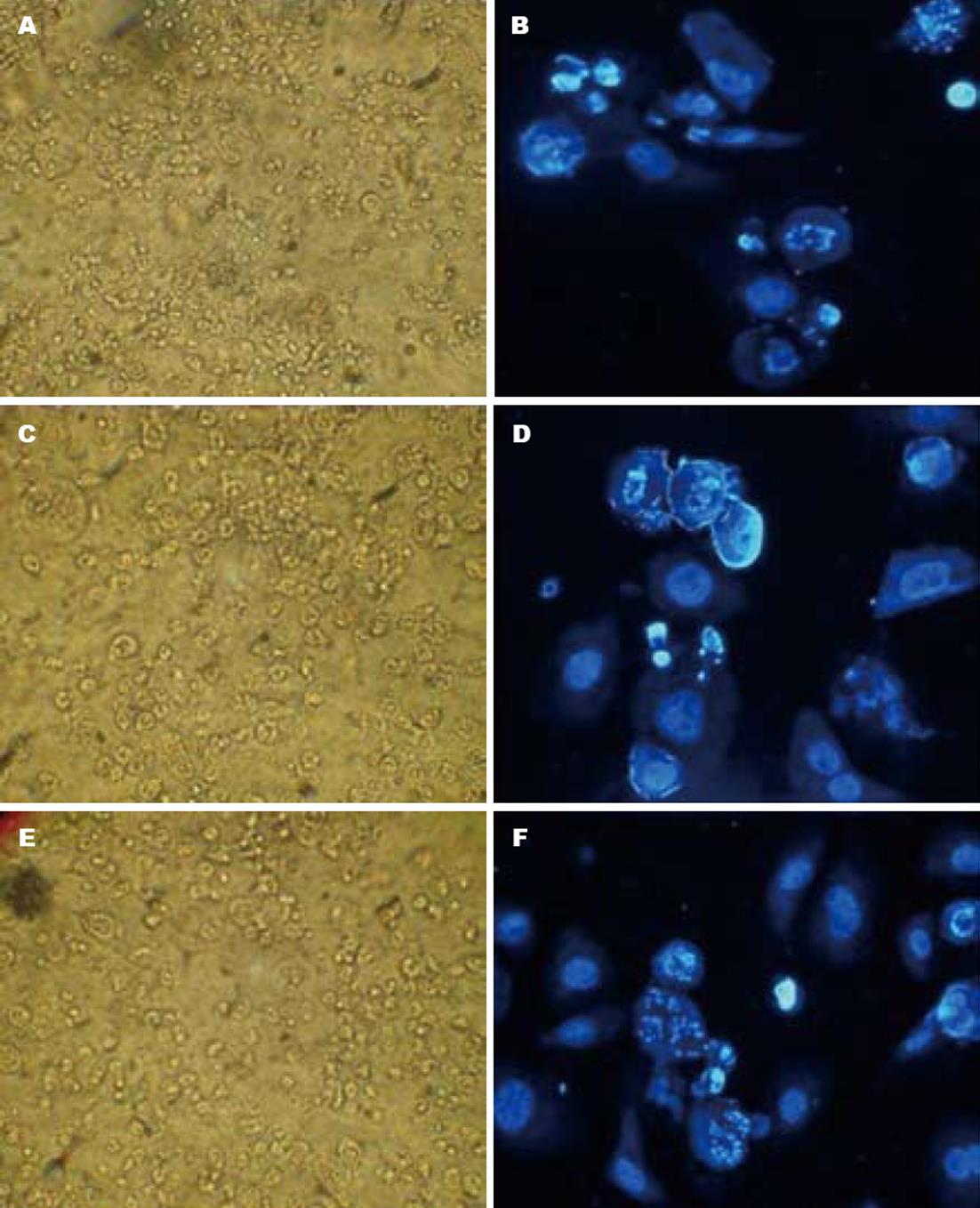
为了解ALA-PDT对KYSE-450和诱导前后KYSE-70细胞的光毒性诱导的细胞凋亡状况, 使用流式细胞仪测定细胞凋亡率. KYSE-450、KYSE-70和分化诱导KYSE-70分别使用的光剂量为270 mJ/cm2、180 mJ/cm2和225 mJ/cm2光照强度, 在此光剂量下三者细胞死亡率均为75%左右. PDT后24 h KYSE-450细胞凋亡率为16.3%, 诱导前KYSE-70细胞凋亡率为33.3%, 诱导后则降至18.1%(图4), 提示抑制细胞凋亡是细胞分化增强对PDT抵御能力的重要机制之一.
为进一步验证PDT诱导的细胞凋亡, PDT处理后24 h的细胞用Hoechst 33342染色, 荧光显微镜观察, 结果见图5. 非凋亡细胞核染色均一, 凋亡细胞核明显凝集变亮, 呈边缘化或裂解. 显微镜下记数的细胞凋亡率基本与流式法结果相符.
许多因素能影响PDT临床疗效, 这些因素除了光敏剂、不同波长的光[12]及氧分子[13-15]以外, 还包括凋亡相关基因的表达状况及肿瘤细胞的分化状态等[16-19]. 阐明影响食管癌PDT疗效的因素与机制, 对于探讨提高PDT临床疗效的新方法和新思路, 为临床上能够预测PDT疗效, 针对不同肿瘤患者制定合理的个体化治疗方案, 或通过干预癌组织的生物学性状而提高肿瘤患者临床PDT的疗效具有重要意义. 我们前期实验初步发现高分化食管鳞癌KYSE-450细胞比低分化KYSE-70细胞PDT敏感性差, 为进一步验证此结果, 我们利用ATRA对低分化KYSE-70细胞进行分化诱导, 经ALA孵育后PDT处理, 发现分化诱导后的KYSE-70细胞具有较低的细胞PDT光毒毒性, 结果进一步显示食管鳞癌细胞的分化影响了PDT效果.
ALA是一种内源性光敏剂[20], 之所以称为内源性光敏剂是因为他是细胞合成血红蛋白的前体, ALA本身无光毒性, 而是通过他的代谢产物原卟啉IX(PpIXp)发挥作用[21]. ALA在胞质中经过胆色素原、尿卟啉、粪卟啉、原卟啉原Ⅲ等途径, 进入线粒体内形成PpIX, 最后在亚铁原卟啉合成酶(Ferrochelatase)催化下成为血红素[22,23]. 在此过程中ALA的产生受Heme的反馈抑制, 当有外源性ALA存在的情况下则解除了这种反馈抑制, 增强了PpIX的合成. 另外限速酶亚铁原卟啉合成酶亦有PpIX合成调控作用[6,22]. 肿瘤细胞内这些代谢酶活性可存在差异, 结果造成PpIX在线粒体内的浓度有所不同, 这可以部分解释不同肿瘤细胞的PDT敏感性差异的结果. 但本实验分化诱导前后PDT结果表明, 分化诱导后肿瘤细胞PDT效果较差, 况且我们前期实验结果表明虽然高分化细胞含较高浓度的PpIX, 但具备一定的抵御PDT毒性作用, 结果进一步提示分化程度造成的不同PpIX积累能力并不是决定PDT效应的唯一因素, 食管癌细胞的分化过程可能形成了某一种机制, 增强了细胞对外界刺激的抵御能力.
全反式维甲酸是维生素A的一种重要衍生物[24,25], 随着全反式维甲酸治疗急性早幼粒细胞性白血病的成功实践, 目前已广泛被作为分化诱导剂应用于肿瘤治疗领域[26-28]. 随着分子生物学研究的深入及对肿瘤多因素多阶段渐进发病机理的认识, 肿瘤的临床治疗趋向于多学科综合治疗. PDT亦能与肿瘤的其他疗法相结合, 如手术切除后结合使用PDT杀死残留的癌细胞[29,31]. 然而本实验中分化诱导后的KYSE-70细胞和未诱导KYSE-70细胞用ALA处理后进行蓝光PDT, MTT显示经分化诱导后的食管鳞癌细胞PDT敏感性明显差于未诱导的低分化食管鳞癌细胞, 提示细胞分化诱导疗法不仅不能增强食管鳞癌细胞PDT效应, 反而降低疗效. PDT对肿瘤细胞的杀伤作用大多是通过诱导凋亡与坏死两种机制的结合, PDT后肿瘤细胞死亡是以凋亡为主还是以坏死为主与许多因素有关[5,16]. 本研究发现ALA-PDT引起的分化诱导后的KYSE-70细胞凋亡率由诱导前的33.3%降至18.1%, Hoechst 33342染色后, 荧光显微镜下也可发现胞核凝集与裂解等典型的凋亡特征, 显微镜下记数的细胞凋亡率基本与流式法结果相符, 提示分化诱导后肿瘤细胞对PDT的抵御作用部分通过抑制凋亡而实现.
食管癌是世界上六大常见的恶性肿瘤之一, 目前仍是引起人类死亡的主要原因, 所以寻求食管癌的综合治疗方法是治疗食管癌的方向之一. 细胞分化疗法与PDT疗法相结合能否提高PDT疗效对临床具有重要的指导意义,因此食管癌细胞的分化诱导是否能影响光动力学效应的探究能对食管癌临床治疗提供理论指导.
姜春萌, 教授, 大连医科大学附属第二医院消化科; 张军, 教授, 西安交通大学医学院第二附属医院消化内科
目前此领域的研究热点、重点是 有关PDT的作用机制和影响PDT疗效因素的研究, 新型光敏剂的研发, PDT治疗与其他治疗方法的结合.
本课题组曾以高分化食管鳞癌细胞KYSE-450和低分化食管鳞癌细胞KYSE-70为研究对象, 利用荧光分光光度法测定不同浓度ALA处理后细胞内PpIX的浓度, 分别使用不同剂量的红光和蓝光对细胞进行照射处理, MTS法测定PDT对细胞的光毒毒性; 发现高分化KYSE-450细胞比低分化KYSE-70细胞具有更强的PpIX合成或累积水平, 高分化细胞虽然PpIX产量高于低分化细胞, 但无论是红光PDT还是蓝光PDT, 其敏感性均明显差于低分化细胞.
虽然以ALA为光敏剂的PDT已经用于食管癌及癌前病变的治疗, 但其具体杀伤机制还不十分清楚, 而且许多因素能影响PDT的效果. 阐明影响食管癌PDT疗效的因素与机制, 对于探讨提高PDT临床疗效的新方法和新思路, 为临床上能够预测PDT疗效, 针对不同肿瘤患者制定合理的个体化治疗方案, 或通过干预癌组织的生物学性状而提高肿瘤患者临床PDT的疗效具有重要意义. 本研究结果显示经分化诱导后的食管鳞癌细胞PDT敏感性明显差于未诱导的食管鳞癌细胞, 提示细胞分化诱导疗法不仅不能增强PDT效应, 反而降低疗效. 结果对食管癌临床PDT治疗具有指导意义.
光动力学疗法: 经口服或局部应用的光敏剂能选择性积蓄于肿瘤细胞和组织内, 在分子氧的存在下, 经特定波长的可见光激发能产生单态氧和氧自由基等活性物质, 导致肿瘤细胞凋亡或坏死.
本实验设计合理, 采用方法实用, 结果可靠, 结论客观, 对临床治疗有指导意义.
编辑: 曹丽鸥 电编:何基才
| 2. | Usuda J, Ichinose S, Ishizumi T, Hayashi H, Ohtani K, Maehara S, Ono S, Honda H, Kajiwara N, Uchida O. Outcome of photodynamic therapy using NPe6 for bronchogenic carcinomas in central airways > 1.0 cm in diameter. Clin Cancer Res. 2010;16:2198-2204. [PubMed] [DOI] |
| 3. | Hilf R. Mitochondria are targets of photodynamic therapy. J Bioenerg Biomembr. 2007;39:85-89. [PubMed] [DOI] |
| 4. | Barge J, Decréau R, Julliard M, Hubaud JC, Sabatier AS, Grob JJ, Verrando P. Killing efficacy of a new silicon phthalocyanine in human melanoma cells treated with photodynamic therapy by early activation of mitochondrion-mediated apoptosis. Exp Dermatol. 2004;13:33-44. [PubMed] [DOI] |
| 5. | Wainwright M. Photodynamic therapy: the development of new photosensitisers. Anticancer Agents Med Chem. 2008;8:280-291. [PubMed] [DOI] |
| 6. | 汲 振余, 赵 立群, 杨 观瑞, 薛 乐勋, 索 振河, Nesland JM, 彭 迁. 食管鳞癌细胞分化状态对内源性光敏剂PpIX产量的影响及对PDT的应答. 世界华人消化杂志. 2006;14:6-11. [DOI] |
| 7. | Jeong E, Hong JW, Min JA, Lee DW, Sohn MY, Lee WJ, Lee JY, Park YM. Topical ALA-Photodynamic Therapy for Acne Can Induce Apoptosis of Sebocytes and Down-regulate Their TLR-2 and TLR-4 Expression. Ann Dermatol. 2011;23:23-32. [PubMed] [DOI] |
| 8. | Marrero A, Becker T, Sunar U, Morgan J, Bellnier D. Aminolevulinic acid-photodynamic therapy combined with topically applied vascular disrupting agent vadimezan leads to enhanced antitumor responses. Photochem Photobiol. 2011;87:910-919. [PubMed] [DOI] |
| 9. | Robertson CA, Abrahamse H. The in vitro PDT efficacy of a novel metallophthalocyanine (MPc) derivative and established 5-ALA photosensitizing dyes against human metastatic melanoma cells. Lasers Surg Med. 2010;42:766-776. [PubMed] [DOI] |
| 10. | Lin HP, Chen HM, Yu CH, Yang H, Wang YP, Chiang CP. Topical photodynamic therapy is very effective for oral verrucous hyperplasia and oral erythroleukoplakia. J Oral Pathol Med. 2010;39:624-630. [PubMed] [DOI] |
| 11. | Choi MS, Yun SJ, Beom HJ, Park HR, Lee JB. Comparative study of the bactericidal effects of 5-aminolevulinic acid with blue and red light on Propionibacterium acnes. J Dermatol. 2011;38:661-666. [PubMed] [DOI] |
| 12. | Busch TM, Xing X, Yu G, Yodh A, Wileyto EP, Wang HW, Durduran T, Zhu TC, Wang KK. Fluence rate-dependent intratumor heterogeneity in physiologic and cytotoxic responses to Photofrin photodynamic therapy. Photochem Photobiol Sci. 2009;8:1683-1693. [PubMed] [DOI] |
| 13. | Wang HW, Putt ME, Emanuele MJ, Shin DB, Glatstein E, Yodh AG, Busch TM. Treatment-induced changes in tumor oxygenation predict photodynamic therapy outcome. Cancer Res. 2004;64:7553-7561. [PubMed] [DOI] |
| 14. | Mitra S, Cassar SE, Niles DJ, Puskas JA, Frelinger JG, Foster TH. Photodynamic therapy mediates the oxygen-independent activation of hypoxia-inducible factor 1alpha. Mol Cancer Ther. 2006;5:3268-3274. [PubMed] [DOI] |
| 15. | Hirata Y, Koga S, Fukui N, Yu A, Koshida S, Kosaka Y, Kurokawa T, Moriwaki S. 5-Aminolevulinic acid-mediated photodynamic therapy to superficial malignant skin tumors using Super Lizer. J Dermatol. 2011;38:748-754. [PubMed] [DOI] |
| 16. | Juzeniene A, Peng Q, Moan J. Milestones in the development of photodynamic therapy and fluorescence diagnosis. Photochem Photobiol Sci. 2007;6:1234-1245. [PubMed] [DOI] |
| 17. | Wu Y, Xing D, Chen WR. Single cell FRET imaging for determination of pathway of tumor cell apoptosis induced by photofrin-PDT. Cell Cycle. 2006;5:729-734. [PubMed] [DOI] |
| 18. | Kinzler I, Haseroth E, Hauser C, Rück A. Role of mitochondria in cell death induced by Photofrin-PDT and ursodeoxycholic acid by means of SLIM. Photochem Photobiol Sci. 2007;6:1332-1340. [PubMed] [DOI] |
| 19. | Juarranz A, Jaén P, Sanz-Rodríguez F, Cuevas J, González S. Photodynamic therapy of cancer. Basic principles and applications. Clin Transl Oncol. 2008;10:148-154. [PubMed] [DOI] |
| 20. | 李步红, 谢树森, HUANG Zheng, WILSON Brian C. 光动力学疗法剂量学的研究进展. 生物化学与生物物理进展. 2009;36:676-683. |
| 21. | Blake E, Curnow A. The hydroxypyridinone iron chelator CP94 can enhance PpIX-induced PDT of cultured human glioma cells. Photochem Photobiol. 2010;86:1154-1160. [PubMed] [DOI] |
| 22. | 汲 振余, 范 天黎, 赵 立群, 杨 小静, 裘 一兵, 张 聚真, 张 亚冰, 孙 予, 裘 宋良, 杨 观瑞. 光敏剂PpIX亚细胞分布方式对食管癌细胞光动力学效应的影响. 世界华人消化杂志. 2009;17:1602-1608. [DOI] |
| 23. | Dögnitz N, Salomon D, Zellweger M, Ballini JP, Gabrecht T, Lange N, van den Bergh H, Wagnières G. Comparison of ALA- and ALA hexyl-ester-induced PpIX depth distribution in human skin carcinoma. J Photochem Photobiol B. 2008;93:140-148. [PubMed] [DOI] |
| 24. | Park JH, Qiao B, Panageas KS, Schymura MJ, Jurcic JG, Rosenblat TL, Altman JK, Douer D, Rowe JM, Tallman MS. Early death rate in acute promyelocytic leukemia remains high despite all-trans retinoic acid. Blood. 2011;118:1248-1254. [PubMed] [DOI] |
| 25. | Park SH, Lim JS, Jang KL. All-trans retinoic acid induces cellular senescence via upregulation of p16, p21, and p27. Cancer Lett. 2011;310:232-239. [PubMed] [DOI] |
| 27. | Hong SD, Kim YK, Kim HN, Lee SR, Ahn JS, Yang DH, Lee JJ, Lee IK, Shin MG, Kim HJ. Treatment outcome of all-trans retinoic acid/anthracycline combination chemotherapy and the prognostic impact of FLT3/ITD mutation in acute promyelocytic leukemia patients. Korean J Hematol. 2011;46:24-30. [PubMed] |
| 28. | Uruno A, Noguchi N, Matsuda K, Nata K, Yoshikawa T, Chikamatsu Y, Kagechika H, Harigae H, Ito S, Okamoto H. All-trans retinoic acid and a novel synthetic retinoid tamibarotene (Am80) differentially regulate CD38 expression in human leukemia HL-60 cells: possible involvement of protein kinase C-delta. J Leukoc Biol. 2011;90:235-247. [PubMed] [DOI] |
| 29. | Separovic D, Bielawski J, Pierce JS, Merchant S, Tarca AL, Ogretmen B, Korbelik M. Increased tumour dihydroceramide production after Photofrin-PDT alone and improved tumour response after the combination with the ceramide analogue LCL29. Evidence from mouse squamous cell carcinomas. Br J Cancer. 2009;100:626-632. [PubMed] [DOI] |
| 30. | Lechardeur D, Dougaparsad S, Nemes C, Lukacs GL. Oligomerization state of the DNA fragmentation factor in normal and apoptotic cells. J Biol Chem. 2005;280:40216-40225. [PubMed] [DOI] |
| 31. | Chan A, Blumenkranz MS, Wu KH, Wang G, Berker N, Parast LM, Sanislo SR. Photodynamic therapy with and without adjunctive intravitreal triamcinolone acetonide: a retrospective comparative study. Ophthalmic Surg Lasers Imaging. 2009;40:561-569. [PubMed] [DOI] |