修回日期: 2011-09-09
接受日期: 2011-08-20
在线出版日期: 2011-09-08
目的: 探讨结肠癌患者肿瘤组织中Nanog、Oct-4、SOX-2表达情况及其对远处转移的预测作用.
方法: 采用免疫组织化学方法检测经手术切除的80例结肠癌术后标本中Nanog、Oct-4、SOX-2表达情况, 并且对三种指标的表达同肿瘤分化程度、分期和术后复发转移关系进行分析.
结果: 80例患者有35例出现复发转移, SOX-2、Oct-4、Nanog在转移组患者中表达率分别为48.57%(17/35)、51.43%(18/35)、60%(21/35), 在非转移组中表达率分别为17.78%(8/45)、13.33%(6/45)、26.67%(12/45). 差异有统计学意义. 原发灶分化程度仅同Nanog表达差异有统计学意义(P = 0.001). 但是三指标表达同T分期和N分期没有明显联系. 三者均为表达阳性其转移率明显高于均为阴性转移率, 生存分析显示不同表达状态其远处转移出现时间差异有统计学意义(P = 0.0001).
结论: 组织中Nanog、Oct-4、SOX-2表达同结肠癌术后复发转移发生相关, 联合检测有助于评估肿瘤转移情况.
引文著录: 李宁, 邓文英, 马懿辉, 陈小兵, 韩黎丽, 吕慧芳, 陈贝贝, 罗素霞. 干细胞标志物Nanog、Oct-4、SOX-2表达与结肠癌术后复发转移关系. 世界华人消化杂志 2011; 19(25): 2644-2648
Revised: September 9, 2011
Accepted: August 20, 2011
Published online: September 8, 2011
AIM: To investigate the expression of Nanog, Oct-4 and SOX-2 in colonic carcinoma and to analyze their relationship with tumor metastasis.
METHODS: Immunohistochemistry was used to evaluate the expression of Nanog, Oct-4 and SOX-2 in 80 colonic cancer surgical specimens. The correlation of Nanog, Oct-4 and SOX-2 expression with tumor histological differentiation, T stage, N stage and metastasis was analyzed.
RESULTS: Thirty-five patients had metastasis. The positive rates of SOX-2, Oct-4 and Nanog expression were significantly higher in the metastasis group than in the non-metastasis group (48.57% vs 17.78%, 51.43% vs 13.33%, 60% vs 26.67%, all P < 0.05). Nanog expression was significantly correlated with differentiation (P = 0.001), but expression of Nanog, Oct-4 and SOX-2 was not associated with T stage or N stage. Metastatic rate was higher in patients with positive expression of the three markers than in those with negative expression. Survival analysis showed that the time to develop metastasis was significant different among patients with differential expression of the three markers (P = 0.0001).
CONCLUSION: The expression of Nanog, Oct-4 and SOX-2 in tumor tissue can predict the postoperative metastasis of colonic cancer. Nanog, Oct-4 and SOX-2 are promising predictors for metastasis of colonic cancer.
- Citation: Li N, Deng WY, Ma YH, Chen XB, Han LL, Lv HF, Chen BB, Luo SX. Correlation of expression of Nanog, Oct-4 and SOX-2 with tumor metastasis in colonic cancer. Shijie Huaren Xiaohua Zazhi 2011; 19(25): 2644-2648
- URL: https://www.wjgnet.com/1009-3079/full/v19/i25/2644.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i25.2644
近几年来, 世界范围内结肠癌的发病率和病死率逐年上升, 多数肿瘤患者无法获得根治, 易于复发转移. 目前飞速发展的肿瘤干细胞理论为肿瘤的治疗带来新希望. 该理论认为肿瘤组织中存在部分有干细胞特性的细胞, 具有无限增殖和自我更新能力, 成为肿瘤生长、复发及转移的根源. 寻找特异性的干细胞表面标志物, 通过其分选肿瘤干细胞, 是进一步治愈恶性肿瘤的关键.
早在1989年就有学者在小鼠成体的各种组织及不同发育阶段的胚胎中检测到一系列因子, 因其能与基因启动子或增强子区域的八聚体模序位点结合而命名为Oct-4[1]. Oct-4基因定位于人类染色体6p21.3, 是维持细胞多能性所必需的, 参与胚胎发育过程中多向性分化的调节[2]. 2003年Mitsui等[3]在胚胎干细胞中发现了另一个新的转录因子, 命名为Nanog. 基础研究表明在卵巢表面上皮[4]、胃癌[5]、膀胱癌[6]和脑胶质瘤[7]的细胞中均能检测到Nanog阳性表达, 但在分化成熟的体细胞中为阴性表达[8]. 作为另一个胚胎干细胞转录因子, SOX-2在维持胚胎干细胞的干性方面同样发挥重要的作用[9], 并且在多种肿瘤组织中可以检测到SOX家族成员, 比如小细胞肺癌、脑膜瘤、胰腺癌等[10-13]. 但是, 在结肠癌组织中SOX-2、Oct-4、Nanog表达情况如何, 三者表达同结肠癌术后的复发转移关系如何目前还不清楚. 因此, 本研究旨在分析结肠癌组织中Nanog、Oct-4、SOX-2基因的表达情况, 探讨干细胞标志物表达情况同结肠癌术后复发转移的关系, 为结肠癌干细胞研究提供一定的理论基础.
随机选取2008-01/2008-12在我院确诊的Dukes'C期结肠癌患者80例. 男38例, 女42例, >60岁患者21例, ≤60岁59例, 中位年龄52岁. 术前未行治疗, 术前检查及术中探查均未发现远处转移. 术后行辅助FOLFOX6方案化疗10-12个疗程, 每位患者每3-4 mo复查胸、腹部CT等, 如CT提示肺、肝吻合口或局部淋巴结转移时, 可再行局部穿刺、MRI、PET-CT等检查证实, 以CT检查时间为转移发生时间.
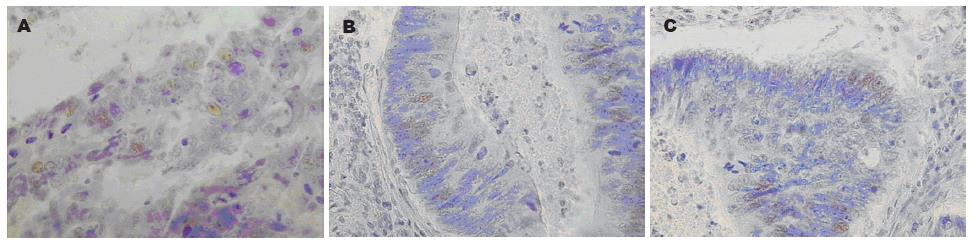
采用SP免疫组织化学方法, 严格按照试剂盒说明书检测Nanog, Oct-4和SOX-2(一抗: Santa Cruz公司)在肿瘤组织中的表达. 免疫组织化学评价标准: 由有经验的病理科医师单盲阅片, 在10×40倍显微镜下观察记数, 每张切片随机选择5个视野, 每个视野记数200个细胞. Nanog、SOX-2、Oct-4抗原阳性反应为位于细胞核内的棕黄色颗粒, 阳性表达程度判断: 阳性细胞数≥10%为阳性表达, <10%为阴性染色.
统计学处理 采用SPSS10.0统计软件包进行数据整理和统计分析. 比较Nanog、Oct-4、SOX-2蛋白表达水平与转移关系时采用χ2检验; 比较表达情况对远处转移出现时间影响时采用Kaplan-Meier生存分析法.
所有患者, 均可评价Nanog、SOX-2、Oct-4染色情况. 随访率100%, 中位随访时间2年. 以复发转移是否发生将患者分为转移组和非转移组. 共有35(43.75%)名患者确诊复发转移, 其中10例为局部吻合口复发, 11例为单个脏器转移, 14例为多发脏器转移.
在转移组中共有17(48.57%)名患者SOX-2阳性表达, 而非转移组中共有8(17.78%)名患者阳性表达, 两组差异有统计学意义(P = 0.001). 同时, 虽然原发灶不同分化程度、不同T分期和N分期中SOX-2表达存在差异, 但是差异没有统计学意义(表1, 图1).
| 临床特征 | n | SOX-2表达 | Nanog表达 | Oct-4表达 | |||
| n | P值 | n | P值 | n | P值 | ||
| 分化程度 | 0.408 | 0.001 | 0.151 | ||||
| 分化型 | 33 | 12 | 5 | 7 | |||
| 未分化型 | 47 | 13 | 28 | 17 | |||
| T分期 | 0.832 | 0.100 | 0.592 | ||||
| T1/T2 | 43 | 13 | 20 | 14 | |||
| T3/T4 | 37 | 12 | 13 | 10 | |||
| N分期(阳性淋巴结数) | 0.124 | 0.407 | 0.071 | ||||
| <4个 | 41 | 16 | 14 | 16 | |||
| ≥4个 | 39 | 9 | 10 | 8 | |||
| 转移 | 0.001 | 0.003 | 0.001 | ||||
| 有 | 35 | 17 | 21 | 18 | |||
| 无 | 45 | 8 | 12 | 6 | |||
在转移组中共有18(51.43%)名患者Oct-4阳性表达, 而非转移组中共有6(13.33%)名患者阳性表达, 两组差异有统计学意义(P = 0.001). 同时, 虽然原发灶不同分化程度、不同T分期和N分期中Oct-4表达存在差异, 但是差异没有统计学意义(表1, 图1).
在转移组中共有21(60%)名患者Nanog阳性表达, 而非转移组中共有12(26.67%)名患者阳性表达, 两组差异有统计学意义(P = 0.003). 同时, 原发灶不同分化程度Nanog表达差异有统计学意义, 但是不同T分期和N分期中Nanog表达存在差异, 但是差异没有统计学意义(表1, 图1).
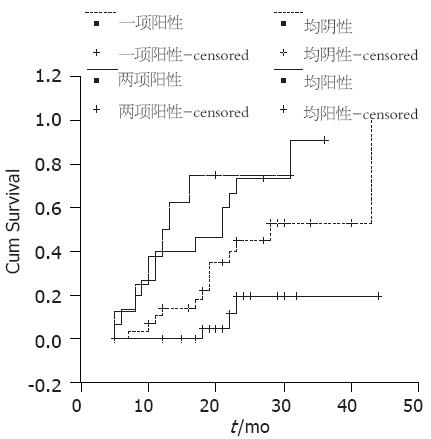
入组80例结肠癌患者, 三者均为阳性表达的患者为8例, 其中发生远处转移为6例, 任两指标为阳性表达为15例, 远处转移13例, 任一指标为阳性表达为29, 远处转移13例, 均为阴性表达为28例, 其中远处转移3例. 不同表达状态同远处转移差异有统计学意义(P = 0.0001). 两项及三项指标均阳性表达者转移发生率明显高于均阴性表达者(图2).
肿瘤干细胞理论认为[14]恶性肿瘤中存在一群数量较少的肿瘤干细胞, 在启动肿瘤形成和生长中起着决定性作用; 而其余多数肿瘤细胞都是肿瘤干细胞异常增殖分化形成的子代细胞, 仅具有有限的增殖及分化能力[15]. 而处于休眠状态的肿瘤干细胞因其处于G0期, 对放化疗都不敏感, 从而存活下来, 成为复发的根源. 因此只有针对肿瘤干细胞的治疗才可能出现持久疗效, 只有彻底清除肿瘤干细胞才能彻底治愈肿瘤.
目前, 在胚胎发育及维系胚胎干细胞干性相关基因研究方面取得较大进展, Oct-4、SOX-2、Nanog转录因子是细胞转录调节系统的重要部分, 共同维持胚胎干细胞的自我更新. 过表达Oct-4, Nanog和SOX-2的成体细胞能够恢复多能干细胞的特性[16,17]. 他们的缺失会直接影响正常细胞的生长发育[18-21], 同时在一些上皮性恶性肿瘤中检测到Oct-4呈高表达, 且其表达水平与上皮性恶性肿瘤发生、进展、转移及预后等密切相关[22,23]. 在脑胶质瘤[24]、乳腺癌及生殖系统肿瘤中同样可检测到Nanog高表达, 而SOX-2的高表达也在多种恶性肿瘤[25,26]中发现. 三种转录因子并不是孤立的发挥作用, 三者之间相互作用, 相互影响. 在冰冻乳腺癌标本中, 虽然研究例数不是很多(18例), 但是SOX-2高表达的患者同样有OCT-4和Nanog的高表达[27]. 在干细胞中下调SOX-2 mRNA水平后发现多种干细胞因子及调控子均下调, 包括Wnt传导通路也会表达下调[28]. 同样Oct-4和Nanog之间又是相互影响, Nanog部分依赖Oct-4[29]. 但是Nanog的调节并不是单靠Oct-4, 一个非常有趣的现象, 在Oct-4缺失的细胞中也能检测到Nanog的表达. 反之, 在Nanog缺失的细胞中, 仅有Oct-4的表达并不能保护细胞免受凋亡[28]. 总之, 可以说SOX-2, Nanog和Oct-4形成了胚胎干细胞自我更新转录系统的核心. 他们之间相互作用维持细胞干性[30,31].
本研究中, 80例结肠癌有33例出现Nanog蛋白阳性表达, 24例Oct-4蛋白阳性表达, 25例出现SOX-2蛋白阳性表达, 其阳性表达细胞多呈点状聚集, 少有灶状聚集, 说明即使Nanog、Oct-4、SOX-2阳性表达, 也只是少部分细胞表达, 这和肿瘤干细胞只占肿瘤组织的很少一部分理论是吻合的. 同时, 发生远处转移患者Nanog、Oct-4或SOX-2阳性表达率要高于没有发生转移的患者, 也说明Nanog、Oct-4、SOX-2蛋白高表达的肿瘤侵袭性要高于低表达的肿瘤. 在免疫组织化学读片中, 发现共有6例患者癌旁正常组织表达Nanog、Oct-4、SOX-2, 这样说明可能存在正常细胞发生恶性转变. 同样佐证了肿瘤是可能来源自成体干细胞恶性转变的假说.
三项指标均阳性表达的患者有6(75%)例出现了远处转移, 任两项指标为阳性表达为15例, 其中转移13(86.67%)例, 任一指标为阳性表达为29, 远处转移13例(44.83%), 均为阴性表达为28例, 其中远处转移3例(10.71%). 均为阳性表达的患者转移发生时间最早, 明显高于均为阴性患者. 三项指标的高表达属于不良预后因素, 提示肿瘤复发转移的风险较高. 联合检测对于预测结肠癌患者术后复发风险具有一定的临床应用价值.
肿瘤的发生发展、复发转移是非常复杂的过程, 众多基因、蛋白、信号传导通路参与其中. 目前, 随着肿瘤干细胞理论不断的完善和发展, 虽然仍然缺乏高特异性的生物学标记, 虽然还有许多问题没有解决, 但是利用干细胞理论, 靶向治疗肿瘤干细胞的研究已经处于基础试验阶段. 因此, 有理由相信干细胞标志物检测有重要的临床应用价值, 为正确检测肿瘤术后的复发转移提供了有力的帮助.
Oct-4、SOX-2、Nanog是细胞转录调节系统的重要部分, 共同维持胚胎干细胞的自我更新. 目前在很多肿瘤组织中发现具有自我更新能力的肿瘤细胞, 并通常表达一些胚胎干细胞因子.
陈卫昌, 教授, 苏州大学附属第一医院消化内科
基础研究发现, 从分离出的具有体外致瘤性的类干细胞肿瘤细胞中检测到Oct-4、SOX-2、Nanog基因的表达, 并且在多种肿瘤组织中也能检测了这些因子的表达. 但是其表达同肿瘤的生物学特性有什么关系成为目前肿瘤学研究的热点.
曹浩哲等报道了Oct-4在宫颈癌中的表达情况, 陈忠等报道了Nanog在胃癌中的表达情况, 但是联合分析三者在结肠癌中表达和复发转移关系的文章还较少.
本文首次报道了Oct-4、SOX-2、Nanog在结肠癌组织中的表达, 并对其表达和肿瘤的分化程度、分期及术后复发转移进行相关性分析, 对结肠癌患者术后复发转移的可能的机制进行了初步探讨.
本文对Oct-4、SOX-2、Nanog在结肠癌组织中的表达情况进行初步探讨, 为进一步深入研究结肠癌复发转移机制提供理论依据, 同时也为寻找合适靶标, 靶向治疗结肠癌提供帮助.
本文有一定的研究价值, 若增加研究的例数和延长随访时间则更具说服力.
编辑: 何基才 电编:何基才
| 2. | 王 海威, 王 家东. Oct-4蛋白在甲状腺肿瘤中的表达及意义. 临床耳鼻咽喉头颈外科杂志. 2010;24:682-685. |
| 3. | Mitsui K, Tokuzawa Y, Itoh H, Segawa K, Murakami M, Takahashi K, Maruyama M, Maeda M, Yamanaka S. The homeoprotein Nanog is required for maintenance of pluripotency in mouse epiblast and ES cells. Cell. 2003;113:631-642. [PubMed] [DOI] |
| 7. | 牛 朝诗, 倪 永丰, 陈 健民. 胶质母细胞瘤肿瘤干细胞的分离培养与生物学特性研究. 中国微侵袭神经外科杂志. 2009;14:25-28. |
| 8. | 文 雯, 翼 静, 郑 鹏生. Nanog基因在宫颈癌中的表达及其意义. 西安交通大学学报(医学版). 2010;31:26-31. |
| 10. | Dong C, Wilhelm D, Koopman P. Sox genes and cancer. Cytogenet Genome Res. 2004;105:442-447. [PubMed] [DOI] |
| 11. | Güre AO, Stockert E, Scanlan MJ, Keresztes RS, Jäger D, Altorki NK, Old LJ, Chen YT. Serological identification of embryonic neural proteins as highly immunogenic tumor antigens in small cell lung cancer. Proc Natl Acad Sci U S A. 2000;97:4198-4203. [PubMed] [DOI] |
| 12. | Comtesse N, Zippel A, Walle S, Monz D, Backes C, Fischer U, Mayer J, Ludwig N, Hildebrandt A, Keller A. Complex humoral immune response against a benign tumor: frequent antibody response against specific antigens as diagnostic targets. Proc Natl Acad Sci U S A. 2005;102:9601-9606. [PubMed] [DOI] |
| 13. | Sanada Y, Yoshida K, Ohara M, Oeda M, Konishi K, Tsutani Y. Histopathologic evaluation of stepwise progression of pancreatic carcinoma with immunohistochemical analysis of gastric epithelial transcription factor SOX2: comparison of expression patterns between invasive components and cancerous or nonneoplastic intraductal components. Pancreas. 2006;32:164-170. [PubMed] [DOI] |
| 14. | Tu SM, Lin SH, Logothetis CJ. Stem-cell origin of metastasis and heterogeneity in solid tumours. Lancet Oncol. 2002;3:508-513. [PubMed] [DOI] |
| 16. | Park IH, Zhao R, West JA, Yabuuchi A, Huo H, Ince TA, Lerou PH, Lensch MW, Daley GQ. Reprogramming of human somatic cells to pluripotency with defined factors. Nature. 2008;451:141-146. [PubMed] [DOI] |
| 18. | Nichols J, Zevnik B, Anastassiadis K, Niwa H, Klewe-Nebenius D, Chambers I, Schöler H, Smith A. Formation of pluripotent stem cells in the mammalian embryo depends on the POU transcription factor Oct4. Cell. 1998;95:379-391. [PubMed] [DOI] |
| 19. | Zhang J, Wang X, Chen B, Suo G, Zhao Y, Duan Z, Dai J. Expression of Nanog gene promotes NIH3T3 cell proliferation. Biochem Biophys Res Commun. 2005;338:1098-1102. [PubMed] [DOI] |
| 20. | 李 冬雪, 牛 朝诗. Nanog与肿瘤细胞和干细胞的关系. 国际病理科学与临床杂志. 2010;30:61-64. |
| 21. | Kamachi Y, Uchikawa M, Kondoh H. Pairing SOX off: with partners in the regulation of embryonic development. Trends Genet. 2000;16:182-187. [PubMed] [DOI] |
| 24. | Liu G, Yuan X, Zeng Z, Tunici P, Ng H, Abdulkadir IR, Lu L, Irvin D, Black KL, Yu JS. Analysis of gene expression and chemoresistance of CD133+ cancer stem cells in glioblastoma. Mol Cancer. 2006;5:67. [PubMed] [DOI] |
| 25. | Li XL, Eishi Y, Bai YQ, Sakai H, Akiyama Y, Tani M, Takizawa T, Koike M, Yuasa Y. Expression of the SRY-related HMG box protein SOX2 in human gastric carcinoma. Int J Oncol. 2004;24:257-263. [PubMed] |
| 26. | Sattler HP, Lensch R, Rohde V, Zimmer E, Meese E, Bonkhoff H, Retz M, Zwergel T, Bex A, Stoeckle M. Novel amplification unit at chromosome 3q25-q27 in human prostate cancer. Prostate. 2000;45:207-215. [PubMed] [DOI] |
| 27. | Lengerke C, Fehm T, Kurth R, Neubauer H, Scheble V, Müller F, Schneider F, Petersen K, Wallwiener D, Kanz L. Expression of the embryonic stem cell marker SOX2 in early-stage breast carcinoma. BMC Cancer. 2011;11:42. [PubMed] [DOI] |
| 28. | Fong H, Hohenstein KA, Donovan PJ. Regulation of self-renewal and pluripotency by Sox2 in human embryonic stem cell. Stem Cells. 2008;26:1931-1938. [PubMed] [DOI] |
| 29. | Sheik Mohamed J, Gaughwin PM, Lim B, Robson P, Lipovich L. Conserved long noncoding RNAs transcriptionally regulated by Oct4 and Nanog modulate pluripotency in mouse embryonic stem cells. RNA. 2010;16:324-337. [PubMed] [DOI] |
| 30. | Yamaguchi S, Kurimoto K, Yabuta Y, Sasaki H, Nakatsuji N, Saitou M, Tada T. Conditional knockdown of Nanog induces apoptotic cell death in mouse migrating primordial germ cells. Development. 2009;136:4011-4020. [PubMed] [DOI] |