修回日期: 2011-08-25
接受日期: 2011-09-01
在线出版日期: 2011-09-08
目的: 观察FoxO3a基因干扰对软脂酸诱导HepG2.2.15细胞凋亡的影响.
方法: HepG2.2.15细胞分五组: mock组(加脂质体)、FoxO3a siRNA组、FoxO3a siRNA+软脂酸组、阴性siRNA对照组、阴性siRNA+软脂酸组; Western blot法检测细胞的FoxO3a蛋白表达水平. MTT法检测细胞存活率; Annexin FITC/PI双染流式细胞术检测细胞凋亡率; 检测细胞的caspase-3活性; RT-PCR检测细胞Bim、p27kip mRNA表达水平; 荧光显微镜观察荧光蛋白所在位置.
结果: FoxO3a siRNA+软脂酸组和FoxO3a siRNA组FoxO3 a总蛋白明显减少(P<0.05), 而其他各组基本相同. 与阴性siRNA+软脂酸组相比, FoxO3a siRNA+软脂酸组的存活率增加, 凋亡率、Caspase3活性下降, Bim mRNA、p27kip mRNA表达减少(P<0.05); 与FoxO3a siRNA 组相比, FoxO3a siRNA+软脂酸组的存活率减少, 凋亡率、caspase-3活性、Bim mRNA、p27kip mRNA增加(P<0.05); 阴性siRNA对照组、FoxO3a siRNA组、mock组的存活率、凋亡率、caspase-3活性、Bim mRNA、p27kip mRNA差异无统计学学意义(P>0.05); FoxO3a siRNA组细胞质的绿色荧光比细胞核多; 而FoxO3a siRNA+软脂酸正相反.
结论: FoxO3a-siRNA单独不能诱导HepG 2.2.15细胞凋亡, 但抑制FoxO3a的表达后能通过降低caspase-3活性、抑制Bim、p27Kip的表达, 从而减少软脂酸诱导的细胞凋亡. 并且FoxO3a是通过去磷酸化(失活)即核移位调控这一过程.
引文著录: 熊清芳, 谢玉桃. RNAi特异性抑制FoxO3a对软脂酸诱导HepG2.2.15细胞凋亡的影响. 世界华人消化杂志 2011; 19(25): 2623-2628
Revised: August 25, 2011
Accepted: September 1, 2011
Published online: September 8, 2011
AIM: To investigate the impact of small interfering RNA (siRNA)-mediated silencing of the FoxO3a gene on palmitate-induced apoptosis of HepG2.2.15 cells.
METHODS: Cultured HepG2.2.15 cells were divided into five groups: mock group (cells cultured in DMEM medium containing LipofectamineTM2000), FoxO3a siRNA group, FoxO3a siRNA+palmitate group, negative siRNA group, and negative siRNA+palmitate group. The protein expression of FoxO3a was detected by Western blot. Cell viability was measured by MTT assay. Apoptosis was evaluated by propidium iodide (PI) staining and flow cytometry. Caspase-3 activity was measured by colorimetric assay. The mRNA expression of Bim and p27kip was examined by reverse transcription (RT)-PCR. The location of fluorescent protein was examined by fluorescence microscopy.
RESULTS: After transfection, the levels of total FoxO3a protein decreased in the FoxO3a siRNA+PA group and FoxO3a siRNA group, while the other groups showed no significant difference. The survival rate was higher, and the apoptosis rate, caspase-3 activity, and mRNA levels of Bim and p27kip were lower in the FoxO3a siRNA+PA group than in the negative siRNA+PA group, while the survival rate was lower, and the apoptosis rate, caspase3 activity, and mRNA levels of Bim and p27kip were higher in the FoxO3a siRNA+PA group than in the FoxO3a siRNA group (all P < 0.05). However, these parameters showed no significant changes among the negative siRNA group, FoxO3a siRNA group and mock group (all P > 0.05). Stronger green fluorescence was noted in the cytoplasm than in the nucleus in the FoxO3a siRNA group, whereas the nucleus had stronger green fluorescence in the FoxO3a siRNA+PA group.
CONCLUSION: FoxO3a siRNA itself does not induce apoptosis of HepG2.2.15 cells. FoxO3a siRNA-mediated knockdown of the FoxO3a gene inhibits palmitate-induced apoptosis of HepG2.2.15 cells by decreasing caspase3 activity and down-regulating Bim and p27Kip expression.
- Citation: Xiong QF, Xie YT. RNA interference-mediated silencing of the FoxO3a gene inhibits palmitate-induced apoptosis in human hepatoma cell line HepG2.2.15. Shijie Huaren Xiaohua Zazhi 2011; 19(25): 2623-2628
- URL: https://www.wjgnet.com/1009-3079/full/v19/i25/2623.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i25.2623
FoxO3a是近年发现的FoxO(Forkhead box-containing protein, class O)家族的蛋白. 一般定位在核内, 通过促进下游靶基因的表达, 从而导致细胞凋亡. 磷酸化后则进入细胞质, 与蛋白14-3-3结合, 失去其促凋亡活性[1,2]. 目前对FoxO3a诱导凋亡的研究多集中在肿瘤形成和免疫调节等领域[3], 对脂紊乱引起的肝细胞凋亡是否有FoxO3a的参与, 研究甚少. 我们通过小RNA干扰技术, 明确FoxO3a在软脂酸诱导肝细胞凋亡中的作用, 为今后将FoxO3a作为阻断脂肪酸诱导的肝细胞凋亡的靶点奠定基础.
人肝肿瘤细胞株HepG2.2.15购自美国菌种保藏中心. 试剂和仪器: Lipofectamine 2000、Opti-MEM I(美国Invitrogen公司); TRIzol, RT-PCR逆转录试剂盒(美国Invitrogen公司); 兔抗人FoxO3a抗体、兔抗人p-FoxO3a(Thr32)抗体、HRP标记的山羊抗兔IgG(美国Santa Cruz公司); 3110 Series II CO2培养箱(美国Thermo Forms公司); PowerPac3000型电泳仪、Transblot SD湿转膜仪(美国Bio.Rad公司); Y-20型脱色摇床(江苏其林贝尔仪器制造有限公司); ABI prism 7500半定量PCR仪(美国ABI公司).
1.2.1 分组: (1)mock组(对照组): 先加脂质体Lipofectamine 2000培养6 h, 然后普通培养基培养48 h. (2)NC组(Negative control, 阴性对照组): 瞬时转染NC-siRNA后培养54 h. (3)NC+PA组: 瞬时转染NC-siRNA 48 h后加400 μmol/L软脂酸(PA)培养6 h. (4)FoxO3a siRNA组: 瞬时转染FoxO3a siRNA后培养54 h. (5)FoxO3a siRNA+PA组: 瞬时转染FoxO3a siRNA48 h后加400 μmol/L软脂酸培养6 h.
1.2.2 细胞培养与转染: HepG2.2.15人肝肿瘤细胞株常规培养于含100 mL/L胎牛血清、20 g/L谷氨酰胺的DMEM高糖完全培养液中, 置37 ℃、体积分数为50 mL/L的CO2饱和湿度孵箱内孵育. 稳定传代后至指数增长期用于本实验. 转染前24 h, 将肿瘤细胞接种在6孔培养板上, 每孔约5×106个细胞, 使每孔细胞饱和度在转染前达到50%-70%以上, 铺板时不使用含抗生素的培养液. 按Lipofectamine2000转染试剂说明书方法进行瞬时转染. 对于6孔板中的每一孔, 将FoxO3a siRNA(序列Sense 5'-ACUCCGGGUCCAGCUCCACTT-3', Antisense 5'-GUGGAGCUGGACCCGGAGUTT-3')、 NC-siRNA(序列Sense 5'-UUCUCCGAACGUGUCACGUTT-3', Antisense 5'-ACGUGACACGUUCGGAGAATT-3')分别和Lipofectamine2000按4∶100 mg/L的比例, 用250 μL转染专用液0pti-MEMI稀释, 孵育5 min后, 将稀释的siRNA和Lipofectamine2000混匀, 室温孵育20 min, 然后将500 μL混合物加入到细胞培养基中, 轻轻混匀, 于37 ℃培养6 h后, 将其中的培养基吸出, 加入新鲜的培养基, 继续孵育. siRNA由上海吉玛设计并化学合成.
1.2.3 四甲基偶氮唑(MTT)法: 转染前按0.5×104细胞/L, 种植在96孔板, 转染54 h后, 每孔加入100 μL MTT(5 g/L), 继续温育4 h, 然后加入100 μL DMSO, 震摇15 min, 酶标仪读取光密度值A490, 实验结果以细胞存活率表示. 细胞存活率 = 处理组A值/对照组A值×100%.
1.2.4 Annexin FITC/碘化丙锭(PI)双染流式细胞术: 将各组细胞, 用预冷的700 mg/L乙醇固定, 4 ℃过夜, PI(50 ms/L)染色, 分析亚二倍体峰. 调整细胞密度为5×106/mL, 取1 mL细胞悬液, 1 000 r/min 4 ℃离心10 min, 重复2次, 将细胞重悬于200 μL结合缓冲液, 加入10 μL膜连蛋白V(Annexin V2 FITC)和5 μL碘化丙锭(PI), 避光室温反应15 min, 加入300 μL结合缓冲液, 流式细胞仪检测细胞凋亡情况.
1.2.5 caspase-3活性检测: 按试剂盒说明操作, 以6孔板培养HepG2.2.15细胞, 每孔细胞数约3-4×105 个, 细胞贴壁达80%左右后分组实验. 细胞造模后, 首先收集培养液中悬浮与贴壁细胞(0.25%胰蛋白酶进行消化), 并重悬于Lysis Buffer(裂解液)中, 冰上孵育10 min, 离心并收集上清液(胞浆提取液), 加入含DDT的Reaction Buffer, 再加pNA标记的蛋白酶底物多肽37 ℃孵育2 h, 在酶标仪405 nm处检测光密度值. 结果以实验组光密度值与对照组光密度值的百分比表示.
1.2.6 RT-PCR法: 收集各组细胞, 按TRIzol试剂盒(Invitrogen公司)说明书提取细胞的总RNA. 而后按RT-PCR试剂盒说明书采用20 μL/L逆转录反应体系操作进行逆转录, 然后进行PCR扩增. RT-PCR扩增Bim、p27Kip1; Bim基因引物序列: 上游引物5'-TAT GAG AAG ATC CTC CCT GC-3', 下游引物5'-ATA TCT GCA GGT TCA GCC TG-3', 扩增片段长430 bp; p27Kip1上游引物5'-CGA GTG GCA AGA GGT GGA GA-3', 下游引物5'-CATTGGGGAACCGTCTGAA-3', 扩增片段长293 bp; 内参β-actin引物序列: 上游引物5'-CTG GCA CCA CAC CTT CTA-3', 下游引物5'-GGGCAC AGT GTG GGT GAC-3', 扩增片段长368 bp. 扩增条件: 94 ℃变性45 s, 58 ℃(Bim)、54 ℃(p27Kip1)、62 ℃(β-actin)退火45 s, 72 ℃延伸1 min, 30个循环, 最后72 ℃延伸7 min. PCR产物经2%琼脂糖凝胶电泳(含0.05 g/L溴化乙啶). 以目的基因与相应β-actin mRNA的条带密度比值表示目标基因的相对含量.
1.2.7 Western blot法: 提取相应各组细胞总蛋白, SDS-PAGE电泳分离蛋白样本: 5%积层胶, 10%分离胶; 电转印法将电泳条带转移到PVDF膜上; 以5%脱脂奶粉/PBST封闭膜, 依次加入兔抗人FoxO3a(1∶500)或β-actin(1∶700)一抗, 孵育、洗涤, 加入HRP标记的山羊抗兔IgG二抗(1∶10 000), 孵育、洗涤, 加入ECL, 封膜. 暗室显影, 冲洗胶片. 凝胶成像分析系统摄像分析, 比较各条带与内参蛋白的光密度值.
统计学处理 所有数据以mean±SD表示, 多组间均数比较采用单因素方差分析(one-way ANOVA)及LSD检验, P<0.05为差异有统计学意义. 采用SPSS12.0统计学软件.
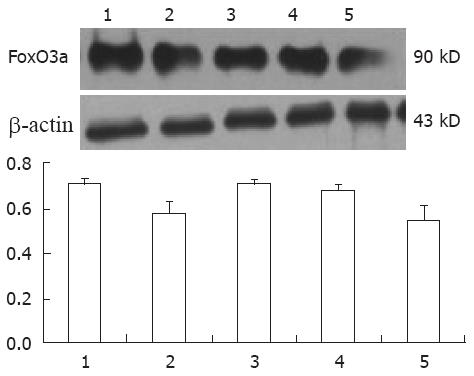
mock组、NC组、NC+PA组内的FoxO3a蛋白表达基本相同(F = 0.013, P = 0.981), FoxO3a siRNA+PA组和FoxO3a siRNA组明显减少, 与前三组相比有统计学意义(P<0.05), 两组间相比无统计学意义(t = 0.16, P = 0.93). 说明FoxO3a siRNA瞬时转染HepG2.2.15细胞成功(图1).
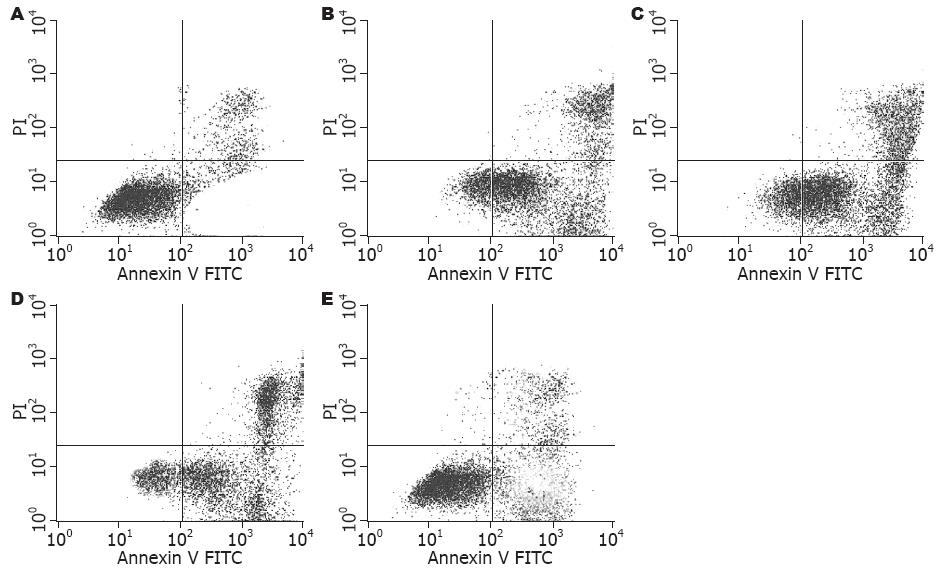
FoxO3a siRNA组、NC组和mock组的细胞存活率、凋亡率和caspase-3活性, 两两相比差异无统计学意义(F = 1.667, P = 0.222; F = 0.147, P = 0.864; F = 0.244, P = 0.787); 软脂酸刺激以后, NC+PA组、FoxO3a siRNA+PA组跟前三组相比存活率下降(P<0.05), 凋亡率和caspase-3活性上升(P<0.05); 但FoxO3a siRNA+PA组与NC+PA组相比存活率增加(t = 5.371, P<0.05), 凋亡率、caspase-3活性下降(t = 10.55, P<0.01; t = 30.76, P<0.01, 表1); 说明转染FoxO3a siRNA对细胞的存活和凋亡无影响; 但可有效的抑制软脂酸诱导的凋亡和caspase-3活性(图2, 表1).
| 存活率(%) | 凋亡率(%) | caspase-3活性 | |
| mock组 | 97.440±0.990 | 5.010±0.720 | 99.330±0.810 |
| NC组 | 96.380±1.310 | 5.270±0.860 | 101.000±7.930 |
| FoxO3a siRNA 组 | 96.700±0.730 | 5.190±0.930 | 102.020±8.780 |
| FoxO3a siRNA +PA组 | 85.460±1.760 | 12.310±0.920 | 150.850±1.450 |
| NC+PA组 | 80.140±1.510 | 20.430±1.640 | 202.000±3.820 |
| F | 220.600 | 241.880 | 390.400 |
| P | <0.001 | <0.001 | <0.001 |
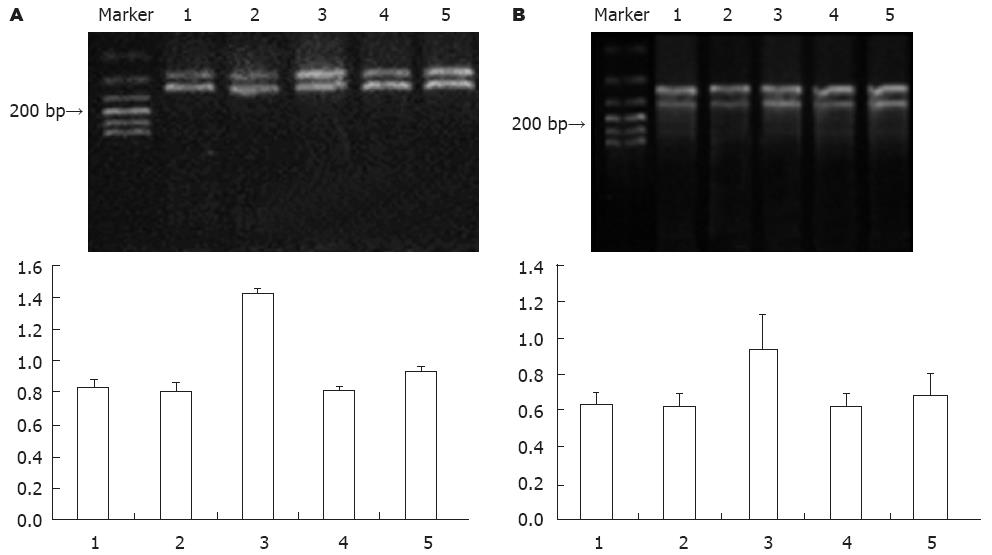
Bim mRNA、p27kip1 mRNA在Mock组、NC组和FoxO3a siRNA组表达最低, 分别在组间无统计学意义(F = 1.804, P = 0.199; F = 0.208, P = 0.815); FoxO3a siRNA+PA组的表达其次, NC+PA组的表达最高, 两组相比有统计学意义(t = 32.21, P<0.01; t = 17.17, P<0.01); 同时分别与FoxO3a siRNA组相比有统计学意义(t = 7.05.21, P<0.01; t = 3.53, P<0.01). 说明抑制FoxO3a的表达可有效的抑制软脂酸诱导的凋亡因子Bim和p27kip1的表达(图3).
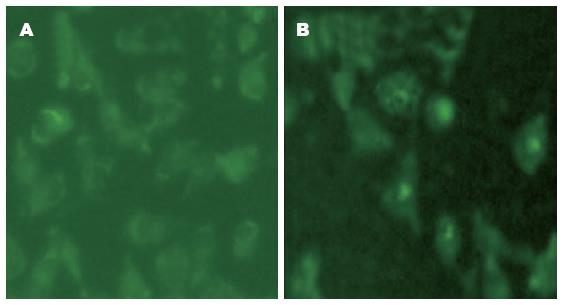
荧光显微镜下可见: FoxO3a siRNA组细胞质绿色荧光较强, 细胞核荧光较弱, 提示细胞核内FoxO3a表达较低, 细胞质内FOXO3a表达相对较多; 而FoxO3a siRNA+PA组胞核的绿色荧光有所增加, 细胞质的绿色荧光有所减少; 说明软脂酸能促进FoxO3a在细胞核内的表达(图4).
高浓度的自由脂肪酸导致肝细胞的凋亡(脂凋亡)是非酒精性脂肪性肝病的特征[4,5], 近年研究发现, 脂凋亡主要参与了"第二次打击"过程, 即促进单纯性脂肪肝向脂肪性肝炎的发展, 并且与肝脏的炎症及纤维化程度有着密切的关系[6,7].
FoxO3a蛋白属于Fox超家族中的"O"亚家族, 定位于6号染色体长臂2区1带, 编码673个氨基酸, 分子量97 kD, 含有forkhead DNA结合结构域, NLS, NES和转录活化区[8]. 活性可受磷酸化、乙酰化和蛋白酶水解等方式调节, 其中磷酸化是最主要的调节方式. 并以AKT促进其磷酸化最为重要[9]. 在无抗原刺激和生长因子下, FoxO3a转录因子在细胞核内保持转录活性, 相应的生长因子活化PI3K-AKT(protein kinase B, PKB)信号通路, FoxO3a蛋白磷酸化, 结合于14-3-3而排出核, 失去转录活性[9], 以这种方式, PI3K-AKT-FOXO3a信号通路通过下游的靶基因如GADD45、Cdkn1a/p2、Cdkn1b/p27、cyclin B和Bim[9-11], 可调节多种生物过程, 包括细胞存活, 凋亡, 氧化应激等.
本研究模拟体外已成熟的肝细胞脂肪变性模型[12-17], 通过用软脂酸刺激HepG2.2.15细胞诱导其凋亡, 研究中发现在凋亡过程中伴随着caspase-3活性、Bim mRNA、p27kip1 mRNA的增加, 说明caspase-3、Bim、p27kip1等参与了软脂酸诱导的肝细胞凋亡的发生, 但是否是转录因子FoxO3a调控了这些靶点, 尚不清楚; 故利用最直接有效的小RNA干扰技术抑制FoxO3a的表达, 结果发现, 软脂酸诱导的凋亡和caspase-3的活性明显下降, Bim mRNA和p27kip1 mRNA表达明显减少, 说明FoxO3a通过调控caspase-3、Bim、p27kip1等参与了软脂酸诱导的肝细胞凋亡. 同时荧光显微镜也直接观察到FoxO3a的胞质和胞核的易位, 进一步从形态学上证实了FoxO3a通过细胞移位(活性的改变)调控了这一过程; 因此, 软脂酸诱导肝细胞凋亡其中的一个机制是通过使FoxO3a在细胞核内保持转录活性, 从而调控下游的Bim、p27kip1和 caspase-3而发生. 这与国外学者的研究是一致的[18,19].
总之, 通过特异而有效的抑制FoxO3a的表达, 能减少软脂酸诱导的肝细胞凋亡, 从分子水平验证了FoxO3a参与了肝细胞的脂凋亡. 为今后将FoxO3a作为阻断脂肪酸诱导肝细胞凋亡的靶点奠定基础.
高浓度的自由脂肪酸导致肝细胞的凋亡(脂凋亡)是非酒精性脂肪性肝病的特征, 近年研究发现, 脂凋亡主要参与了"第二次打击"过程, 即促进单纯性脂肪肝向脂肪性肝炎的发展, 并且与肝脏的炎症及纤维化程度有着密切的关系.
姚树坤, 教授, 中日友好医院消化内科
目前对FoxO3a诱导凋亡的研究多集中在肿瘤形成和免疫调节等领域, 对脂紊乱引起的肝细胞凋亡是否有FoxO3a的参与, 研究甚少.
本研究模拟体外已成熟的肝细胞脂肪变性模型, 通过用软脂酸刺激HepG2.2.15细胞诱导其凋亡, 研究中发现在凋亡过程中伴随着caspase-3活性、Bim mRNA、p27kip1 mRNA的增加, 说明caspase-3、Bim、p27kip1等参与了软脂酸诱导的肝细胞凋亡的发生.
本文通过特异而有效的抑制FoxO3a的表达, 能减少软脂酸诱导的肝细胞凋亡, 从分子水平验证了FoxO3a参与了肝细胞的脂凋亡. 为今后将FoxO3a作为阻断脂肪酸诱导肝细胞凋亡的靶点奠定基础.
本研究工作量较大, 设计基本合理, 结果和结论可信, 有一定的参考价值.
编辑: 李薇 电编:何基才
| 1. | Tran H, Brunet A, Griffith EC, Greenberg ME. The many forks in FOXO's road. Sci STKE. 2003;2003:RE5. [PubMed] |
| 2. | Obsil T, Obsilova V. Structure/function relationships underlying regulation of FOXO transcription factors. Oncogene. 2008;27:2263-2275. [PubMed] [DOI] |
| 3. | Barthel A, Schmoll D, Unterman TG. FoxO proteins in insulin action and metabolism. Trends Endocrinol Metab. 2005;16:183-189. [PubMed] [DOI] |
| 4. | Wieckowska A, Zein NN, Yerian LM, Lopez AR, McCullough AJ, Feldstein AE. In vivo assessment of liver cell apoptosis as a novel biomarker of disease severity in nonalcoholic fatty liver disease. Hepatology. 2006;44:27-33. [PubMed] [DOI] |
| 5. | Wieckowska A, McCullough AJ, Feldstein AE. Noninvasive diagnosis and monitoring of nonalcoholic steatohepatitis: present and future. Hepatology. 2007;46:582-589. [PubMed] [DOI] |
| 6. | Malhi H, Bronk SF, Werneburg NW, Gores GJ. Free fatty acids induce JNK-dependent hepatocyte lipoapoptosis. J Biol Chem. 2006;281:12093-12101. [PubMed] [DOI] |
| 7. | Feldstein AE, Canbay A, Angulo P, Taniai M, Burgart LJ, Lindor KD, Gores GJ. Hepatocyte apoptosis and fas expression are prominent features of human nonalcoholic steatohepatitis. Gastroenterology. 2003;125:437-443. [PubMed] [DOI] |
| 8. | Le Lay J, Kaestner KH. The Fox genes in the liver: from organogenesis to functional integration. Physiol Rev. 2010;90:1-22. [PubMed] [DOI] |
| 9. | Kwon ES, Narasimhan SD, Yen K, Tissenbaum HA. A new DAF-16 isoform regulates longevity. Nature. 2010;466:498-502. [PubMed] [DOI] |
| 10. | Park SJ, Sohn HY, Yoon J, Park SI. Down-regulation of FoxO-dependent c-FLIP expression mediates TRAIL-induced apoptosis in activated hepatic stellate cells. Cell Signal. 2009;21:1495-1503. [PubMed] [DOI] |
| 11. | Kelly-Spratt KS, Philipp-Staheli J, Gurley KE, Hoon-Kim K, Knoblaugh S, Kemp CJ. Inhibition of PI-3K restores nuclear p27Kip1 expression in a mouse model of Kras-driven lung cancer. Oncogene. 2009;28:3652-3662. [PubMed] [DOI] |
| 12. | Schwarz M, Andrade-Navarro MA, Gross A. Mitochondrial carriers and pores: key regulators of the mitochondrial apoptotic program? Apoptosis. 2007;12:869-876. [PubMed] [DOI] |
| 13. | Gómez-Lechón MJ, Donato MT, Martínez-Romero A, Jiménez N, Castell JV, O'Connor JE. A human hepatocellular in vitro model to investigate steatosis. Chem Biol Interact. 2007;165:106-116. [PubMed] [DOI] |
| 14. | Listenberger LL, Han X, Lewis SE, Cases S, Farese RV, Ory DS, Schaffer JE. Triglyceride accumulation protects against fatty acid-induced lipotoxicity. Proc Natl Acad Sci USA. 2003;100:3077-3082. [PubMed] [DOI] |
| 15. | Ricchi M, Odoardi MR, Carulli L, Anzivino C, Ballestri S, Pinetti A, Fantoni LI, Marra F, Bertolotti M, Banni S. Differential effect of oleic and palmitic acid on lipid accumulation and apoptosis in cultured hepatocytes. J Gastroenterol Hepatol. 2009;24:830-840. [PubMed] [DOI] |
| 16. | Wei Y, Wang D, Topczewski F, Pagliassotti MJ. Saturated fatty acids induce endoplasmic reticulum stress and apoptosis independently of ceramide in liver cells. Am J Physiol Endocrinol Metab. 2006;291:E275-E281. [PubMed] [DOI] |
| 17. | Pagliassotti MJ, Wei Y, Wang D. Insulin protects liver cells from saturated fatty acid-induced apoptosis via inhibition of c-Jun NH2 terminal kinase activity. Endocrinology. 2007;148:3338-3345. [PubMed] [DOI] |