修回日期: 2011-08-03
接受日期: 2011-08-26
在线出版日期: 2011-08-28
目的: 探讨结直肠高危腺瘤内镜下切除后的复发特点. 对今后高危腺瘤患者规范筛查和合理随访提出指导.
方法: 收集2004-01/2009-01发现结直肠高危腺瘤并经内镜下切除的患者详细临床资料. 对于腺瘤切除后继续在我院内镜随访的患者进行登记.
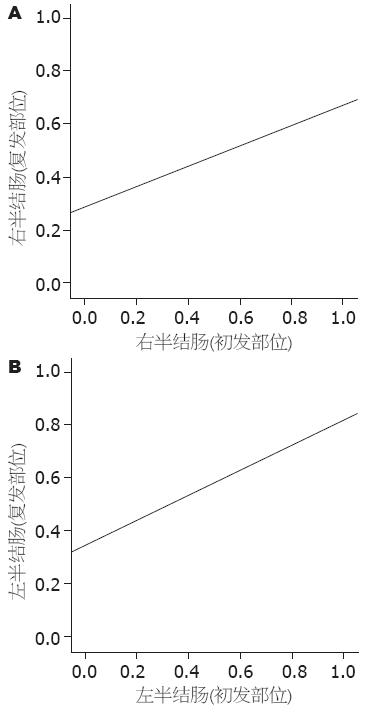
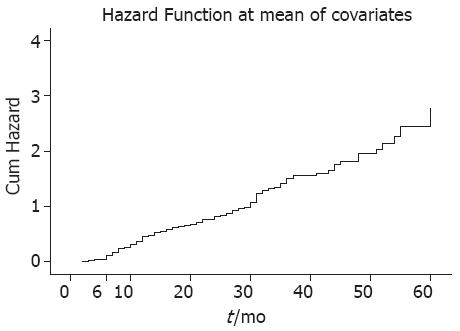
结果: 共收集结直肠高危腺瘤497例患者, 其中166例腺瘤切除后继续在我院行内镜随访. 随访的166例患者一般资料分布: 年龄32-82(平均61.64±11.07)岁,其中年龄≥55岁患者128例(128/166, 77.11%), 男性94例(94/166, 56.63%),高危腺瘤以便血为首发症状的患者较多见(71/166, 46.38%), 且腺瘤表面易形成分叶(75/166, 54.82%). 首次复查时间为切除后1-28 mo, 共102例患者(102/166, 61.45%)复发. 高危腺瘤切除后的复发部位特点: 初发于左半结肠的腺瘤易复发于左半结肠, 初发于右半结肠的腺瘤易复发于右半结肠(r = 0.440, 0.387, 均P<0.01), 将高危腺瘤切除前后的病理表现进行比较未见明显相关性. Cox模型的风险量曲线图提示随时间的延长, 从6 mo开始患者息肉复发的风险逐渐增大.
结论: 结直肠高危腺瘤切除后存在复发情况, 复发前后病理类型无明显关联, 为预防复发应在腺瘤切除后6 mo尽早复查.
引文著录: 张慧, 曹海龙, 王邦茂. 内镜下切除结直肠高危腺瘤随访166例. 世界华人消化杂志 2011; 19(24): 2593-2596
Revised: August 3, 2011
Accepted: August 26, 2011
Published online: August 28, 2011
AIM: To investigate the characteristics of recurrence of advanced colorectal adenomas after polypectomy.
METHODS: The clinical data for patients with advanced colorectal adenoma who underwent polypectomy from January 2004 to January 2009 were collected and reevaluated. The patients who had follow-up data were included in the study.
RESULTS: A total of 497 patients with diagnosed advanced colorectal adenoma were collected, and follow-up data were available in 166 patients. These patients ranged in age from 32 to 82 years (average, 61.64 ± 11.07 years), and 128 cases had an age of ≥ 55 years (128/166, 77.11%). Ninety-four (94/166, 56.63%) patients were males. The most common initial manifestations of advanced adenomas were hematochezia (71/166, 46.38%) and lobular changes (75/166, 54.82%). The interval between polypectomy and first reexamination was 1-28 months. There were 102 (102/166, 61.45%) recurrences in all. Advanced colorectal adenomas in the left hemicolon more likely recurred in the left hemicolon, while those in the right hemicolon more likely recurred in the right hemicolon. No pathological differences were found between recurrent adenomas and original ones (P > 0.05). The hazard curve of Cox model suggested that the risk of recurrence increased gradually from 6 months after polypectomy.
CONCLUSION: Advanced colorectal adenomas may recur after polypectomy. No pathological differences were found between recurrent adenomas and original ones. Colonoscopy should be performed 6 mo after polypectomy for detection of possible recurrence.
- Citation: Zhang H, Cao HL, Wang BM. A follow-up study of 166 cases of advanced colorectal adenomas after polypectomy. Shijie Huaren Xiaohua Zazhi 2011; 19(24): 2593-2596
- URL: https://www.wjgnet.com/1009-3079/full/v19/i24/2593.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i24.2593
结直肠息肉是一种常见病、多发病, 依据病理表现可分为炎性息肉、腺瘤性息肉、增生性息肉和错构性瘤等, 其中腺瘤性息肉被公认为结直肠癌的癌前病变. 研究认为80%以上的结直肠癌由腺瘤发展而来, 腺瘤切除可降低76%-90%的结直肠癌发病率[1]. 目前公认的腺瘤癌变的高危因素有息肉数目、大小、有无绒毛成分及高级别上皮内瘤变[2]. 腺瘤性息肉分为低危和高危腺瘤, 其中高危腺瘤因其高恶变率逐渐引起人们的重视, 本研究拟对初诊为高危腺瘤并行内镜下切除的患者进行随访, 旨在探讨高危腺瘤的复发特点, 对今后规范筛查和合理随访提出指导意义.
收集2004-01/2009-01在我院消化内镜中心进行结肠镜检查发现结直肠高危腺瘤并经内经下切除的患者详细资料. 对一般人口学特征、内镜下表现、病理改变等有关变量特征的数据进行摘录、转换. 两位评论员独立提取资料, 如遇不一致, 通过讨论协商解决.
1.2.1 诊断标准: 2006年美国《结直肠息肉切除术后随访指南》指出高危腺瘤应具备以下条件之一: 数目在3个或以上, 腺瘤直径≥1 cm, 绒毛状腺瘤或高级别上皮内瘤变. 排除标准: 除外家族性腺瘤性息肉病、炎症性肠病、结直肠癌病史、Peutz-Jeghers综合征及Cronkhite-Canada综合征及腺瘤未能切除完全者等.
1.2.2 治疗: 选用德国爱尔博 ICC200型高频电发生器, 常规肠道准备. 0.5 cm以下息肉采用热活检钳烧灼, 0.5-2.0 cm的息肉行高频电圈套加电凝, 对于直径>2.0 cm以上的息肉, 圈套器无法一次全部圈套者可分步摘除或按照ESD步骤进行切除.
统计学处理 对每例患者的临床、内镜及病理等有关变量特征的描述性流行病学资料数据采用Excel统计软件进行分类汇总分析. 双变量相关性分析采用Spearman秩和检验. 相关因素分析采用Cox回归模型. 应用SPSS17.0统计软件包处理, 以P<0.05为差异有统计学意义.
初次发现结直肠腺瘤患者共1 556例, 其中高危腺瘤患者497例(497/1 556,31.94%). 首次发现结直肠高危腺瘤并行内镜下切除且5年内行1次以上内镜随访患者共166例, 年龄32-82(平均61. 64±11.07)岁, 首次复查时间1-28(平均11.55±7.35) mo, 共102例患者复发(102/166, 61.45%). 随访的166例患者一般资料分布:男性94例(94/166, 56.63%),年龄≥55岁患者128例(128/166, 77.11%),肠道息肉数目≥3个的患者52例(52/166, 31.33%),息肉直径≥1 cm的患者87例(87/166, 46.39%),息肉表面有分叶者91例(91/166, 54.82%),息肉存在高级别上皮内瘤变者11例(11/166, 6.63%),临床症状以便血为主者77例(77/166, 46.38%),以腹痛为主者14例(14/166, 9.44%),其他症状75例(75/166, 45.18%).
对102例高危腺瘤复发患者复查前后息肉发生部位进行双变量相关性分析, 提示首次发现高危腺瘤患者经内镜下切除后其复发部位特点为: 初发于左半结肠的腺瘤易复发于左半结肠, 初发于右半结肠的腺瘤易复发于右半结肠(r = 0.440, 0.387, 均P<0.01, 图1).
102例切除后复查的患者术前病理表现为管状腺瘤31例(30.39%)、绒毛状腺瘤71例(69.61%), 腺瘤切除后复查所得病理类型分别为管状腺瘤40例(39.22%)、绒毛状腺瘤45例(44.12%)、炎性息肉10例(9.80%)、增生性息肉2例(1.96%), 癌变5例(4.90%), 其中1例在原高危腺瘤生长部位癌变, 5例癌变患者复查时间分布在12-36 mo. 将高危腺瘤切除前后的病理表现进行比较未见明显差异. 若同一患者一次检查结果中包含两种或两种以上病理类型, 取其较为严重的类型进行统计.
本研究中166例患者高危腺瘤切除后均进行了1次以上结肠镜复查, 复查时间为术后1-60 mo, 用Cox回归模型对可能影响高危腺瘤切除后复发的性别、年龄、息肉数目、大小、有无分叶、病理表现等进行多因素分析, 可得到风险量曲线图(图2), 从术后6 mo开始随时间的延长, 息肉复发的风险逐渐增大.
高危腺瘤在50-75岁无症状人群中的发生率是9.6%, 内镜检查阴性的患者3年和5年后随访高危腺瘤发生率分别为0.9%和1.1%[3]. 高危腺瘤因其高发生率及高恶变率逐渐引起人们的重视. 2006年美国《大肠息肉切除术后随访指南》对高危腺瘤进行了定义, 腺瘤大小、数目、有无绒毛组织及高级别上皮内瘤变为构成高危腺瘤的关键因素. 其中腺瘤的大小已在多项研究中列为研究对象, 但并不是体积大的腺瘤一定发展成肿瘤, 进展性结肠癌有时来源于小的管状腺瘤, 腺瘤的大小、绒毛组织及上皮异型程度是密切相关的, 高度异型增生更易发生在绒毛状及体积较大的腺瘤[4]; 而Toll等[5]的研究则发现直径大于10 mm且伴有高度异型增生的腺瘤切除后再发高度异型增生或肿瘤的概率很高. Lorenzo-Zúñiga等[6]认为初发息肉直径较大的患者其息肉切除后更易再发高危腺瘤.
内镜下息肉切除术为防治高危腺瘤的首选方法, 其成功率高, Ahlawat等[7]发现切除直径>20 mm的息肉术中发生出血和穿孔的概率仅为5%和2%. 有研究称结直肠腺瘤随年龄增长其发生部位出现右移[8], 对于高危腺瘤切除后复发位置国内外尚无相关报道, 本组资料发现初发于左半结肠的腺瘤易复发于左半结肠, 而初发于右半结肠的腺瘤易复发于右半结肠. 当然我们不能完全除外行结肠镜时有漏诊息肉的可能性, 毕竟由于肠道内含有较多皱襞这种解剖结构造成其病变的漏诊率较高, 有研究提出对于≥10 mm及<5 mm的腺瘤漏诊率分别为6%和27%[9], 这提示内镜操作者行结肠镜时应严谨细致, 尽可能减少人为因素造成的病变漏诊.
高危腺瘤以便血为首发症状的患者较多见, 且腺瘤表面易形成分叶, 这就提示有便血症状的患者应及时就诊以免延误病情. 本研究中高危腺瘤复发患者病理表现主要为管状腺瘤、绒毛状腺瘤、炎性息肉、增生性息肉或癌变, 高危腺瘤复发前后的病理表现无明显差异. 结直肠高危腺瘤切除后, 复查时有5例患者发现癌变, 1例在原生长部位发现癌变, 原因可能为原高危腺瘤未切除完全或再发腺瘤发生癌变, 这也提示高危腺瘤切除后必须定期随访.
息肉切除后规律随访为预防息肉复发和癌变的有效方法, 尤其对于高癌变风险的人群尤为重要[10]. 有报道称腺瘤切除后3-4年内其复发率在15%-60%[11], 本研究发现高危腺瘤除后初次复查复发率为61.45%. 美国及欧洲相关的指南建议低危腺瘤患者应在息肉切除后5-10年内行结肠镜复查, 而高危腺瘤患者则应在3年内复查[12,13], 一项对于我国南方人群的相关调查研究也推荐高危腺瘤患者3年内行结肠镜复查[14]. 而另一项研究认为结直肠腺瘤切除后1年内的随访复查最重要[15]. 本组资料从Cox模型风险量曲线图我们可以看到, 高危腺瘤随时间延长(从6 mo开始)复发风险逐渐加大, 这提示高危腺瘤患者在息肉切除后6 mo宜尽早行结直肠镜复查, 早于国内外对于普通腺瘤所推荐的3年及1年复查间隔[12,15], 其原因除了高危腺瘤更易复发外, 还可能受人种、地理位置、生活环境以及依从性等因素的影响. 当然, 对于高危腺瘤切除术后患者定期复查结肠镜还需要考虑成本效益分析.
总之, 本研究对高危腺瘤切除后复发的患者进行了随访研究, 发现结直肠高危腺瘤切除后复发率较高, 对比复发前后病理未见明显关联, 建议高危腺瘤患者在息肉切除后6 mo尽早行结肠镜复查. 此外, 仍有必要扩大样本且进行更深入的随访研究.
结直肠腺瘤性息肉被公认为结直肠癌的癌前病变, 目前公认的腺瘤癌变的高危因素有息肉数目、大小、有无绒毛成分及高级别上皮内瘤变, 而具备以上一项或多项高危因素的高危腺瘤因其高恶变率逐渐引起人们的重视. 目前, 内镜下切除高危腺瘤为防治其癌变的有效方法, 但高危腺瘤切除后的复发特点如何日趋引起消化科医师的关注
陈光, 教授, 吉林大学第一医院
高危腺瘤发病率较高, 其复发特点为现如今研究的热点, 应根据种族因素、各国国情、环境因素等制备可行的具体随访方案.
美国及欧洲相关的指南建议低危腺瘤患者应在息肉切除后5-10年内行结肠镜复查, 而高危腺瘤患者则应在3年内复查, 一项对于我国南方人群的相关调查研究也推荐高危腺瘤患者3年内行结肠镜复查. 而另一项研究认为结直肠腺瘤切除后1年内的随访复查最重要.
本研究对确诊为高危腺瘤并行内经下切除的患者进行随访研究, 对患者的息肉复发部位、复发时间趋势、癌变情况等进行了详尽的研究.
本研究对初诊为高危腺瘤并行内镜下切除的患者进行随访, 旨在探讨高危腺瘤的复发特点, 对今后规范筛查和合理随访提出指导意义.
本组研究结合临床实际, 随访设计先进合理, 所得结论客观. 对临床防治结直肠癌并降低其发生率有实际意义.
编辑: 曹丽鸥 电编:何基才
| 1. | Winawer SJ, Zauber AG, Ho MN, O'Brien MJ, Gottlieb LS, Sternberg SS, Waye JD, Schapiro M, Bond JH, Panish JF. Prevention of colorectal cancer by colonoscopic polypectomy. The National Polyp Study Workgroup. N Engl J Med. 1993;329:1977-1981. [PubMed] [DOI] |
| 2. | Winawer SJ, Zauber AG, Fletcher RH, Stillman JS, O'Brien MJ, Levin B, Smith RA, Lieberman DA, Burt RW, Levin TR. Guidelines for colonoscopy surveillance after polypectomy: a consensus update by the US Multi-Society Task Force on Colorectal Cancer and the American Cancer Society. Gastroenterology. 2006;130:1872-1885. [PubMed] [DOI] |
| 3. | Strum WB. Incidence of advanced adenomas of the rectosigmoid colon three years and five years after negative flexible sigmoidoscopy in 4010 patients. Dig Dis Sci. 2003;48:2278-2283. [PubMed] [DOI] |
| 4. | Terry MB, Neugut AI, Bostick RM, Sandler RS, Haile RW, Jacobson JS, Fenoglio-Preiser CM, Potter JD. Risk factors for advanced colorectal adenomas: a pooled analysis. Cancer. Epidemiol Biomarkers Prev. 2002;11:622-629. [PubMed] |
| 5. | Toll AD, Fabius D, Hyslop T, Pequignot E, DiMarino AJ, Infantolino A, Palazzo JP. Prognostic significance of high-grade dysplasia in colorectal adenomas. Colorectal Dis. 2011;13:370-373. [PubMed] [DOI] |
| 6. | Lorenzo-Zúñiga V, Moreno de Vega V, Domènech E, Mañosa M, Cabré E, Planas R, Boix J. High-definition colonoscopy and risk factors for recurrence of advanced adenomas in patients with a personal history of polyps. Eur J Gastroenterol Hepatol. 2011;23:425-430. [PubMed] [DOI] |
| 7. | Ahlawat SK, Gupta N, Benjamin SB, Al-Kawas FH. Large colorectal polyps: endoscopic management and rate of malignancy: does size matter? J Clin Gastroenterol. 2011;45:347-354. [PubMed] [DOI] |
| 8. | Yamaji Y, Mitsushima T, Ikuma H, Watabe H, Okamoto M, Yoshida H, Kawabe T, Wada R, Omata M. Right-side shift of colorectal adenomas with aging. Gastrointest Endosc. 2006;63:453-458; quiz 464. [PubMed] [DOI] |
| 9. | Ratiu N, Gelbmann C, Rath HR, Herfarth H, Kullmann F, Schölmerich J, Messmann H. Chromoendoscopy with indigo carmine in flexible sigmoidoscopy screening: does it improve the detection of adenomas in the distal colon and rectum? J Gastrointestin Liver Dis. 2007;16:153-156. [PubMed] |
| 10. | Saini SD, Schoenfeld P, Vijan S. Surveillance colonoscopy is cost-effective for patients with adenomas who are at high risk of colorectal cancer. Gastroenterology. 2010;138:2292-2299, 2299.e1. [PubMed] |
| 11. | Martínez ME, Sampliner R, Marshall JR, Bhattacharyya AK, Reid ME, Alberts DS. Adenoma characteristics as risk factors for recurrence of advanced adenomas. Gastroenterology. 2001;120:1077-1083. [PubMed] [DOI] |
| 12. | Brooks DD, Winawer SJ, Rex DK, Zauber AG, Kahi CJ, Smith RA, Levin B, Wender R. Colonoscopy surveillance after polypectomy and colorectal cancer resection. Am Fam Physician. 2008;77:995-1002. [PubMed] |
| 13. | Arditi C, Gonvers JJ, Burnand B, Minoli G, Oertli D, Lacaine F, Dubois RW, Vader JP, Schusselé Filliettaz S, Peytremann-Bridevaux I. Appropriateness of colonoscopy in Europe (EPAGE II). Surveillance after polypectomy and after resection of colorectal cancer. Endoscopy. 2009;41:209-217. [PubMed] [DOI] |
| 14. | Huang Y, Gong W, Su B, Zhi F, Liu S, Bai Y, Jiang B. Recurrence and surveillance of colorectal adenoma after polypectomy in a southern Chinese population. J Gastroenterol. 2010;45:838-845. [PubMed] [DOI] |
| 15. | Gao QY, Chen HM, Sheng JQ, Zheng P, Yu CG, Jiang B, Fang JY. The first year follow-up after colorectal adenoma polypectomy is important: a multiple-center study in symptomatic hospital-based individuals in China. Front Med China. 2010;4:436-442. [PubMed] [DOI] |