修回日期: 2011-05-28
接受日期: 2011-06-28
在线出版日期: 2011-08-28
目的: 探讨血必净对大鼠重症胰腺炎(severe acute pancreatitis, SAP)的治疗作用.
方法: 经十二指肠乳头逆行胆胰管注射3.5%牛磺胆酸钠建立SAP模型, 给予血必净治疗, 观察血清中淀粉酶含量、白介素-6(interleukin-6, IL-6)、丙二醛(malondialdehyde, MDA)、超氧化物歧化酶(superoxide dimutase, SOD)、内毒素(lipopolysaccharide, LPS)的变化, 并进行胰腺组织病理学检查.
结果: 与空白对照组相比, 模型组中血淀粉酶(U/L)、IL-6(pg/mL)、LPS(EU/mL)、MDA(nmol/mL)明显增高(P<0.05), SOD(U/L)则明显降低(P<0.05),光镜下胰腺组织损伤明显; 血必净治疗后上述检测指标均较模型组明显改善(血清淀粉酶: 12 h: 4 386±1 198 vs 5 494±1 082, 24 h: 3 122±487 vs 4 489±845, 均P<0.05; IL-6: 12 h:174.5±18.2 vs 291.3±21.9, 24 h: 140.9±25.0 vs 258.7±22.0, 均P<0.05; LPS: 12 h: 0.09±0.02 vs 0.12±0.02, 24 h: 0.14±0.02 vs 0.19±0.02, 均P<0.05; MDA: 12 h: 8.8±0.3 vs 10.8±0.4, 24 h: 10.1±0.6 vs 14.7±0.4, 均P<0.05; SOD 12 h: 266.2±14.6 vs 195.7±14.8, 24 h: 235.6±12.1 vs 114.8±16.0, 均P<0.05).
结论: 血必净可以拮抗内毒素, 下调IL-6, 提高机体对氧自由基的清除能力, 减轻胰腺组织的损伤.
引文著录: 耿小峰, 脱红芳, 彭彦辉, 赵宝川. 血必净对大鼠重症急性胰腺炎的治疗作用. 世界华人消化杂志 2011; 19(24): 2567-2571
Revised: May 28, 2011
Accepted: June 28, 2011
Published online: August 28, 2011
AIM: To study the therapeutic effect of Xuebijing on pancreatic injury in rats with experimental severe acute pancreatitis (SAP).
METHODS: SAP was induced in rats by retrograde injection of 3.5% sodium taurocholate into the biliopancreatic duct. Xuebijing was then intraperitoneally injected in SAP rats. The levels of serum amylase, interleukin-6 (IL-6), malondialdehyde (MDA), superoxide dimutase (SOD), and lipopolysaccharide (LPS) were measured, and pancreatic pathological changes were evaluated.
RESULTS: Compared to normal rats, the levels of serum amylase (U/L), IL-6 (pg/mL), LPS (EU/mL), and MDA (nmol/mL) were significantly higher (all P < 0.05) and that of SOD (U/L) was significantly lower (P < 0.05) in rats with SAP. Additionally, significant pancreatic pathological changes were observed in SAP rats. After treatment with Xuebijing, the above serum parameters were significantly improved (serum amylase: 12 h: 4 386 ± 1 198 vs 5 494 ± 1 082, 24 h: 3 122 ± 487 vs 4 489 ± 845; IL-6: 12 h: 174.5 ± 18.2 vs 291.3 ± 21.9, 24 h: 140.9 ± 25.0 vs 258.7 ± 22.0; LPS: 12 h: 0.09 ± 0.02 vs 0.12 ± 0.02, 24 h: 0.14 ± 0.02 vs 0.19 ± 0.02; MDA: 12 h: 8.8 ± 0.3 vs 10.8 ± 0.4, 24 h: 10.1 ± 0.6 vs 14.7 ± 0.4; SOD: 12 h: 266.2 ± 14.6 vs 195.7 ± 14.8, 24 h: 235.6 ± 12.1 vs 114.8 ± 16.0; all P < 0.05) and pancreatic pathological changes became milder in rats with SAP.
CONCLUSION: Xuebijing reduces pancreatic tissue damage in rats with SAP by decreasing serum endotoxin and IL-6 and enhancing the oxygen free radical scavenging capacity of the body.
- Citation: Geng XF, Tuo HF, Peng YH, Zhao BC. Therapeutic effect of Xuebijing on experimental severe acute pancreatitis in rats. Shijie Huaren Xiaohua Zazhi 2011; 19(24): 2567-2571
- URL: https://www.wjgnet.com/1009-3079/full/v19/i24/2567.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i24.2567
重症急性胰腺炎(Severe acute pancreatitis, SAP) 的临床表现凶险, 并发症多, 病死率高, 其确切病因和发病机制迄今尚未完全阐明, 治疗效果也不够满意. 中药用于治疗胰腺炎取得一定效果. 研究证明, 血必净注射液能有效拮抗内毒素, 下调促炎介质水平, 调节免疫反应[1,2], 避免内毒素攻击所致的组织损伤[3], 同时提高超氧化物歧化酶活性等作用, 临床大多用于治疗急性危重疾病. 本实验拟在血必净对SAP的治疗基础上探讨其作用机制, 为临床治疗提供理论依据.
SD大鼠54只, 雄雌各半, 体质量250-300 g, 由河北医科大学实验动物中心提供, 编号904245. 牛磺胆酸钠原料购自Sigma公司. 血必净注射液购自天津红日药业股份有限公司, 编号Z20040033. IL-6试剂盒购自美国ADL公司, MDA和SOD试剂盒购自南京建成生物工程研究所, 内毒素检测试剂盒厦门市鲎试剂实验厂有限公司.
1.2.1 动物模型及分组: 将实验大鼠随机分为空白对照组(n = 18), 模型组(n = 18), 药物治疗组(n = 18). 各实验组又分12、24 h亚组, 各9只. 模型制备参照A ho等[4]的方法并改良, 大鼠术前12 h禁食不禁水, 3%戊巴比妥钠(1 mL/kg)腹腔麻醉, 固定开腹, 24号套管针经十二指肠乳头对侧的无血管区穿刺十二指肠肠壁, 进入胆胰管, 穿刺成功时有一定的漏空感, 并有少量淡黄色胆汁流出, 用无创伤动脉夹暂时阻断肝门端胰胆管, 外套管末端连接输液转换器, 微量注射泵注入3.5%牛磺胆酸钠(1 mL/kg), 3分钟注完拔除外套管, 无创伤动脉夹夹闭十二指肠乳头端胰胆管5 min, 生物胶粘合十二指肠肠壁的戳孔, 防止胆漏, 放开两端动脉夹, 关腹. 对照组大鼠胆胰管内不注射3.5%牛磺胆酸钠, 只轻翻动胰腺及十二指肠后关腹. 模型组及对照组大鼠腹腔给予生理盐水(4 mL/kg), 每隔6 h给1次; 血必净治疗组制备动物模型成功后, 腹腔内注射血必净注射液[5](4 mL/kg), 每隔6 h给1次. 按预定的时间点, 用24号套管针穿刺颈内侧动脉, 取血4-5 mL, 4 ℃下3 000 r/min离心10 min, 取血清3 mL于-80 ℃冰箱冻存待测以上指标, 大鼠开腹, 取胰腺组织制作病理组织切片及参照Sc hmidt法[6]对胰腺损伤进行评分.
1.2.2 观测指标及检测方法: 大鼠血清0.5 mL稀释8倍, 于全自动生化分析仪检测淀粉酶含量; 采用酶联免疫吸附检测IL-6; 采用硫代巴比妥酸法检测MDA, 采用盐酸羟胺法检测SOD; 采用基质显色法测定内毒素.
统计学处理 实验各组数据采用SPSS11.5统计学软件处理, 结果以mean±SD表示, 采用单因素方差分析, 当P<0.05时认为具有统计学意义.
血清淀粉酶、IL-6、MDA、SOD、内毒素及病理学评分测定结果见表1.
| 分组时间 | 淀粉酶(U/L) | IL-6(ng/L) | MDA(nmol/mL) | SOD(U/L) | LPS(EU/mL) | 病理学分 |
| 空白 | ||||||
| 12 h | 1 005±144 | 97.0±12.6 | 4.2±0.3 | 338.3±14.3 | 0.04±0.02 | 0.5±0.1 |
| 24 h | 890±122 | 90.1±16.8 | 5.8±0.5 | 356.8±15.5 | 0.03±0.08 | 0.5±0.1 |
| 模型 | ||||||
| 12 h | 5 494±1 082a | 291.3±21.9a | 10.8±0.4a | 195.7±14.8a | 0.12±0.02a | 11.5±0.7a |
| 24 h | 4 489±845ae | 258.7±22.0ae | 14.7±0.4ae | 114.8±16.0ae | 0.19±0.02ae | 13.8±1.3ae |
| 治疗 | ||||||
| 12 h | 4 386±1 198c | 174.5±18.2c | 8.8±0.3c | 266.2±14.6c | 0.09±0.02c | 10.9±0.6c |
| 24 h | 3 122±487cg | 140.9±25.0cg | 10.1±0.6cg | 235.6±12.1cg | 0.14±0.02cg | 11.5±0.8cg |
测定模型组血清中的淀粉酶、IL-6、LPS、MDA含量在各时间点与空白对照组比较均明显升高, 差异有显著性(P<0.05); 模型组血清中淀粉酶、IL-6、LPS、MDA含量在各时间点间随时间延长而增加, 差异有显著性(P<0.05); 治疗组各时间点的淀粉酶、IL-6、LPS、MDA含量较模型组同时间点均降低, 差异有显著性(P<0.05).
模型组血清SOD含量各时间点较空白对照组均降低, 差异有显著性(P<0.05); 模型组血清SOD含量各时间点间随时间延长而降低, 差异有显著性(P<0.05); 治疗组血清SOD含量各时间点较模型组同时间点升高, 差异有显著性(P<0.05).
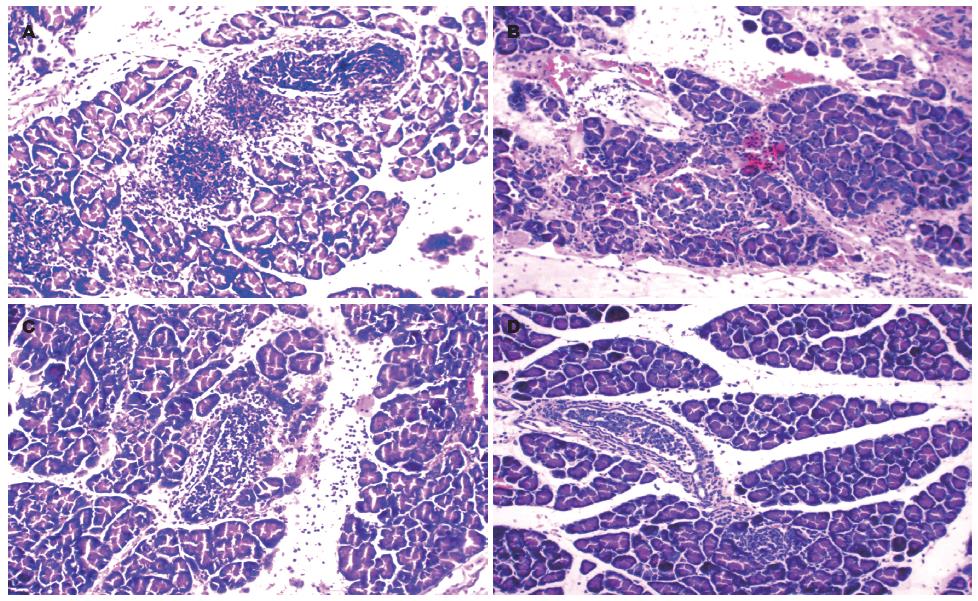
病理模型组12 h可见胰腺小叶排列紊乱, 小叶间充斥大量炎症细胞及红细胞, 胰腺组织坏死; 造模24 h后见胰腺腺泡细胞结构消失, 腺泡细胞萎缩、胞核溶解消失明显, 间质内见大量炎性细胞浸润. 治疗组12 h见胰腺小叶间隙有增宽, 间质内可见红细胞、炎性细胞散在分布; 治疗组24 h胰腺腺泡细胞水肿, 间质内散在炎性细胞浸润(图1).
模型组随时间延长损伤程度加重, 各时间点间差异有显著性(P<0.05), 与空白对照组相比在各时间点损伤程度均加重, 差异有显著性(P<0.05); 治疗组胰腺损伤的组织病理学评分在各时间点与模型组相比均降低, 差异有显著性(P<0.05).
SAP的发病机制目前仍不甚清楚, 近年来的研究表明, AP重症化与中性粒细胞过度激活、细胞因子的过度释放、肠源性内毒血症等学说有关.
SAP与IL-6: IL-6主要由单核细胞产生. 有研究表明[7]IL-6升高的程度及持续水平与SAP的严重程度均有关. SAP症状出现数小时IL-6水平就增高, 可以作为评估SAP预后病情发展的指标. 因此本研究选用IL-6作为研究SAP的指标. 实验结果表明: SAP血清IL-6水平呈持续升高, 且与胰腺病理损害程度一致, 各时点与空白对照组相比有明显差异, 结果证实了IL-6升高的程度与SAP的病情严重程度相关, 可以用IL-6作为评价SAP的炎症程度.
SAP与中性粒细胞(polymorphonuclear, PMN): SAP发生后, 大量的PMN通过循环系统进入组织激活, 激活后的PMN主要通过细胞呼吸爆发, 释放大量氧自由基(oxygen free radicals, OFR)和脱颗粒(释放多种蛋白水解酶), 促使组织损伤和炎症迁延, 造成SIRS和MOF[8]. 生理状态下胰腺组织中的OFR处于动态平衡. SAP时, 大量的OFR产生超过了机体清除能力, 动态平衡被打破. Keck等[9]的研究表明OFR可通过上调内皮ICAM-1表达而加重 AP时机体的微循环障碍. Czako等[10]认为OFR通过损伤腺泡细胞, 引起细胞因子和血管活性物质的释放, 从而吸引炎性细胞聚集和血管内皮的活化表达黏附分子. Tadao等[11]也认为OFR及其衍生物在AP的发展过程中发挥了重要的作用, 是胰腺损伤过程中的分子扳机. OFR失平衡是导致AP重症化的关键因素. 过量的OFR与组织内细胞膜多价不饱和脂肪酸结合, 形成多种脂质过氧化物(lipid peroxide, LPO), 使细胞膜通透性增加, Ca2+大量内流, 线粒体和溶酶体被破坏, 导致细胞死亡; 而且, 致炎因子和氧化应激发挥过协同作用, 触发共同的信号传导通路, 通过MAPK和NF-κB的激活[12], 导致了炎症的级联反应. 此外, OFR的作用并不局限于胰腺组织, 还参与了AP的全身炎症反应, 特别是在肺、肝和血液中, 这就促使多器官功能障碍(multiple organic dysfunction syndrome, MODS)发生. 超氧化物歧化酶(Super oxide Dimutase, SOD)是一种清除氧自由基的重要酶类, 其含量水平可以反映机体清除OFR的能力, SOD的过度含量降低导致OFR的过量, 过量的OFR则参与脂质过氧化反应. 丙二醛(malondialdehyde, MDA)是LPO的终产物之一, 测定MDA的含量可以反映机体内LPO的程度, 脂质过氧化程度的升高则提示胰腺组织损伤程度加重. 本研究结果显示, 诱发SAP后, 血清MDA含量增高、SOD降低, 且随着时间推移, 血清MDA 进行性升高、SOD进行性降低, 二者改变的程度与胰腺的病理改变相吻合. 应用血必净后, 血清MDA降低、SOD升高. 因此, 降低PMN的过度激活, 平衡OFR的含量, 降低细胞脂质过氧化的程度, 有益于减轻SAP的炎症反应.
SAP与内毒素: 临床统计资料及动物实验研究表明, 多数的胰腺和胰周组织感染是由肠道细菌移位及内毒素所致的肠源性感染, 肠道是引发感染细菌的主要来源[13,14]. LPS可作为激活剂, 启动多条信号转导通路激活炎细胞, 导致体内第二次细胞因子与炎症介质的释放高峰, 同时激活补体等途径加速病程, 通过"二次打击"加重胰腺微循环障碍与胰外器官的病理损伤恶化. 由此, 本研究从检测大鼠SAP血浆中LPS的含量, 联系SAP严重程度, SAP血浆LPS水平呈持续升高, 且与胰腺病理损害程度一致. 应用血必净后, LPS含量明显降低, 减少肠源性感染及细胞因子的释放, 进一步减轻胰腺组织损伤.
SAP与血必净: 血必净注射液是王今达教授在中西医结合治疗大量急性危重病基础上, 以古方血府逐癖汤为基础, 反复筛选精炼出而成. 其主要有效成分包括红花黄色素A、川芍嗦、丹参素、阿魏酸、芍药昔、原儿茶醛等, 具有降低LPS, 扩张血管, 改善微循环与组织灌注, 抑制血小板聚集, 促进纤维组织重吸收、胶原纤维的降解及保护血管内皮细胞等作用, 能抑制炎性介质的过度释放, 从而有效地减少损伤因子对机体的损伤[15]. 因此, 我们选用血必净注射液作为SAP大鼠的治疗药物. 实验研究结果显示, 经血必净治疗后, 与模型组相比, 血淀粉酶、IL-6、LPS、MDA明显降低(P<0.05), SOD明显升高(P<0.05), 光镜下胰腺组织损伤改善, 分析血必净的治疗SAP机制可能为: (1)下调IL-6, 减轻过度炎症反应, 缓解免疫麻痹; (2)平衡OFR含量, 减少脂质过氧化程度, 减轻胰腺组织损伤; (3)拮抗内毒素, 减轻全身炎症反应.
急性胰腺炎(AP)是临床常见急腹症之一, 临床表现多变, 以突发腹痛及血清淀粉酶(AMY)升高为主要临床特征. 约有20%以上的胰腺炎为重症急性胰腺炎(SAP), 胰酶过度激活、胰腺自身消化、大量细胞因子的释放, 导致全身炎症反应综合征(SIRS)和多器官功能障碍综合征(MODS). 相关研究报道, 血必净注射液能有效拮抗内毒素, 下调促炎介质水平, 调节免疫反应, 避免内毒素攻击所致的组织损伤, 临床大多用于急性危重病的治疗.
白雪巍, 副教授, 哈尔滨医科大学
重型胰腺炎死亡率为20%, 有并发症者可高达50%. 为降低死亡率, 与之相应的各项措施被用于SAP的诊断和治疗中, 抑制过度的促炎因子、减轻体内氧自由基对腺细胞的损伤和肠源性内毒素血症的形成是目前治疗SAP的热点和难点问题.
血必净注射液临床大多用于治疗烧伤、手术和感染等导致全身免疫反应综合征. 选用血必净注射液治疗急性胰腺炎大鼠模型, 减轻胰腺病理损伤, 降低死亡率可以为临床治疗提供理论依据.
本研究内容贴近临床, 有较强的实用性.
编辑: 李薇 电编:何基才
| 4. | Aho HJ, Nevalainen TJ, Aho AJ. Experimental pancreatitis in the rat. Development of pancreatic necrosis, isc hemia and edema after intraductal sodium tauroc holate injection. Eur Surg Res. 1983;15:28-36. [PubMed] [DOI] |
| 6. | Sc hmidt J, Lewandrowsi K, Wars haw AL, Compton CC, Rattner DW. Morp hometric c haracteristics and homogeneity of a new model of acute pancreatitis in the rat. Int J Pancreatol. 1992;12:41-51. [PubMed] |
| 8. | Chen CC, Wang SS, Lee FY. Action of antiproteases on the inflammatory response in acute pancreatitis. JOP. 2007;8:488-494. [PubMed] |
| 9. | Keck T, Werner J, Banafsc he R, Stalmann A, Sc hneider L, Geb hard MM, herfart h C, Klar E. Oxygen radicals promote ICAM-1 expression and microcirculatory disturbances in experimental acute pancreatitis. Pancreatology. 2003;3:156-163. [PubMed] [DOI] |
| 10. | Czakó L, hegyi P, Takács T, Góg C, Farkas A, Mándy Y, Varga IS, Tiszlavicz L, Lonovics J. Effects of octreotide on acute necrotizing pancreatitis in rabbits. World J Gastroenterol. 2004;10:2082-2086. [PubMed] |
| 11. | Tadao M, Yuji O. [Role of free radicals in the development of severe acute pancreatitis]. Nihon Rinsho. 2004;62:2015-2020. [PubMed] |
| 12. | Pereda J, Sabater L, Aparisi L, Escobar J, Sandoval J, Viña J, López-Rodas G, Sastre J. Interaction between cytokines and oxidative stress in acute pancreatitis. Curr Med Chem. 2006;13:2775-2787. [PubMed] [DOI] |
| 13. | Taka has hi Y, Fukus hima J, Fukusato T, S higa J, Tanaka F, Imamura T, Fukayama M, Inoue T, S himizu S, Mori S. Prevalence of isc hemic enterocolitis in patients with acute pancreatitis. J Gastroenterol. 2005;40:827-832. [PubMed] |
| 14. | Penalva JC, Martínez J, Laveda R, Esteban A, Muñoz C, Sáez J, Suc h J, Navarro S, Feu F, Sánc hez-Payá J. A study of intestinal permeability in relation to the inflammatory response and plasma endocab IgM levels in patients wit h acute pancreatitis. J Clin Gastroenterol. 2004;38:512-517. [PubMed] [DOI] |