修回日期: 2011-07-22
接受日期: 2011-08-26
在线出版日期: 2011-08-28
目的: 为肥胖症和2型糖尿病的手术和内镜介入治疗研究建立一种大型动物实验模型.
方法: 选用10只健康♂成年Beagle犬, 随机分成两组, 对照组5只全程(16 wk)给予标准饲料喂养, 模型组5只全程给予高脂高热量饲料喂养, 并于第8周给予小剂量链脲佐菌素(STZ)静脉注射. 定时检测动物体质量、体长、空腹血糖、静脉葡萄糖实验(IVGTT)、血脂等与肥胖症及2型糖尿病相关临床指标.
结果: 在第8周, 模型组平均体质量是16.9 kg±0.8 kg, 较对照组体质量(14.8 kg±1.03 kg)有显著升高(P<0.01), Lee指数与对照组比较也有显著差异(P<0.05); 模型组血清胰岛素、C-肽较对照组明显上升(P<0.01). STZ注射后1 wk, 模型组空腹血糖明显高于对照组(P<0.05), IVGTT-2h血糖比注射前增高(143 mg/dL±7.4 mg/dL vs 127 mg/dL±4.2 mg/dL, P<0.05), 血清胰岛素、C-肽分泌比注射前明显下降(P<0.01). STZ注射后8 wk, 模型组空腹血糖显著高于对照组(P<0.01), IVGTT-2 h血糖较注射前显著增高(323 mg/dL±12.1 mg/dL vs 127 mg/dL±4.2 mg/dL, P<0.01). 本实验模型组Beagle犬成模率为100%, 实验期间Beagle犬未见死亡.
结论: 联合高脂高热量喂养和小剂量STZ注射可在Beagle犬上成功建立肥胖症并2型糖尿病动物模型, 此模型接近人类2型糖尿病的发病过程和代谢特征, 可用于肥胖症和2型糖尿病的手术和内镜介入治疗的研究.
引文著录: 付唆林, 朱惠明, 郑丽. 实验性Beagle犬肥胖症并2型糖尿病模型的建立. 世界华人消化杂志 2011; 19(24): 2534-2539
Revised: July 22, 2011
Accepted: August 26, 2011
Published online: August 28, 2011
AIM: To establish a big animal model of obesity and type 2 diabetes for further investigation of surgical or endoscopic interventional therapy of this disease.
METHODS: Ten healthy adult male Beagle dogs were randomly and equally divided into two groups: control group and model group. The control group was feed a standard diet during the whole experiment (16 wk), while the model group was feed a high-fat hypercaloric diet. At week 8, the model group was intravenously injected with small dose of streptozotocin (STZ). The body mass, length, fasting blood glucose, intravenous glucose tolerance test (IVGTT), and lipid were measured regularly.
RESULTS: At week 8, the average body mass (16.9 kg ± 0.8 kg vs 14.8 kg ± 1.03 kg, P < 0.01), Lee index (P < 0.05), serum insulin and c-peptide (both P < 0.01) were significantly higher in the model group than in the control group. One week after STZ injection, in the model group, the fast blood glucose was significantly higher than that in the control group (P < 0.05), IVGTT-2 h glucose was significantly higher than the pre-injection value (143 mg/dL ± 7.4 mg/dL vs 127 mg/dL ± 4.2 mg/dL, P < 0.05), and serum insulin and c-peptide decreased significantly (P < 0.01). Eight weeks after STZ injection, in the model group, the fast blood glucose was significantly higher than that in the control group (P < 0.01), and IVGTT-2h glucose was significantly higher than the pre-injection value (323 mg/dL ± 12.1 mg/dL vs 127 mg/dL ± 4.2 mg/dL, P < 0.01). All Beagle dogs were confirmed to have type 2 diabetes, and no Beagle dogs died during the experimental period.
CONCLUSION: A high-fat hypercaloric diet combined with intravenous injection of small dose of STZ can induce obesity and type 2 diabetes in Beagle dogs. This animal model mimics the nature history and metabolic characteristics of human type 2 diabetes and can be used for further investigation of surgical or endoscopic interventional therapy of obesity and type 2 diabetes.
- Citation: Fu SL, Zhu HM, Zheng L. Establishment of a Beagle dog model of obesity and type 2 diabetes. Shijie Huaren Xiaohua Zazhi 2011; 19(24): 2534-2539
- URL: https://www.wjgnet.com/1009-3079/full/v19/i24/2534.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i24.2534
现代社会肥胖症(obesity)患者越来越多, 肥胖症容易引发2型糖尿病(type 2 diabetes mellitus, T2DM)和代谢综合征(metabolic syndrome, MS)[1]. 传统方法治疗此类慢性代谢疾病收效甚微, 而手术治疗效果显著[2,3], 在国外十分普及, 已成为标准的治疗方法, 是目前国际上的研究热点[4]. 目前手术方式已由传统的开放性手术转为腹腔镜操作[5,6]. 随着腹腔镜减肥手术的广泛开展和逐渐成熟, 内镜手术治疗代谢疾病已经开始进入各国学者的视野[7]. 对减肥手术治疗肥胖症和T2DM的机制研究需要在动物模型上进行, 到目前为止, 多数研究以大鼠等啮齿类动物建立模型[8], 因其体型小并不能耐受手术及内镜治疗, 因此, 我们利用Beagle犬建立肥胖症并T2DM大型动物模型, 为进一步的内镜减肥手术研究提供合适载体.
纯种成年Beagle犬10只, 体质量14 kg±0.5 kg, ♂, 12月龄, 经心、肝、肾等常规生化指标检测未见异常, 购于广东省康达实验动物中心. 恒温恒湿环境条件下分笼饲养, 每笼1只, 每日定时定量喂食, 自由饮水.
1.2.1 分组及饲养: 随机分为对照组和模型组, 每组5只. 对照组全程给予标准基础饲料(15 084 kJ/d: 27%蛋白质, 38%碳水化合物, 35%脂肪, 购于北京华埠康生物科技公司). 模型组全程给予高脂高热量饲料(21 369 kJ/d: 20%蛋白质, 27%碳水化合物, 53%脂肪, 购于北京华埠康生物科技公司). 本实验动物每日投喂量及饲料热量比较高, 实验周期设置16 wk. 模型组于第8周注射STZ. STZ注射前禁食12 h, 自由饮水. 速眠新(军需大学兽医研究所)0.08-0.10 mL/kg肌注麻醉Beagle犬, 背位固定手术台, 碘伏、750 mL/L酒精消毒表面皮肤, 铺无菌单, 注射STZ前先行右小隐静脉抽血, 用于造模前两组Beagle犬血液指标检测. 模型组Beagle犬从右小隐静脉一次性静脉推注62.5 g/L的STZ-柠檬酸溶液[9], 推注剂量为22 mg/kg, 推注时间在3-4 min. 正常对照组行0.9%生理盐水静脉注射. 注射完毕后2组动物以0.9%生理盐水缓慢静脉滴注30 min.
1.2.2 检测指标及判定标准: 每周检测Beagle犬体质量、鼻肛体长计算Lee指数(肥胖评定指数) = ×103/体长(cm)(M为体质量)[10]. 分别于STZ注射前(STZ 0 wk)、STZ注射后1 wk(STZ 1 wk)、4 wk(STZ 4 wk)、8 wk(STZ 8 wk)检测血脂、空腹血糖、IVGTT试验判定Beagle犬肥胖症并T2DM模型的建立. 胰岛素抵抗和胰岛β细胞分泌功能不全是T2DM发病的两个重要病理生理基础, 故本研究以Beagle犬产生胰岛素抵抗并胰岛B细胞功能下降, 体质量大于对照组体质量的20%[11], Lee指数较对照组显著增高[10], 空腹血糖>126 mg/dL(7.0 mmol/L)或者IVGTT试验2 h血糖>200 mg/dL(11.1 mmol/L)为模型建立成功.
统计学处理 计量资料以mean±SD表示, 采用SPSS13.0中的ANOVA程序进行单因素方差分析, 组间比较采用t检验, P<0.05表示差异有统计学意义.
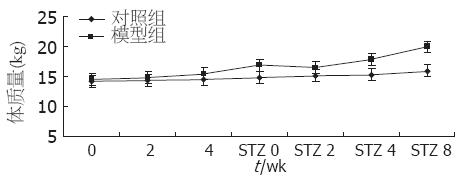
2.1.1 两组Beagle犬体质量的比较: 随着饲养周数的延长, 模型组的体质量在实验4 wk后已高于对照组(P<0.05), 这种差异随着时间延长逐渐加大(P<0.01). 模型组在8 wk的高脂热量饮食后, 平均体质量是16.9 kg±0.8 kg, 较对照组体质量(14.8 kg±1.03 kg)高14.2%. 模型组在STZ注射后1 wk体质量略有下降, 在STZ注射后4 wk、8 wk体质量呈加快增长趋势, 至STZ注射后8 wk较对照组(15.9 kg±1.13 kg)体质量高25.1%, 提示模型组已发生肥胖(表1, 图1).
2.1.2 两组Beagle犬Lee指数的比较: 第8周Lee指数模型组较对照组显著性增高(P<0.05). Lee指数是通常采用的实验动物肥胖评定标准, Lee指数与体内脂肪呈显著正相关[10], 提示高脂高热量饮食后模型组已发生肥胖. STZ注射后4 wk, 8 wk Lee指数模型组较对照组显著性增高(P<0.01), 表明持续高脂高热量因素使模型组动物仍保持肥胖(表2).
2.2.1 两组Beagle犬空腹血糖变化: 两组动物STZ注射前空腹血糖比较差异没有显著意义. STZ注射后1 wk测定两组Beagle犬空腹血糖差异有统计学意义(117 mg/dL±3.6 mg/dL vs 88.2 mg/dL±5.4 mg/dL, P<0.05). 至STZ注射后4 wk两组动物空腹血糖有显著差异(171 mg/dL±9.0 mg/dL vs 68.4 mg/dL±1.8 mg/dL, P<0.01). 模型组Beagle犬空腹血糖由STZ注射后1-8 wk逐渐达到糖尿病标准, 并非在几天内全部复制成标准的糖尿病模型.
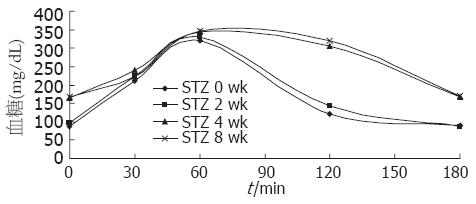
2.2.2 两组Beagle犬静脉葡萄糖实验结果: (1)STZ注射前两组Beagle犬胰岛素敏感性、糖耐量状态变化的比较. 模型组胰岛素敏感性(insulin sensitivity, SI)[6.1 μU/(mL•min)±0.8 μU/(mL•min)]照组[4.2 μU/(mL•min)±0.3 μU/(mL•min)]下降, P<0.05, 差异有统计学意义. 胰岛素分泌(acute insulin response to glucose, AIRg)较对照组增高41.4%、C-肽(C-peptide)较对照组增高55%, 有显著统计学意义(P<0.01), 可以看出模型组已通过高脂高热饲料诱导出胰岛素抵抗, 胰岛素敏感性下降. 葡萄糖处置指数(disposition index, DI, 胰岛素敏感度和胰岛素分泌的乘积), 美国学者在2010欧洲糖尿病研究学会(EASD)年会上指出葡萄糖处置指数维持失败可导致糖耐量状态的恶化. 模型组葡萄糖处置指数(3 024±487)较对照组(3 105±525)比较, 无统计学意义, 提示此阶段模型组动物尚未发生IGT; (2)STZ注射后模型组Beagle犬胰岛B细胞功能、糖耐量状态的变化. 模型组Beagle犬在注射STZ前后胰岛素[720 μU/(mL•min)±19.4 μU/(mL•min) vs 35 μU/(mL•min)±3.2 μU/(mL•min), P<0.01], c-肽(7 068±1 750 0-10 min, pM•min vs 1 470±65 0-10 min, pM•min, P<0.01), 提示STZ对胰岛B细胞的破坏作用, 导致胰岛B细胞功能显著下降. STZ注射后第8周胰岛素[50 μU/(mL•min)±2.1 μU/(mL•min)]与STZ注射后第4周[46 μU/(mL•min)±3.1 μU/(mL•min)维持平稳显示STZ对胰岛B细胞的破坏作用的持久性. STZ注射后葡萄糖处置指数(108±34)与STZ注射前(3 024±487)比较有显著统计学差异(P<0.01), 说明Beagle犬在注射STZ后产生了IGT; (3)模型组注射STZ前后IVGTT-2 h血糖变化. 模型组Beagle犬在STZ注射后1 wk的IVGTT-2h血糖(143±7.4) mg/dL, 产生糖耐量受损, 在STZ注射后4 wk的IVGTT-2h血糖(305±11.3) mg/dL, 到STZ第8周与STZ第4周保持大致平稳, 提示模型组Beagle犬已达到T2DM标准并维持稳定(图2).
2.2.3 高脂喂养后Beagle犬血脂变化: 至实验结束, 模型组的血清总胆固醇(total cholesterol, TC)(7.85 mmol/L±1.42 mmol/L)、低密度脂蛋白(low-density lipoprotein, LDL)(1.84 mmol/L±0.72 mmol/L)水平明显高于对照组(4.51 mmol/L±1.20 mmol/L, 0.28 mmol/L±0.03 mmol/L), 有显著统计学差异(P<0.01). 高密度脂蛋白(high-density lipoprotein, HDL)(2.02 mmol/L±1.02 mmol/L)与对照组(1.41 mmol/L±0.58 mmol/L)相比无显著性差异, 模型组三酰甘油(triglyceride, TG)(3.04 mmol/L±1.12 mmol/L)高于对照组(1.75 mmol/L±0.39 mmol/L), 差异有统计学意义(P<0.01). 提示模型组已产生部分代谢综合征特征.
目前, 关于糖尿病和代谢综合征发病的确切机制仍不清楚. 各项研究表明, 主要与遗传和环境因素有关, 而环境因素中, 最主要的是肥胖. 国际糖尿病联盟(IDF)认为肥胖, 特别是腹型肥胖是T2DM发病的中心环节, 建议将肥胖作为T2DM干预的首要或一级目标. 可以推测, 相当部分患者是因为肥胖引发胰岛素抵抗, 同时高血脂和高血糖也可影响胰腺β细胞功能, 造成胰岛素分泌功能障碍, 逐渐发展成糖耐量异常, 最后发展为糖尿病. 临床上, 肥胖症、血脂异常、脂肪肝、高血压、冠心病、IGT或T2DM等疾病常同时或先后发生, 并伴高胰岛素血症, 目前认为这些均与肥胖及肥胖相关联的胰岛素抵抗有关, 称为MS. MS患者常具有多重心血管危险因素, 是心血管疾病的高危人群[12,13]. 可以认为肥胖症-T2DM-MS-心脑血管疾病是目前和未来除恶性肿瘤外最危害人类健康的问题, 应及早预防和干预. 因此, 建立肥胖症-T2DM-MS发展模式的动物模型对此类疾病的治疗研究意义重大, 而内镜手术治疗的探索则需要大型动物模型作依托.
用于T2DM研究的动物模型很多, 包括老鼠、猫、猪、灵长类等动物, 制备方式从基因打靶到化学诱导各式各样[14-16]. 然而, 这些动物模型中能够模拟重现T2DM自然史及生理病理特点的很少, 特别是肥胖相关的T2DM. 研究证明, 高脂高糖饮食和小剂量STZ破坏胰岛B细胞联合作用建立起来的T2DM动物模型与人类T2DM的发病机制接近, 成模率高, 稳定, 重复性好[17,18]. 我们的研究利用此模式在Beagle犬身上成功的建立起一种类似人类T2DM代谢特征的动物模型, 他由早期的肥胖引发的胰岛素抵抗逐渐发展成胰岛B细胞功能缺陷、对胰岛素无法代偿时最终进展成IGT和T2DM.
相关研究证明, 狗的肥胖多与饮食模式和热量摄入有关[19]. 在我们的研究中, 运用高脂高热量饲料给予实验组动物饲养4 wk后其体质量增长较对照组比较有统计学意义(P<0.05). 判断人类肥胖的常用指标是体质量指数(body mass index, BMI), 但还没有明确的指标用来界定狗的肥胖状况, 有研究采用一种基于视觉观察、形态测量等基础上的体况评分(body condition score, BCS)来界定狗的体质量是标准、超重或者肥胖[20]. 相关报道认为, 狗的体质量超过正常的15%[21]或者20%[11]可界定成肥胖. 本研究采用Lee指数及体质量来判断狗肥胖模型的建立, 模型组在给予高脂高热量饮食8 wk后, Lee指数与对照组比较有显著差异(P<0.05), 证实高脂高热量饮食可诱导Beagle犬肥胖症的产生. 至实验结束模型组平均体质量(19.9 kg±0.84 kg)较对照组体质量(15.9 kg±1.13 kg)高25.1%, 达到狗的肥胖诊断标准. 胰岛素抵抗常伴随肥胖而产生, 有研究显示狗在高脂高热量喂养1 wk开始出现胰岛素抵抗并持续整个高脂高热量喂养过程[9], 本研究中Beagle犬在高脂高热量饲料喂养8 wk行IVGTT, 胰岛素分泌、C-肽显著高于正常对照组, 而血糖与对照组比较没有统计学差异, 这与文献报道相一致[22,23], 模拟了人类T2DM早期存在肥胖相关的胰岛素抵抗而胰岛B细胞可代偿性增加胰岛素分泌来维持血糖正常这一重要特征.
本实验的第二阶段是注射小剂量的STZ破坏胰岛B细胞造成胰岛B细胞功能缺陷, 进而最终发展成IGT和T2DM. 自从20世纪60年代和70年代开始, 利用STZ诱发动物糖尿病模型以来[24-26], STZ已经成为目前广泛采用的糖尿病动物模型化学诱导剂. STZ诱导的糖尿病因剂量不同, 其成模效果也有所差别, 肝肾毒性是其主要的缺点[27], STZ剂量过大对动物肝肾损伤大并且易导致动物死亡, 过小则难以成模或自然阴转率高. 国内外尤其国外对STZ诱导的灵长类动物糖尿病模型研究较多, 对造模狗的最适剂量的报道不尽相同, STZ的各种剂量(15-150 mg/kg)均可见报道. 有研究显示狗STZ注射的半致死剂量为50 mg/kg, 与致DM的剂量非常接近[28], 故有重复多次小剂量STZ注射制备DM的报道[29]. 本研究旨在Beagle犬上重现人类T2DM的肥胖-胰岛素抵抗-糖耐量调节受损-T2DM自然发展过程, 故给带有肥胖症伴随胰岛素抵抗的Beagle犬谨慎的采取了22 mg/kg的小剂量的STZ静脉注射量, 使模型组动物逐渐复制成T2DM. 模型组动物在注射STZ后的1 wk的静脉葡萄糖耐量试验显示胰岛素分泌量较STZ注射前显著减少, 这表明注射STZ后对胰岛B细胞的破坏作用. 本实验在STZ注射后1 wk模型组动物因食欲下降饮食减少体质量曾有一过性下降, 1 wk后所有模型组动物逐渐恢复饮食, 并出现多饮多食多尿症状. 有文献报道, 当犬类的随机血糖>200 mg/dL(11.1 mmol/L), 并伴随糖尿病症状时可诊断为DM[30], 这与人类DM极为一致. 本实验STZ注射后1 wk, 模型组动物空腹血糖波动在112-121 mg/dl之间, IVGTT-2 h血糖在142-191 mg/dL之间, 均表现有糖耐量调节受损. 注射后8 wk模型组动物空腹血糖波动在164-185 mg/dL之间, IVGTT-2 h血糖在230-320 mg/dL之间, 表明模型组Beagle犬是逐渐全部复制成DM模型而非在几天内全部复制成标准的DM模型. 本实验结束时模型组Beagle犬血脂较对照组明显增高, 已具备部分代谢综合征特征. 有关研究显示, STZ运用于犬类制备DM动物模型剂量较大[28], 本实验采取小剂量STZ静脉注射能够成功制备T2DM很可能是因为动物处于肥胖并胰岛素抵抗阶段.
尽管至今还没有一种公认的理想动物模型与人类T2DM的复杂特征完全吻合, 但本实验建立了一种新的综合了肥胖, 胰岛素抵抗和胰岛B细胞功能缺陷等特征的T2DM大型动物模型, 他有诸多类似人类T2DM的特征: 成人发病, 多数症状较轻, 肥胖, 胰岛素抵抗及首先出现胰岛素抵抗和代偿性高胰岛素血症, 之后出现胰腺功能下降、糖耐量受损这一自然发展过程. 这给T2DM的疾病发展模式提供了一定见解. 本研究建立的Beagle犬肥胖症并T2DM模型, 模型稳定安全, 肝肾功能损害小, 动物糖尿病症状多较轻, 体质状况良好, 不需要胰岛素治疗, 耐受性较好, 适用于肥胖症和T2DM的手术和内镜介入治疗的研究.
手术治疗肥胖症并2型糖尿病在西方国家开展十分普及, 疗效明显, 已成为常用方法, 相似原理的内镜手术也已见报道, 但其机制并不清楚. 当前相关机制研究多使用大鼠等小动物模型, 不太适合手术的干预研究.
徐庆, 教授, 桂林医学院药理教研室; 郝建宇, 教授, 首都医科大学附属北京朝阳医院消化内科
减肥手术治疗肥胖症并2型糖尿病的机制研究成为代谢外科领域的研究热点, 在临床应用已观察到其显著疗效, 但其机制研究缺乏相应的大型动物模型.
Ionut等首次报道了利用大型动物狗通过高脂肪高热量饲料喂养联合链脲佐菌素化学损伤胰腺的方法成功制造出符合人类自然发病过程的肥胖症合并2型糖尿病模型, 为手术或内镜治疗疗效观察及其机制研究提供了良好载体.
本研究首次在大型实验动物Beagle犬制造出肥胖症并2型糖尿病模型, 为需要该种模型的研究提供了稳定可靠的来源.
本文设计合理, 数据可靠, 在目前很少大动物糖尿病模型的情况下, 该模型的建立对于糖尿病的研究有一定价值及意义.
编辑: 李薇 电编:何基才
| 1. | 卫生部疾病控制司, 中华医学会糖尿病学分会. 《中国糖尿病防治指南》(试行本)(节选). 中国慢性病预防与控制. 2004;12:283-285. |
| 2. | Pories WJ, MacDonald KG, Flickinger EG, Dohm GL, Sinha MK, Barakat HA, May HJ, Khazanie P, Swanson MS, Morgan E. Is type II diabetes mellitus (NIDDM) a surgical disease? Ann Surg. 1992;215:633-642; discussion 643. [PubMed] [DOI] |
| 3. | Rubino F, Forgione A, Cummings DE, Vix M, Gnuli D, Mingrone G, Castagneto M, Marescaux J. The mechanism of diabetes control after gastrointestinal bypass surgery reveals a role of the proximal small intestine in the pathophysiology of type 2 diabetes. Ann Surg. 2006;244:741-749. [PubMed] [DOI] |
| 4. | Rubino F, Marescaux J. Effect of duodenal-jejunal exclusion in a non-obese animal model of type 2 diabetes: a new perspective for an old disease. Ann Surg. 2004;239:1-11. [PubMed] [DOI] |
| 5. | Higa KD, Boone KB, Ho T, Davies OG. Laparoscopic Roux-en-Y gastric bypass for morbid obesity: technique and preliminary results of our first 400 patients. Arch Surg. 2000;135:1029-1033; discussion 1029-1033. [PubMed] [DOI] |
| 6. | DeMaria EJ, Sugerman HJ, Kellum JM, Meador JG, Wolfe LG. Results of 281 consecutive total laparoscopic Roux-en-Y gastric bypasses to treat morbid obesity. Ann Surg. 2002;235:640-645; discussion 640-645. [PubMed] [DOI] |
| 9. | Ionut V, Liu H, Mooradian V, Castro AV, Kabir M, Stefanovski D, Zheng D, Kirkman EL, Bergman RN. Novel canine models of obese prediabetes and mild type 2 diabetes. Am J Physiol Endocrinol Metab. 2010;298:E38-E48. [PubMed] [DOI] |
| 10. | Bernardis LL, Patterson BD. Correlation between 'Lee index' and carcass fat content in weanling and adult female rats with hypothalamic lesions. J Endocrinol. 1968;40:527-528. [PubMed] [DOI] |
| 11. | German AJ, Holden SL, Bissot T, Morris PJ, Biourge V. Use of starting condition score to estimate changes in body weight and composition during weight loss in obese dogs. Res Vet Sci. 2009;87:249-254. [PubMed] [DOI] |
| 12. | Gupta S, Gupta BM. Metabolic syndrome: diabetes and cardiovascular disease. Indian Heart J. 2006;58:149-152. [PubMed] |
| 13. | Guize L, Pannier B, Thomas F, Bean K, Jégo B, Benetos A. Recent advances in metabolic syndrome and cardiovascular disease. Arch Cardiovasc Dis. 2008;101:577-583. [PubMed] [DOI] |
| 14. | Masiello P. Animal models of type 2 diabetes with reduced pancreatic beta-cell mass. Int J Biochem Cell Biol. 2006;38:873-893. [PubMed] [DOI] |
| 16. | Srinivasan K, Ramarao P. Animal models in type 2 diabetes research: an overview. Indian J Med Res. 2007;125:451-472. [PubMed] |
| 17. | Srinivasan K, Viswanad B, Asrat L, Kaul CL, Ramarao P. Combination of high-fat diet-fed and low-dose streptozotocin-treated rat: a model for type 2 diabetes and pharmacological screening. Pharmacol Res. 2005;52:313-320. [PubMed] [DOI] |
| 18. | Wang HJ, Jin YX, Shen W, Neng J, Wu T, Li YJ, Fu ZW. Low dose streptozotocin (STZ) combined with high energy intake can effectively induce type 2 diabetes through altering the related gene expression. Asia Pac J Clin Nutr. 2007;16 Suppl 1:412-417. [PubMed] |
| 19. | Heuberger R, Wakshlag J. The relationship of feeding patterns and obesity in dogs. J Anim Physiol Anim Nutr (Berl). 2011;95:98-105. [PubMed] [DOI] |
| 20. | Mawby DI, Bartges JW, d'Avignon A, Laflamme DP, Moyers TD, Cottrell T. Comparison of various methods for estimating body fat in dogs. J Am Anim Hosp Assoc. 2004;40:109-114. [PubMed] |
| 21. | Colliard L, Ancel J, Benet JJ, Paragon BM, Blanchard G. Risk factors for obesity in dogs in France. J Nutr. 2006;136:1951S-1954S. [PubMed] |
| 22. | Mittelman SD, Van Citters GW, Kim SP, Davis DA, Dea MK, Hamilton-Wessler M, Bergman RN. Longitudinal compensation for fat-induced insulin resistance includes reduced insulin clearance and enhanced beta-cell response. Diabetes. 2000;49:2116-2125. [PubMed] [DOI] |
| 23. | Verkest KR, Fleeman LM, Rand JS, Morton JM. Evaluation of beta-cell sensitivity to glucose and first-phase insulin secretion in obese dogs. Am J Vet Res. 2011;72:357-366. [PubMed] [DOI] |
| 24. | Rakieten N, Rakieten ML, Nadkarni MR. Studies on the diabetogenic action of streptozotocin (NSC-37917). Cancer Chemother Rep. 1963;29:91-98. [PubMed] |
| 25. | Erdal N, Gürgül S, Kavak S, Yildiz A, Emre M. Deterioration of bone quality by streptozotocin (STZ)-induced type 2 diabetes mellitus in rats. Biol Trace Elem Res. 2011;140:342-353. [PubMed] [DOI] |
| 26. | Black HE, Rosenblum IY, Capen CC. Chemically induced (streptozotocin-alloxan) diabetes mellitus in the dog. Biochemical and ultrastructural studies. Am J Pathol. 1980;98:295-310. [PubMed] |
| 27. | Dufrane D, van Steenberghe M, Guiot Y, Goebbels RM, Saliez A, Gianello P. Streptozotocin-induced diabetes in large animals (pigs/primates): role of GLUT2 transporter and beta-cell plasticity. Transplantation. 2006;81:36-45. [PubMed] [DOI] |
| 28. | Rerup CC. Drugs producing diabetes through damage of the insulin secreting cells. Pharmacol Rev. 1970;22:485-518. [PubMed] |
| 29. | Tobin BL, Finegood DT. Reduced insulin secretion by repeated low doses of STZ impairs glucose effectiveness but does not induce insulin resistance in dogs. Diabetes. 1993;42:474-483. [PubMed] [DOI] |
| 30. | Stockham SL, Scott MA. Fundamentals of Veterinary Clinical Pathology. Ames, IA: Iowa State Press, A Blackwell Publishing Company 2000; . |