修回日期: 2011-08-22
接受日期: 2011-08-26
在线出版日期: 2011-08-28
目的: 探讨ω-3多不饱和脂肪酸(ω-3PUFA)对大鼠肝切除术后肝脏紧密连接和肝脏再生的影响.
方法: 采用大鼠70%肝切除模型, ♂SD大鼠80只随机分为假手术组、70%肝切除对照组、小剂量ω-3PUFA组(1 mL/kg)和大剂量ω-3PUFA组(2 mL/kg). 检测术后1、2、3、5 d血清总胆汁酸、总胆红素、ALT和白蛋白值. Western blot检测肝脏紧密连接蛋白Occludin, Claudin-3和ZO-1表达及反映肝再生的PCNA表达. 激光共聚焦显微镜下观察肝脏紧密连接结构变化.
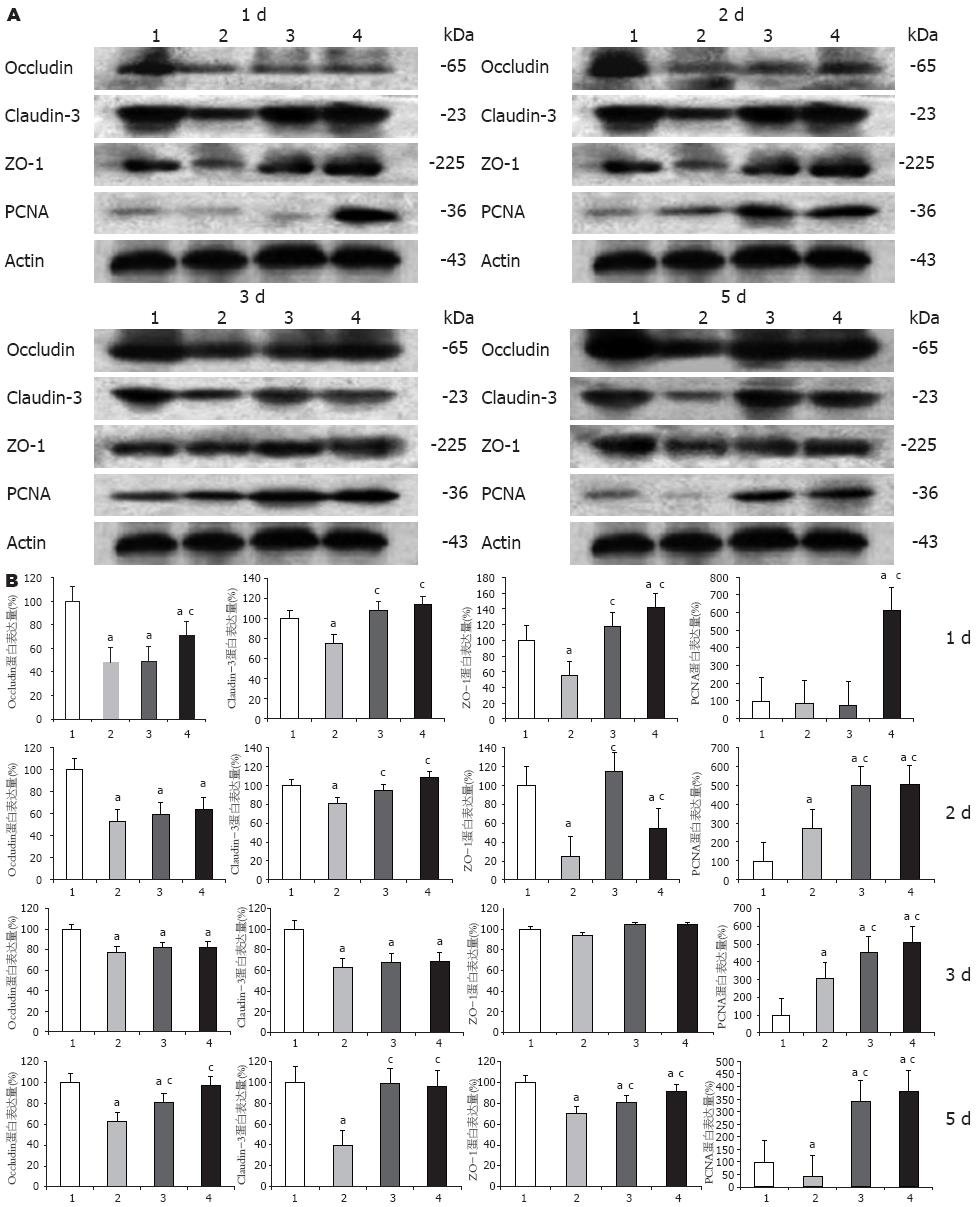
结果: 术后1 d, 与对照组相比较, ω-3PUFA组血清总胆汁酸(181.2±63.9, 166.7±68.9 vs 228.9±37.7), 总胆红素(13.5±8.8, 7.6±0.1 vs 25.9±15.3)和ALT(1042.2±179.7, 901.4±182.3 vs 2703.9±130.0)均显著降低(P<0.05), 白蛋白(27.2±1.1, 29.8±0.9 vs 30.5±1.2)无明显变化. 术后2 d, 与对照组相比较, ω-3PUFA组血清总胆红素(6.8±9.2, 6.1±2.0 vs 17.7±1.1)和ALT(452.8±258.5, 499.8±155.9 vs 1466.5±30.2)均显著降低(P<0.05), 白蛋白(26.8±0.4, 27.7±1.0 vs 25.7±0.6)无明显变化. ω-3PUFA组术后1、2、5 d肝脏紧密连接(Occludin, Claudin-3, ZO-1)的表达显著增加(P<0.05), 术后1、2、3、5 d肝脏再生程度明显增加(P<0.05). 激光共聚焦显示ω-3 PUFA组肝脏紧密连接结构恢复.
结论: ω-3PUFA可以促进大鼠肝切除术后肝脏紧密连接的稳定高表达, 保护其结构, 并促进肝再生, 保护肝功能.
引文著录: 严笑鹏, 王升, 杨跃, 仇毓东. ω-3多不饱和脂肪酸对大鼠肝切除术后肝脏紧密连接及肝再生的影响. 世界华人消化杂志 2011; 19(24): 2527-2533
Revised: August 22, 2011
Accepted: August 26, 2011
Published online: August 28, 2011
AIM: To investigate the effect of ω-3 polyunsaturated fatty acids (PUFAs) on hepatic tight junctions and liver regeneration in rats after partial hepatectomy (PH)
METHODS: A rat model of 70% PH was used in this study. Eighty male SD rats were randomly divided into sham operation group, PH group, PH + low-dose ω-3 PUFA (1 mL/kg) group and PH + high-dose ω-3 PUFA (2 mL/kg) group. Serum samples were collected to measure the levels of total bile acids, total bilirubin, alanine aminotransferase (ALT) and albumin on days 1, 2, 3 and 5 after PH. Tissue samples were collected for detecting the expression of hepatic tight junction proteins (Occludin, Claudin-3 and ZO-1) and PCNA (a parameter reflecting liver regeneration) by Western blot. Tissue samples were also collected for observation of structural changes in hepatic tight junctions by confocal microscopy.
RESULTS: In comparison with the PH group on day 1, the levels of total bile acids (181.2 ± 63.9, 166.7 ± 68.9 vs 228.9 ± 37.7), total bilirubin (13.5 ± 8.8, 7.6 ± 0.1 vs 25.9 ± 15.3) and ALT (1042.2 ± 179.7, 901.4 ± 182.3 vs 2703.9 ± 130.0) decreased significantly in the low- and high-dose ω-3 PUFA groups (all P < 0.05), whereas no marked changes in the level of albumin (27.2 ± 1.1, 29.8 ± 0.9 vs 30.5 ± 1.2) were observed. Compared to the PH group on day 2, a significant decrease in the levels of total bilirubin (6.8 ± 9.2, 6.1 ± 2.0 vs 17.7 ± 1.1) and ALT (452.8 ± 258.5, 499.8 ± 155.9 vs 1 466.5 ± 30.2) was noted in the low- and high-dose ω-3 PUFA groups (all P < 0.05), whereas no marked changes in the level of albumin (26.8 ± 0.4, 27.7 ± 1.0 vs 25.7 ± 0.6) were observed. The expression of hepatic tight junction proteins (Occludin, Claudin-3 and ZO-1) increased significantly on days 1, 2 and 5 after PH (all P < 0.05), and liver regeneration was enhanced significantly on days 1, 2, 3 and 5 after PH (all P < 0.05). Treatment with ω-3 PUFAs promoted structural restoration of hepatic tight junctions.
CONCLUSION: ω-3 PUFAs not only promote the expression of tight junction proteins and protect the structure of hepatic tight junctions but also promote liver regeneration and protect liver function in rats after PH.
- Citation: Yan XP, Wang S, Yang Y, Qiu YD. Effect of ω-3 polyunsaturated fatty acids on hepatic tight junctions and liver regeneration in rats after partial hepatectomy. Shijie Huaren Xiaohua Zazhi 2011; 19(24): 2527-2533
- URL: https://www.wjgnet.com/1009-3079/full/v19/i24/2527.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i24.2527
肝脏紧密连接(tight junction, TJ)不仅存在于肝细胞间, 还分布于胆小管上, 构成血液-胆汁屏障, 使胆汁在胆小管内与血液循环分离开来, 并对于细胞间的通透性, 胆汁的分泌和细胞的极性起到了重要的作用[1,2]. 肝脏紧密连接同其他组织细胞间紧密连接一样, 由不同的TJ蛋白组成. TJ主要由跨膜蛋白Occludin、Claudins、JAMs和连接蛋白ZOs等构成, 对于组织结构的稳定和功能的维持起到重要的作用[3-7]. 在肝再生的过程中, TJ的形成对于肝脏功能的维持起到了重要的作用, 并可导致胆小管结构的重建以及肝细胞极性的重新形成[8-13]. 为了控制肝切除术后的肝衰, 提高术后生存率, 对于肝再生的促进及肝脏紧密连接的保护就显得尤为重要. 本研究通过围手术期应用具有抗炎、抗氧化和保肝等作用的营养制剂ω-3多不饱和脂肪酸(ω-3PUFA)[14-19], 采用70%大鼠肝切除模型, 探索其对于大鼠部分肝切除术后肝脏TJ的表达和结构以及肝再生的影响.
实验采用体质量220-250 g的♂SD大鼠(购自南京大学附属鼓楼医院动物实验中心). ω-3多不饱和脂肪酸(ω-3PUFA, 商品名尤文注射液, 批号: 16DA0043)购自德国费森尤斯卡比公司. 羊抗Occludin和羊抗Claudin-3抗体购自Santa Cruz公司, 兔抗ZO-1和小鼠抗PCNA购自Invitrogen公司, 小鼠抗Actin购自Sigma-Aldrich公司.
1.2.1 分组及造模: 实验大鼠随机分为假手术组、对照组、小剂量ω-3PUFA组和大剂量ω-3PUFA组. 假手术组仅作开关腹, 对照组行70%肝切除, 其他大鼠从术前两天开始, 分别以1 mL/kg和2 mL/kg的剂量, 静脉给予ω-3PUFA, 肝切除手术结束以及术后每天亦给予相应剂量的鱼油, 直至处死的时间点(术后1、2、3、5 d). 每组每时间点设10个样本行Western blot、激光共聚焦、肝功能和残肝/体质量比检查. 大鼠70%肝切除模型参照Higgins-Anderson[20]所采用的肝切除方法进行, 切除大鼠左叶, 中叶, 保留右叶和尾状叶.
1.2.2 肝功能测定: 各组分别于肝切除术后1、2、3、5 d从大鼠眶后静脉丛采血2 mL送鼓楼医院检验科生化试验室检验, 用大型生化分析仪检测血清中总胆汁酸、总胆红素、ALT及白蛋白的水平.
1.2.3 肝脏紧密连接蛋白的表达: 各组分别于肝切除术后1、2、3、5 d取10 g左右大鼠肝组织冻存于液氮罐中, 取0.1 g的肝脏组织加入500 mL的组织蛋白裂解液, 充分研磨后取上清蛋白溶液, Western blot法检测肝脏紧密连接蛋白的表达水平.
1.2.4 肝脏紧密连接蛋白结构的变化: 各组分别于肝切除术后1、2、3、5 d取20 g左右大鼠肝组织置于-80 ℃冰箱中, 以20 μm厚度制作冰冻切片, 在激光共聚焦显微镜(Zeiss)下观察肝脏紧密连接蛋白结构的改变情况.
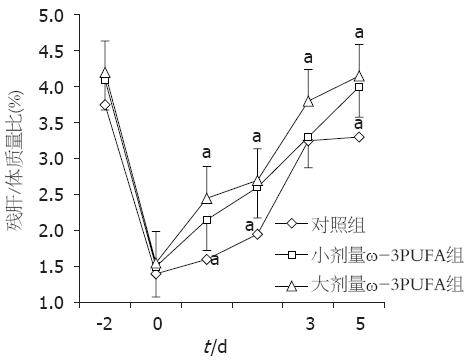
1.2.5 肝再生的测定: 各组分别于肝切除术后1、2、3、5 d取10 g左右大鼠肝组织冻存于液氮罐中, 取0.1 g的肝脏组织加入500 mL的组织蛋白裂解液, 充分研磨后取上清蛋白溶液, Western blot法检测肝脏PCNA的表达水平. 另外, 于术后1、2、3、5 d处死动物, 每组大鼠处死前称其体质量, 处死后取出残肝, 生理盐水漂洗后称质量, 计算每组残肝/体质量比.
统计学处理 计量资料用mean±SD表示, 多组样本均数比较采用单因素方差分析, 先进行方差齐性检验, 然后采用Student-Newman-Keuls检验进行两两比较, 以双侧α = 0.05为检验水准, 全部统计分析采用SPSS16.0软件实现.
术后1 d和2 d的总胆汁酸、总胆红素和ALT值: 对照组与假手术组比较均增高, 统计学差异显著(P<0.05), ω-3PUFA组与对照组比较均降低, 统计学差异显著(P<0.05), 大剂量ω-3PUFA组与小剂量ω-3PUFA组比较无统计学差异(表1, 表2, 表3). 术后各时间点的白蛋白值各组间比较无统计学差异(表4).
| 术后时间 | 白蛋白(g/L) | |||
| 假手术组 | 对照组 | 小剂量ω-3PUFA组 | 大剂量ω-3PUFA组 | |
| 1 d | 35.4±0.8 | 30.5±1.2 | 27.2±1.1 | 29.8±0.9 |
| 2 d | 36.1±1.2 | 25.7±0.6 | 26.8±0.4 | 27.7±1.0 |
| 3 d | 35.8±1.1 | 26.3±2.0 | 26.8±2.3 | 24.3±0.7 |
| 5 d | 36.2±0.7 | 26.8±0.7 | 27.9±0.3 | 29.8±0.6 |
与假手术组比较, 术后1、2和5 d的Occludin、Claudin-3和ZO-1蛋白的表达均显著降低(P<0.05), 术后3 d的Occludin和Claudin-3蛋白的表达显著降低(P<0.05), ZO-1无变化. 与对照组比较, 小剂量ω-3PUFA组术后1和2 d的Claudin-3和ZO-1蛋白表达显著增加(P<0.05), 术后5 d的Occludin、Claudin-3和ZO-1蛋白表达显著增加(P<0.05). 与对照组比较, 大剂量ω-3PUFA组术后1 d和5 d的Occludin、Claudin-3和ZO-1蛋白表达显著增加(P<0.05), 术后2 d的Claudin-3和ZO-1蛋白表达显著增加(P<0.05, 图1).
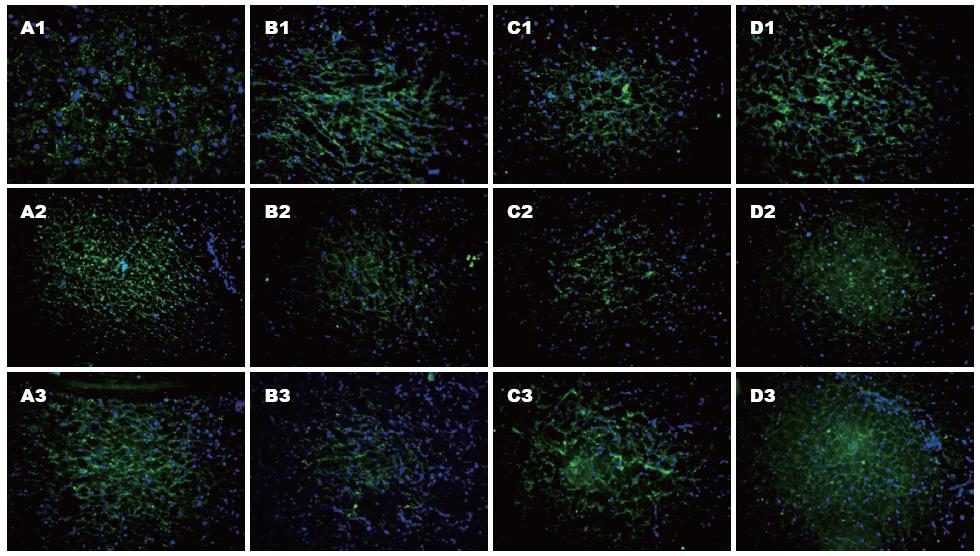
部分肝切除后, 激光共聚焦显微镜下观察发现, 对照组可见紧密连接蛋白荧光染色强度减低, 排列极度紊乱. 小剂量ω-3PUFA组可见紧密连接蛋白荧光染色强度增加, 蛋白呈连续性排列, 紊乱程度减轻. 大剂量ω-3PUFA组可见紧密连接蛋白荧光染色强度增加更为明显, 蛋白排列有序(图2).
21世纪是微创和精准外科的时代. 作为肝脏外科最主要的治疗手段, 肝切除术也面临着重大变革[21,22]. 以精确的术前评估、精细的手术操作和精良的术后处理为核心的精准肝脏外科技术日益受到重视[23,24]. 长期以来的临床实践证明, 对于肝脏肿瘤采用肝切除术有望提高患者的无瘤生存率, 但是病灶切除后的残余肝脏能否维持功能、顺利修复再生将直接影响患者的生存[25-28]. 临床研究表明: 围手术期采用有针对性的营养支持治疗可使患者肝功能损害明显减轻, 并发症显著降低, 对肝再生有促进作用[29,30]. ω-3PUFA是临床静脉营养支持中常用的脂肪乳剂[31], 我们的前期研究证实: 大鼠肝切除术后应用ω-3PUFA可抑制血清中炎症因子的释放, 控制门静脉系统的内毒素血症, 有效保护肝功能[32-35]. 不过, 其对于肝脏TJ及肝再生的影响并没有具体的阐述. 因此, 我们选择ω-3PUFA干预的手段, 初步探讨了其对大鼠肝切除术后肝脏的保护作用.
本实验重点观察了ω-3PUFA在大鼠70%肝切除术后对肝脏紧密连接有无保护作用及对肝再生有无促进作用. 研究结果显示, 通过肝功能检测发现, ω-3PUFA组术后1 d和2 d的总胆汁酸、总胆红素和ALT值较对照组均显著降低, 而白蛋白值各时间点各组间无显著差异, 提示ω-3PUFA可以在早期使肝切除术后的肝功能得到有效的改善, 肝损害得到缓解. 而白蛋白的无显著性变化则提示ω-3PUFA可能对肝脏合成功能的影响不大, 仅对与紧密连接相关的功能如代谢和分泌功能产生保护作用. 肝脏紧密连接蛋白的表达测定发现, ω-3PUFA组在术后1、2和5 d肝脏紧密连接蛋白的表达较对照组显著增加, 而大剂量ω-3PUFA组肝脏紧密连接蛋白的表达增加更为明显. 鉴于术后3 d紧密连接蛋白表达无显著性差异, 我们又通过激光共聚焦显微镜对术后3 d的肝脏紧密连接蛋白的结构进行观察, 发现对照组可见紧密连接蛋白荧光染色强度减低, 排列极度紊乱. 小剂量ω-3PUFA组可见紧密连接蛋白荧光染色强度增加, 蛋白呈连续性排列, 紊乱程度减轻. 大剂量ω-3PUFA组可见紧密连接蛋白荧光染色强度增加更为明显, 蛋白排列有序. 由此可见, ω-3PUFA在一定程度上可以促进肝切除术后肝脏紧密连接蛋白的表达, 保护其结构的完整性. 肝再生的测定发现, ω-3PUFA组在术后各时间点的PCNA表达较对照组显著增加, 而大剂量ω-3PUFA组术后各时间点的PCNA表达增加更为明显, 这些结果与术后各时间点各组残肝/体质量比差异一致, 提示ω-3PUFA可以极大程度的促进肝切除术后的肝再生. 我们认为, ω-3PUFA可以促进肝切除术后肝脏紧密连接的表达, 保护其结构, 有效促进术后肝再生, 保护肝功能. 其在一定程度上可以减轻肝内实质组织和非实质组织的损伤, 对肝细胞和肝脏紧密连接有较好的促进和保护作用.
总之, 本实验在大鼠70%肝切除模型的基础上, 采用围手术期应用ω-3PUFA的方法, 通过肝脏酶学指标, 肝脏紧密连接蛋白表达水平和肝再生水平的检测以及激光共聚焦显微镜观察肝脏紧密连接的结构变化, 阐明了ω-3PUFA对于70%肝切除可以保护术后肝脏的紧密连接结构, 加速肝功能的恢复, 并有效的促进肝再生. 实验结果为进一步研究ω-3PUFA在极限性肝切除中应用奠定了理论基础.
肝脏切除术是治疗肝脏肿瘤、胆管疾病等常用的治疗方法, 挽救了大量患者的生命. 然而, 病灶切除后的残余肝脏能否维持功能、顺利修复再生将直接影响患者的生存, 因此, 肝切除术后肝功能的维护及肝再生的促进是防止术后肝功能衰竭的重要措施.
秦建民, 副教授, 上海中医药大学附属普陀医院肝胆外科; 吴泰璜, 教授, 山东省立医院肝胆外科; 徐迅迪, 教授, 中南大学湘雅二医院肝胆胰外科
有关ω-3多不饱和脂肪酸对肝切除术后肝脏紧密连接及肝再生的作用机制的深入研究仍是下一步要研究的热点.
本课题组前期研究中发现, 大鼠肝切除术后应用ω-3多不饱和脂肪酸可抑制血清中炎症因子的释放, 控制门静脉系统的内毒素血症, 有效保护肝功能.
本研究通过围手术期应用具有抗炎、抗氧化和保肝等作用的营养制剂ω-3多不饱和脂肪酸, 采用70%大鼠肝切除模型, 初步探索了其对于大鼠部分肝切除术后肝脏紧密连接和肝再生的影响.
本研究为进一步研究ω-3多不饱和脂肪酸在极限性肝切除中的应用奠定了理论基础.
本研究探讨了ω-3多不饱和脂肪酸对大鼠肝切除术后肝脏紧密连接和肝脏再生的影响, 文章选题较新颖, 结构紧凑, 分析合理, 条理分明, 参考文献引用恰当, 具有一定的临床意义.
编辑: 何基才 电编:何基才
| 1. | Kojima T, Murata M, Go M, Spray DC, Sawada N. Connexins induce and maintain tight junctions in epithelial cells. J Membr Biol. 2007;217:13-19. [PubMed] [DOI] |
| 2. | Lee NP, Luk JM. Hepatic tight junctions: from viral entry to cancer metastasis. World J Gastroenterol. 2010;16:289-295. [PubMed] [DOI] |
| 3. | Kojima T, Murata M, Yamamoto T, Lan M, Imamura M, Son S, Takano K, Yamaguchi H, Ito T, Tanaka S. Tight junction proteins and signal transduction pathways in hepatocytes. Histol Histopathol. 2009;24:1463-1472. [PubMed] |
| 4. | Powell DW. Barrier function of epithelia. Am J Physiol. 1981;241:G275-G288. [PubMed] |
| 5. | Eaton S, Simons K. Apical, basal, and lateral cues for epithelial polarization. Cell. 1995;82:5-8. [PubMed] [DOI] |
| 7. | Balda MS, Matter K. Tight junctions. J Cell Sci. 1998;111:541-547. [PubMed] |
| 8. | Takaki Y, Hirai S, Manabe N, Izumi Y, Hirose T, Nakaya M, Suzuki A, Mizuno K, Akimoto K, Tsukita S. Dynamic changes in protein components of the tight junction during liver regeneration. Cell Tissue Res. 2001;305:399-409. [PubMed] [DOI] |
| 9. | Yamamoto T, Kojima T, Murata M, Takano K, Go M, Hatakeyama N, Chiba H, Sawada N. p38 MAP-kinase regulates function of gap and tight junctions during regeneration of rat hepatocytes. J Hepatol. 2005;42:707-718. [PubMed] [DOI] |
| 10. | Green RM, Gollan JL, Hagenbuch B, Meier PJ, Beier DR. Regulation of hepatocyte bile salt transporters during hepatic regeneration. Am J Physiol. 1997;273:G621-G627. [PubMed] |
| 11. | Gerloff T, Geier A, Stieger B, Hagenbuch B, Meier PJ, Matern S, Gartung C. Differential expression of basolateral and canalicular organic anion transporters during regeneration of rat liver. Gastroenterology. 1999;117:1408-1415. [PubMed] [DOI] |
| 12. | Vos TA, Ros JE, Havinga R, Moshage H, Kuipers F, Jansen PL, Müller M. Regulation of hepatic transport systems involved in bile secretion during liver regeneration in rats. Hepatology. 1999;29:1833-1839. [PubMed] [DOI] |
| 13. | Kojima T, Yamamoto T, Murata M, Chiba H, Kokai Y, Sawada N. Regulation of the blood-biliary barrier: interaction between gap and tight junctions in hepatocytes. Med Electron Microsc. 2003;36:157-164. [PubMed] [DOI] |
| 14. | Schmöcker C, Weylandt KH, Kahlke L, Wang J, Lobeck H, Tiegs G, Berg T, Kang JX. Omega-3 fatty acids alleviate chemically induced acute hepatitis by suppression of cytokines. Hepatology. 2007;45:864-869. [PubMed] [DOI] |
| 15. | Willemsen LE, Koetsier MA, Balvers M, Beermann C, Stahl B, van Tol EA. Polyunsaturated fatty acids support epithelial barrier integrity and reduce IL-4 mediated permeability in vitro. Eur J Nutr. 2008;47:183-191. [PubMed] [DOI] |
| 16. | Bonis PA, Chung M, Tatsioni A, Sun Y, Kupelnick B, Lichtenstein A, Perrone R, Chew P, DeVine D, Lau J. Effects of omega-3 fatty acids on organ transplantation. Evid Rep Technol Assess (Summ). 2005;1-11. [PubMed] |
| 17. | Gura KM, Duggan CP, Collier SB, Jennings RW, Folkman J, Bistrian BR, Puder M. Reversal of parenteral nutrition-associated liver disease in two infants with short bowel syndrome using parenteral fish oil: implications for future management. Pediatrics. 2006;118:e197-e201. [PubMed] [DOI] |
| 18. | Qiu Y, Wang M, Tan T, Yuan X, Ding Y. Effects of n-3 polyunsaturated fatty acids on hepatic tight junction after partial hepatectomy in rats. Transplant Proc. 2011;43:1480-1483. [PubMed] [DOI] |
| 19. | Hao W, Wong OY, Liu X, Lee P, Chen Y, Wong KK. ω-3 fatty acids suppress inflammatory cytokine production by macrophages and hepatocytes. J Pediatr Surg. 2010;45:2412-2418. [PubMed] [DOI] |
| 20. | Higgins GM, Anderson RM. Experimental pathology of the liver. I. Restoration of the liver of the white rat following partial surgical removal. Arch Pathol. 1931;12:186-202. |
| 21. | Nguyen KT, Gamblin TC, Geller DA. World review of laparoscopic liver resection-2, 804 patients. Ann Surg. 2009;250:831-841. [PubMed] [DOI] |
| 22. | Fan ST. Precise hepatectomy guided by the middle hepatic vein. Hepatobiliary Pancreat Dis Int. 2007;6:430-434. [PubMed] |
| 27. | Lee WM. Acute liver failure. N Engl J Med. 1993;329:1862-1872. [PubMed] [DOI] |
| 28. | O'Grady JG, Schalm SW, Williams R. Acute liver failure: redefining the syndromes. Lancet. 1993;342:273-275. [PubMed] [DOI] |
| 31. | Calder PC. Use of fish oil in parenteral nutrition: Rationale and reality. Proc Nutr Soc. 2006;65:264-277. [PubMed] [DOI] |
| 33. | Simopoulos AP. Omega-3 fatty acids in health and disease and in growth and development. Am J Clin Nutr. 1991;54:438-463. [PubMed] |
| 34. | Richard D, Kefi K, Barbe U, Bausero P, Visioli F. Polyunsaturated fatty acids as antioxidants. Pharmacol Res. 2008;57:451-455. [PubMed] [DOI] |