修回日期: 2011-08-04
接受日期: 2011-08-12
在线出版日期: 2011-08-18
目的: 探讨哺乳动物雷帕霉素靶蛋白(mTOR)及其下游关键因子p-p70S6K的表达与食管鳞癌发生、发展及浸润、转移的关系.
方法: 35例食管癌手术切除标本取自河南省安阳市肿瘤医院. 应用免疫组织化学SP法检测35例食管鳞癌组织, 15例癌旁不典型增生组织及15例正常食管黏膜组织中mTOR及p-p70S6K蛋白的表达.
结果: 食管鳞癌组织中mTOR蛋白表达与肿瘤TNM分期密切相关 (χ2 = 9.121, P<0.05); 在食管鳞癌癌变过程中, mTOR蛋白在正常黏膜组织、癌旁不典型增生组织及癌组织中的表达率依次增高, 分别为20%(3/15)、46.7%(7/15)、62.9%(22/35), 组间比较有明显差异(χ2 = 7.767, P<0.05). p-p70S6K蛋白表达与肿瘤的淋巴结转移及TNM分期密切相关(χ2 = 5.846, 4.523; 均P<0.05), 其在正常黏膜组织、癌旁不典型增生组织及癌组织中的表达率依次增高, 分别为33.3%(5/15)、73.3%(11/15)、74.3%(26/35), 组间比较有明显差异(χ2 = 8.350, P<0.05), mTOR及p-p70S6K的表达呈正相关关系(γp = 0.359, P = 0.034).
结论: mTOR及p-p70S6K蛋白在食管鳞癌组织中表达显著升高, 且二者与食管鳞癌的生物学行为关系密切. 提示二者高表达与食管鳞癌的发生、发展有关, 可作为食管鳞癌早期诊断和判断预后的辅助指标.
引文著录: 尹玉慧, 张艳, 李晟磊, 刘红涛, 侯桂琴. mTOR和p-p70S6K在食管鳞癌组织中蛋白表达的相关性及其临床意义. 世界华人消化杂志 2011; 19(23): 2450-2454
Revised: August 4, 2011
Accepted: August 12, 2011
Published online: August 18, 2011
AIM: To explore the relationship of expression of mammalian target of rapamycin (mTOR) and its downstream effector ribosomal S6 kinase (p70S6K) with the development, progression, invasion and metastasis of esophageal squamous cell carcinoma (ESCC).
METHODS: Immunohistochemistry was used to detect the protein expression of mTOR and phosphorylated p70S6K (p-p70S6K) in 35 ESCC specimens, 15 tumor-adjacent atypical hyperplastic epithelial specimens, and 15 normal esophageal epithelial specimens.
RESULTS: The expression of mTOR protein was closely correlated with tumor TNM grade in ESCC (χ2 = 9.121, P < 0.01). The positive rates of mTOR protein expression in normal esophageal epithelium, tumor-adjacent atypical hyperplastic epithelium and carcinoma were 20% (3/15), 46.7% (7/15) and 62.9% (22/35), respectively, with a significant difference among the three groups (χ2 = 7.767, P < 0.05). The expression levels of p-p70S6K protein were closely correlated with lymph node metastasis and TNM grade in ESCC (χ2 = 5.846, 4.523, both P < 0.05). The positive rates of p-p70S6K protein expression in normal esophageal epithelium, tumor-adjacent atypical hyperplastic epithelium and carcinoma were 33.3% (5/15), 73.3% (11/15) and 74.3% (26/35), respectively, with a significant difference among the three groups (χ2 = 8.350, P < 0.05). There is a positive correlation between the protein expression levels of mTOR and p-p70S6K (γp = 0.346, P = 0.006).
CONCLUSION: High expression of mTOR and p-p70S6K was detected in ESCC. mTOR and p-p70S6K play an important role in the carcinogenesis, invasion and metastasis of ESCC. The expression of mTOR and p-p70S6K may be used as molecular parameters for early diagnosis and prognostic evaluation of ESCC.
- Citation: Yin YH, Zhang Y, Li SL, Liu HT, Hou GQ. Clinical significance of expression of mTOR and p-p70S6K in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2011; 19(23): 2450-2454
- URL: https://www.wjgnet.com/1009-3079/full/v19/i23/2450.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i23.2450
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)是近年来发现的一种进化上保守的蛋白激酶, 也是一种重要的信号转导分子, 参与多种病理和生理过程, 不仅在正常的细胞生长增殖中起主要作用, 而且与细胞分化以及癌细胞的生长、增殖密切相关, 是细胞生长的中心调控因子[1-4]. 核糖体S6激酶(p70S6K)是其下游重要的分子靶点. 激活的mTOR能促使p70S6K磷酸化, 从而促进翻译的进行, 最终加快细胞的生长和增殖[5-7]. 研究证明, 许多肿瘤中存在mTOR/p70S6K信号通路的异常激活[8,13]. 由于食管鳞癌在我国尤其是河南省林州市(林县)发生率和死亡率均很高, 故本研究应用免疫组织化学技术对35例食管癌组织、15例食管癌正常组织和20例癌旁组织进行检测, 观察mTOR及p-p70S6K在食管鳞癌中的表达情况及其与食管癌发生发展的关系, 以期为食管鳞癌的早期诊断和判断预后寻找分子指标.
35例食管癌手术切除标本于2008-05- 23/06-16取自食管癌高发区河南省安阳市肿瘤医院, 所有病例术前均无化疗, 放疗及免疫治疗史. 其中男16例, 女19例, 年龄33-77(平均61.3±9.1)岁. 全部病理组织学证实均为鳞状细胞癌. 其中组织学分级Ⅰ级9例, Ⅱ级14例, Ⅲ级12例; 伴淋巴结转移者16例, 无淋巴结转移者19例. 浸润深度分3组, 浸达黏膜者7例, 浸达肌层15例, 浸达纤维膜13例. TNM分期Ⅰ-Ⅱ者13例, Ⅲ-Ⅳ者22例. 选取全部35例病例中癌旁3 cm以内经HE切片证实有中-重度不典型增生或原位癌组织做癌旁对照; 另选取15例>3 cm的远端正常食管黏膜组织做正常对照. 兔抗人p-p70S6K多克隆抗体购自美国Santa Cruz公司, 兔抗人mTOR单克隆抗体购自武汉博士德生物技术有限公司, 二抗及免疫组织化学SP试剂盒和二甲基联苯胺(DAB)购自北京中杉金桥生物技术有限公司, 封闭血清、3%双氧水、磷酸盐缓冲液(phosphate buffered saline, PBS)、乙二胺四乙酸(ethylenediamine tetraacetic acid, EDTA)及苏木素等均由河南省肿瘤病理重点实验室提供.
1.2.1 免疫组织化学: 全部样本经40 g/L多聚甲醛液固定, 常规脱水, 石蜡包埋, 连续切片, 切片厚度4-6 μm, 分别用于HE和免疫组织化学染色. 采用SP法, mTOR及p-p70S6K抗体稀释倍数分别为1∶100及1∶300. 具体步骤如下: 组织切片用60 ℃烤60 min后用二甲苯、乙醇脱蜡至水, 3%双氧水浸泡20 min以封闭内源性过氧化物酶活性; 高压锅枸橼酸盐抗原修复, 降至室温后用PBS洗3次, 每次5 min; 滴加10%血清以阻断非特异性结合, 37 ℃孵育10 min. 加一抗4 ℃过夜, PBS洗3次每次5 min; 滴加生物素标记二抗, 37 ℃孵育10 min, PBS洗3次每次5 min, 滴加辣根过氧化物酶标记的链霉素卵白素工作液37 ℃孵育10 min, DAB显色, 苏木素复染, 脱水、干燥并用中性树脂封片. 以PBS液代替一抗作为阴性对照.
1.2.2 结果判定: p-p70S6K蛋白定位在细胞核内, 阳性信号呈棕黄色颗粒样物质, mTOR蛋白定位于细胞质内, 阳性信号呈棕黄色颗粒样物质. 高倍镜下随机选取5个视野(每个视野观察细胞数不少于200个), 按阳性细胞所占百分比及着色深浅进行结果判定[14,15]: (1)按阳性细胞数占同类细胞数的百分比, <30%为1分, 30%-70%为2分; >70%为3分; (2)按切片中细胞着色深浅评分: 0分, 细胞无显色; 1分, 浅黄色; 2分, 棕黄色; 3分, 棕褐色. 取(1)(2)两项评分的乘积作为总积分, 0-1分为阴性(-), >1分为阳性(+).
统计学处理 应用SPSS13.0统计学软件分别对p-p70S6K在食管癌与正常食管组织中的表达情况, p-p70S6K与食管癌的病理分级、临床分期及有无淋巴结转移的关系进行统计分析, 采用χ2检验, 检验水准α = 0.05.
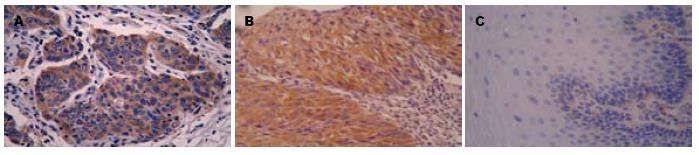
mTOR蛋白阳性表达主要位于肿瘤细胞的胞质中, 呈浅黄色至深黄色颗粒(图1). 在食管鳞癌癌变过程中mTOR蛋白表达在正常黏膜组织、癌旁不典型增生组织及癌组织中的表达率依次增高, 分别为20%(3/15)、46.7%(7/15)、62.9%(22/35), 组间比较有明显差异(χ2 = 7.767, P<0.05, 表1). mTOR蛋白表达与食管鳞癌组织学分级、浸润深度、淋巴结转移无关, 组间差别无统计学意义(χ2 = 0.173, 2.353, 1.861, 均P>0.05), mTOR蛋白阳性表达率与TNM分期密切相关(χ2 = 9.121, 均P<0.01, 表2).
| mTOR | p-p70S6K | ||||||||||
| n | - | + | 阳性率(%) | χ2值 | P值 | - | + | 阳性率(%) | χ2值 | P值 | |
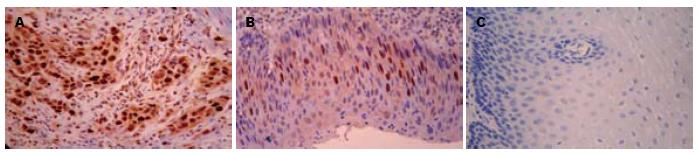
| 正常黏膜上皮组织 | 15 | 12 | 3 | 20.0 | 7.767 | 0.021 | 10 | 5 | 33.3 | 8.350 | 0.015 |
| 非典型增生组织 | 15 | 8 | 7 | 46.7 | 4 | 11 | 73.3 | ||||
| 鳞癌组织 | 35 | 13 | 22 | 62.9 | 9 | 26 | 74.3 | ||||
| 病理特征 | n | mTOR | p-p70S6K | ||||
| 阳性表达n(%) | χ2值 | P值 | 阳性表达n(%) | χ2值 | P值 | ||
| 组织学分级 | |||||||
| Ⅰ | 9 | 6(66.7) | 0.173 | 0.917 | 7(77.8) | 0.120 | 0.942 |
| Ⅱ | 14 | 9(64.3) | 10(71.4) | ||||
| Ⅲ | 12 | 7(58.3) | 9(75.0) | ||||
| 浸润深度 | |||||||
| 黏膜层 | 7 | 3(42.9) | 2.353 | 0.308 | 4(57.1) | 1.810 | 0.404 |
| 肌层 | 15 | 9(60.0) | 11(73.3) | ||||
| 纤维膜 | 13 | 10(76.9) | 11(84.6) | ||||
| 淋巴结转移 | |||||||
| 无 | 19 | 10(52.6) | 1.861 | 0.172 | 11(57.9) | 5.846 | 0.016 |
| 有 | 16 | 12(75.0) | 15(93.8) | ||||
| TNM分期 | |||||||
| Ⅰ、Ⅱ | 13 | 4(30.8) | 9.121 | 0.003 | 7(53.8) | 4.523 | 0.033 |
| Ⅲ、Ⅳ | 22 | 18(81.8) | 19(86.4) |
p-p70S6K蛋白阳性着色定位于细胞核, 呈棕黄色或深黄色颗粒(图2). 在食管鳞癌癌变过程中p-p70S6K蛋白在正常黏膜组织、癌旁不典型增生组织及癌组织中的表达率依次升高, 分别为33.3%(5/15)、73.3%(11/15)、74.3%(26/35), 组间比较有明显差异(χ2 = 8.350, P<0.05, 表1). p-p70S6K蛋白表达与食管鳞癌组织的组织学分级及浸润深度无关, 组间比较差异无统计学意义(χ2 = 0.120, 1.810, 均P>0.05), p-p70S6K蛋白阳性表达率与癌组织的淋巴结转移及TNM分期密切相关(χ2 = 5.846及4.523; 均P<0.05, 表2).
TOR是1994年筛选啤酒酵母免疫抑制剂雷帕霉素抗性株时被发现并克隆[16,17]. 随后, 在哺乳动物也发现了结构和功能保守的TOR蛋白, 称为mTOR, 又称FRAP、RAFT、RAPT. 与肿瘤发生密切相关的多项细胞功能如: 细胞生长增殖、细胞周期调控及细胞迁移等受控于mTOR[18]. mTOR下游的一个重要的靶分子是核糖体p70S6K, p70S6K可调控细胞生长, 是mTOR的一个直接靶点. 许多证据表明, p70S6K通过增强mRNA翻译来控制细胞生长[19,20]. 通常认为, 激活的p70S6K促进了5'TOP(terminal oligopyrimidine tract) mRNA的翻译, 此种mRNA包含一个短的多聚嘧啶(4-14个核苷酸), 与5'帽结构紧密相邻[20,21], 主要编码翻译机制中涉及的成员, 包括所有核糖体蛋白、延长因子和polyA结合蛋白(PABP). 研究表明, p70S6K是5'TOP mRNA翻译所必需的[22,23]. 活化的mTOR/p70S6K信号通路通过调控下游基因的表达, 从而促进肿瘤的发生和发展, 其已成为肿瘤研究中的热点[24,25]. 目前, 国内外对mTOR/p70S6K信号通路的研究多集中在乳腺癌[2]、宫颈癌[12]、肝癌[26]、肺癌等[27], 而在食管鳞癌中的研究报道不多, 由于食管鳞癌是河南省高发的肿瘤, 其侵袭性强, 对临床化疗药不敏感, 且易复发, 因此, 本研究以食管鳞癌为研究对象, 检测mTOR及p-p70S6K在食管鳞癌中的表达情况并分析其临床意义, 以期为食管鳞癌寻找新的分子治疗靶点.
本研究结果显示, mTOR及p-p70S6K在食管鳞癌组织中的表达远高于其在相对应的癌旁不典型增生组织及正常食管黏膜内, 并且二者具有正相关, 进一步证实了mTOR可以促使p70S6K发生磷酸化. mTOR与食管鳞癌的TNM分期密切相关, p-p70S6K与TNM分期及有无淋巴结转移密切相关, 提示mTOR及p-p70S6K高表达的食管鳞癌具有更强的侵袭能力, 二者可能共同参与了食管鳞癌浸润转移的过程. 联合检测食管鳞癌中mTOR及p-p70S6K蛋白的表达有利于我们进一步地了解食管癌的生物学行为, 为食管鳞癌的早期诊断和治疗提供一个新的分子靶点.
雷帕霉素靶蛋白(TOR)可以控制与肿瘤发生密切相关的多项细胞功能, 如: 细胞生长增殖、细胞周期调控及细胞迁移等. mTOR下游的一个重要的靶分子是核糖体p70S6K, p70S6K可调控细胞生长, 是mTOR的一个直接靶点.
李淳, 副教授, 汕头大学医学院病理教研室
mTOR/p70S6K信号通路在肿瘤的演进过程中发挥着极其重要的作用, 明确mTOR/p70S6K信号通路在食管鳞癌中的作用是目前研究的重点.
国内外已有报道表明, 许多肿瘤中存在mTOR/ p70S6K信号通路的异常激活.
本文首次采用免疫组织化学技术检测食管癌高发区安阳肿瘤医院食管癌标本中mTOR及p-p70S6K蛋白表达, 并探讨其可能的分子作用机制.
本研究应用临床标本验证mTOR及p-p70S6K与食管癌的关系, 具有一定的意义.
编辑 李薇 电编 何基才
| 1. | Peterson RT, Beal PA, Comb MJ, Schreiber SL. FKBP12-rapamycin-associated protein (FRAP) autophosphorylates at serine 2481 under translationally repressive conditions. J Biol Chem. 2000;275:7416-7423. [PubMed] [DOI] |
| 3. | Gingras AC, Raught B, Sonenberg N. Regulation of translation initiation by FRAP/mTOR. Genes Dev. 2001;15:807-826. [PubMed] [DOI] |
| 4. | Fingar DC, Blenis J. Target of rapamycin (TOR): an integrator of nutrient and growth factor signals and coordinator of cell growth and cell cycle progression. Oncogene. 2004;23:3151-3171. [PubMed] [DOI] |
| 5. | Takahashi T, Hara K, Inoue H, Kawa Y, Tokunaga C, Hidayat S, Yoshino K, Kuroda Y, Yonezawa K. Carboxyl-terminal region conserved among phosphoinositide-kinase-related kinases is indispensable for mTOR function in vivo and in vitro. Genes Cells. 2000;5:765-775. [PubMed] [DOI] |
| 6. | Liu L, Li F, Cardelli JA, Martin KA, Blenis J, Huang S. Rapamycin inhibits cell motility by suppression of mTOR-mediated S6K1 and 4E-BP1 pathways. Oncogene. 2006;25:7029-7040. [PubMed] [DOI] |
| 7. | Easley CA, Ben-Yehudah A, Redinger CJ, Oliver SL, Varum ST, Eisinger VM, Carlisle DL, Donovan PJ, Schatten GP. mTOR-mediated activation of p70 S6K induces differentiation of pluripotent human embryonic stem cells. Cell Reprogram. 2010;12:263-273. [PubMed] [DOI] |
| 8. | Bjornsti MA, Houghton PJ. The TOR pathway: a target for cancer therapy. Nat Rev Cancer. 2004;4:335-348. [PubMed] [DOI] |
| 9. | Zhang YJ, Dai Q, Sun DF, Xiong H, Tian XQ, Gao FH, Xu MH, Chen GQ, Han ZG, Fang JY. mTOR signaling pathway is a target for the treatment of colorectal cancer. Ann Surg Oncol. 2009;16:2617-2628. [PubMed] [DOI] |
| 10. | Pene F, Claessens YE, Muller O, Viguié F, Mayeux P, Dreyfus F, Lacombe C, Bouscary D. Role of the phosphatidylinositol 3-kinase/Akt and mTOR/P70S6-kinase pathways in the proliferation and apoptosis in multiple myeloma. Oncogene. 2002;21:6587-6597. [PubMed] [DOI] |
| 11. | Panwalkar A, Verstovsek S, Giles FJ. Mammalian target of rapamycin inhibition as therapy for hematologic malignancies. Cancer. 2004;100:657-666. [PubMed] [DOI] |
| 12. | Albert JM, Kim KW, Cao C, Lu B. Targeting the Akt/mammalian target of rapamycin pathway for radiosensitization of breast cancer. Mol Cancer Ther. 2006;5:1183-1189. [PubMed] [DOI] |
| 13. | Morgensztern D, McLeod HL. PI3K/Akt/mTOR pathway as a target for cancer therapy. Anticancer Drugs. 2005;16:797-803. [PubMed] [DOI] |
| 14. | 高 冬玲, 李 晟磊, 陈 奎生, 赵 志华, 赵 秋民, 刘 宗文, 张 云汉. 金属蛋白酶抑制基因RECK在食管鳞癌中的表达及生物学意义. 世界华人消化杂志. 2008;16:1634-1638. [DOI] |
| 15. | 李 晟磊, 赵 秋民, 刘 宗文, 赵 志华, 高 冬玲, 郑 湘予, 陈 奎生, 张 云汉. 食管鳞癌中RECK和MMP-9蛋白表达的相关性及临床病理意义. 世界华人消化杂志. 2007;15:1082-1086. [DOI] |
| 16. | Chen J, Zheng XF, Brown EJ, Schreiber SL. Identification of an 11-kDa FKBP12-rapamycin-binding domain within the 289-kDa FKBP12-rapamycin-associated protein and characterization of a critical serine residue. Proc Natl Acad Sci U S A. 1995;92:4947-4951. [PubMed] [DOI] |
| 17. | Choi J, Chen J, Schreiber SL, Clardy J. Structure of the FKBP12-rapamycin complex interacting with the binding domain of human FRAP. Science. 1996;273:239-242. [PubMed] [DOI] |
| 18. | Hansel DE, Platt E, Orloff M, Harwalker J, Sethu S, Hicks JL, De Marzo A, Steinle RE, Hsi ED, Theodorescu D. Mammalian target of rapamycin (mTOR) regulates cellular proliferation and tumor growth in urothelial carcinoma. Am J Pathol. 2010;176:3062-3072. [PubMed] [DOI] |
| 19. | Fenton TR, Gwalter J, Cramer R, Gout IT. S6K1 is acetylated at lysine 516 in response to growth factor stimulation. Biochem Biophys Res Commun. 2010;398:400-405. [PubMed] [DOI] |
| 20. | Meng Q, Xia C, Fang J, Rojanasakul Y, Jiang BH. Role of PI3K and AKT specific isoforms in ovarian cancer cell migration, invasion and proliferation through the p70S6K1 pathway. Cell Signal. 2006;18:2262-2271. [PubMed] [DOI] |
| 21. | Stolovich M, Lerer T, Bolkier Y, Cohen H, Meyuhas O. Lithium can relieve translational repression of TOP mRNAs elicited by various blocks along the cell cycle in a glycogen synthase kinase-3- and S6-kinase-independent manner. J Biol Chem. 2005;5336-5342. [DOI] |
| 22. | Jefferies HB, Fumagalli S, Dennis PB, Reinhard C, Pearson RB, Thomas G. Rapamycin suppresses 5'TOP mRNA translation through inhibition of p70s6k. EMBO J. 1997;16:3693-3704. [PubMed] [DOI] |
| 23. | Schwab MS, Kim SH, Terada N, Edfjäll C, Kozma SC, Thomas G, Maller JL. p70(S6K) controls selective mRNA translation during oocyte maturation and early embryogenesis in Xenopus laevis. Mol Cell Biol. 1999;19:2485-2494. [PubMed] [DOI] |
| 24. | Li W, Tan D, Zhang Z, Liang JJ, Brown RE. Activation of Akt-mTOR-p70S6K pathway in angiogenesis in hepatocellular carcinoma. Oncol Rep. 2008;20:713-719. [PubMed] |
| 25. | Gibbons JJ, Abraham RT, Yu K. Mammalian target of rapamycin: discovery of rapamycin reveals a signaling pathway important for normal and cancer cell growth. Semin Oncol. 2009;36 Suppl 3:S3-S17. [PubMed] [DOI] |
| 26. | 冀 静, 顾 婷婷, 郑 鹏生. mTOR/P70S6K信号通路在宫颈癌组织中的表达及其临床意义. 西安交通大学学报(医学版). 2010;31:10-13. |
| 27. | Tarhini A, Kotsakis A, Gooding W, Shuai Y, Petro D, Friedland D, Belani CP, Dacic S, Argiris A. Phase II study of everolimus (RAD001) in previously treated small cell lung cancer. Clin Cancer Res. 2010;16:5900-5907. [PubMed] [DOI] |