修回日期: 2011-06-22
接受日期: 2011-07-05
在线出版日期: 2011-08-08
目的: 探讨黄芩苷对肝癌细胞SMMC-7721 JAK-STAT信号通路STAT3的影响.
方法: 将肝癌细胞SMMC-7721分为4组: 对照组、黄芩苷组、AG490组、黄芩苷+AG490组. 应用RT-PCR法检测各组肝癌细胞SMMC-7721中STAT3 mRNA表达, Western blot法检测肝癌细胞SMMC-7721中STAT3、P-STAT3蛋白表达.
结果: 黄芩苷可以下调肝癌细胞SMMC-7721 STAT3 mRNA表达, 与对照组比较明显下降(0.505±0.111 vs 0.697±0.145, P<0.05); 并可以降低STAT3蛋白的表达量(0.879±0.012 vs 1.087±0.015, P<0.05); 还可以抑制STAT3向活化形式P-STAT3转化, 与对照组比较P-STAT3表达明显下降(0.983±0.085 vs 1.103±0.074, P<0.05), 而与AG490联合应用后P-STAT3蛋白表达量较单用黄芩苷下降明显(0.756±0.103 vs 0.983±0.085, P<0.05).
结论: 黄芩苷能下调STAT3 mRNA表达水平, 降低STAT3蛋白表达, 还可以抑制STAT3向活化形式P-STAT3转化, 与AG490有协同作用. 黄芩苷可能通过抑制JAK-STAT信号通路发挥抗肿瘤作用.
引文著录: 郭昱, 霍瑞静, 姚金锋. 黄芩苷对肝癌细胞SMMC-7721 JAK-STAT信号通路STAT3的影响. 世界华人消化杂志 2011; 19(22): 2363-2367
Revised: June 22, 2011
Accepted: July 5, 2011
Published online: August 8, 2011
AIM: To investigate the effect of baicalin on the JAK-STAT3 signaling pathway in human hepatocellular carcinoma cell line SMMC-7721.
METHODS: SMMC-7721 cells were divided into four groups: blank control group, baicalin group, AG490 group, and baicalin plus AG490 group. The mRNA expressional level of STAT3 in SMMC-7721 cells was measured by RT-PCR. The protein expression levels of STAT3 and p-STAT3 in SMMC-7721 cells were measured by Western blot.
RESULTS: The expressional level of STAT3 mRNA in SMMC-7721 cells was significantly lower in the baicalin group than in the blank control group (0.505 ± 0.111 vs 0.697 ± 0.145, P < 0.05). The protein expressional levels of STAT3 and p-STAT3 in SMMC-7721 cells were also significantly lower in the baicalin group than in the blank control group (0.879 ± 0.012 vs 1.087 ± 0.015, 0.983 ± 0.085 vs 1.103 ± 0.074, both P < 0.05). Compared to the baicalin group, the protein expressional level of p-STAT3 in SMMC-7721 cells was significantly decreased in the baicalin plus AG490 (0.756 ± 0.103 vs 0.983 ± 0.085, P < 0.05).
CONCLUSION: Baicalin could significantly down-regulate the mRNA and protein expressional levels of STAT3 and p-STAT3 and inhibit the activation of STAT3 protein in SMMC-7721 cells.
- Citation: Guo Y, Huo RJ, Yao JF. Effect of baicalin on the JAK-STAT3 signaling pathway in human hepatocellular carcinoma cell line SMMC-7721. Shijie Huaren Xiaohua Zazhi 2011; 19(22): 2363-2367
- URL: https://www.wjgnet.com/1009-3079/full/v19/i22/2363.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i22.2363
原发性肝癌是人类常见的恶性肿瘤之一, 严重的危害我国人民的生命和健康. 据统计, 全世界每年新发肝癌26万例, 其中42.5%在中国, 中国肝癌死亡率为20.4/10万. 目前普遍认为肝癌的发生发展是多基因突变、多环节、多步骤、多阶段的演进过程. 细胞信号转导在细胞生长调控中起重要作用, 信号通路中任何组分的改变都会导致细胞增殖凋亡的失控, 发生癌变. 研究表明在肝癌细胞的信号转导链中涉及多种信号转导途径, 起主要作用的是Janus蛋白酪氨酸激酶/信号转导和转录激活因子(Janus kinases/signal transducer and activator of transcription, JAK-STAT)通路. 其中信号转导和转录激活因子3(signal transducer and activator of transcription 3, STAT3)是该信号通路中一个至关重要的转录因子. P-STAT3是其磷酸化的活化形式. 他参与许多肿瘤发生的环节如加速细胞周期循环、诱导细胞转化和抑制细胞凋亡等. 黄芩苷是由黄芩的干燥根中提取的一种黄酮类化合物, 分子式为C21H18O11, 相对分子质量为446.36, 具有抗炎、抗变态反应、抗肿瘤等多种药理作用[1-5]. 我们以往的研究表明黄芩苷可以影响肝癌细胞的多种生物学特性如抑制肝癌细胞增殖, 诱导肝癌细胞凋亡, 降低肝癌细胞侵袭力等[6-10], 其机制是否是通过抑制STAT3途径完成的尚乏研究. 本实验通过应用黄芩苷干预肝癌细胞, 采用RT-PCR技术及Western blot技术, 从基因水平及蛋白水平探讨黄芩苷对STAT3及P-STAT3表达的影响, 探讨其抗肿瘤作用可能的信号通路机制.
人肝癌细胞株SMMC-7721河北医科大学第四医院肿瘤实验室惠赠. 黄芩苷(baicalin)购自成都曼斯特生物科技有限公司, 纯度>98%; AG490酪氨酸磷酸化抑制剂购自杭州四季青生物制品公司; TRIzol购自北京赛百盛基因有限公司. 兔抗STAT3多克隆抗体购自北京中山生物技术公司; 兔抗P-STAT3多克隆抗体 购自北京中山生物技术公司; 兔抗β-actin多克隆抗体购自北京中山生物技术公司.
1.2.1 细胞培养: 人肝癌细胞株SMMC-7721培养于RPMI 1640培养液, 内含100 mL/L小牛血清、100 kU/L青霉素、100 mg/L链霉素, 置37 ℃, 50 mL/L CO2, 恒温密闭式孵箱内培养. 实验分为4组: (1)对照组(只加培养基); (2)黄芩苷组(浓度为10 mg/L); (3)AG490(浓度为50 μmol/L); (4)黄芩苷+AG490组(10 mg/L黄芩苷+50 μmol/L AG490). 作用48 h后收集细胞.
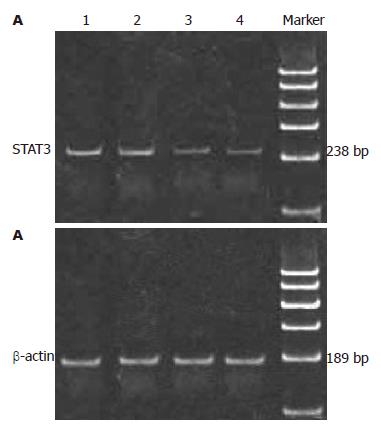
1.2.2 RT-PCR法检测黄芩苷对肝癌SMMC-7721细胞STAT3 mRNA的影响: 将作用48 h后收集的细胞, 按TRIzol试剂盒说明书提取细胞总RNA, 测定RNA纯度及定量并完整性鉴定, 逆转录cDNA第一链合成后行PCR; 利用基因设计软件Primer 5.0进行引物对设计. 在PE9700 PCR仪上进行实时定量扩增. STAT3上游引物: 5'-ATTCAAACACTTGACCCTGA-3', 下游引物: 5'-ATTGTTGGTCAGCATGTTGT-3', 扩增的目的片段长度为238 bp. PCR的具体循环参数为: 94 ℃, 5 min; 94 ℃, 1 min; 56 ℃, 40 s; 72 ℃, 30 s, 循环35次, 以后72 ℃延伸7 min. β-actin上游引物: 5'-TCCACCGCAAATGCTTCTAG-3', 下游引物: 5'-TGCTGTCACCTTCACCGTTC-3', 扩增的目的片段长度为189 bp, PCR的具体循环参数为: 95 ℃, 5 min; 95 ℃, 30 s; 50.4 ℃, 30 s; 72 ℃, 30 s, 循环35次, 以后72 ℃延伸7 min. 用美国ST公司AlphaImager TM1200型读胶仪读取扩增条带的灰度值进行分析, 以目标基因与β-actin扩增产物的灰度值的比值来表示基因表达水平.
1.2.3 Western blot法检测SMMC-7721细胞中STAT3、P-STAT3蛋白表达: 分别提取各组细胞总蛋白, -80 ℃冰箱冻存备用. 考马斯亮蓝G-250法测定蛋白含量. 配制100 mL/L分离胶及制备浓缩胶. 将已加入上样缓冲液的标准蛋白质样品及待测样品加入样品槽内. 然后接通电源, 上槽负极, 下槽正极, 80 V电压, 4 ℃, 进行电泳, 样品在浓缩胶中电泳约1 h, 待样品进入分离胶后, 150 V电泳1.5 h左右, 直到溴酚蓝到达分离胶的底部, 关闭电源. 转膜终了, 丽春红染色, 以确定胶中蛋白质的转移情况. 在50 mL/L脱脂奶粉中, 室温振摇封闭1 h. 封闭结束后, 以TBS溶液稀释兔抗STAT3(1:500)多克隆抗体, 兔抗P-STAT3多克隆抗体(1:500), 兔抗β-actin多克隆抗体(1:200), 按0.1 mL/cm2加入一抗溶液, 封膜机封口, 4 ℃过夜. 加入二抗(1:1 000稀释), 按每cm2膜加入0.1 mL, 室温摇动孵育1 h. 取出NC膜, 用TBS溶液振摇洗3次, 每次10 min, 在暗室中进行化学发光, 胶片曝光显影后分析结果. 采用美国Image JA软件对Western blot结果进行定量分析, 灰度值以累积吸光度值(IA)表示, 结果以目的蛋白与β-actin的累积吸光度的比值表示.
统计学处理 用SPSS12.0软件统计分析, 所有计量资料数据均采用mean±SD表示, 同一个指标的各组间比较采用单因素方差分析, P<0.05表示差异有显著性.
黄芩苷组肝癌细胞SMMC-7721 STAT3 mRNA表达量与对照组和AG490组比较均有明显下降(P<0.05); AG490组STAT3 mRNA表达量与对照组比较无显著差异(P>0.05); 黄芩苷+AG490组STAT3 mRNA表达量与对照组和AG490组比较明显下降(P<0.05), 与黄芩苷组比较无显著差异(P>0.05, 图1, 表1).
黄芩苷组肝癌细胞SMMC-7721 STAT3蛋白表达量与对照组和AG490组比较均有明显下降(P<0.05); AG490组STAT3蛋白表达量与对照组比较差异无显著性(P>0.05); 黄芩苷+AG490组STAT3蛋白与对照组和AG490组比较明显下降(P<0.05), 与黄芩苷组比较无显著差异(P>0.05, 图2, 表1).
黄芩苷组, AG490组肝癌细胞SMMC-7721 P-STAT3蛋白表达量与对照组比较明显下降(P<0.05); 黄芩苷组与AG490组比较无显著差异; 黄芩苷+AG490组P-STAT3与对照组、黄芩苷组和AG490组比较均有明显下降(P<0.05, 图2).
随着治疗时间的延长, 2组ALT复常率都在提高, 治疗组ALT阴转率高于对照组, 比较有统计学差异(P<0.05或0.01, 表1).
目前已知转录因子在调节多个肿瘤相关基因方面起重要作用. 靶向性阻断某个转录因子也逐渐成为探讨治疗肿瘤的一个新策略. 近年来, 研究针对肿瘤细胞内异常信号通路为靶点的特异性抗肿瘤药物已成为肿瘤治疗研究的热点. 这类药物的优势在于只对肿瘤细胞具有杀伤作用, 而对正常细胞没有影响或影响较小. 减轻了药物对正常组织的损伤, 这恰恰弥补了传统化疗药物的不足. JAK-STAT信号通路在多种实体瘤及血液系统肿瘤中都有其异常表达及活化, 与肿瘤细胞的增殖、分化、凋亡、转移及血管生成等过程有关. 许多该通路抑制剂在体内外实验中均体现出抗肿瘤效果. 新近研究表明某些中药单体如苦参碱、姜黄素等其发挥抗肿瘤的作用机制与JAK-STAT信号传导通路的阻断有关[11,12]. 在STAT成员中, STAT3是多个致癌性酪氨酸激酶信号通道的汇聚的焦点. STAT3存在于胞质, 活化的STAT3可进入细胞核内导致其下游靶基因的异常激活. 而其下游靶基因如Survivin、bcl-2、caspases、c-myc等均已证实与细胞增殖、分化、恶性转化、凋亡抑制等过程密切相关. STAT3己被认为与癌症的发生、发展的关系最为密切.在正常生理状态下, STAT3的激活是短暂而且受严格调控的, 然而在许多人类的肿瘤中都发现STAT3分子的持续激活[13,14]. 显性负性抑制STAT3的信号转导或应用STAT3反义寡核苷酸可抑制一些肿瘤的恶性转化过程. 表明STAT3持续性激活与细胞的恶性转化进程密切相关[15]. 选择性抑制STAT3的活化可能成为一个新的有潜力的癌症治疗靶向[16].
JAK-STAT信号转导通路与肝癌发生、发展的关系目前已积累了较多资料. 赵军艳等[17]发现肝癌组织中存在JAK-STAT信号转导通路过度活化, 而且活化程度与肝癌组织中细胞的分化程度关系密切, 恶性程度较高的肝癌组织中STAT表达阳性率高于恶性度较低的肝癌组织. 张斌等[18]研究发现JAK-1蛋白和STAT-3蛋白在无包膜肝细胞癌组织中的表达明显高于在有包膜肝细胞癌组织中的表达, 其与患者的病理分级和临床分期也密切相关, 进一步行Cox模型多因素分析表明, 患者JAK-1蛋白和STAT-3蛋白的表达、临床分期、病理学分级是影响肝癌预后的独立危险因素. 黄芩苷作为传统中药黄芩的主要有效成分之一, 近年来其抗肿瘤作用得到越来越多的实验证实. 我们以往的研究发现黄芩苷能显著抑制肝癌细胞增殖, 具有直接抗肿瘤作用, 并呈时间、剂量依赖关系; 诱导肝癌细胞凋亡; 黄芩苷还可能通过下调癌细胞integrinβ1表达, 上调E-cd的表达, 改变癌细胞的黏附功能, 抑制肿瘤侵袭和转移等[6-10]. 黄毅等[19]研究发现黄芩苷体外能抑制人Burkitt淋巴瘤细胞株CA46增殖; 并下调了CA46细胞的PI3K/Akt信号通路蛋白pAkt、NF-κB、 pIκB、pGSK-3β、mTOR、pmTOR的表达, 而对Akt、GSK-3β、IκB的表达无明显影响; 下调了MAPK(ERK1/2)信号通路蛋白pMAPK(44/42)的表达, 而对MAPK(44/42)的表达无明显影响. 认为黄芩苷抑制人Burkitt淋巴瘤细胞株CA46增殖的机制与阻断PDGFR/MEK/ERK1/2信号通路有关. 郑静等[20]研究结果显示黄芩苷下调了对耐阿霉素人髓系白血病HL-60/ADR细胞株PI3K/Akt/mTOR和MAPK信号通路蛋白中p-Akt、NF-κB、p-NF-κB、p-IκB-α、p-GSK-3β、p-MAPK、mTOR、p-mTOR的表达, 而不影响Akt、IκB-α、MAPK和GSK-3β的表达. 提示PI3K/Akt/mTOR、MAPK信号通路的改变可能参与了黄芩苷抑制HL-60/ADR细胞增殖、诱导其凋亡的过程. 但黄芩苷抑制肝癌细胞增殖的作用是否通过阻断JAK-STAT信号传导通路来实现尚未见报道. 本实验通过黄芩苷作用于肝癌细胞后发现, 黄芩苷不仅可以抑制STAT3 mRNA、STAT3蛋白的表达, 还可以抑制STAT3蛋白的磷酸化, 从而减少其活化形式P-STAT3的生成, 阻断JAK-STAT信号转导通路, 抑制肝癌细胞增殖. Liu等[4]在观察黄芩苷对多发性骨髓瘤细胞的作用时发现黄芩苷能抑制JAK、STAT3、MAPK和Akt蛋白的磷酸化, 同时抑制靶基因如Bcl-xl表达, 与我们的结果一致. 近来的研究报道显示STAT3的表达与肿瘤的侵袭转移有密切的关系. 抑制STAT3的表达阻断其活化, 可以明显地抑制胰腺癌的转移. 提示我们黄芩苷抑制肝癌细胞侵袭、转移的机制可能也与阻断STAT3的表达及活化有关.
α-氰基-(3,4-羟基)N-苄苯乙烯胺(AG490)是一种人工合成的苯亚甲基丙二腈的脂类衍生物, 结构上类似酪氨酸, 可以和受体酪氨酸激酶竞争结合位置, 是JAK-STAT信号转导通路的特异性抑制剂. 他作用于卵巢癌、乳腺癌、胰腺癌、白血病细胞等, 抑制癌细胞STAT3的活化, 使癌细胞的增殖受到抑制, 凋亡增加[21,22]. 如Burke等[23]发现AG490处理卵巢癌细胞株Caov3和MDAH2774后, 肿瘤细胞STAT3的磷酸化水平和Bcl-xL的表达水平均明显减少, STAT3与DNA特异性的结合能力也下降. AG490对正常细胞如卵巢细胞、人皮肤成纤维细胞和乳腺细胞等的增殖和凋亡不受影响. 本实验发现AG490作用于肝癌细胞后STAT3 mRNA及蛋白的表达与对照组相比并无明显差别, 但P-STAT3表达降低, 表明AG490作用位点在抑制STAT3向其活化形式P-STAT3转化这一水平; 结果还显示黄芩苷与AG490在此水平上的作用无显著差别. AG490与黄芩苷联合作用于肝癌细胞后STAT3 mRNA及蛋白的表达与对照组和单用AG490相比均有明显降低, 与单用黄芩苷无显著差别; 同时P-STAT3表达与对照组相比下降明显, 且与单用黄芩苷比有明显降低. 表明AG490可以抑制STAT3向活化形式P-STAT3转化, 在抑制STAT3蛋白磷酸化水平与黄芩苷有协同作用.
总之, 可以看出黄芩苷对肝癌细胞STAT3表达的抑制作用是多层次的, 他不但可以抑制STAT3向活化形式P-STAT3转化, 还下调STAT3 mRNA表达, 降低STAT3蛋白表达, 从而阻断JAK-STAT信号转导通路, 抑制肝癌细胞增殖.
STAT3是JAK-STAT信号通路中一个至关重要的转录因子. P-STAT3是其磷酸化的活化形式. 他参与许多肿瘤发生的环节如加速细胞周期循环、诱导细胞转化和抑制细胞凋亡等. 黄芩苷具有明显的抗肿瘤作用, 作用机制是否与JAK/STAT信号通路有关尚不清楚.
宣世英, 教授, 山东省青岛市市立医院肝病内科
近年来, 研究针对肿瘤细胞内异常信号通路为靶点的特异性抗肿瘤药物已成为肿瘤治疗研究的热点.
赵军艳等发现肝癌组织中存在JAK-STAT信号转导通路过度活化, 而且活化程度与肝癌组织中细胞的分化程度关系密切, 恶性程度较高的肝癌组织中.
黄芩苷作为传统中药黄芩的主要有效成分之一, 近年来其抗肿瘤作用得到越来越多的实验证实. 本研究结果加深了对其作用机制的认识, 为其进一步开发应用奠定了理论基础.
本文阐明了黄芩苷在信号转导水平发挥抗肿瘤作用的可能机制, 具有较高的学术价值和重要的理论意义.
编辑: 曹丽鸥 电编:何基才
| 1. | Gao J, Zhao H, Hylands PJ, Corcoran O. Secondary metabolite mapping identifies Scutellaria inhibitors of human lung cancer cells. J Pharm Biomed Anal. 2010;53:723-728. [PubMed] [DOI] |
| 2. | Zhou BR, Liu WL, Luo D. Protective effect of baicalin against multiple ultraviolet B exposure-mediated injuries in C57BL/6 mouse skin. Arch Pharm Res. 2011;34:261-268. [PubMed] [DOI] |
| 3. | Dong LH, Wen JK, Miao SB, Jia Z, Hu HJ, Sun RH, Wu Y, Han M. Baicalin inhibits PDGF-BB-stimulated vascular smooth muscle cell proliferation through suppressing PDGFRβ-ERK signaling and increase in p27 accumulation and prevents injury-induced neointimal hyperplasia. Cell Res. 2010;20:1252-1262. [PubMed] [DOI] |
| 4. | Liu S, Ma Z, Cai H, Li Q, Rong W, Kawano M. Inhibitory effect of baicalein on IL-6-mediated signaling cascades in human myeloma cells. Eur J Haematol. 2010;84:137-144. [PubMed] [DOI] |
| 5. | Du G, Han G, Zhang S, Lin H, Wu X, Wang M, Ji L, Lu L, Yu L, Liang W. Baicalin suppresses lung carcinoma and lung metastasis by SOD mimic and HIF-1alpha inhibition. Eur J Pharmacol. 2010;630:121-130. [PubMed] [DOI] |
| 8. | 郭 昱, 郭 霞, 武 京学, 姚 金锋, 崔 东来. 黄芩甙对人肝癌BEL-7402细胞增殖和侵袭转移的影响及机制. 中国组织化学与细胞化学杂志. 2008;17:336-339. |
| 11. | Abuzeid WM, Davis S, Tang AL, Saunders L, Brenner JC, Lin J, Fuchs JR, Light E, Bradford CR, Prince ME. Sensitization of head and neck cancer to Cisplatin through the use of a novel curcumin analog. Arch Otolaryngol Head Neck Surg. 2011;137:499-507. [PubMed] [DOI] |
| 12. | Kato T. Stat3-driven cancer-related inflammation as a key therapeutic target for cancer immunotherapy. Immunotherapy. 2011;3:587-590. [PubMed] [DOI] |
| 13. | Wang H, Lafdil F, Kong X, Gao B. Signal transducer and activator of transcription 3 in liver diseases: a novel therapeutic target. Int J Biol Sci. 2011;7:536-550. [PubMed] |
| 14. | Zhang J, Gill A, Atmore B, Johns A, Delbridge L, Lai R, McMullen T. Upregulation of the signal transducers and activators of transcription 3 (STAT3) pathway in lymphatic metastases of papillary thyroid cancer. Int J Clin Exp Pathol. 2011;4:356-362. [PubMed] |
| 15. | Wang H, Lafdil F, Kong X, Gao B. Signal transducer and activator of transcription 3 in liver diseases: a novel therapeutic target. Int J Biol Sci. 2011;7:536-550. [PubMed] |
| 16. | Masciocchi D, Gelain A, Villa S, Meneghetti F, Barlocco D. Signal transducer and activator of transcription 3 (STAT3): a promising target for anticancer therapy. Future Med Chem. 2011;3:567-597. [PubMed] [DOI] |
| 17. | 赵 军艳, 郑 艳敏, 赵 红艳. MAPK和JAK-STAT途径中酪氨酸蛋白激酶在肝癌组织中的表达及意义. 中国组织化学与细胞化学杂志. 2008;17:335-340. |
| 21. | Zhang H, Zhang D, Luan X, Xie G, Pan X. Inhibition of the signal transducers and activators of transcription (STAT) 3 signalling pathway by AG490 in laryngeal carcinoma cells. J Int Med Res. 2010;38:1673-1681. [PubMed] |
| 22. | C , Priester M, Polacin M, Schröder K, Seifert V, Kögel D, Weissenberger J. Inhibition of the JAK-2/STAT3 signaling pathway impedes the migratory and invasive potential of human glioblastoma cells. J Neurooncol. 2011;101:393-403. [PubMed] |