修回日期: 2011-08-04
接受日期: 2011-08-06
在线出版日期: 2011-08-08
目的: 研究siRNA抑制NF-κB p65后Bcl-2在肝癌细胞中的变化及对肝癌细胞凋亡的影响.
方法: 选择肝癌细胞HepG2、SMMC7721和人胚胎肝细胞LO2细胞株, 应用Western blot法分别检测NF-κB p65、Bcl-2在不同细胞中的表达; 应用siRNA方法抑制NF-κB p65在肝癌细胞中的表达, 观察NF-κB p65、Bcl-2在肝癌细胞中的变化及应用流式细胞仪观察肝癌细胞的凋亡情况.
结果: Western blot法检测显示NF-κB p65、Bcl-2在肝癌细胞HepG2、SMMC7721中的表达明显高于人胚胎肝细胞LO2(2.14±0.19, 2.09±0.27 vs 0.54±0.11; 1.42±0.15, 1.47±0.14 vs 0.60±0.08, 均P<0.05), 而NF-κB p65、Bcl-2在肝癌细胞HepG2、SMMC7721中的表达差异无统计学意义; 应用siRNA抑制NF-κB p65的表达后, 应用Western blot法检测显示NF-κB p65在肝癌细胞HepG2、SMMC7721中的表达较未转染组明显下降(2.08±0.19 vs 0.99±0.12; 2.03±0.17 vs 0.94±0.14, 均P<0.05), 说明转染成功. 随后应用Western blot法检测显示Bcl-2在肝癌细胞HepG2、SMMC7721中的表达较未转染组明显下降(1.37±0.05 vs 0.72±0.02; 1.44±0.03 vs 0.69±0.03, 均P<0.05), 且肝癌细胞凋亡较未转染组明显增加(5.12%±0.61% vs 37.87%±4.10%; 5.80%±0.71% vs 40.19%±3.78%, 均P<0.05).
结论: siRNA可以成功抑制NF-κB p65在肝癌细胞中的活性, 进一步证实NF-κB p65对Bcl-2具有调控作用, 他们共同参与了肝癌的发生发展过程.
引文著录: 赵心恺, 宁巧明, 孙晓宁, 田德安. siRNA抑制NF-κB p65对Bcl-2及肝癌细胞凋亡的影响. 世界华人消化杂志 2011; 19(22): 2358-2362
Revised: August 4, 2011
Accepted: August 6, 2011
Published online: August 8, 2011
AIM: To investigate the impact of small interfering RNA (siRNA)-mediated inhibition of nuclear factor-κB P65 (NF-κB p65) on Bcl-2 expression and apoptosis in human hepatocellular carcinoma (HCC) cell lines.
METHODS: HCC cell lines HepG2, SMMC7721 and human fetal liver cell line LO2 were used in the study. The expression of NF-κB p65 and Bcl-2 in the above three cell lines was detected by Western blot. SiRNA technology was then used to inhibit NF-κB p65 to observe the effect of NF-κB p65 knockdown on Bcl-2 expression and cell apoptosis.
RESULTS: The expression levels of NF-κB p65 and Bcl-2 in HepG2 and SMMC7721 cells were significantly higher than those in LO2 cells (2.14 ± 0.19, 2.09 ± 0.27 vs 0.54 ± 0.11; 1.42 ± 0.15, 1.47 ± 0.14 vs 0.60 ± 0.08, all P < 0.05). No significant difference was detected in the expression levels of NF-κB p65 and Bcl-2 between HepG2 and SMMC7721 cells. SiRNA transfection significantly down-regulated NF-κB p65 expression in HepG2 and SMMC7721 cells compared to non-transfected cells (2.08 ± 0.19 vs 0.99 ± 0.12; 2.03 ± 0.17 vs 0.94 ± 0.14, both P < 0.05). SiRNA-mediated NF-κB p65 knockdown significantly down-regulated Bcl-2 expression (1.37 ± 0.05 vs 0.72 ± 0.02; 1.44 ± 0.03 vs 0.69 ± 0.03, both P < 0.05) and increased apoptosis (5.12% ± 0.61% vs 37.87% ± 4.10%; 5.80% ± 0.71% vs 40.19% ± 3.78%, both P < 0.05) in HepG2 and SMMC7721 cells compared to non-transfected cells.
CONCLUSION: SiRNA-mediated NF-κB p65 knockdown significantly down-regulates Bcl-2 expression and promotes apoptosis in HepG2 and SMMC7721 cells.
- Citation: Zhao XK, Ning QM, Sun XN, Tian DA. SiRNA-mediated inhibition of NF-κB p65 down-regulations Bcl-2 expression and promotes apoptosis in hepatocellular carcinoma cell lines. Shijie Huaren Xiaohua Zazhi 2011; 19(22): 2358-2362
- URL: https://www.wjgnet.com/1009-3079/full/v19/i22/2358.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i22.2358
肝癌的发生、发展过程均与肝癌细胞的增殖与凋亡失衡有关, 其中较为重要的是核因子-κB(nuclearfactor-κB, NF-κB)基因和细胞凋亡相关基因bcl-2表达的改变. NF-κB是重要的转录调节因子, NF-κB的活化在肿瘤的抗凋亡机制中起了关键作用. bcl-2是最早发现的参与细胞凋亡的癌基因之一, 其表达产物具有抗凋亡的重要作用. 我们通过以下实验深入研究NF-κB p65与Bcl-2信号通路间的联系, 了解二者在肝癌发生发展中的意义.
RPMI 1640培养基购自美国Gibco公司; RIPA裂解液购自美国Pierce公司; 鼠抗人p65(sc-8008)购自美国Santa Cruz公司; 鼠抗人Bcl-2(sc-7382)购自美国Santa Cruz公司; 羊抗兔IgG-HRP购自美国Fermentas公司; Lipofectamine 2000购自美国Invitrogen公司; NF-κB p65小分子干扰核糖核酸购自美国Thermo Scientific Dharmacon公司.
1.2.1 细胞培养: 人肝癌细胞株HepG2、SMMC 7721、人胚胎肝细胞株LO2购自中国科学院上海生物所细胞库. 细胞培养在RPMI 1640培养基中, 常规加入100 mL/L胎牛血清(FBS), 在50 mL/L CO2培养箱中37 ℃培养, 每3 d传代1次.
1.2.2 核蛋白提取及Western blot: NE-PER® Nuclear and Cytoplasmic Extraction Kit (PIERCE)参照说明书进行操作. Western blot采用化学发光法(PIERCE Bitecnology)和放射自显影进行检测.
1.2.3 NF-κB p65的RNA干扰: NF-κB p65小分子干扰核糖核酸(siRNA: 5'GCCCUAUCCCUUUACGUCA3')转染入肝癌细胞HepG2、SMMC7721中[1], 首先将处于对数生长期的细胞以3.0×106个/孔铺于6孔板中, 待到细胞融合至80%-90%时进行转染. 转染时取10 μL的Lipofectamine 2000与4 μg siRNA寡聚物分别加入到250 μL的OPTI-MEM中, 混匀后室温孵育30 min, 再将混合液加入每个孔中, 37 ℃、50 mL/L CO2孵育4 h后换用含有100 mL/L胎牛血清的培养基培养. 转染后24 h提取细胞核蛋白, Western blot的方法检测NF-κB p65的表达.
1.2.4 流式细胞仪检测细胞凋亡: 取对数生长期的细胞以3×105个/孔接种6孔板, 待细胞汇合率达到80%-90%时, 胰酶消化收集细胞. 进行细胞凋亡检测时, PBS细胞洗3次, 加入10 μL的Annexin V混匀后避光保存30 min, 再加入5 μL的PI, 立即上机检测.
统计学处理 用SPSS11.0进行数据处理, 采用mean±SD表示, 同一组变量比较采用单因素方差分析(One-Way ANOVA), 组间两两比较采用SNK法, P<0.05为差异有显著性.
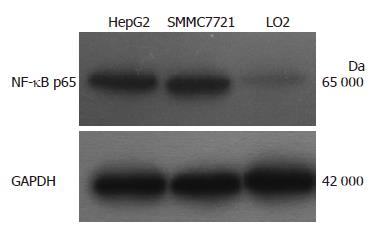
2.1.1 NF-κB p65在3种细胞中的表达: NF-κB p65在HepG2和SMMC7721细胞核中的蛋白表达水平明显高于LO2细胞(2.14±0.19, 2.09±0.27 vs 0.54±0.11, 均P<0.05), 在HepG2、SMMC7721细胞中表达无明显差异(2.14±0.19 vs 2.09±0.27, P>0.05, 图1).
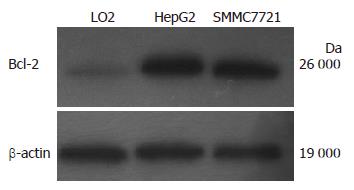
2.1.2 Bcl-2蛋白在3种细胞中的表达: Bcl-2蛋白在HepG2、SMMC7721细胞中表达明显高于LO2细胞(1.42±0.15, 1.47±0.14 vs 0.60±0.08, 均P<0.05), 在HepG2、SMMC7721细胞中表达无明显差异(1.42±0.15 vs 1.47±0.14, P>0.05, 图2).
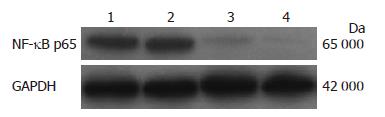
2.2.1 Western blot检测NF-κB p65蛋白的表达: SiRNA转染HepG2和SMMC7721细胞24 h后NF-κB p65蛋白的表达明显下调(2.08±0.19 vs 0.99±0.12; 2.03±0.17 vs 0.94±0.14, 均P<0.05, 图3).
2.2.2 Western blot检测HepG2、SMMC7721细胞核中蛋白的表达: 沉默NF-κB p65后, Bcl-2在肝癌细胞HepG2、SMMC7721细胞核中蛋白的表达水平明显降低(1.37±0.05 vs 0.72±0.02; 1.44±0.03 vs 0.69±0.03, 均P<0.05, 图4).
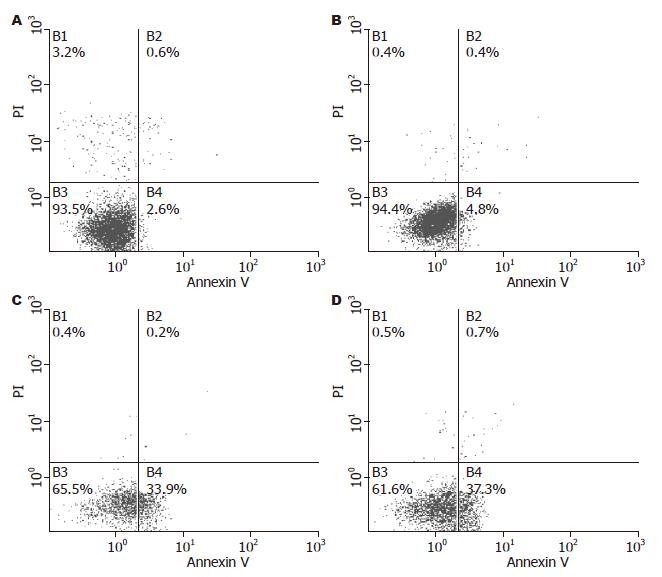
siRNA转染HepG2、SMMC7721细胞后24 h, SiRNA转染组细胞凋亡率显著增加, 明显高于未转染组细胞的凋亡率(5.12%±0.61% vs 37.87%±4.10%; 5.80%±0.71% vs 40.19%±3.78%, 均P<0.05). 未转染组细胞之间的凋亡率差异无统计学意义(5.12%±0.61% vs 5.80%±0.71%, P>0.05, 图5).
细胞凋亡相关基因bcl-2和NF-κB基因表达的改变是肝癌的发生、发展过程中重要的调节因素[2].
NF-κB是一种广泛存在于体内多种细胞的核转录因子, 在细胞的癌变及凋亡调控等方面发挥着重要作用, 目前有研究表明, NF-κB信号转导途径参与了肝脏中原癌基因和抑癌基因的转录表达可通过抑制细胞凋亡参与肝癌的发生发展[3-6]. bcl-2也是一种原癌基因, 由其编码的蛋白产物Bcl-2蛋白, 定位于细胞线粒体外膜、核膜及内质网膜上, 是一种膜定位蛋白, 促进细胞由G1期向S期转化并修复染色体损伤, 与肿瘤的早期形成有关[7].
首先, 我们检测了肝癌细胞和人胚胎肝细胞中NF-κB p65、Bcl-2的表达, 结果显示在肝癌细胞系(HepG2、SMMC7721)中二者均高表达, 明显高于正常人胚胎肝细胞中的表达. 这同国内外的研究结果相符[8,9]. 为了进一步揭示二者是否存在调控关系, 我们应用基因沉默的方法下调NF-κB p65的表达, 本实验显示转染p65 siRNA阻断NF-κB信号通路后, 可使肝癌细胞凋亡明显增加, 同时Bcl-2的表达受到影响, 在实验组中Bcl-2的表达明显降低. 这些结果表明: 在肝癌的发生发展中可能存在NF-κB调控Bcl-2的表达, 通过抑制各种凋亡刺激信号从而抑制细胞凋亡, 在肝癌的发生中具有重要的作用.
大量研究[10,11]提示, NF-κB与Bcl-2可能在促进肝癌形成中具有协同作用, 可能的机制为NF-κB基因的持续存在激活了原癌基因bcl-2, 进一步合成Bcl-2蛋白, 后者又反馈性刺激NF-κB基因的增殖, 形成环路状的级联放大, 使增殖信号不断加强. 这与我们的实验结果相符[12,13], 当使用p65 siRNA阻断肝癌细胞中NF-κB信号通路时, Bcl-2的表达下调, 细胞凋亡数增加, 可以得出Bcl-2位于NF-κB基因下游的结论. NF-κB作为一种抑制凋亡的转录因子, 通过对bcl-2等下游抗凋亡基因的表达, 对癌细胞的正常程序化死亡产生抑制作用[14,15]. 我们的研究揭示NF-κB是Bcl-2的上游调控基因. siRNA可以成功抑制NF-κB p65在肝癌细胞中的活性, 进一步证实NF-κB p65对Bcl-2具有调控作用, 他们共同参与了肝癌的发生发展过程. 他们之间是直接调控还是间接调控及其具体调控机制还有待于进一步研究.
肝癌的发生、发展过程均与肝癌细胞的增殖与凋亡失衡有关, 其中较为重要的是核因子-κB(NF-κB)基因和细胞凋亡相关基因bcl-2表达的改变. NF-κB是重要的转录调节因子, NF-κB的活化在肿瘤的抗凋亡机制中起了关键作用. bcl-2是最早发现的参与细胞凋亡的癌基因之一, 其表达产物具有抗凋亡的重要作用.
沈柏用, 副教授, 上海交通大学医学院附属瑞金医院肝胆胰外科中心; 党双锁, 教授, 西安交通大学第二医院感染科
RNA干扰(RNAi), 即用20多个核苷 酸组成的短的双链RNA(siRNA)代替传统反义核酸进行转录后基因沉默, 已经迅速而广泛地应用到基因功能, 基因表达调控机制研究等热门领域, 并为基因治疗开辟了新的途径.
本文通过研究siRNA成功抑制NF-κB p65在肝癌细胞中的表达及引起肝癌细胞凋亡明显增加, 进一步证实NF-κB p65对Bcl-2具有调控作用, 为肝癌的靶向治疗提供更好的理论依据.
本文方法得当, 结论可靠, 对于了解NF-κB p65与Bcl-2在肝癌细胞发生相互关系及作用机制有研究意义.
编辑: 李薇 电编:何基才
| 1. | Pinkenburg O, Platz J, Beisswenger C, Vogelmeier C, Bals R. Inhibition of NF-kappaB mediated inflammation by siRNA expressed by recombinant adeno-associated virus. J Virol Methods. 2004;120:119-122. [PubMed] [DOI] |
| 2. | Elsharkawy AM, Mann DA. Nuclear factor-kappaB and the hepatic inflammation-fibrosis-cancer axis. Hepatology. 2007;46:590-597. [PubMed] [DOI] |
| 3. | Pikarsky E, Porat RM, Stein I, Abramovitch R, Amit S, Kasem S, Gutkovich-Pyest E, Urieli-Shoval S, Galun E, Ben-Neriah Y. NF-kappaB functions as a tumour promoter in inflammation-associated cancer. Nature. 2004;431:461-466. [PubMed] [DOI] |
| 4. | Wang T, Wang Y, Wu MC, Guan XY, Yin ZF. Activating mechanism of transcriptor NF-kappaB regulated by hepatitis B virus X protein in hepatocellular carcinoma. World J Gastroenterol. 2004;10:356-360. [PubMed] |
| 5. | Djavaheri-Mergny M, Amelotti M, Mathieu J, Besançon F, Bauvy C, Souquère S, Pierron G, Codogno P. NF-kappaB activation represses tumor necrosis factor-alpha-induced autophagy. J Biol Chem. 2006;281:30373-30382. [PubMed] [DOI] |
| 6. | Guo SP, Wang WL, Zhai YQ, Zhao YL. Expression of nuclear factor-kappa B in hepatocellular carcinoma and its relation with the X protein of hepatitis B virus. World J Gastroenterol. 2001;7:340-344. [PubMed] |
| 7. | Beerheide W, Tan YJ, Teng E, Ting AE, Jedpiyawongse A, Srivatanakul P. Downregulation of proapoptotic proteins Bax and Bcl-X(S) in p53 overexpressing hepatocellular carcinomas. Biochem Biophys Res Commun. 2000;273:54-61. [PubMed] [DOI] |
| 8. | Chen Y, Li R, Wang R, Liu Z. [The significance of nuclear factor kappa Bp65 (NF kappa Bp65) expression on the vascular endothelial cells of rectum adenocarcinoma of human]. Huaxi Yike Daxue Xuebao. 2001;32:196-199. [PubMed] |
| 9. | O'Neil BH, Bůzková P, Farrah H, Kashatus D, Sanoff H, Goldberg RM, Baldwin AS, Funkhouser WK. Expression of nuclear factor-kappaB family proteins in hepatocellular carcinomas. Oncology. 2007;72:97-104. [PubMed] |
| 10. | Pereira SG, Oakley F. Nuclear factor-kappaB1: regulation and function. Int J Biochem Cell Biol. 2008;40:1425-1430. [PubMed] [DOI] |
| 11. | Yu Y, Wan Y, Huang C. The biological functions of NF-kappaB1 (p50) and its potential as an anti-cancer target. Curr Cancer Drug Targets. 2009;9:566-571. [PubMed] [DOI] |
| 12. | Wu LF, Li GP, Su JD, Pu ZJ, Feng JL, Ye YQ, Wei BL. Involvement of NF-kappaB activation in the apoptosis induced by extracellular adenosine in human hepatocellular carcinoma HepG2 cells. Biochem Cell Biol. 2010;88:705-714. [PubMed] [DOI] |
| 13. | Huang C, Yao JY, Li ZF, Liu LY, Ni L, Song TS. [Small interfering RNA-mediated nuclear factor-kappaB P65 suppression induces apoptosis of hepatic carcinoma SMMC-7721 cells]. Nanfang Yike Daxue Xuebao. 2007;27:1841-1844. [PubMed] |
| 14. | Arsura M, Cavin LG. Nuclear factor-kappaB and liver carcinogenesis. Cancer Lett. 2005;229:157-169. [PubMed] [DOI] |