修回日期: 2011-07-18
接受日期: 2011-07-22
在线出版日期: 2011-08-08
目的: 研究食管鳞癌组织及周围正常食管黏膜组织的差异表达基因, 为寻找食管鳞癌早期诊断高敏感性, 高特异性的分子指标提供理论依据.
方法: 分别抽提人食管鳞癌组织及周围正常食管黏膜组织总mRNA, 逆转录成cDNA, 用单标法以Cy3-dUTP为标记制成探针, 与基因芯片进行杂交, 筛选出差异表达的基因, 并用生物信息学方法做进一步分析.
结果: 在45 051个人类全基因组芯片中依Ratio实验组(癌组织)/对照组(正常食管组织)>4.0或<0.25的数据项, 共发现1 113条差异表达基因, 其中464条上调, 649条下调. 经生物信息学分析, 表明包含多种功能基因. RT-PCR验证其中3条基因, 表达方向与芯片检测结果一致, 符合预期结果.
结论: 在食管鳞癌的发生、发展中存在着大量异常表达基因; 基因芯片是一高效筛选食管癌相关基因的方法.
引文著录: 赵路, 杨娟, 于婧, 张红, 高冬玲, 陈奎生. 食管鳞癌组织及周围正常食管黏膜组织差异表达基因的筛选. 世界华人消化杂志 2011; 19(22): 2328-2333
Revised: July 18, 2011
Accepted: July 22, 2011
Published online: August 8, 2011
AIM: To screen differentially expressed genes between human esophageal squamous cell carcinoma and tumor-adjacent normal tissue to lay a theoretical basis for finding molecular markers specific for esophageal squamous cell carcinoma.
METHODS: Total RNA was extracted from human esophageal squamous cell carcinoma and tumor adjacent normal tissue specimens and cDNA was synthesized by reverse transcription. Probes were prepared by labeling the synthesized cDNA with Cy3-dUTP and hybridized with gene chips to screen differentially expressed genes. Bioinformatic tools were used for characterization of differentially expressed genes obtained.
RESULTS: According to the expression ratio of >4.0 or <0.25, a total of 1 113 differentially expressed genes were identified, including 464 up-regulated and 649 down-regulated ones. Bioinformatic analysis identified a variety of known functional genes. RT-PCR analysis confirmed that three genes were differentially expressed between human esophageal squamous cell carcinoma and tumor adjacent normal tissue.
CONCLUSION: Gene chip technology is highly efficient and reliable in screening genes differentially expressed in esophageal squamous cell carcinoma. The occurrence and development of esophageal squamous cell carcinoma is the result of expression of many cancer-related genes.
- Citation: Zhao L, Yang J, Yu J, Zhang H, Gao DL, Chen KS. Screening of genes differentially expressed between human esophageal squamous cell carcinoma and tumor-adjacent normal tissue using gene chip technology. Shijie Huaren Xiaohua Zazhi 2011; 19(22): 2328-2333
- URL: https://www.wjgnet.com/1009-3079/full/v19/i22/2328.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i22.2328
河南省是我国食管癌高发区之一, 且其中绝大多数为鳞癌. 因此从分子生物学水平来研究揭示食管鳞癌(esophageal squamous cell carcinoma, ESCC)的发病机制具有重要价值. 人类基因组计划的实施使肿瘤分子遗传学迅速发展, 但近几年应用基因芯片来研究寻找在ESCC及癌旁组织中的差异表达基因, 进一步丰富ESCC的基因表达谱信息及尽可能对ESCC作出早期诊断鲜有报道[1-5]. 本实验通过基因芯片技术对ESCC的基因表达情况进行分析, 通过与正常食管组织对比, 寻找表达异常的基因, 以寻找与ESCC发生、发展有关的基因, 为ESCC的临床诊断、预防和治疗提供分子标记和靶基因.
收集2010-03/07河南省肿瘤医院手术切除的食管癌标本35例(注: 其中5例用于芯片扫描, 另外30例用于RT-PCR验证芯片扫描结果)患者男20例, 女15例, 平均年龄56.6岁, 符合ESCC诊断标准, 临床病理资料完整. 术前未接受任何放、化疗. 手术切除后立即取食管癌组织及相应远端正常食管黏膜组织在20-30 min内快速冷冻在液氮罐中, 于-80 ℃的冰箱中保存. 术后病理证实均为中、高分化鳞状细胞癌, 均无淋巴结转移. 基因芯片采用Aglient公司的人全基因组表达谱芯片, 每张芯片包括45 015个寡核苷酸, 其中有43 376个人基因探针和1 639个实验控制探针. 主要仪器: PCR仪(MJ, PTC-100)、杂交炉(Agilent, G2545A)、扫描仪(Agilent, G2565BA)、分光光度计(Nanodrop, ND1000). 主要试剂: 荧光染料Cy3 NHS ester(GE Healthcare, PA13105)、aaUTP(Ambion, AM8436)、Low RNA Input Linear Amplication kit(Agilent, 5184-3523)、杂交试剂盒(Agilent, 5188-5242)、Gene Expression Wash Buffer Kit (including wash buffer 1 & 2)(Agilent, 5188-5327)、Stabilization and Drying Solution(Agilent, 5185-5979)、Gasket slide(Agilent, G2534-60003)、杂交仪, (Agilent, G2534A)、RNeasy Mini kit(QIAGEN, 74106).
1.2.1 样品准备: 经活检证实为ESCC的5例标本, 手术切除离体后, 立即切取癌组织及其3 cm以上远端切缘(对照, 经病理证实为食管黏膜正常组织)投入液氮中.
1.2.2 总RNA抽提: 将样品从液氮中取出放入研钵中, 边加液氮边研磨, 按照mirVanaTM miRNA试剂说明书进行, 抽提总RNA, 测A260/280值, 进行琼脂糖电泳. 每份组织样品总RNA的A值均在1.8-2.1, 总RNA经1%琼脂糖电泳, 可见18S和28S两条清晰的条带, 证实已经获得高纯度完整的总RNA. 确认RNA质量合乎实验要求.
1.2.3 逆转录和标记: 用Low RNA Input Linear Amplification Kit将mRNA逆转录成cDNA, 同时用Cy3分别标记实验组(癌组织)和对照组(正常食管组织).
1.2.4 杂交: 按芯片使用说明书的步骤进行, 温度在65 ℃, 经17 h 10 r/min滚动杂交, 37 ℃洗片.
1.2.5 数据处理: 杂交后芯片用Agilent扫描仪扫描, 分辨率为5 μm, 扫描仪自动以100%和10% PMT各扫描1次, 2次结果Agilent软件自动合并. 扫描图像数据采用Feature Extraction进行处理分析, 得到的原始数据应用Bioconductor程序包进行后续数据处理. 最后Ratio值为实验组(癌组织)/对照组(正常食管组织). 差异基因筛选标准: ratio≥4为上调基因, ≤0.25为下调基因.
1.2.6 RT-PCR验证结果: 为了验证芯片结果的有效性, 我们另取30例ESCC组织及其周围正常组织为研究对象, 进行RT-PCR试验, 验证3条基因产物.
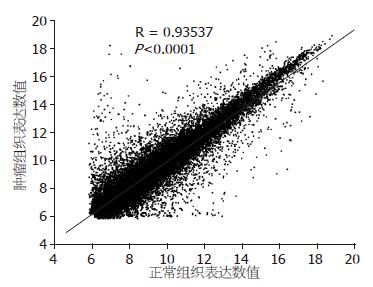
芯片上每个基因克隆双点检验同一阵列的重复性. 杂交后扫描图像阳性对照点信号强, 阴性对照点与空白对照点信号弱或无. 图像信号清晰, 背景信噪低, 证实该实验可靠. 用实验组(癌组织)与对照组(正常组织)的荧光信号作散点图, 大部分聚集在一个以45度对角线为中心的区域里, 表示信号差异在0.25-4.00(图1, 2).
依荧光素实验组/对照组比值(Ratio)>4.0或<0.25的数据项差异表达, 在45 015个基因中共筛选出1 113个差异表达基因, 其中464条上调, 649条下调, 占总数的2.47%(1 113/45 015). 在异常表达的基因中, 表达序列标签(EST)329个, 其中上调基因167个, 下调基因162个. 在784个已知功能的基因中, 上调基因297个, 下调基因487个. 根据GO(gene ontology)分析分类, 将差异表达的基因按分子功能(molecular function)进行分类, 发现在这些异常的基因中, 与细胞分化、成熟, 分子定位、连接, 信号传导, 酶活性调节, 以及基因转录、翻译有关的基因最多(表1, 2).
| 基因名称 | 下调基因功能 | 染色体定位 |
| ACTA1 | actin, alpha 1, skeletal muscle | 1q42.13-q42.2 |
| MYH7 | myosin, heavy chain 1, cardiac muscle, beta | 14q12 |
| CKM | creatine kinase, muscle | 19q13.2-q13.3 |
| TNNC1 | troponin C type 1 (slow) | 3p21.3-p14.3 |
| MB | myoglobin | 22q13.1 |
| MYH2 | myosin, heavy chain 2, skeletal muscle, adult | 17p13.1 |
| TFF1 | trefoil factor 1 (breast cancer, estrogen-inducible sequence expressed in) | 21q22.3 |
| OGN | osteoglycin (osteoinductive factor, mimecan) | 9q22 |
| 基因名称 | 上调基因功能 | 染色体定位 |
| MMP-3 | matrix metallopeptidase 3 (stromelysin 1, progelatinase) | 11q22.3 |
| COL11A1 | collagen, type XI, alpha 1 | 1p21 |
| SPANXD | SPANX family, member D | Xq27.1 |
| CALB1 | calbindin 1, 28 kDa | 8q21.3-q22.1 |
| SPANXA1 | sperm protein associated with the nucleus, X-linked, family member A1 | Xq27.1 |
| SPRR2G | small proline-rich protein 2G | 1q21-q22 |
| MAGEA2B | melanoma antigen family A, 2B | Xq28 |
| MMP-1 | matrix metallopeptidase 1 (interstitial collagenase) | 11q22.3 |
为了验证芯片结果的有效性, 我们另取30例ESCC组织及其周围正常组织为研究对象, 进行RT-PCR试验, 验证3条基因产物. (1)MMP-1上游引物TCAACCAGGCCCAGGTATTG; 下游引物TGGCCGAGTTCATGAGCTG; 产物长度111 bp; (2)MYH7上游引物CGCATCATCACGCGTATCC; 下游引物GCCCGAATGTTCCACTGGA; 产物长度113 bp; (3)SPANXA1上游引物GCCTGCCACTGACATTGAAGA; 下游引物CGTTGGCCTCGTTGGAATC; 产物长度101 bp. PCR两步法, 反应条件为: 95 ℃预变性30 s; 95 ℃ 5 s; 60 ℃ 30 s; 25个循环. 采用Smart View分析软件或Gel-Pro analyzer software Versino 3.1对电泳所得条带进行密度定量分析符合预期结果(图3).
癌的发生是一系列分子变化的结果, 是许多肿瘤相关基因表达失常所致. ESCC与其他肿瘤一样, 有多个癌基因, 抑癌基因参与了其形成过程. 通过基因芯片检测和确定在ESCC样本中差异表达的基因, 可以从分子水平寻找病因, 探索发病机制, 为ESCC的早期诊断、基因治疗和预后判断提供思路和依据.
本次实验采用基因芯片技术筛选食管癌中异常表达的基因, 共发现1 113条, 其中784个已知功能的基因, 上调297个, 下调487个. 在这些差异表达基因中基质金属蛋白酶MMPs是一类具有Zn2+依赖性的内源性蛋白水解酶, 他们通过蛋白水解的作用降解重塑细胞外基质, 包括基底膜降解, 是肿瘤浸润和在远处克隆生长的基本步骤[6]. 他们既可以通过重塑ECM, 又可以通过刺激肿瘤生长和运动来帮助肿瘤细胞转移[7]. 基质金属蛋白酶-1(matrix metalloproteinase-1, MMP-1)是上调最明显的一个, 其差异表达倍数有135倍之多. 研究证实, 在胃癌、肺癌、宫颈癌、口腔鳞癌中都发现了MMP-1基因具有多态性[8-10], 并且伴随着MMP-l mRNA及蛋白的表达上升, 肿瘤恶性转化和演进的能力提高. Brmmer等[11]发现在宫颈癌组织中MMP-1的表达增多, 并且随着肿瘤分级和分期的增加而增加. Schütz等[12]发现在肺鳞癌中MMP-1的表达较正常的肺组织增多, 认为其可能参与了肺鳞癌的侵袭和转移. 头颈部、阴部鳞癌、乳腺癌、膀胱癌、软骨肉瘤黑色素瘤等恶性肿瘤中MMP-13都有较高的表达, 且主要表达于肿瘤侵袭的边缘[13-15]. 其他MMP家族成员表达普遍升高, MMP-3, 9, 10, 11, 12均在20倍以上. 可见MMPs对ESCC的发生、发展有着极大的影响. 黑色素瘤抗原基因(melanoma antigen, MAGE)家族, 该家族共12个成员均位于X染色体长臂末端Xq28上[16,17]. Inoue等[18]曾用RT-PCR方法分析了42例食管癌手术切除的新鲜标本, 发现MAGE-1, 2, 3表达率分别为62%、43%和57%, 而癌旁正常组织均不表达. 79%患者的肿瘤细胞至少表达其中一种基因, 29%表达全部3种基因. Zambon等[19]分析报道了24例ESCC和24例食管腺癌中MAGE基因的表达及其与预后因素的关系. 结果发现, 67%鳞癌和37.5%腺癌至少表达一种MAGE基因, Liang等[20]通过RT-PCR技术检测发现, 在食管癌中, MAGEA3在肿瘤组织中高表达(62.9%), 正常组织中不表达. 三叶因子1(trefoil factor 1, TFF1)又称雌激素调节蛋白pS2, 他与TFF2(解痉多肽SP)和TFF3(肠三叶因子ITF)构成TFFs家族. 目前, TFF1在胃肠道肿瘤中的作用以胃癌研究相对较多, 他的功能不全与胃黏膜的瘤性转化密切相关. TFF1在胃肠道肿瘤细胞中抑制细胞分化增殖, 另一方面抑制凋亡, 提示其双重活性. 故有学者认为其在胃中的抗癌作用可能是抑癌-促癌潜能的综合结果[21]. TFF1参与细胞增殖、分化和凋亡, 理论上能通过任一过程参与肿瘤形成[22]. 国内学者[23]在食管癌及癌旁组织中未检测到TFF1的阳性表达, 但Labouvie等[24]用免疫组织化学的方法研究了40例ESCC和21例BE化生上皮的标本, 发现其中10%鳞状细胞癌和100% BE化生上皮TFF1高表达. 梁志海等[25]采用免疫组织化学法检测33例ESCC及癌旁组织的TFF1、血管内皮生长因子(vascular endothelial growth factor, VEGF)和微血管密度(microvessel density, MVD)的表达提出TFF1可能通过上调VEGF表达促进ESCC新生血管的形成. 而本研究结果提示, TFF1在食管癌中低表达, 表明TFF1在食管癌发生、发展中也可能是抑癌-促癌潜能的综合结果. 骨诱导因子(osteoglycin, OGN)基因定位于人染色体的9q22, 属于小亮氨酸富集蛋白家族. 该蛋白广泛分布于角膜、心室、小肠、骨、皮肤等正常组织中, 具有调节Ⅰ型胶原纤维生成的功能[26], 可能是血管外基质成分之一, 还可能具有调节细胞生长和分化的功能[27]. OGN第一个内含子区含有p53基因的结合位点, 而且研究证实P53能增强OGN基因的转录活性, 并且在P53突变的肿瘤和癌细胞系中OGN表达下降或缺失[28,29]. Wang等[30]研究发现骨诱导因子蛋白在正常肠黏膜中高表达, 而在直肠癌组织中表达缺失, Lee等[31]发现OGN在胃癌组织中的表达比癌旁正常组织明显下调, 提示OGN可能与直肠癌和胃癌的发生相关. 潘秀华等[32]OGN mRNA在乳腺癌旁正常组织、良性肿瘤、原发癌和转移癌的高表达率分别为76.7%、83.3%、44.4%和6.7%, 其中在非癌的良性肿瘤与正常组织间无差异, 提示OGN mRNA低水平状态与乳腺癌的发生和转移相关, 有望作为乳腺癌诊断和监测肿瘤进展的分子标志物. 但国内外还没有对OGN与食管癌之间的关系有所研究、报道. 本实验利用基因芯片筛选到的食管癌差异表达基因中OGN也是低水平表达, 且差异表达倍数有19.4倍之多. 提示OGN有望成为食管癌诊断的分子标志物. S100基因染色体定位于1q21. 该蛋白家族是一类由21个成员组成的、低分子量的、酸性钙离子结合蛋白. 研究证实, 这类蛋白的表达具有高度的组织和细胞类型特异性, 已发现其中数个S100成员在多种肿瘤中表达异常, 与肿瘤的浸润、转移有关, 因此S100家族与肿瘤的发生发展关系密切, 该家族成员与肿瘤生物学特性之间的相关性研究已成为临床医学和基础研究关注的焦点. S100A12或CAAF1同属S100家族, Hitomi等[33]证实S100A12与食管上皮细胞终末分化密切相关; 而S100P涉及食管上皮细胞早期分化过程. S100A2作为一个候选抑癌基因, Kyriazanos等[34]认为评价其表达情况对于ESCC的治疗和预后具有重要意义. 孔建平[35]研究结果表明S100A8和S100A9在食管癌变不同时期均有下调, 其表达随癌变进程逐渐减低(中、低分化细胞比高分化细胞表达水平低)表达水平与病理分级呈显著相关.
基因芯片高通量的特点, 可以同时分析上万个基因的表达结果. 因此通过对基因芯片结果的整理和分析, 我们不难发现, 在食管癌中存在大量异常表达的基因, 这些基因中有许多已经证明和癌的发生、发展有关, 也发现许多新的异常表达基因, 这些异常表达的基因参与许多分子生物学过程, 他们之间相互影响有着极其复杂的关系, 在不同阶段发挥作用, 影响细胞的增殖、分化、成熟及凋亡等, 还跟分子定位、连接, 信号传导, 酶活性调节, 以及基因转录、翻译调节有关, 这也证明了食管癌的发生、发展是一个多因素、多阶段的过程; 虽然有许多基因涉及, 但其中相当一部分可能是继发性改变, 因此只有进一步筛选出关键性的基因/通路, 才可能对疾病的诊断和治疗提供有效的指导; 而从基因到蛋白质需要经过转录, 翻译以及加工修饰才有活性, 细胞中的mRNA与蛋白质丰度存在不相关, 而且很多蛋白质调节其功能不主要是依赖其是否表达或表达量高低, 而是依赖蛋白质磷酸化-去磷酸化等方式, 因此还需将基因分析与蛋白质分析相结合, 才能更准确地揭示肿瘤的发生、发展过程.
总之, 基因芯片是一种高通量, 快速的检测基因表达量的手段. 随着生物信息学、计算机生物学的发展, 基于基因芯片数据的生物统计分析方法不断完善. 基因芯片在肿瘤发生机制、早期诊断、肿瘤亚型分类、指导治疗、评估预后已显示出广阔的临床应用前景.
人类基因组计划的实施使肿瘤分子遗传学迅速发展, 但近几年应用基因芯片来研究寻找在食管鳞癌及癌旁组织中的差异表达基因, 进一步丰富食管鳞癌的基因表达谱信息及尽可能对食管鳞癌作出早期诊断鲜有报道.
刘丽江, 教授, 江汉大学医学院病理学与病理生理学教研室
目前采用基因芯片筛选食管鳞癌差异表达基因是一个研究热点.
姜玉章等使用双标法(cy5.cy3)在含有14 000点的基因芯片上, 依Ratio(cy5/cy3)>2.0或<0.5的数据项筛选出有差异表达的基因共1 855 个.
本文为克服双标法荧光竞争, 背景难于扣除, 两种荧光的标记效率不同等缺点采用单标法(cy3)在45 051个人类全基因组芯片中依Ratio实验组(癌组织)/对照组(正常食管组织)>4.0或<0.25的数据项, 共发现1 113条差异表达基因, 经生物信息学分析, 表明包含多种功能基因. 并且用RT-PCR技术对芯片结果进行了反证.
本文通过与正常食管黏膜组织对比, 在食管鳞癌中筛选出大量差异表达基因为寻找食管鳞癌早期诊断高敏感性, 高特异性的分子指标提供理论依据, 并且证明了基因芯片是一高效筛选差异表达基因的方法.
本文选题较好, 具有较高的科学价值和应用价值.
编辑: 曹丽鸥 电编:何基才
| 5. | 李 沛, 凌 志强, 杨 洪艳, 黄 幼田, 赵 继敏, 郑 智敏, 董 子明. 实时荧光定量RT-PCR和cDNA基因芯片方法分析食管癌组织中基因的表达. 郑州大学学报(医学版). 2006;41:841-843. |
| 6. | Egeblad M, Werb Z. New functions for the matrix metalloproteinases in cancer progression. Nat Rev Cancer. 2002;2:161-174. [PubMed] [DOI] |
| 7. | Chang C, Werb Z. The many faces of metalloproteases: cell growth, invasion, angiogenesis and metastasis. Trends Cell Biol. 2001;11:S37-S43. [PubMed] |
| 8. | Matsumura S, Oue N, Kitadai Y, Chayama K, Yoshida K, Yamaguchi Y, Toge T, Imai K, Nakachi K, Yasui W. A single nucleotide polymorphism in the MMP-1 promoter is correlated with histological differentiation of gastric cancer. J Cancer Res Clin Oncol. 2004;130:259-265. [PubMed] [DOI] |
| 9. | Nishioka Y, Sagae S, Nishikawa A, Ishioka S, Kudo R. A relationship between Matrix metalloproteinase-1 (MMP-1) promoter polymorphism and cervical cancer progression. Cancer Lett. 2003;200:49-55. [PubMed] [DOI] |
| 10. | Lin SC, Chung MY, Huang JW, Shieh TM, Liu CJ, Chang KW. Correlation between functional genotypes in the matrix metalloproteinases-1 promoter and risk of oral squamous cell carcinomas. J Oral Pathol Med. 2004;33:323-326. [PubMed] [DOI] |
| 11. | Brummer O, Böhmer G, Hollwitz B, Flemming P, Petry KU, Kühnle H. MMP-1 and MMP-2 in the cervix uteri in different steps of malignant transformation--an immunohistochemical study. Gynecol Oncol. 2002;84:222-227. [PubMed] [DOI] |
| 12. | Schütz A, Schneidenbach D, Aust G, Tannapfel A, Steinert M, Wittekind C. Differential expression and activity status of MMP-1, MMP-2 and MMP-9 in tumor and stromal cells of squamous cell carcinomas of the lung. Tumour Biol. 2002;23:179-184. [PubMed] [DOI] |
| 13. | Zhang B, Cao X, Liu Y, Cao W, Zhang F, Zhang S, Li H, Ning L, Fu L, Niu Y. Tumor-derived matrix metalloproteinase-13 (MMP-13) correlates with poor prognoses of invasive breast cancer. BMC Cancer. 2008;8:83. [PubMed] [DOI] |
| 14. | Corte MD, Gonzalez LO, Corte MG, Quintela I, Pidal I, Bongera M, Vizoso F. Collagenase-3 (MMP-13) expression in cutaneous malignant melanoma. Int J Biol Markers. 2005;20:242-248. [PubMed] |
| 15. | Aaltonen V, Boström PJ, Söderström KO, Hirvonen O, Tuukkanen J, Nurmi M, Laato M, Peltonen J. Urinary bladder transitional cell carcinogenesis is associated with down-regulation of NF1 tumor suppressor gene in vivo and in vitro. Am J Pathol. 1999;154:755-765. [PubMed] [DOI] |
| 16. | Oaks MK, Hanson JP, O'Malley DP. Molecular cytogenetic mapping of the human melanoma antigen (MAGE) gene family to chromosome region Xq27-qter: implications for MAGE immunotherapy. Cancer Res. 1994;54:1627-1629. [PubMed] |
| 17. | De Plaen E, Arden K, Traversari C, Gaforio JJ, Szikora JP, De Smet C, Brasseur F, van der Bruggen P, Lethé B, Lurquin C. Structure, chromosomal localization, and expression of 12 genes of the MAGE family. Immunogenetics. 1994;40:360-369. [PubMed] [DOI] |
| 18. | Inoue H, Mori M, Li J, Mimori K, Honda M, Nakashima H, Mafune K, Tanaka Y, Akiyoshi T. Human esophageal carcinomas frequently express the tumor-rejection antigens of MAGE genes. Int J Cancer. 1995;63:523-526. [PubMed] [DOI] |
| 19. | Zambon A, Mandruzzato S, Parenti A, Macino B, Dalerba P, Ruol A, Merigliano S, Zaninotto G, Zanovello P. MAGE, BAGE, and GAGE gene expression in patients with esophageal squamous cell carcinoma and adenocarcinoma of the gastric cardia. Cancer. 2001;91:1882-1888. [PubMed] [DOI] |
| 20. | Liang Z, Sun ZY, Yuan YH, Han Y, Wang Y, Gu J, Zhang LJ. [The expression of 11 cancer/testis (CT) antigen genes in esophageal carcinoma]. Zhonghua Zhongliu Zazhi. 2005;27:534-537. [PubMed] |
| 21. | Yio X, Diamond M, Zhang JY, Weinstein H, Wang LH, Werther L, Itzkowitz S. Trefoil factor family-1 mutations enhance gastric cancer cell invasion through distinct signaling pathways. Gastroenterology. 2006;130:1696-1706. [PubMed] [DOI] |
| 24. | Labouvie C, Machado JC, Carneiro F, Sarbia M, Vieth M, Porschen R, Seitz G, Blin N. Differential expression of mucins and trefoil peptides in native epithelium, Barrett's metaplasia and squamous cell carcinoma of the oesophagus. J Cancer Res Clin Oncol. 1999;125:71-76. [PubMed] [DOI] |
| 26. | Ge G, Seo NS, Liang X, Hopkins DR, Höök M, Greenspan DS. Bone morphogenetic protein-1/tolloid-related metalloproteinases process osteoglycin and enhance its ability to regulate collagen fibrillogenesis. J Biol Chem. 2004;279:41626-41633. [PubMed] [DOI] |
| 27. | Tasheva ES, Ke A, Deng Y, Jun C, Takemoto LJ, Koester A, Conrad GW. Differentially expressed genes in the lens of mimecan-null mice. Mol Vis. 2004;10:403-416. [PubMed] |
| 28. | Tasheva ES, Maki CG, Conrad AH, Conrad GW. Transcriptional activation of bovine mimecan by p53 through an intronic DNA-binding site. Biochim Biophys Acta. 2001;1517:333-338. [PubMed] |
| 29. | Tasheva ES, Conrad GW. The UV responsive elements in the human mimecan promoter: a functional characterization. Mol Vis. 2003;9:1-9. [PubMed] |
| 30. | Wang Y, Ma Y, Lü B, Xu E, Huang Q, Lai M. Differential expression of mimecan and thioredoxin domain-containing protein 5 in colorectal adenoma and cancer: a proteomic study. Exp Biol Med (Maywood). 2007;232:1152-1159. [PubMed] [DOI] |
| 31. | Lee JY, Eom EM, Kim DS, Ha-Lee YM, Lee DH. Analysis of gene expression profiles of gastric normal and cancer tissues by SAGE. Genomics. 2003;82:78-85. [PubMed] [DOI] |
| 33. | Hitomi J, Kimura T, Kusumi E, Nakagawa S, Kuwabara S, Hatakeyama K, Yamaguchi K. Novel S100 proteins in human esophageal epithelial cells: CAAF1 expression is associated with cell growth arrest. Arch Histol Cytol. 1998;61:163-178. [PubMed] [DOI] |
| 34. | Kyriazanos ID, Tachibana M, Dhar DK, Shibakita M, Ono T, Kohno H, Nagasue N. Expression and prognostic significance of S100A2 protein in squamous cell carcinoma of the esophagus. Oncol Rep. 2002;9:503-510. [PubMed] |
| 35. | 孔 建平. 食管癌基因表达谱的分析及S100A8/S100A9在食管癌变中的作用研究. 北京: 中国协和医科大学 2004; 1-142. |