修回日期: 2011-07-02
接受日期: 2011-07-11
在线出版日期: 2011-07-28
目的: 探讨经门静脉导入重组血管内皮生长因子165对大鼠肝纤维化的影响.
方法: ♂SD大鼠50只, 体质量180-220 g, 完全随机分成正常组10只、诱导模型组40只. 采用硫代乙酰胺诱导模型方法, 10 wk后成模25只, 随机分为模型实验组15只和模型对照组10只, 实验组经门静脉插管并植入Alzet微渗泵灌注血管内皮生长因子入门静脉, 持续作用2 wk. 正常组和模型对照组行开腹后关腹对照处理. 2 wk后处死大鼠, HE染色观察肝脏病理组织学改变; 放射免疫法检测血清HA、LN含量; 免疫组织化学法检测肝组织内Ⅰ、Ⅳ型胶原含量.
结果: 模型对照组肝细胞变性坏死、弥漫纤维结缔组织增生, 有假小叶形成. 而模型实验组变性坏死程度减轻, 纤维结缔组织增生范围缩小, 肝纤维化分级较模型对照组有明显的改善, 差异具有统计学意义(P<0.01). 与正常组比较, 模型对照组血清HA、LN浓度急剧增高, 差异具有统计学意义(741.60 μg/L±72.83 μg/L vs 46.11 μg/L±12.10 μg/L; 92.80 μg/L±8.41 μg/L vs 27.74 μg/L± 3.29 μg/L; 均P<0.01); 模型实验组血清HA、LN浓度与模型对照组比较显著下降, 差异具有统计学意义(412.63 μg/L± 85.18 μg/L vs 741.60 μg/L±72.83 μg/L; 58.87 μg/L± 5.46 μg/L vs 92.80 μg/L±8.41 μg/L; 均P<0.01);Ⅰ、Ⅳ型胶原免疫组织化学定量分析结果显示, 模型实验组明显低于模型对照组, 差异具有统计学意义(6.84±0.96, 8.25±0.82 vs 18.32±1.86, 20.84±2.42, 均P<0.01).
结论: 经门静脉灌注重组血管内皮生长因子165具有减缓大鼠肝纤维化的作用.
引文著录: 于良立, 赵金满, 蒋伟伟. 重组血管内皮生长因子165对大鼠肝纤维化的影响. 世界华人消化杂志 2011; 19(21): 2214-2219
Revised: July 2, 2011
Accepted: July 11, 2011
Published online: July 28, 2011
AIM: To evaluate the effect of portal vein infusion of recombinant vascular endothelial growth factor (VEGF) 165 on liver fibrosis in rats with cirrhosis.
METHODS: Fifty male SD rats were randomly divided into normal group (n = 10) and model group (n = 40). The model group was used to induce cirrhosis using the thioacetamide approach. After 10 wk, 25 cirrhotic rats were randomly divided into experimental group (n = 15) and model control group (n = 10). The experimental group was intubated for implantation of an Alzet osmotic pump, which was used to infuse recombinant VEGF165 via the portal vein for 2 wk. The normal group and model control group underwent sham operation. All rats were killed after 2 wk, and HE staining was used to observe the pathological changes in liver tissue. Serum hyaluronic acid and laminin were measured using radioimmunoassay method. Immunohistochemistry was used to detect the expression of type I and type IV collagen in the liver.
RESULTS: Degeneration and necrosis of liver cells, diffuse proliferation of fibrous connective tissue and formation of pseudo lobules occurred in the model control group. In the experimental group, degeneration and necrosis of liver cells were milder and the rate of liver fibrosis was improved significantly compared to the model control group (P < 0.01). Compared to the normal group, serum hyaluronic acid and laminin concentrations increased significantly in the model control group (P < 0.01). However, serum concentrations of hyaluronic acid and laminin was significantly lower in the experimental group than in the model control group (412.63 μg/L ± 85.18 μg/L vs 741.60 μg/L ± 72.83 μg/L; 58.87 μg/L ± 5.46 μg/L vs 92.80 μg/L ± 8.41 μg/L; both P < 0.01). The expression levels of type I and type IV collagen in the liver was significantly lower in the experimental group than in the model control group (6.84 ± 0.96, 8.25 ± 0.82 vs 18.38 ± 1.86, 20.86 ± 2.48, all P < 0.01).
CONCLUSION: Portal vein infusion of VEGF165 can relieve liver fibrosis in rats with cirrhosis.
- Citation: Yu LL, Zhao JM, Jiang WW. Portal vein infusion of recombinant vascular endothelial growth factor 165 mitigates liver fibrosis in cirrhotic rats. Shijie Huaren Xiaohua Zazhi 2011; 19(21): 2214-2219
- URL: https://www.wjgnet.com/1009-3079/full/v19/i21/2214.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i21.2214
肝纤维化是慢性肝病发展成肝硬化的病理阶段, 抗肝纤维化治疗有助于减缓肝硬化的发展. 目前临床抗肝纤维化的药物疗效尚不能令人满意, 寻找一种有效的抗纤维化的新方法具有重要的临床意义. 近年来, 血管内皮生长因子(vascular endothelial growth factor, VEGF)促进血管生成的作用已十分明确[1,2], 并且肝脏血管病变在肝硬化病程中的作用也逐步清晰[3,4], 但VEGF干预对肝纤维化的影响目前在国内外罕见报道. 本研究以肝硬化时血管病理改变为基础, 利用VEGF促进血管生成的生物学特性, 探讨经门静脉应用外源性VEGF对于大鼠肝纤维化的影响.
♂SD大鼠50只, 体质量180-220 g, 购于中国医科大学实验动物中心; 重组大鼠VEGF165 (rr-VEGF165), 购于美国PeproTech公司; ALzet微渗泵[Alzet osmotic pumps(model2002)], 购于美国健康医疗仪器国际公司; 硫代乙酰胺(TAA); 购于国药集团化学试剂有限公司. 透明质酸(hyaluronic acid, HA)、层粘连蛋白(laminin, LN)放射免疫分析试剂盒, 购于北京北方生物技术研究所; 兔抗大鼠Ⅰ、Ⅳ型胶原多克隆抗体, 生物素化羊抗兔IgG(H+L), SABC免疫组织化学试剂盒, 购于北京博奥森生物技术有限公司.
1.2.1 造模与分组: 实验动物完全随机分成正常组、诱导模型组. 正常组10只, 给予正常饮食饮水. 模型诱导组40只, 采用硫代乙酰胺造模法[5], 每只大鼠每天饮用水量约20 mL, 前5 wk使用0.03% TAA, 后5 wk使用0.04% TAA作为其饮用水, 定期更换饮用水和垫料. 大体观察实验动物在诱导过程中活动减少, 其间大鼠死亡15只. 10 wk后诱导成模25只, 将其随机分为模型实验组15只和模型对照组10只.
1.2.2 植入Alzet微渗泵: 在无菌条件下, 模型实验组行门静脉插管植入并固定Alzet微渗泵于腹腔, 逐层缝合腹肌及皮肤, 根据文献[6], VEGF剂量给予30 ng/d, 微渗泵以0.5 μL/h的速度将VEGF灌注入门静脉至肝脏, 2 wk完全排空药物. 正常组和模型对照组行开腹后关腹对照处理. 术后3 d连续肌肉注射青霉素4万U/d预防感染, 常规喂养. 持续作用2 wk后处死各组大鼠.
1.2.3 肝脏组织病理学检查: 肝组织标本置于甲醛中固定, 石蜡包埋, HE染色, 观察肝脏病理组织学改变. 根据切片中纤维组织增生程度, 使用METAVIR肝脏纤维化评分系统[7], 按肝纤维化程度分为0-4四级: F0: 无纤维化; F1: 门静脉旁纤维化不伴分隔; F2: 门脉旁纤维化伴少量分隔; F3: 大量分隔不伴肝硬化; F4: 肝硬化.
1.2.4 血清HA、LN检测: 应用放射免疫分析法检测血清HA、LN水平, 具体操作严格按照试剂盒说明书进行.
1.2.5 肝组织Ⅰ、Ⅳ型胶原检测: 采用SABC法. 石蜡包埋的肝组织切成5 μm厚的切片, 常规二甲苯, 梯度乙醇脱蜡至水. 30 mL/L过氧化氢溶液37 ℃孵育15 min以去除内源性过氧化物酶, PBS冲洗5 min×3; 高压30 s进行抗原修复, PBS洗5 min×3; 加入正常山羊血清37 ℃封闭30 min, 不洗即加入兔抗大鼠多克隆Ⅰ、Ⅳ型胶原抗体(1:50倍稀释), 阴性对照用PBS代替一抗, 4 ℃过夜; PBS洗5 min×3, 加入生物素标记的羊抗兔IgG(H+L)抗体, 37 ℃孵育20 min; PBS洗5 min×3, 加入SABC液, 37 ℃孵育20 min; PBS洗5 min×3, DAB显色, 显微镜下控制显色时间, 3 min左右; 自来水冲洗, 苏木素复染40 s, 盐酸-乙醇分化, 常规脱水透明, 中性树胶封片. 结果应用病理图像分析仪对染色强度和染色面积进行分析, 分析时每张切片随机选取10个视野.
统计学处理 以mean±SD表示, 应用SPSS13.0对各组间数据进行单因素方差分析(AVONA), 各组间两两比较应用LSD方法, 等级资料的比较采用秩和检验, P<0.05有统计学意义.
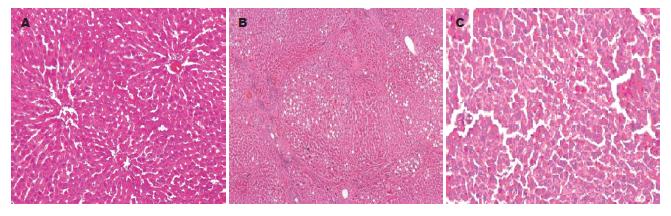
正常组肝细胞排列整齐, 无变性坏死, 中央静脉及肝血窦完好, 无纤维组织增生, 纤维化分级均为0级(图1A); 模型对照组肝细胞出现不同程度变性坏死, 中央静脉及汇管区周围胶原纤维组织明显增生, 呈条索状向肝小叶内延伸, 形成大小不等的假小叶, 纤维化分级绝大部分为F4级(图1B); 而模型实验组肝细胞变性坏死程度轻, 中央静脉和肝血窦有所恢复, 汇管区可见少量胶原纤维, 纤维结缔组织增生范围缩小, 纤维化分级以F2为主(图1C).
经过秩和分析, 模型对照组和正常组纤维化分级差异具有统计学意义(P<0.01), 表明模型复制是成功的, 模型对照组和模型实验组差异具有统计学意义(P<0.01), 表明药物干预是有效的(表1).
与正常组比较, 模型对照组血清HA、LN浓度急剧增高(P<0.01); 模型实验组较模型对照组血清HA、LN浓度显著下降, 比较差异具有统计学意义(P<0.01, 表2).
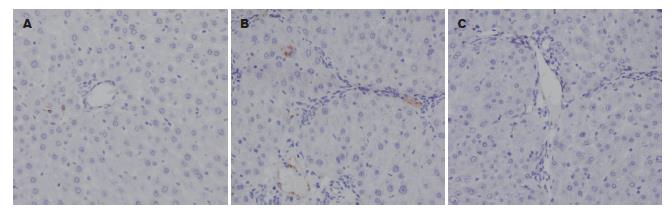
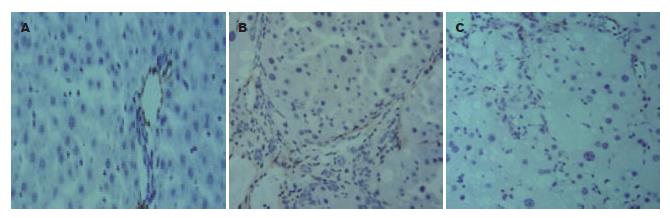
正常组中Ⅰ型胶原纤维少量分布于中央静脉管壁, 沿肝窦壁形成的细丝状着色, 染色呈弱阳性(图2A); 模型对照组中Ⅰ型胶原主要分布于中央静脉周围及增生的纤维组织处, 形成宽而粗大的纤维条索, 呈强阳性条性染色(图2B); 模型实验组大鼠中Ⅰ型胶原主要分布于中央静脉及肝窦壁的结缔组织处, 纤维条索狭窄, 中等强度染色(图2C). 病理图像分析仪Ⅰ型胶原免疫组织化学定量分析结果显示模型实验组明显低于模型对照组(6.84±0.96 vs 18.38±1.86, P<0.01). 正常组中Ⅳ型胶原中央静脉、汇管区的血管壁少量沉积, 肝窦壁未见分布, 呈弱阳性染色(图3A); 模型对照组中Ⅳ型胶原大量沉积于增生的纤维间隔内, 呈强阳性染色, 并可见沿肝窦壁弥漫分布的强阳性条性染色(图3B); 模型实验组中Ⅳ型胶原主要位于中央静脉壁, 肝窦壁呈线样分布, 中等强度染色(图3C). 病理图像分析仪所示Ⅳ型胶原免疫组织化学定量分析结果显示模型实验组明显低于模型对照组(8.25±0.82 vs 20.86±2.48, P<0.01).
肝纤维化是指由各种致病因子所致纤维结缔组织增生, 弥漫性细胞外基质过度沉积的病理过程, 是慢性肝病发展成肝硬化重要的病理阶段, 晚期常出现一系列致命并发症, 死亡率极高[8,9]. 抑制肝纤维化能阻止肝硬化进一步恶化, 所以抗肝纤维化对于肝硬化的治疗具有重要价值, 但目前临床抗纤维化的药物疗效尚不能令人满意, 寻找一种安全、有效、合理有效的抗纤维化的新方法具有重要的临床意义.
近年来, VEGF强大的促血管生成的生物学特性被充分证实, 他是内皮细胞特异性有丝分裂原, 可促使内皮细胞分裂增殖、诱导血管生成, 其中VEGF165是VEGF家族中发挥生物学效应的最主要成分. 目前国内外学者利用VEGF来治疗缺血性疾病, 使治疗性血管生成[10-12]疗法成为研究新热点, 并已经在实验和临床研究中取得良好的治疗效果[13-16]. 随着研究的深入, 肝脏血管病变在肝硬化病程中的作用也逐渐清晰, 这会加重肝细胞缺血缺氧, 促进肝硬化进一步发展, 因此有学者提出, 改善肝硬化血管病变将有助于减缓肝纤维化进程[17]. 目前, 国内外研究认为内源性VEGF在肝硬化的病程中扮演着重要的角色[18-24], 多数倾向于VEGF的代偿性改善肝脏缺血缺氧的积极作用. 我们的前期实验[25]证实分布在血管内皮细胞的VEGFR-2可能通过促进肝内小叶间静脉的血管生成来改善肝组织的缺血缺氧状态并维持肝细胞功能. 而小叶间静脉是门静脉的分支, 这从理论上支持了经门静脉导入外源性VEGF同VEGFR-2结合可以产生生物学效应.
血清HA是一种广泛存在于细胞外基质中的高分子多糖, 由间质细胞合成, 主要在肝内皮细胞进行降解. LN是一种大分子非胶原糖蛋白, 主要存在于基底膜的透明层中. HA、LN能敏感地反映肝硬化的病理变化并可作为肝纤维化活动及动态变化的观察指标. 肝纤维化是慢性肝病共有的病理改变, 其本质是以胶原为主的细胞外基质合成增多, 而降解相对减少, 两者失去动态平衡, 致使过多细胞外基质沉积于肝内. 肝硬化肝内沉积的胶原蛋白主要为Ⅰ、Ⅲ型胶原, 正常组肝组织中的Ⅰ型胶原纤维少量分布于汇管区和中央静脉管壁, 在肝硬化时Ⅰ型胶原的增生最为明显. Ⅳ型胶原并不是肝脏内沉积胶原的主要成分, Ⅳ型胶原的增生沉积并不是很突出, 但其主要表达于肝窦基底膜, 其过度沉积增生可导致肝窦毛细血管化, 影响肝内外物质交换, 加重肝功能损害.
本研究结果显示, 模型实验组纤维化分级显著低于模型对照组(P<0.05). 与正常组比较, 模型对照组血清HA、LN浓度急剧增高(P<0.01). 模型实验组与模型对照组比较, 血清HA、LN浓度显著下降(P<0.01). 免疫组织化学结果显示模型实验组Ⅰ、Ⅳ型胶原在肝组织的沉积程度亦轻于模型对照组(P<0.01). 实验结果提示模型实验组大鼠肝纤维化程度有减轻. 原因可能与下述机制有关: 肝硬化时, 肝实质细胞变性坏死, 肝星状细胞被激活, 在多种细胞因子参与下, 导致细胞外基质的过度沉积, 降解减少, 尤以肝内结缔组织增生明显. 而VEGF与VEGFR-2结合后, 诱导肝组织肝窦内皮细胞分裂增殖, 促使肝内形成新生毛细血管, 新生血管能够穿过纤维隔代偿性增加肝实质细胞血氧和营养供应. 同时VEGF还减弱肝窦毛细血管化, 能促进肝窦内皮窗孔形成和基底膜的降解, 肝脏微循环改善, 改善肝细胞与肝窦血液间的物质交换[26,27]. 上述作用均会使受损的肝细胞功能得到修复, 逐渐恢复了肝细胞周围的细胞外基质的微环境, 削弱了一些有害因子对肝细胞的连续损伤, 阻止了肝星状细胞的增生和活化, 转化生长因子、血小板衍生生长因子等纤维化因子的表达下降, 抑制胶原基因的表达, 减少Ⅰ、Ⅲ型胶原成分的mRNA转录, 从而抑制细胞外基质成分的表达, 并减少胶原纤维的沉积. 与此同时肝细胞坏死减少, 也降低了由此引起的肝小叶纤维支架塌陷和纤维结缔组织增生.
本研究采用Alzet微渗泵缓释技术, 利用微渗泵经门静脉给予rr-VEGF165对肝硬化大鼠进行干预, 使药物只作用于肝脏, 减少全身的不良反应. 保证了VEGF以既定速率持续通过导管将药物输送到靶血管门静脉, 克服了VEGF半衰期短的缺点[28,29], 稳定药物浓度, 避免了重复给药, 减少了对实验动物的操作和应激, 其结果稳定、可靠[30], 目前国内外尚无相关报道. 跟传统抗纤维化疗法相比, 本研究中肝组织得到血氧供应, 大大降低了纤维结缔组织增生机会, 所以抗纤维化作用更加持久. 因此, 经门静脉灌注VEGF是一个减缓肝硬化大鼠肝纤维化程度的新方法, 值得进一步深入研究.
肝纤维化是慢性肝病发展成肝硬化重要的病理阶段, 肝硬化晚期常出现一系列致命并发症, 死亡率极高. 抗肝纤维化治疗对于肝硬化具有重要价值, 但对于肝纤维化的治疗尚缺乏理想的治疗方案, 目前临床抗纤维化的药物均有其不足之处, 有必要寻求一种抗纤维化的新方法.
刘绍能, 主任医师, 中国中医科学院广安门医院消化科
近年来, 肝脏的血管病变在肝硬化病程中的作用逐渐清晰, 有学者提出, 改善肝硬化血管病变将有助于减缓肝纤维化进程. 同时治疗性血管生成也成为研究新热点.
Xu等报道经门静脉转染VEGF质粒可以抑制肝硬化大鼠肝窦毛细血管化, 增加窗孔数目和肝窦内皮细胞通透性, 并有效的降低门静脉压力.
本研究利用微渗泵经门静脉给予VEGF对肝硬化大鼠进行干预, 使药物只作用于肝脏, 减少全身的不良反应. 保证了VEGF以既定速率持续通过导管将药物输送到靶血管门静脉, 克服了VEGF半衰期短的缺点, 稳定药物浓度, 避免了重复给药, 减少了对实验动物的操作和应激, 目前国内外尚无相关报道.
本实验结果表明, 应用外源性VEGF可以改善肝硬化大鼠肝纤维化程度, 为应用血管生成疗法对肝硬化的抗纤维化治疗开辟了一条新途径.
本文思路新颖, 设计合理, 有较好的可读性和科学价值.
编辑: 曹丽鸥 电编:何基才
| 1. | Ylä-Herttuala S. Gene therapy with vascular endothelial growth factors. Biochem Soc Trans. 2009;37:1198-1200. [PubMed] [DOI] |
| 2. | Senger DR. Vascular endothelial growth factor: much more than an angiogenesis factor. Mol Biol Cell. 2010;21:377-379. [PubMed] [DOI] |
| 3. | Thabut D, Shah V. Intrahepatic angiogenesis and sinusoidal remodeling in chronic liver disease: new targets for the treatment of portal hypertension? J Hepatol. 2010;53:976-980. [PubMed] [DOI] |
| 4. | Rosmorduc O, Housset C. Hypoxia: a link between fibrogenesis, angiogenesis, and carcinogenesis in liver disease. Semin Liver Dis. 2010;30:258-270. [PubMed] [DOI] |
| 6. | Nicoletti JN, Shah SK, McCloskey DP, Goodman JH, Elkady A, Atassi H, Hylton D, Rudge JS, Scharfman HE, Croll SD. Vascular endothelial growth factor is up-regulated after status epilepticus and protects against seizure-induced neuronal loss in hippocampus. Neuroscience. 2008;151:232-241. [PubMed] [DOI] |
| 7. | Goodman ZD. Grading and staging systems for inflammation and fibrosis in chronic liver diseases. J Hepatol. 2007;47:598-607. [PubMed] [DOI] |
| 8. | Mejias M, Garcia-Pras E, Tiani C, Miquel R, Bosch J, Fernandez M. Beneficial effects of sorafenib on splanchnic, intrahepatic, and portocollateral circulations in portal hypertensive and cirrhotic rats. Hepatology. 2009;49:1245-1256. [PubMed] [DOI] |
| 9. | Bosch J, Abraldes JG, Fernández M, García-Pagán JC. Hepatic endothelial dysfunction and abnormal angiogenesis: new targets in the treatment of portal hypertension. J Hepatol. 2010;53:558-567. [PubMed] [DOI] |
| 10. | Wu FT, Stefanini MO, Mac Gabhann F, Kontos CD, Annex BH, Popel AS. VEGF and soluble VEGF receptor-1 (sFlt-1) distributions in peripheral arterial disease: an in silico model. Am J Physiol Heart Circ Physiol. 2010;298:H2174-H2191. [PubMed] [DOI] |
| 11. | Zhou B, Poon MC, Pu WT, Han ZC. Therapeutic neovascularization for peripheral arterial diseases: advances and perspectives. Histol Histopathol. 2007;22:677-686. [PubMed] |
| 12. | Silva EA, Mooney DJ. Effects of VEGF temporal and spatial presentation on angiogenesis. Biomaterials. 2010;31:1235-1241. [PubMed] [DOI] |
| 13. | Golub JS, Kim YT, Duvall CL, Bellamkonda RV, Gupta D, Lin AS, Weiss D, Robert Taylor W, Guldberg RE. Sustained VEGF delivery via PLGA nanoparticles promotes vascular growth. Am J Physiol Heart Circ Physiol. 2010;298:H1959-H1965. [PubMed] [DOI] |
| 14. | Philippi C, Loretz B, Schaefer UF, Lehr CM. Telomerase as an emerging target to fight cancer--opportunities and challenges for nanomedicine. J Control Release. 2010;146:228-240. [PubMed] [DOI] |
| 15. | Wernike E, Montjovent MO, Liu Y, Wismeijer D, Hunziker EB, Siebenrock KA, Hofstetter W, Klenke FM. VEGF incorporated into calcium phosphate ceramics promotes vascularisation and bone formation in vivo. Eur Cell Mater. 2010;19:30-40. [PubMed] |
| 16. | Zhang J, Ding L, Zhao Y, Sun W, Chen B, Lin H, Wang X, Zhang L, Xu B, Dai J. Collagen-targeting vascular endothelial growth factor improves cardiac performance after myocardial infarction. Circulation. 2009;119:1776-1784. [PubMed] [DOI] |
| 17. | Deleve LD, Wang X, Guo Y. Sinusoidal endothelial cells prevent rat stellate cell activation and promote reversion to quiescence. Hepatology. 2008;48:920-930. [PubMed] [DOI] |
| 20. | Jaroszewicz J, Januszkiewicz M, Flisiak R, Rogalska M, Kalinowska A, Wierzbicka I. Circulating vascular endothelial growth factor and its soluble receptors in patients with liver cirrhosis: possible association with hepatic function impairment. Cytokine. 2008;44:14-17. [PubMed] [DOI] |
| 21. | Bozova S, Elpek GO. Hypoxia-inducible factor-1alpha expression in experimental cirrhosis: correlation with vascular endothelial growth factor expression and angiogenesis. APMIS. 2007;115:795-801. [PubMed] [DOI] |
| 22. | Brodsky SV, Mendelev N, Melamed M, Ramaswamy G. Vascular density and VEGF expression in hepatic lesions. J Gastrointestin Liver Dis. 2007;16:373-377. [PubMed] |
| 23. | Giatromanolaki A, Kotsiou S, Koukourakis MI, Sivridis E. Angiogenic factor expression in hepatic cirrhosis. Mediators Inflamm. 2007;2007:67187. [PubMed] |
| 24. | Vanheule E, Geerts AM, Van Huysse J, Schelfhout D, Praet M, Van Vlierberghe H, De Vos M, Colle I. An intravital microscopic study of the hepatic microcirculation in cirrhotic mice models: relationship between fibrosis and angiogenesis. Int J Exp Pathol. 2008;89:419-432. [PubMed] [DOI] |
| 26. | Xu H, Shi BM, Lu XF, Liang F, Jin X, Wu TH, Xu J. Vascular endothelial growth factor attenuates hepatic sinusoidal capillarization in thioacetamide-induced cirrhotic rats. World J Gastroenterol. 2008;14:2349-2357. [PubMed] [DOI] |
| 27. | Yokomori H, Oda M, Yoshimura K, Nagai T, Ogi M, Nomura M, Ishii H. Vascular endothelial growth factor increases fenestral permeability in hepatic sinusoidal endothelial cells. Liver Int. 2003;23:467-475. [PubMed] [DOI] |
| 28. | Kleinheinz J, Jung S, Wermker K, Fischer C, Joos U. Release kinetics of VEGF165 from a collagen matrix and structural matrix changes in a circulation model. Head Face Med. 2010;6:17. [PubMed] [DOI] |
| 29. | Emerich DF, Silva E, Ali O, Mooney D, Bell W, Yu SJ, Kaneko Y, Borlongan C. Injectable VEGF hydrogels produce near complete neurological and anatomical protection following cerebral ischemia in rats. Cell Transplant. 2010;19:1063-1071. [PubMed] [DOI] |
| 30. | Ortiz SG, Ma T, Epstein NJ, Smith RL, Goodman SB. Validation and quantification of an in vitro model of continuous infusion of submicron-sized particles. J Biomed Mater Res B Appl Biomater. 2008;84:328-333. [PubMed] [DOI] |