修回日期: 2011-06-29
接受日期: 2011-07-05
在线出版日期: 2011-07-18
目的: 探讨香菇多糖对DCF方案(多西他赛, 顺铂和5-氟尿嘧啶)治疗晚期胃癌疗效的影响.
方法: 将2007-01/2008-12诊治的80例Ⅲ-Ⅳ期晚期胃癌患者随机分成2组, 分别给予DCF方案(DCF组)和香菇多糖联合DCF方案(Len+DCF组)治疗, 分析2组患者的疗效、血常规、淋巴细胞亚群和生存质量差异.
结果: DCF组患者疾病控制率为75.0%, Len+DCF组为87.5%. Len+DCF组化疗的不良反应均低于DCF组, 其中在中性粒细胞减少、淋巴细胞减少、贫血、血小板减少和感染方面的差异具有统计学意义(P<0.05). 两组患者化疗前的血常规、淋巴细胞亚群和生存质量无明显差异. 化疗后, Len+DCF组的WBC、Lym、CD3+、CD4+、CD8+、NK细胞及生存质量显著高于DCF组(P<0.05), 而Hb和Plt无明显差异.
结论: 香菇多糖能显著提高晚期胃癌患者免疫功能, 减少不良反应, 提高生存质量, 显著增强DCF方案治疗晚期胃癌的疗效.
引文著录: 伍海鹰, 陈一明, 林龙, 林友刚, 邱庆安, 刘宁. 香菇多糖增强DCF方案治疗晚期胃癌40例. 世界华人消化杂志 2011; 19(20): 2176-2180
Revised: June 29, 2011
Accepted: July 5, 2011
Published online: July 18, 2011
AIM: To evaluate whether lentinan enhances the curative effects of the DCF (docetaxel, cisplatin and fluorouracil) regimen in patients with advanced gastric cancer.
METHODS: Eighty patients with stages III and IV gastric cancer who were treated at our hospital between January 2007 and December 2008 were randomly divided into two groups to receive DCF chemotherapy alone or DCF chemotherapy in combination with lentinan. The curative effects, routine blood parameters, lymphocyte subsets and quality of life were compared between the two groups.
RESULTS: The disease control rate was significantly higher in the lentinan plus DCF group than in the DCF group (87.5% vs 75.0%, P < 0.05), while the incidence of side effects (including neutropenia, leukopenia, anemia, thrombocytopenia and infection) was significantly lower in the lentinan plus DCF group than in the DCF group (P < 0.05). No significant differences were noted in routine blood parameters, lymphocyte subsets and quality of life before chemotherapy between the two groups (all P > 0.05). After chemotherapy, the numbers of WBC, lymphocytes, CD3+, CD4+, CD8+, NK cells and quality of life were significantly improved in the lentinan plus DCF group compared to the DCF group (all P < 0.05).
CONCLUSION: Lentinan significantly enhanced the efficacy and safety of the DCF regimen in patients with advanced gastric cancer.
- Citation: Wu HY, Chen YM, Lin L, Lin YG, Qiu QA, Liu N. Lentinan enhances the efficacy of the DCF regimen in patients with advanced gastric cancer: an analysis of 40 cases. Shijie Huaren Xiaohua Zazhi 2011; 19(20): 2176-2180
- URL: https://www.wjgnet.com/1009-3079/full/v19/i20/2176.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i20.2176
机体免疫功能低下导致无法清除癌变细胞而发生恶性肿瘤, 目前认为细胞免疫在抗肿瘤发生中扮演重要角色, 其中淋巴细胞在肿瘤免疫中起着中心调控作用[1-3]. 研究表明, 胃癌细胞分泌细胞因子抑制免疫细胞增殖、分化和成熟, 诱导免疫耐受状态[4], 因此提高机体免疫对清除肿瘤细胞具有重要意义[5,6]. 香菇多糖作为典型的T淋巴细胞激活剂, 可显著增强机体免疫功能, 提高化疗药物的抗肿瘤作用[7,8]. 本研究采用香菇多糖联合DCF方案治疗晚期胃癌, 探讨其对患者疗效、血常规、淋巴细胞亚群和生存质量的影响.
研究对象为2007-01/2008-12本科室诊治的80例Ⅲ-Ⅳ期初治晚期胃癌患者, 按照随机对照原则分为DCF组(40例)和香菇多糖联合DCF方案(Len+DCF组)(40例). 患者均经影像学、病理组织学检查确诊为晚期胃癌, 预计生存期>3 mo, 无心、肝、肺等重要器官功能异常而不能耐受化疗, Karnofsky评分≥70分. DCF组患者男24例, 女16例, 年龄55-80(平均67.9±8.1)岁, Ⅲ期19例, Ⅳ期21例; Len+DCF组患者男25例, 女15例, 年龄56-78(平均67.5±7.2)岁, Ⅲ期20例, Ⅳ期20例. 2组患者在性别、年龄和TNM分期的差异无统计学意义(均P>0.05).
1.2.1 各组用药方案: 80例晚期胃癌患者在常规支持对症治疗的基础上接受化疗治疗. DCF组: 多西他赛75 mg/m2, 静脉注射, d1; 顺铂100 mg/m2, 静脉滴注, d1; 5-氟尿嘧啶1 000 mg/(m2•d), 静脉滴注, d1-d5, 每4 wk为一个疗程. Len+DCF组患者在DCF方案治疗的基础上, 给予香菇多糖(天地欣)1 mg加入250 mL生理盐水静脉滴注, 2次/wk.
1.2.2 疗效及毒性评价: 疗效评价参考国际抗癌联盟(UICC)实体瘤的疗效评价标准RECIST, 测量瘤体最大径计算肿瘤大小. 完全缓解(complete remission, CR): 肿瘤完全消失或无新的肿瘤出现, 肿瘤指标下降到正常; 部分缓解(partial remission, PR): 单一或数个最长直径总数减少≥30%; 病情稳定(stable disease, SD): 肿瘤有缩小, 但没到PR程度; 肿瘤长大, 还没到PD程度; 疾病进展(progressive disease, PD): 单一或数个肿瘤最长直径总数增加≥20%, 或有新的肿瘤出现. 疾病控制率为CR+PR+SD. 化疗药物毒性不良反应按照WHO抗癌药急性及亚急性毒性分级标准分为Ⅰ-Ⅳ级, 在化疗疗程结束后, 根据临床观察和实验室检查结果对不良反应进行全面评价.
1.2.3 观察指标: 在化疗前、化疗1、3和6 mo检测患者外周血白细胞(white blood cell, WBC)、淋巴细胞(lymphocyte, Lym)、血红蛋白(hemoglobin, Hb)和血小板(platelet, Plt)、T淋巴细胞亚群(CD3+、CD4+、CD8+和NK细胞). 采用欧洲癌症研究与治疗组织研制的生命质量测定量表EORTC QLQ-STO22对患者进行生存质量评价.
统计学处理 采用SPSS12.0进行数据处理和统计学分析. 计量资料采用mean±SD表示, 采用t检验, 计数资料采用χ2检验. 采用Kaplan-Meier法进行生存分析, Log-rank法检验差异. 检验水准α = 0.05, P<0.05差异有统计学意义.
80例患者均完成治疗计划, 无病例死亡. DCF组患者CR 5例, PR 11例, SD 14例, PD 10例, 疾病控制率为75.0%; Len+DCF组患者CR 9例, PR 17例, SD 9例, PD 5例, 疾病控制率为87.5%, Len+DCF组的疾病控制率高于DCF组. Len+DCF组化疗的不良反应均低于DCF组, 其中在中性粒细胞减少、淋巴细胞减少、贫血、血小板减少和感染等方面的差异具有统计学意义(P<0.05), 而在胃肠道反应、口腔黏膜炎、嗜睡和周围神经炎等方面的差异无统计学意义(P>0.05, 表1).
| 不良反应 | DCF组(n) | Len+DCF组(n) | P值 | ||
| Ⅰ-Ⅱ级 | Ⅲ-Ⅳ级 | Ⅰ-Ⅱ级 | Ⅲ-Ⅳ级 | ||
| 中性粒细胞减少 | 23 | 12 | 15 | 7 | 0.023 |
| 淋巴细胞减少 | 11 | 9 | 8 | 3 | 0.037 |
| 贫血 | 8 | 5 | 5 | 2 | 0.018 |
| 血小板减少 | 5 | 3 | 2 | 1 | 0.024 |
| 胃肠道反应 | 19 | 18 | 21 | 11 | 0.575 |
| 口腔黏膜炎 | 9 | 7 | 7 | 6 | 0.432 |
| 嗜睡 | 7 | 5 | 6 | 4 | 0.614 |
| 感染 | 7 | 3 | 4 | 1 | 0.003 |
| 周围神经炎 | 5 | 2 | 4 | 2 | 0.872 |
两组患者化疗前的血常规和淋巴细胞亚群无明显差异(均P>0.05). 化疗后的各指标均降低, Len+DCF组的WBC、Lym、CD3+、CD4+、CD8+和NK细胞均显著高于DCF组(P<0.05), 而Hb和Plt无明显差异(P>0.05, 表2, 3).
| 指标 | 分组 | 化疗前 | 化疗1 mo | 化疗3 mo | 化疗6 mo |
| WBC(×109) | DCF组 | 6.7±1.6 | 5.3±0.6a | 4.6±0.8a | 4.2±1.1a |
| Len+DCF组 | 6.6±1.5 | 5.8±0.5 | 5.5±0.9 | 5.4±1.2 | |
| Lym(×109) | DCF组 | 3.0±0.8 | 1.8±0.4a | 1.4±0.5a | 1.2±0.4a |
| Len+DCF组 | 3.0±0.7 | 2.2±0.7 | 1.9±0.4 | 1.8±0.7 | |
| Hb(g/L) | DCF组 | 146.7±5.7 | 141.3±8.5 | 136.3±6.5 | 130.1±4.6 |
| Len+DCF组 | 146.1±5.4 | 145.1±7.6 | 140.1±5.6 | 136.2±6.2 | |
| Plt(×109) | DCF组 | 205.1±23.3 | 184.5±15.7 | 164.2±11.2 | 144.6±9.2 |
| Len+DCF组 | 208.2±19.7 | 193.3±11.4 | 173.5±10.8 | 150.8±11.5 |
| 淋巴细胞亚群 | 分组 | 化疗前 | 化疗1 mo | 化疗3 mo | 化疗6 mo |
| CD3+ | DCF组 | 67.5±3.5 | 62.3±2.0a | 57.3±1.8a | 52.4±2.8a |
| Len+DCF组 | 67.4±3.6 | 65.1±1.9 | 60.1±2.2 | 56.3±2.1 | |
| CD4+ | DCF组 | 35.2±2.2 | 30.1±1.8a | 26.1±2.3a | 25.7±1.7a |
| Len+DCF组 | 35.4±2.8 | 32.9±2.1 | 29.5±1.5 | 28.4±2.4 | |
| CD8+ | DCF组 | 29.2±3.4 | 25.3±2.1a | 18.3±2.3a | 12.7±3.1a |
| Len+DCF组 | 29.5±3.1 | 27.8±1.6 | 21.2±2.2 | 17.2±3.6 | |
| NK | DCF组 | 18.7±1.3 | 14.3±0.8a | 10.1±0.5a | 6.7±1.1a |
| Len+DCF组 | 18.9±1.4 | 15.5±0.6 | 13.8±0.6 | 10.5±1.4 |
2组患者化疗前的生存质量无明显差异(P>0.05), Len+DCF组患者化疗1、3和6 mo的生存质量评分均低于DCF组, Len+DCF组患者生活质量显著高于DCF组(P<0.05, 表4).
| 分组 | 化疗前 | 化疗后(mo) | ||
| 1 | 3 | 6 | ||
| DCF组 | 67.1±3.5 | 56.4±2.6 | 45.3±2.1 | 36.4±3.8 |
| Len+DCF组 | 67.0±3.1 | 51.2±2.8 | 37.6±2.7 | 28.1±3.2 |
| t值 | 0.135 | 8.607 | 14.237 | 10.567 |
| P值 | 0.893 | <0.001 | <0.001 | <0.001 |
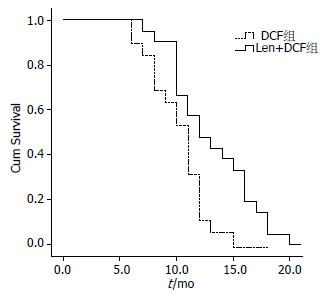
DCF组患者肿瘤进展时间为5.5 mo, 中位总生存期为9.3 mo; Len+DCF组患者肿瘤进展时间为7.2 mo, 中位总生存期为11.6 mo, Len+DCF组患者肿瘤进展时间和中位总生存期均显著高于DCF组患者(P<0.05, 图1).
肿瘤细胞与宿主免疫系统相互作用在肿瘤的发生、发展和转移过程中起到关键作用. 免疫系统可清除发生癌变的细胞或抑制肿瘤的发展及转移, 肿瘤自身和其标志物可诱发机体抗肿瘤的细胞免疫和体液免疫, 而肿瘤细胞的基因突变和免疫原性改变形成局部组织抑制性微环境[9,10]. 这种平衡一旦受到破坏, 肿瘤细胞增殖失去调控, 宿主免疫系统受抑, 导致患者的免疫功能进一步降低, T淋巴细胞介导的细胞免疫受到抑制, 主要表现为CD3+、CD4+和CD8+细胞数目降低[11]. 因此, 在肿瘤的治疗中应用免疫增强剂, 可显著减少化疗药物相关的免疫抑制, 提高机体的免疫功能, 增强对肿瘤细胞的清除作用, 显著提高化疗疗效[12,13].
香菇多糖的主要成分为甘露糖甘肽, 其余为多种糖分和各种氨基酸等, 是典型的T淋巴细胞激活剂, 促进T、B淋巴细胞增殖, 提高NK细胞活性, 体内外均能促进细胞毒T淋巴细胞(cytotoxic T lymphocyte, CTL)的产生, 提高CTL细胞杀伤力, 增强正常或免疫功能低下小鼠的迟发型超敏反应, 提高抗体依赖性细胞毒作用, 同时能结合到人单核细胞上激活内源性信号传导通路[14]. 作为免疫增强的辅助药物, 香菇多糖体外可促进顺铂对胃癌细胞增殖的抑制作用[15], 与化疗药物联合使用有减毒增效的作用, 在治疗胰腺癌[16]、肝癌[17]、结肠癌[18]等肿瘤具有良好疗效, 显著延长肿瘤患者的生存时间. 目前认为香菇多糖的免疫调节功能是抗肿瘤作用的基础.
目前对晚期胃癌尚无疗效显著的化疗药物, 减少患者痛苦及提高生存质量为主要治疗目的. 本研究表明, 香菇多糖对晚期胃癌患者的淋巴细胞亚群具有显著的促进增殖作用, DCF化疗方案能显著降低胃癌患者淋巴细胞亚群的数目, 而香菇多糖能显著改善该状况, 减少了升白细胞药物的使用. 与DCF组患者相比, Len+DCF组患者化疗后的WBC、Lym、CD3+、CD4+、CD8+和NK细胞均显著高于DCF组(P<0.05), 而化疗毒性不良反应降低, 特别是免疫相关的不良反应显著降低, 极大纠正化疗对患者外周血白细胞和淋巴细胞的抑制作用, 提高患者的生存质量和生存期, 疗效高于Van Cutsem等[19]报道的DCF方案治疗晚期胃癌的疗效.
总之, 香菇多糖作为一种免疫增强剂, 与DCF方案联合应用可显著提高机体免疫功能, 提高患者对化疗药物毒性的耐受力, 减少化疗毒性不良反应, 提高晚期胃癌的综合治疗效果, 在治疗晚期胃癌方面具有广阔的应用前景, 但本研究病例数较少, 有待于大规模临床试验验证.
胃癌细胞分泌细胞因子抑制免疫细胞增殖、分化和成熟, 诱导免疫耐受状态, 因此提高机体免疫对清除肿瘤细胞具有重要意义.
宛新建, 副教授, 上海市第一人民医院消化内科
本文采用香菇多糖联合DCF方案治疗晚期胃癌, 探讨其对患者疗效、血常规、淋巴细胞亚群和生存质量的影响, 从增强患者免疫角度探讨香菇多糖增强DCF治疗晚期胃癌疗效的机制.
本研究揭示香菇多糖可显著提高晚期胃癌患者淋巴细胞数目, 减少DCF化疗药物的不良反应, 显著提高患者的生存质量和时间, 为香菇多糖治疗恶性肿瘤提供客观证据.
本文选题密切结合临床实践, 设计较合理, 病例资料较丰富, 统计学基本符合要求, 有一定的临床指导意义.
编辑: 李军亮 电编:何基才
| 1. | Speiser DE, Romero P. Molecularly defined vaccines for cancer immunotherapy, and protective T cell immunity. Semin Immunol. 2010;22:144-154. [PubMed] [DOI] |
| 2. | Yaqub S, Aandahl EM. Inflammation versus adaptive immunity in cancer pathogenesis. Crit Rev Oncog. 2009;15:43-63. [PubMed] |
| 3. | Rubin B. Natural immunity has significant impact on immune responses against cancer. Scand J Immunol. 2009;69:275-290. [PubMed] [DOI] |
| 4. | 赵 敬柱, 张 汝鹏, 津 浦, 李 慧, 王 刚, 王 学军, 薛 强, 昉 璇, 任 秀宝. 胃癌微环境中免疫活性细胞与患者预后的关系. 中国肿瘤临床. 2010;37:1290-1292. |
| 5. | He S, Wang L, Wu Y, Li D, Zhang Y. CCL3 and CCL20-recruited dendritic cells modified by melanoma antigen gene-1 induce anti-tumor immunity against gastric cancer ex vivo and in vivo. J Exp Clin Cancer Res. 2010;29:37. [PubMed] [DOI] |
| 6. | Li YL, Wu YG, Wang YQ, Li Z, Wang RC, Wang L, Zhang YY. Bone marrow-derived dendritic cells pulsed with tumor lysates induce anti-tumor immunity against gastric cancer ex vivo. World J Gastroenterol. 2008;14:7127-7132. [PubMed] [DOI] |
| 8. | 朱 江, 周 桂萍. 香菇多糖联合化疗治疗中晚期肺癌疗效观察. 中国中西医结合急救杂志. 2011;18:37. |
| 9. | Preston CC, Goode EL, Hartmann LC, Kalli KR, Knutson KL. Immunity and immune suppression in human ovarian cancer. Immunotherapy. 2011;3:539-556. [PubMed] [DOI] |
| 10. | Sanchez CJ, Le Treut T, Boehrer A, Knoblauch B, Imbert J, Olive D, Costello RT. Natural killer cells and malignant haemopathies: a model for the interaction of cancer with innate immunity. Cancer Immunol Immunother. 2011;60:1-13. [PubMed] [DOI] |
| 11. | Palucka K, Ueno H, Fay J, Banchereau J. Dendritic cells and immunity against cancer. J Intern Med. 2011;269:64-73. [PubMed] [DOI] |
| 12. | Gattinoni L, Ji Y, Restifo NP. Wnt/beta-catenin signaling in T-cell immunity and cancer immunotherapy. Clin Cancer Res. 2010;16:4695-4701. [PubMed] [DOI] |
| 13. | Yoshino S, Watanabe S, Imano M, Suga T, Nakazawa S, Hazama S, Oka M. Improvement of QOL and prognosis by treatment of superfine dispersed lentinan in patients with advanced gastric cancer. Hepatogastroenterology. 2010;57:172-177. [PubMed] |
| 14. | Kurita K, Matsumura Y, Takahara H, Hatta K, Shimojoh M. Synthesis and Macrophage Activation of Lentinan-Mimic Branched Amino Polysaccharides: Curdlans Having N-Acetyl-d-glucosamine Branches. Biomacromolecules. 2011;12:2267-2274. [PubMed] [DOI] |
| 16. | Shimizu K, Watanabe S, Watanabe S, Matsuda K, Suga T, Nakazawa S, Shiratori K. Efficacy of oral administered superfine dispersed lentinan for advanced pancreatic cancer. Hepatogastroenterology. 2009;56:240-244. [PubMed] |
| 17. | Isoda N, Eguchi Y, Nukaya H, Hosho K, Suga Y, Suga T, Nakazawa S, Sugano K. Clinical efficacy of superfine dispersed lentinan (beta-1,3-glucan) in patients with hepatocellular carcinoma. Hepatogastroenterology. 2009;56:437-441. [PubMed] |
| 18. | Hazama S, Watanabe S, Ohashi M, Yagi M, Suzuki M, Matsuda K, Yamamoto T, Suga Y, Suga T, Nakazawa S. Efficacy of orally administered superfine dispersed lentinan (beta-1,3-glucan) for the treatment of advanced colorectal cancer. Anticancer Res. 2009;29:2611-2617. [PubMed] |
| 19. | Van Cutsem E, Moiseyenko VM, Tjulandin S, Majlis A, Constenla M, Boni C, Rodrigues A, Fodor M, Chao Y, Voznyi E. Phase III study of docetaxel and cisplatin plus fluorouracil compared with cisplatin and fluorouracil as first-line therapy for advanced gastric cancer: a report of the V325 Study Group. J Clin Oncol. 2006;24:4991-4997. [PubMed] [DOI] |