修回日期: 2011-06-26
接受日期: 2011-07-05
在线出版日期: 2011-07-18
目的: 探讨GRIM-19在肝细胞癌组织中表达的临床意义.
方法: 用RT-PCR检测40例肝细胞癌及非癌组织中GRIM-19 mRNA表达水平, 用免疫组织化学pv二步法和Western blot检测40例肝细胞癌及非癌组织中GRIM-19蛋白的表达情况, 分析GRIM-19与临床病理特征的关系.
结果: GRIM-19 mRNA在肝细胞癌的表达明显低于非癌组织(0.40±0.31 vs 0.56±0.67, P<0.05). GRIM-19蛋白主要定位于细胞质, 肝细胞癌中的阳性率明显低于非癌组织(47.5% vs 80%, P<0.05). GRIM-19蛋白在肝细胞癌的表达低于非癌组织(0.30±0.29 vs 0.57±0.10, P<0.05). 在肝细胞癌组织中, GRIM-19的表达在临床分期为Ⅰ+Ⅱ与Ⅲ+Ⅳ组间、门脉有癌栓与无癌栓组间均有统计学差别(0.57±0.38 vs 0.30±0.20; 0.04±0.02 vs 0.44±0.32, 均P<0.05); GRIM-19的表达与AFP数值呈负相关(r = -0.352, P<0.05).
结论: GRIM-19表达下降, 是肝细胞癌发生过程的重要事件, 可能与肝细胞癌的发生、发展、侵袭等有关.
引文著录: 赵延大, 李菲菲, 任万华, 秦成勇. GRIM-19在肝细胞癌组织中的表达及临床意义. 世界华人消化杂志 2011; 19(20): 2123-2127
Revised: June 26, 2011
Accepted: July 5, 2011
Published online: July 18, 2011
AIM: To investigate the clinical significance of expression of gene associated with retinoid-interferon-induced mortality-19 (GRIM-19) in hepatocellular carcinoma (HCC).
METHODS: The expression of GRIM-19 mRNA and protein in 40 cases of HCC tissues and matched non-cancerous tissues was detected by reverse transcription-polymerase chain reaction (RT-PCR), immunohistochemistry and Western blot. The correlation between GRIM-19 expression and clinicopathologic features of HCC was analyzed statistically.
RESULTS: The expression of GRIM-19 mRNA was significantly lower in HCC than in matched non-cancerous tissue (0.40 ± 0.31 vs 0.56 ± 0.67, P < 0.05). The positive rate of GRIM-19 protein expression in HCC was significantly lower than that in matched non-cancerous tissue (47.5% vs 80%, P < 0.05). The expression level of GRIM-19 protein was also significantly lower in HCC than in matched non-cancerous tissue (0.30 ± 0.29 vs 0.57 ± 0.10, P < 0.05). GRIM-19 expression differed significantly between patients with stages I + II disease and those with stages III+IV disease (0.57 ± 0.38 vs 0.30 ± 0.20, P < 0.05) as well as between patients with and without portal vein thrombosis (0.04 ± 0.02 vs 0.44 ± 0.32, P < 0.05). The expression of GRIM-19 was negatively correlated with serum AFP (r = -0.352, P < 0.05).
CONCLUSION: Decreased GRIM-19 expression is probably a significant event in the carcinogenesis of HCC and may be associated with tumor development, progression and invasion.
- Citation: Zhao YD, Li FF, Ren WH, Qin CY. Clinical significance of GRIM-19 expression in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2011; 19(20): 2123-2127
- URL: https://www.wjgnet.com/1009-3079/full/v19/i20/2123.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i20.2123
洋干扰素/维甲酸联合应用诱导凋亡的相关基因19(genes associated with retinoid-interferon- induced mortality 19, GRIM-19)是一种凋亡调节基因, 他可以提高细胞对干扰素(interferon, IFN)及全反式维甲酸(retinoic acid, RA)诱导的死亡的敏感性, 从而抑制肿瘤细胞的增殖. 促进凋亡[1]. 研究证实, 他在人类多种正常组织中均有表达[1], 而在肺癌、结直肠癌等肿瘤组织中的表达明显减低[2,3]. GRIM-19在肝细胞癌中表达情况的研究, 国内、外尚未见报道, 本研究通过检测40例肝细胞癌患者癌及其非癌组织中GRIM-19的表达及定位, 分析其与临床病理特征的关系, 并进一步探讨GRIM-19在肝细胞癌发生、发展中的意义.
收集山东大学附属省立医院肝胆外科2010-04/2010-12经手术切除的、术后病理诊断为肝细胞癌的40例患者的癌及非癌组织(肉眼正常且距离肿瘤组织边缘5 cm以上), 于手术切除后尽快采集, 存于-80 ℃冰箱. 患者年龄38-81岁, 中位年龄58岁. 肿瘤分级采用Edmondsrr steiner分级法: 1、2级36例, 3、4级4例. 肿瘤分期根据国际抗癌联盟(UICC, 2003)的TNM分期, Ⅰ、Ⅱ期24例, Ⅲ、Ⅳ期16例. GRIM-19鼠多抗(abcam, Hong Kong); 小鼠超敏二步法免疫组织化学检测试剂、DAB试剂盒、β-actin鼠单抗、辣根酶标记山羊抗小鼠IgG(北京中杉金桥); RIPA裂解液、超敏ECL化学发光试剂盒(碧云天); BCA-100蛋白质定量测定试剂盒(上海博彩); TRIzol RNA提取试剂(北京全式金); RT-PCR试剂盒(TaKaRa); PCR引物(南京金瑞思).
1.2.1 RT-PCR: 取约50 mg组织应用TRIzol法常规提取总RNA. 测定RNA浓度后, 取500 ng总RNA, 随机引物法逆转录合成cDNA. 以β-actin为内参照, 进行PCR扩增, GRIM-19特异性引物上游序列: 5'-GACTACAAACGGAACTTGCC-3', 下游: 5'-GAGCCTCCTCTGTGGTGC-3', 扩增片段长度343 bp. β-actin特异性引物上游序列: 5'-CTGGGACGACATGGAGAAAA-3', 下游: 5'- AAGGAAGGCTGGAAGAGTGC-3', 扩增片段长度564 bp. 反应条件: 95 ℃预变性2 min, 35个循环(94 ℃ 30 s, 55℃ 30 s, 72 ℃ 34 s), 72 ℃充分延伸10 min. 取扩增产物于2%琼脂糖凝胶中电泳, 然后置于紫外光可见分析装置中拍照.
1.2.2 免疫组织化学: 组织经固定、脱水、浸蜡、包埋, 4 μm厚切片. 常规脱蜡和水化后, 高温高压修复, 加3%过氧化氢37 ℃孵育30 min, 加一抗4 ℃过夜, 37 ℃复温30 min, 加Poly Helper 37 ℃孵育30 min, 加二抗37 ℃孵育30 min. DAB显色, 苏木精复染, 脱水、分化、封片观察. 各步间用PBS冲洗3次, 每次5 min. 染色结果参照Fromowitz等综合分类法, 阳性细胞按百分比分为0-3分, 阳性信号强度分为0-3分, 两项分值相加, 总分0-1分为阴性(-), 2分为弱阳性(+), 3-4分为中度阳性(++), 5-6分为强阳性(+++)[4].
1.2.3 Western blot: 取约50 mg组织研磨、裂解、 离心, 上清液用蛋白定量试剂盒测定浓度后, 加热变性. 取50 μg总蛋白, 行SDS-PAGE电泳分离(15%的分离胶), 电转移于PVDF膜上, 脱脂牛奶封闭, 再分别加入GRIM-19鼠多抗(1:400)、内参β-actin(1:800), 4 ℃过夜, 山羊抗小鼠二抗(1:8 000)反应1 h. 用ECL化学发光试剂盒检测杂交信号.
统计学处理 RT-PCR及Western blot条带的灰度值用Image J软件分析. 计量数据用mean±SD表示, 用SPSS16.0软件进行统计分析, 两组均数比较用t检验, 关联性分析用Pearson相关检验. 以P<0.05为差异有统计学意义.
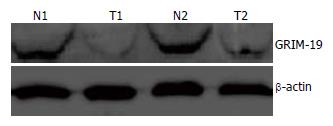
GRIM-19、β-actin条带与DNA ladder约340 bp、560 bp处对应, GRIM-19/β-actin mRNA的灰度比值明显低于相应非癌组织(0.40±0.31 vs 0.56±0.67, P<0.05, 图1).
临床分期为Ⅲ、Ⅳ期的肝细胞癌GRIM-19 mRNA表达明显低于Ⅰ、Ⅱ期(0.30±0.20 vs 0.57±0.38, P<0.05), 有门脉癌栓者明显低于无门脉癌栓者(0.04±0.02 vs 0.44±0.32, P<0.05), 而与性别、肿瘤大小、肝硬化、转移、组织分级无关(P>0.05, 表1). 此外, 经Pearson检验, GRIM-19 mRNA表达与年龄无关(r = 0.219, P>0.05), 而与AFP数值大小呈负相关(r = -0.352, P<0.05).
| 临床病理特征 | n | GRIM-19/β-actin (灰度比值) | P值 |
| 性别 | |||
| 男 | 32 | 0.42±0.34 | 0.903 |
| 女 | 8 | 0.34±0.16 | |
| 肿瘤大小(cm) | |||
| ≤5 | 24 | 0.45±0.33 | 0.098 |
| >5 | 16 | 0.29±0.19 | |
| 肝硬化 | |||
| 有 | 22 | 0.47±0.36 | 0.094 |
| 无 | 18 | 0.32±0.21 | |
| 门脉癌栓 | |||
| 有 | 5 | 0.04±0.02 | 0.001 |
| 无 | 35 | 0.44±0.32 | |
| 转移 | |||
| 有 | 8 | 0.32±0.28 | 0.456 |
| 无 | 32 | 0.42±0.32 | |
| HBeAg | |||
| 阳性 | 15 | 0.43±0.40 | 0.774 |
| 阴性 | 25 | 0.39±0.27 | |
| 组织分级 | |||
| 1+2 | 36 | 0.42±0.31 | 0.219 |
| 3+4 | 4 | 0.14±0.01 | |
| 临床分期 | |||
| Ⅰ+Ⅱ | 24 | 0.57±0.38 | 0.022 |
| Ⅲ+Ⅳ | 16 | 0.30±0.20 |
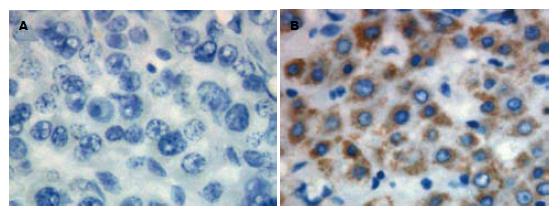
肝细胞癌和非癌组织中GRIM-19蛋白的表达主要定位于细胞质, 表现为不同染色程度的棕黄色颗粒. GRIM-19在非癌组织中的阳性率为80%(32/40), 在肝细胞癌中的阳性率为47.5%(19/40), 肝细胞癌中GRIM-19蛋白的阳性率明显低于其非癌组织(P<0.05, 图2).
40例肝细胞癌和非癌组织均有GRIM-19表达, 经曝光1 000 s, 16 000 Da位置有相应条带, 肝细胞癌组织中GRIM-19/β-actin灰度比值明显低于非癌组织(0.30±0.29 vs 0.57±0.10, P<0.05, 图3). GRIM-19蛋白表达与肝细胞癌的临床分期、门脉癌栓、AFP有关(P<0.05), 与其他临床病理特征无关.
原发性肝癌(绝大部分是肝细胞癌)是世界上最常见的恶性肿瘤之一, 在东亚的发病率特别高[5], 在我国为死亡率第二位的恶性肿瘤[6]. 完善肝细胞癌发病机制以更好地指导治疗显得尤为重要. GRIM-19等肿瘤相关基因及因子的发现, 为阐明肝细胞癌发病机制奠定了基础.
GRIM-19是2000年由Angell等[1]应用反义基因敲除的方法分离发现的一种细胞凋亡调节基因, 定位于人染色体19p13.2[7,8], 可编码一种16 000 Da的小分子蛋白[9]. 有学者认为GRIM-19是一种抑癌基因[10,11], 基于以下理由: (1)IFN/RA均能抑制肿瘤生长, 并被用于一些肿瘤的治疗[12-14]; (2)IFN/RA使乳腺癌细胞系中GRIM-19 mRNA及蛋白表达均增加, IFN/RA致GRIM-19过表达可引起细胞凋亡, GRIM-19抑制剂促进细胞生长[10]; (3)人染色体19p13.2是前列腺肿瘤抑制基因[8]及散发性、家族性甲状腺癌杂合性丢失的关键区域[15,16]. 另有研究表明, GRIM-19可以特异性地与STAT3结合. 阻断细胞质内的STAT3进人细胞核, 通过下调STAT3的转录激活活性, 抑制其靶基因的表达和细胞生长[17,18]; 同时参与病毒感染导致的癌变过程及多种肿瘤的形成[19]. 因此, 研究GRIM-19 mRNA、蛋白在肿瘤中的表达及作用, 具有重要的意义.
在GRIM-19 mRNA水平, 研究证实原发性肾细胞癌、肺癌、前列腺癌、子宫颈癌等肿瘤中均有不同程度的表达降低甚至缺失[20-23]; 而在脑胶质瘤中的表达明显高于正常脑组织[24]. 在本实验中, RT-PCR检测的肝细胞癌组织中GRIM-19 mRNA表达水平均明显低于非癌组织, 提示GRIM-19转录过程可能参与了肝细胞癌的发生、发展. 甲状腺肿瘤中已经发现了GRIM-19突变的现象[25], 肝细胞癌中是否存在类似的突变, 需进一步的研究证实.
在GRIM-19蛋白水平, 其细胞学定位是一个重要的方面. GRIM-19在细胞中的定位存有争议, Hu等[26]研究认为GRIM-19定位于细胞核; Huang等[27]认为GRIM-19主要定位于线粒体; 在结直肠癌、乳腺癌的研究中发现胞质、胞核均有GRIM-19的表达, 但胞质多于胞核[3,28]; 本实验发现GRIM-19在肝细胞癌及非癌组织中的阳性定位于细胞质, 这与"GRIM-19是线粒体复合物Ⅰ的亚基[29]"是相符的. GRIM-19在肝细胞中定位与其他组织存在一定差异的具体机制需进一步研究.
在GRIM-19蛋白水平, 其表达变化亦非常重要. 研究表明, GRIM-19蛋白在非小细胞肺癌、肺腺癌、口腔癌等肿瘤中表达明显降低[30-32], 而脑胶质瘤中表达升高[24]. 本实验中, 免疫组织化学检测的肝细胞癌中GRIM-19阳性率明显低于非癌组织; Western blot检测的肝细胞癌中GRIM-19表达水平明显低于非癌组织. 此结果提示: GRIM-19蛋白表达可能主要受其mRNA水平的影响, 亦可能存在上游调节子, 比如GW112, 他能与GRIM-19结合, 削弱通过干扰素/维甲酸通路诱导的细胞凋亡[33,34].
GRIM-19 mRNA、蛋白不仅在肝细胞癌中的表达方面有较好的一致性, 而且在与肝细胞癌临床病理特征的关系上有相同的结论: 二者均与临床分期、门脉癌栓、AFP有关联. 临床分期为Ⅲ、Ⅳ期者GRIM-19表达明显低于Ⅰ、Ⅱ期, 提示其与肝细胞癌的发生发展等生物学行为有关; 有门脉癌栓者GRIM-19表达明显减低, 说明其表达很可能与肝细胞癌的侵袭有关. AFP是一种具有抑制免疫细胞生长、促进各种肿瘤细胞增生功能的糖蛋白[35], 他在肝细胞癌中与GRIM-19的表达呈负相关, 提示二者可能共同参与了肝细胞癌的发生发展, 二者是否存在相互作用, 有待进一步研究.
总之, 本研究发现了GRIM-19mRNA及蛋白在肝细胞癌组织中的表达减低, 探讨了其与肝细胞癌临床病理特征的关系, 为进一步研究肝细胞癌的致病机制奠定了基础, 同时GRIM-19有希望成为肝细胞癌的诊断指标及其治疗的新靶标.
感谢山东大学附属省立医院中心实验室人员的大力支持与帮助.
GRIM-19被认为是凋亡调节基因和抑癌基因, 在一些肿瘤中已有较为深入的研究, 但在肝细胞癌中的表达及意义尚未明确.
于聪慧, 教授, 北京军区总医院肝胆外科
GRIM-19在肿瘤中的研究尚属未成熟阶段, 他在一些肿瘤中的表达及意义亟须阐明, 他在各种肿瘤发生发展中的作用及与其他肿瘤相关因子的关系成为研究的重点.
Hu等研究认为GRIM-19定位于细胞核; Huang等认为GRIM-19主要定位于线粒体.
本文首次揭示了GRIM-19在肝细胞癌中的表达及意义, 为进一步完善肝细胞癌发病机制奠定了基础.
肝细胞癌组织中GRIM-19表达减低, 其表达水平与肝细胞癌的临床分期、门脉癌栓、AFP有关.
本文选题尚可, 具有一定的新颖性和临床意义.
编辑: 李薇 电编:张洋
| 1. | Angell JE, Lindner DJ, Shapiro PS, Hofmann ER, Kalvakolanu DV. Identification of GRIM-19, a novel cell death-regulatory gene induced by the interferon-beta and retinoic acid combination, using a genetic approach. J Biol Chem. 2000;275:33416-33426. [PubMed] [DOI] |
| 5. | Jemal A, Siegel R, Ward E, Hao Y, Xu J, Thun MJ. Cancer statistics, 2009. CA Cancer J Clin. 2009;59:225-249. [PubMed] [DOI] |
| 7. | Hofmann ER, Boyanapalli M, Lindner DJ, Weihua X, Hassel BA, Jagus R, Gutierrez PL, Kalvakolanu DV. Thioredoxin reductase mediates cell death effects of the combination of beta interferon and retinoic acid. Mol Cell Biol. 1998;18:6493-6504. [PubMed] |
| 8. | Chidambaram NV, Angell JE, Ling W, Hofmann ER, Kalvakolanu DV. Chromosomal localization of human GRIM-19, a novel IFN-beta and retinoic acid-activated regulator of cell death. J Interferon Cytokine Res. 2000;20:661-665. [PubMed] [DOI] |
| 9. | Kalvakolanu DV. The GRIMs: a new interface between cell death regulation and interferon/retinoid induced growth suppression. Cytokine Growth Factor Rev. 2004;15:169-194. [PubMed] [DOI] |
| 10. | Moreira S, Correia M, Soares P, Máximo V. GRIM-19 function in cancer development. Mitochondrion. 2011; Jun 2. [Epub ahead of print]. [PubMed] |
| 11. | Kalvakolanu DV, Nallar SC, Kalakonda S. Cytokine-induced tumor suppressors: a GRIM story. Cytokine. 2010;52:128-142. [PubMed] [DOI] |
| 12. | Altucci L, Gronemeyer H. The promise of retinoids to fight against cancer. Nat Rev Cancer. 2001;1:181-193. [PubMed] [DOI] |
| 13. | Gresser I, Belardelli F. Endogenous type I interferons as a defense against tumors. Cytokine Growth Factor Rev. 2002;13:111-118. [PubMed] [DOI] |
| 14. | Ikeda H, Old LJ, Schreiber RD. The roles of IFN gamma in protection against tumor development and cancer immunoediting. Cytokine Growth Factor Rev. 2002;13:95-109. [PubMed] [DOI] |
| 15. | Prazeres HJ, Rodrigues F, Soares P, Naidenov P, Figueiredo P, Campos B, Lacerda M, Martins TC. Loss of heterozygosity at 19p13.2 and 2q21 in tumours from familial clusters of non-medullary thyroid carcinoma. Fam Cancer. 2008;7:141-149. [PubMed] [DOI] |
| 16. | Stankov K, Pastore A, Toschi L, McKay J, Lesueur F, Kraimps JL, Bonneau D, Gibelin H, Levillain P, Volante M. Allelic loss on chromosomes 2q21 and 19p 13.2 in oxyphilic thyroid tumors. Int J Cancer. 2004;111:463-467. [PubMed] [DOI] |
| 17. | Lufei C, Ma J, Huang G, Zhang T, Novotny-Diermayr V, Ong CT, Cao X. GRIM-19, a death-regulatory gene product, suppresses Stat3 activity via functional interaction. EMBO J. 2003;22:1325-1335. [PubMed] [DOI] |
| 18. | Kalakonda S, Nallar SC, Lindner DJ, Hu J, Reddy SP, Kalvakolanu DV. Tumor-suppressive activity of the cell death activator GRIM-19 on a constitutively active signal transducer and activator of transcription 3. Cancer Res. 2007;67:6212-6220. [PubMed] [DOI] |
| 20. | Alchanati I, Nallar SC, Sun P, Gao L, Hu J, Stein A, Yakirevich E, Konforty D, Alroy I, Zhao X. A proteomic analysis reveals the loss of expression of the cell death regulatory gene GRIM-19 in human renal cell carcinomas. Oncogene. 2006;25:7138-7147. [PubMed] [DOI] |
| 22. | Liu YB, Shen WG, Ge H, Gai XD, Lu LL, Zhao XJ. [Expressions of survivin and GRIM-19 in prostate cancer]. Zhonghua Nankexue. 2011;17:21-26. [PubMed] |
| 23. | 朱 靖, 卫 莹, 周 颖, 王 青元, 许 乾乾, 肖 卫华, 凌 斌. 子宫颈癌组织中GRIM-19的表达及其意义. 临床与实验病理学杂志. 2010;26:681-683. |
| 24. | Jin YH, Jung S, Jin SG, Jung TY, Moon KS, Kim IY. GRIM-19 Expression and Function in Human Gliomas. J Korean Neurosurg Soc. 2010;48:20-30. [PubMed] [DOI] |
| 25. | Máximo V, Botelho T, Capela J, Soares P, Lima J, Taveira A, Amaro T, Barbosa AP, Preto A, Harach HR. Somatic and germline mutation in GRIM-19, a dual function gene involved in mitochondrial metabolism and cell death, is linked to mitochondrion-rich (Hurthle cell) tumours of the thyroid. Br J Cancer. 2005;92:1892-1898. [PubMed] [DOI] |
| 26. | Hu J, Angell JE, Zhang J, Ma X, Seo T, Raha A, Hayashi J, Choe J, Kalvakolanu DV. Characterization of monoclonal antibodies against GRIM-19, a novel IFN-beta and retinoic acid-activated regulator of cell death. J Interferon Cytokine Res. 2002;22:1017-1026. [PubMed] [DOI] |
| 27. | Huang G, Lu H, Hao A, Ng DC, Ponniah S, Guo K, Lufei C, Zeng Q, Cao X. GRIM-19, a cell death regulatory protein, is essential for assembly and function of mitochondrial complex I. Mol Cell Biol. 2004;24:8447-8456. [PubMed] [DOI] |
| 28. | 荣 国华, 李 哲, 金 广超, 马 国辉, 孙 涛, 田 斌, 陈 连胜, 刘 惠萍, 王 晓. GRIM-19蛋白在乳腺癌组织中的表达及其意义. 中国普通外科杂志. 2010;19:1242-1245. |
| 29. | Murray J, Zhang B, Taylor SW, Oglesbee D, Fahy E, Marusich MF, Ghosh SS, Capaldi RA. The subunit composition of the human NADH dehydrogenase obtained by rapid one-step immunopurification. J Biol Chem. 2003;278:13619-13622. [PubMed] [DOI] |
| 31. | Wang T, Yan XB, Zhao JJ, Ye J, Jiang ZF, Wu DR, Xiao WH, Liu RY. Gene associated with retinoid-interferon-induced mortality-19 suppresses growth of lung adenocarcinoma tumor in vitro and in vivo. Lung Cancer. 2011;72:287-293. [PubMed] [DOI] |
| 32. | Zhou Y, Li M, Wei Y, Feng D, Peng C, Weng H, Ma Y, Bao L, Nallar S, Kalakonda S. Down-regulation of GRIM-19 expression is associated with hyperactivation of STAT3-induced gene expression and tumor growth in human cervical cancers. J Interferon Cytokine Res. 2009;29:695-703. [PubMed] [DOI] |
| 33. | Kalvakolanu DV. The GRIMs: a new interface between cell death regulation and interferon/retinoid induced growth suppression. Cytokine Growth Factor Rev. 2004;15:169-194. [PubMed] [DOI] |
| 34. | Zhang X, Huang Q, Yang Z, Li Y, Li CY. GW112, a novel antiapoptotic protein that promotes tumor growth. Cancer Res. 2004;64:2474-2481. [PubMed] [DOI] |
| 35. | de Paulo GA, Ardengh JC, Nakao FS, Ferrari AP. Treatment of esophageal varices: a randomized controlled trial comparing endoscopic sclerotherapy and EUS-guided sclerotherapy of esophageal collateral veins. Gastrointest Endosc. 2006;63:396-402; quiz 463. [PubMed] [DOI] |