修回日期: 2011-06-21
接受日期: 2011-06-28
在线出版日期: 2011-07-18
目的: 探讨ENT1在人肝癌细胞株中的表达特征及其临床意义.
方法: 人肝癌细胞HuH-7、HepG2、Hep3B并选择人乳腺癌细胞MCF-7为对照, 采用免疫荧光法检测细胞中ENT1的定位表达; RT-PCR法检测细胞中ENT1 mRNA的表达; CDKs特异性抑制剂干预人肝癌细胞HuH-7的细胞周期, RT-PCR法检测细胞不同周期ENT1 mRNA的表达特征.
结果: 3株人肝癌细胞膜上均可见ENT1的表达; 肝癌细胞中ENT1 mRNA的表达水平均高于乳腺癌细胞; 不同肝癌细胞株中ENT1 mRNA的表达水平存在差异(HuH-7: 0.756±0.019, HepG2: 0.469±0.041, Hep3B: 0.580±0.030, MCF-7: 0.356±0.029); 肝癌细胞被阻滞在G0/G1期后, ENT1 mRNA的表达水平明显上调(0.737±0.017 vs 0.345±0.027, P<0.05).
结论: 人肝癌细胞膜上普遍存在较高的ENT1表达, 不同的肝癌细胞及不同的细胞周期其表达均存在差异. ENT1在人肝癌细胞中的表达特征对临床化疗策略具有潜在的临床价值, 并为认识肝癌的耐药机制提供新的思路.
引文著录: 蒋星星, 傅华群, 巢映辉, 刘征宇. ENT1在人肝癌细胞中的表达特征及临床意义. 世界华人消化杂志 2011; 19(20): 2104-2108
Revised: June 21, 2011
Accepted: June 28, 2011
Published online: July 18, 2011
AIM: To investigate the expression characteristics of equilibrative nucleoside transporter 1 (ENT1) in human hepatocellular carcinoma (HCC) cell lines.
METHODS: Human HCC cell lines HuH-7, HepG2 and Hep3B, and the breast cancer cell line MCF7 were used in this study. ENT1 was localized by immunofluorescence staining. Before and after treatment with roscovitine, a cyclin-dependent kinase inhibitor, the expression of ENT1 mRNA in the above cell lines was detected by reverse transcription-polymerase chain reaction (RT-PCR).
RESULTS: ENT1 could be detected on the membrane of the three human HCC cell lines. The expression levels of ENT1 mRNA in HCC cell lines were higher than that in the breast cancer cell line (HuH-7: 0.756 ± 0.019; HepG2: 0.469 ± 0.041; Hep3B: 0.580 ± 0.030; MCF-7: 0.356 ± 0.029). The expression level of ENT1 mRNA differed significantly among the three human HCC cell lines. Treatment with roscovitine increased the expression level of ENT1 mRNA (0.737 ± 0.017 vs 0.345 ± 0.027, P < 0.05).
CONCLUSION: ENT1 was localized to the membrane of HCC cells. The expression levels of ENT1 mRNA vary among different HCC cell lines. Treatment with roscovitine increased the expression level of ENT1 mRNA in HCC cell lines.
- Citation: Jiang XX, Fu HQ, Chao YH, Liu ZY. Expression characteristics of ENT1 in human hepatocellular carcinoma cells. Shijie Huaren Xiaohua Zazhi 2011; 19(20): 2104-2108
- URL: https://www.wjgnet.com/1009-3079/full/v19/i20/2104.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i20.2104
核苷载体(nucleoside transporters, NTs)是分布在细胞膜上的一种载体蛋白, 对5-氟尿嘧啶、吉西他滨及阿糖胞苷等核苷类化疗药的细胞转运起着至关重要的作用[1]. 细胞膜NTs的表达水平, 直接决定了细胞内核苷类化疗药物的浓度, 从而影响核苷类药物的化疗效果. 平衡型核苷载体(equilibrative nucleoside transporters, ENTs)是核苷载体的一大类, 目前ENTs有4种亚型基因已得到证实, 即ENT1、ENT2、ENT3、ENT4[2]. 本文通过检测人肝癌细胞株中ENT1的表达特征, 对临床化疗策略具有潜在的临床价值, 并为认识肝癌的耐药机制提供新的思路.
人肝癌细胞株HuH-7、HepG2、Hep3B和人乳腺癌细胞株MCF-7购自中科院上海生物研究所细胞库; hENT1抗体购自Santa Cruz公司; TRIzol试剂购自Invitrogen公司, RT-PCR试剂盒购自TaKaRa公司; CDKs抑制剂Roscovitine购自美国Sigma公司; hENT1与β-actin引物由上海生物试剂公司合成; 引物序列号hENT1: 上游5'-CCTTCGGCTACTTTATCACA-3', 下游5'-GTCACGGCTGGAAACATC-3', β-actin: 上游5'-CGGGAAATCGTGCGTGAC-3', 下游5'-TGGAAGGTGGACAGCGAGG-3'. 两者引物扩增后产物理论长度为: hENT1 319 bp, β-actin 434 bp.
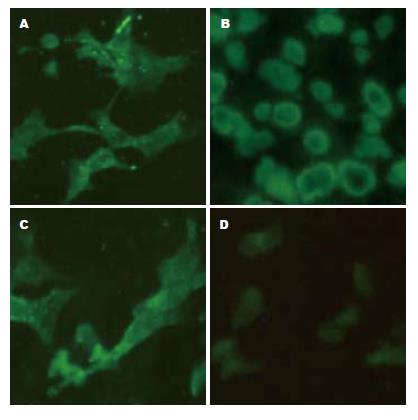
1.2.1 免疫荧光检测细胞膜hENT1的定位表达: 按照细胞爬片、固定、封闭、抗体孵育、封片及荧光检测的实验步骤进行, 实验设阴性对照组, 其不加一抗.
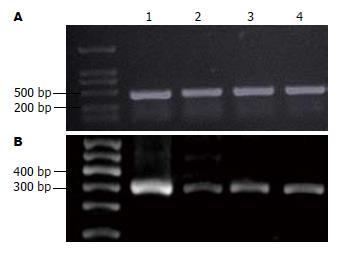
1.2.2 RT-PCR半定量检测细胞株hENT1 mRNA的表达: 总RNA按TRIzol试剂盒说明书进行提取, 测定RNA浓度并调整各细胞株RNA浓度基本一致后, 按TaKaRa公司试剂盒所提供的方法进行RT-PCR. RT-PCR的反应条件为: 94 ℃预变性3 min, 94 ℃变性40 s, 55 ℃退火40 s, 72 ℃延伸60 s, 共35个循环, 最后72 ℃延伸5 min. 反应产物用1%琼脂糖凝胶进行电泳(电压95 V, 时间30 min), 通过Gene Genius全自动凝胶成像系统读取目的电泳条带的斑点密度扫描值, 以各组β-actin条带的扫描值来标化其相应组hENT1 mRNA表达量.
1.2.3 流式细胞仪检测HuH-7细胞周期时相分布: 选取对数生长期细胞, 将细胞接种于2个培养瓶中; 培养24 h后换含有不同浓度的Roscovitine(对照组浓度为0 μmol/L, 实验组浓度为32 μmol/L)的培养液处理细胞, 培养24 h后, 制成单细胞悬液; 取1 mL细胞悬液, 4 ℃、1 000 r/min离心10 min, 弃上清; 加入1 mL冷PBS, 轻轻吹打使细胞悬浮, 4 ℃、1 000 r/min离心10 min, 弃上清; 重复悬浮3次; 将细胞重悬于100 μL PBS中加入Triton X-100 250 μL, 室温孵育10 min; 加入RNA酶200 μL, 室温孵育10 min; 加入碘化丙啶200 μL 4 ℃孵育10 min后立即上机检测.
统计学处理 数据采用SPSS13.0统计软件分析, 各组数据以mean±SD表示, 采用t检验, 以P<0.05为差异有统计学意义.
通过荧光显微镜观察发现, 与阴性对照组相比, 3株肝癌细胞膜上均可见较强的荧光, 其中HuH-7细胞膜上的荧光最强, MCF-7细胞膜上的荧光相对较弱(图1).
3株肝癌细胞中存在较高的ENT1 mRNA表达(图2), ENT1 mRNA在3株肝癌细胞中的表达量均比乳腺癌细胞株高, 差异有统计学意义(P<0.05); 3株肝癌细胞间ENT1 mRNA的表达水平存在差异, 以HuH-7中的表达水平最高, 差异有统计学意义(P<0.05).
对照组中G0/G1期细胞占58.50%±0.33%, S期占25.55%±0.15%, G2/M期占16.35%±0.31%; 实验组中G0/G1期细胞占76.29%±0.34%, S期占15.19%±0.34%, G2/M期占8.51%±0.41%. 与对照组相比, 实验组G0/G1期细胞比例增多, S期、G2/M期细胞比例减少(均P<0.05, 表1).
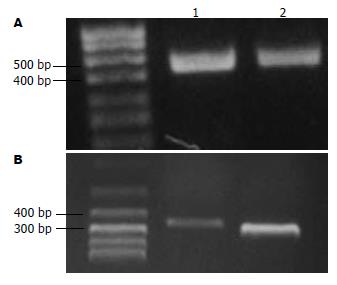
实验组与对照组相比(图3), hENT1 mRNA表达水平明显上调, 两组间的差异有统计学意义(P<0.05).
5-氟尿嘧啶、吉西他滨及阿糖胞苷等核苷类药物是很多抗肿瘤化疗方案的基础用药, 通过影响DNA、RNA起到干扰肿瘤的生长、分裂, 进而达到治疗肿瘤的目的[3]. 该类药物需要NTs的转运才能进入细胞, 发挥其抗肿瘤作用. 至今已发现人类有两大类NTs, 即hENTs和hCNTs[4-6], hENTs对核苷及核苷类药物的跨膜转运原动力是细胞膜两侧的浓差, 转运过程具有饱和特性, 而且是易化扩散的过程, 即核苷既可内流入细胞又可外流出细胞, 最终使细胞内外底物浓度一致, 其转运速度快、流量高[7-9]. hCNTs是一种主动转运蛋白, 只能将细胞外底物转运至细胞内, 即使逆浓度差转运, 其方向也不变, 从而使细胞内达到较高的浓度[10,11]. 基于ENTs和CNTs的转运功能和特性, 以及hENT1对核苷类化疗药转运的突出作用, 目前国内外关于核苷载体和肿瘤关系的研究, 多数是关于hENT1表达水平与肿瘤化疗效果关系的研究, 以及调控hENT1的表达水平对肿瘤化疗效果影响的研究, 尤其是hENT1表达水平与胰腺癌化疗效果的报道较多. 有研究表明, 人肝细胞和乳腺癌细胞膜上存在ENT1的表达[12,13], 但是人肝癌细胞膜上ENT1的表达及特征尚不清楚, 不同肝癌细胞株中hENT1的表达水平是否存在差异, 以及不同细胞周期肝癌细胞中hENT1的表达水平又有何特点, 均不清楚.
近年来研究发现, hENT1的表达水平与肿瘤患者的化疗效果和预后密切相关[14-17]. 徐建敏等研究发现hENT1是肿瘤细胞内核苷类化疗药物的主要反流通道, 下调hENT1的表达水平, 可以提高细胞内核苷类化疗药物的浓度, 延长药物在细胞内的持续时间, 增强化疗效果[18,19].
本研究结果显示, 3株肝癌细胞膜上均可见较高的ENT1表达, ENT1在肝癌细胞株中的表达存在普遍性, 说明治疗肝癌的核苷类化疗药物有一定的化疗效果. 有研究表明, 5-氟尿嘧啶及其衍生物用于治疗原发性肝癌的有效率、生存期及半年生存率较仅行对症支持治疗的对照组皆有明显的提高. 吉西他滨与5-氟尿嘧啶联合化疗对原发性肝细胞癌远期疗效较好, 具有一定的临床使用价值[20].
ENT1 mRNA在3株肝癌细胞中的表达水平均较乳腺癌细胞中的高, 说明人肝癌细胞中ENT1 mRNA的表达水平较人乳腺癌细胞出现普遍上调. 由于hENT1是核苷类药物主要反流通道, 从而不利于核苷类化疗药在肝癌细胞内积聚, 药物在细胞内持续的时间相对较短, 导致肝癌的化疗效果较乳腺癌差. 据报道, 5-氟尿嘧啶单药治疗肝癌的有效率多在20%以下, 治疗乳腺癌的有效率可达30%-40%. 3株肝癌细胞株之间ENT1 mRNA的表达水平存在差异, 这说明不同肝癌患者ENT1 mRNA的表达水平存在差异, 提示临床上不同肝癌患者对5-氟尿嘧啶化疗效果产生差异及耐药的原因可能与此有关.
Roscovitine是嘌呤类细胞周期依赖性蛋白激酶(cell cycle dependent kinases, CDKs)抑制剂, 此化合物及其衍生物对CDKs有特异性的抑制作用而对其他蛋白激酶基本无作用, X射线晶体衍射测定结果表明, Roscovitine是通过与ATP竞争ATP结合位点起到抑制CDKs的作用. 我们的前期研究已证实, 利用适宜浓度的CDKs抑制剂Roscovotine抑制CDKs的活性后发现, 肝癌细胞周期时相的分布会发生改变[21]. 因此, 我们在前期的研究基础上利用对肝癌细胞生长抑制最有效的Roscovitine浓度(32 μmol/L)作用人肝癌细胞HuH-7, 将细胞阻滞在G0/G1期, 然后观察ENT1 mRNA的表达情况, 结果发现ENT1 mRNA的表达水平明显上调, 差异有统计学意义(P<0.05), 提示肝癌化疗时, 处于G2/M期的肝癌细胞, 核苷类化疗药更容易在细胞内积聚, 药物在细胞内持续的时间更长, 此时的化疗效果更好. 我们知道, 手术后的肝癌患者, 大部分癌细胞处于增殖期, 即G2/M期的细胞占多数, 此时的化疗效果最好, 提示肝癌术后患者提倡早期化疗.
目前, 临床上5-氟尿嘧啶对肝癌的化疗效果并不理想. 本研究证实了人肝癌细胞膜上存在ENT1的表达, 进一步研究人肝癌细胞膜上CNTs的表达情况, 通过调控ENT1的表达, 或阻断ENT1的转运, 防止细胞内的5-氟尿嘧啶向细胞外反流, 同时保持CNTs对5-氟尿嘧啶向细胞内的单向转运功能, 提高肝癌细胞内药物浓度是提高肝癌化疗效果的重要思路, 有潜在的临床价值.
细胞膜核苷载体对核苷类化疗药物的细胞内外转运起着至关重要的作用, 细胞膜核苷载体的表达水平, 直接决定了细胞内核苷类药物的浓度, 从而影响肿瘤的化疗效果. ENT1对核苷类化疗药的转运作用最为突出.
仇毓东, 副教授, 南京大学医学院附属鼓楼医院肝胆外科
ENT1的表达水平与肿瘤患者的化疗效果的关系是目前研究的热点. 采用外源性干预肿瘤细胞膜上核苷载体的表达, 可能提高核苷类化疗药物在细胞内的浓度及持续时间, 增强抗癌效果. ENT1在人肝癌细胞中的表达及特征尚不清楚.
郑杰等研究发现ENT1是肿瘤细胞内核苷类化疗药物的主要反流通道, 下调hENT1的表达水平, 可以提高细胞内核苷类化疗药物的浓度, 延长药物在细胞内的持续时间, 增强化疗效果.
本研究发现, 人肝癌细胞膜上存在ENT1的表达, 不同肝癌细胞株中ENT1 mRNA的表达水平存在差异, 处于G0/G1期的肝癌细胞, ENT1 mRNA的表达水平明显上调.
ENT1在人肝癌细胞中的表达特征对临床化疗策略具有潜在的临床价值, 并为认识肝癌的耐药机制提供新的思路. 调控肝癌细胞膜上ENT1的表达, 可提高肝癌的化疗效果.
本文选题结合临床面临的问题, 设计合理, 方法可靠, 数据完整, 结果可信, 具有较好的参考意义.
编辑: 李军亮 电编:张洋
| 1. | Zhang J, Visser F, King KM, Baldwin SA, Young JD, Cass CE. The role of nucleoside transporters in cancer chemotherapy with nucleoside drugs. Cancer Metastasis Rev. 2007;26:85-110. [PubMed] [DOI] |
| 2. | Podgorska M, Kocbuch K, Pawelczyk T. Recent advances in studies on biochemical and structural properties of equilibrative and concentrative nucleoside transporters. Acta Biochim Pol. 2005;52:749-758. [PubMed] |
| 3. | Procházková A, Liu S, Friess H, Aebi S, Thormann W. Determination of 5-fluorouracil and 5-fluoro-2'-deoxyuridine-5'-monophosphate in pancreatic cancer cell line and other biological materials using capillary electrophoresis. J Chromatogr A. 2001;916:215-224. [PubMed] [DOI] |
| 4. | Baldwin SA, Beal PR, Yao SY, King AE, Cass CE, Young JD. The equilibrative nucleoside transporter family, SLC29. Pflugers Arch. 2004;447:735-743. [PubMed] [DOI] |
| 5. | Gray JH, Owen RP, Giacomini KM. The concentrative nucleoside transporter family, SLC28. Pflugers Arch. 2004;447:728-734. [PubMed] [DOI] |
| 6. | Kong W, Engel K, Wang J. Mammalian nucleoside transporters. Curr Drug Metab. 2004;5:63-84. [PubMed] [DOI] |
| 7. | Visser F, Zhang J, Raborn RT, Baldwin SA, Young JD, Cass CE. Residue 33 of human equilibrative nucleoside transporter 2 is a functionally important component of both the dipyridamole and nucleoside binding sites. Mol Pharmacol. 2005;67:1291-1298. [PubMed] [DOI] |
| 8. | Huang Y, Anderle P, Bussey KJ, Barbacioru C, Shankavaram U, Dai Z, Reinhold WC, Papp A, Weinstein JN, Sadée W. Membrane transporters and channels: role of the transportome in cancer chemosensitivity and chemoresistance. Cancer Res. 2004;64:4294-4301. [PubMed] [DOI] |
| 9. | Rauchwerger DR, Firby PS, Hedley DW, Moore MJ. Equilibrative-sensitive nucleoside transporter and its role in gemcitabine sensitivity. Cancer Res. 2000;60:6075-6079. [PubMed] |
| 10. | Smith KM, Ng AM, Yao SY, Labedz KA, Knaus EE, Wiebe LI, Cass CE, Baldwin SA, Chen XZ, Karpinski E. Electrophysiological characterization of a recombinant human Na+-coupled nucleoside transporter (hCNT1) produced in Xenopus oocytes. J Physiol. 2004;558:807-823. [PubMed] [DOI] |
| 11. | Zhang J, Smith KM, Tackaberry T, Visser F, Robins MJ, Nielsen LP, Nowak I, Karpinski E, Baldwin SA, Young JD. Uridine binding and transportability determinants of human concentrative nucleoside transporters. Mol Pharmacol. 2005;68:830-839. [PubMed] |
| 12. | Govindarajan R, Endres CJ, Whittington D, LeCluyse E, Pastor-Anglada M, Tse CM, Unadkat JD. Expression and hepatobiliary transport characteristics of the concentrative and equilibrative nucleoside transporters in sandwich-cultured human hepatocytes. Am J Physiol Gastrointest Liver Physiol. 2008;295:G570-G580. [PubMed] [DOI] |
| 13. | Cano-Soldado P, Molina-Arcas M, Algueró B, Larráyoz I, Lostao MP, Grandas A, Casado FJ, Pastor-Anglada M. Compensatory effects of the human nucleoside transporters on the response to nucleoside-derived drugs in breast cancer MCF7 cells. Biochem Pharmacol. 2008;75:639-648. [PubMed] |
| 14. | Santini D, Perrone G, Vincenzi B, Lai R, Cass C, Alloni R, Rabitti C, Antinori A, Vecchio F, Morini S. Human equilibrative nucleoside transporter 1 (hENT1) protein is associated with short survival in resected ampullary cancer. Ann Oncol. 2008;19:724-728. [PubMed] [DOI] |
| 15. | Farrell JJ, Elsaleh H, Garcia M, Lai R, Ammar A, Regine WF, Abrams R, Benson AB, Macdonald J, Cass CE. Human equilibrative nucleoside transporter 1 levels predict response to gemcitabine in patients with pancreatic cancer. Gastroenterology. 2009;136:187-195. [PubMed] [DOI] |
| 16. | Santini D, Vincenzi B, Fratto ME, Perrone G, Lai R, Catalano V, Cass C, Ruffini PA, Spoto C, Muretto P. Prognostic role of human equilibrative transporter 1 (hENT1) in patients with resected gastric cancer. J Cell Physiol. 2010;223:384-388. [PubMed] |
| 17. | Mori R, Ishikawa T, Ichikawa Y, Taniguchi K, Matsuyama R, Ueda M, Fujii Y, Endo I, Togo S, Danenberg PV. Human equilibrative nucleoside transporter 1 is associated with the chemosensitivity of gemcitabine in human pancreatic adenocarcinoma and biliary tract carcinoma cells. Oncol Rep. 2007;17:1201-1205. |