修回日期: 2011-06-23
接受日期: 2011-06-28
在线出版日期: 2011-07-18
目的: 探讨ERK1/2信号通路在RECK基因抑制侵袭转移中的作用.
方法: 体外培养人胃癌MGC-803细胞, 采用MTT法观察胃癌细胞MGC-803增殖情况, Western blot检测P-ERK的蛋白表达, RT-PCR法和Western blot法检测RECK和基质金属蛋白酶9(MMP-9) mRNA和蛋白表达.
结果: MTT法显示PD98059在一定范围内能够明显抑制胃癌MGC803细胞增殖, 其作用具有时间依赖性及浓度依赖性, PD98059的有效浓度为25 μmol/L, 在此浓度下有效时间为24 h; Western blot法检测结果显示PD98059能够抑制ERK1/2的磷酸化, 即下调P-ERK1/2, 从而使得ERK1/2信号传导途径失活; RT-PCR法和Western blot法检测结果显示PD98059能够浓度依赖性(25-100 μmol/L)和时间依赖性(12-48 h)刺激培养的胃癌MGC803细胞RECK mRNA和蛋白表达增加, MMP-9 mRNA和蛋白表达下降.
结论: PD98059可以通过抑制ERK1/2信号途径, 上调RECK的表达, 下调MMP-9的表达, 从而抑制人胃癌MGC-803细胞的增殖、生长.
引文著录: 黄靓, 李国庆, 毛振江, 钟鹰, 殷清华. ERK1/2信号通路阻断剂PD98059对胃癌细胞MGC-803中RECK、MMP-9基因表达的影响. 世界华人消化杂志 2011; 19(20): 2097-2103
Revised: June 23, 2011
Accepted: June 28, 2011
Published online: July 18, 2011
AIM: To investigate the role of extracellular signal-regulated kinase (ERK) 1/2 in the invasion and metastasis of gastric cancer by studying the impact of PD98059, an ERK1/2 inhibitor, on the expression of RECK and MMP-9 in human gastric cancer cell line MGC-803.
METHODS: The proliferation of MGC-803 cells was determined by methyl thiazolyl tetrazoliym (MTT) assay. P-ERK expression was determined by Western blot to evaluate the activation of ERK1/2. The expression of RECK and MMP-9 mRNAs and proteins was determined by reverse transcription-polymerase chain reaction (RT-PCR) and Western blot, respectively.
RESULTS: PD98059 inhibited the proliferation of MGC-803 cells in a concentration- and time-dependent manner. Treatment with PD98059 not only suppressed ERK1/2 phosphorylation but also up-regulated the expression of RECK mRNA and protein and down-regulated that of MMP-9 mRNA and protein in MGC-803 cells in a concentration- and time-dependent manner.
CONCLUSION: Treatment with PD98059 inhibited the proliferation of MGC-803 cells possibly by inhibiting ERK1/2 activation to up-regulate the expression of RECK and down-regulate that of MMP-9.
- Citation: Huang L, Li GQ, Mao ZJ, Zhong Y, Yin QH. Effect of the ERK1/2 kinase inhibitor PD98059 on the expression of RECK and MMP-9 in human gastric cancer cell line MGC-803. Shijie Huaren Xiaohua Zazhi 2011; 19(20): 2097-2103
- URL: https://www.wjgnet.com/1009-3079/full/v19/i20/2097.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i20.2097
胃癌是最常见的消化系恶性肿瘤, 据统计, 全球每年新发胃癌934 000例, 且每年约700 000人死于胃癌, 占据癌症死亡率第2位, 几乎2/3的病例发生在发展中国家, 其中中国占42%[1,2]. 近年胃癌的治疗技术虽有明显提高, 但其5年生存率仍低于20%[3], 癌细胞侵袭转移是制约临床治疗效果的常见因素, 是涉及许多基因变化的一系列复杂过程[4]. 大量研究表明, 基质金属蛋白酶(matrix metalloproteinase, MMPs)在肿瘤侵袭转移中发挥了重要作用[5-7]. 在ERK1/2信号转导通路是调控细胞增殖的重要途径, 与细胞增殖和某些恶性肿瘤的浸润转移密切相关, 有研究表明ERK在MMP-9的基因表达中起作用[8,9]. 研究证实[10], Kazal基序逆向诱导半胱氨酸丰富蛋白(reversion-inducing-cysteine-rich protein with kazal motifs, RECK)这种新型的膜表面锚定的MMPs抑制基因, 是影响肿瘤转移及侵袭能力的独立因素, 且其下降的幅度与肿瘤侵袭转移能力成明显正相关. RECK通过下调MMP-2、MMP-9、MT1-MMP、VEGF等, 抑制肿瘤细胞的跨膜、远处转移以及肿瘤中血管生成[11]. 根据上述特性, 可将其作为判断患者预后新的分子标志物[12]. 目前的研究表明, RECK基因的表达受到癌基因Ras的调控[13], 与细胞外信号调节激酶(ERK1/2)途径相关[14]. 目前国内关于RECK下调胃癌细胞侵袭转移的机制以及信号转导通路的研究尚少. 我们通过体外细胞培养技术, 应用ERK1/2特异性抑制剂PD98059作用于MGC-803细胞, 检测RECK、MMP-9、P-ERK1/2的表达, 进一步研究ERK1/2通路调控胃癌细胞侵袭转移的信号转导机制, 以抑制肿瘤细胞的远处转移和局部复发. 对于以上调RECK为靶点的分子生物治疗的临床应用提供理论和实验依据, 为胃癌的治疗提供新的思路.
胃癌细胞株MGC-803由中南大学湘雅医学院肿瘤研究所购得, 其表型为低分化人胃腺癌细胞. PD98059购自江苏碧云天生物技术公司, RPMI 1640培养基购自Hyclone-Pierce公司, 二甲基亚砜(DMSO)购自美国Sigma公司, MMP-9基因、RECK基因及GAPDH引物设计与合成由上海生工生物技术公司合成, 兔抗MMP-9单克隆抗体购自美国ABZOOM公司, 兔抗RECK单克隆抗体购自美国Cell Signaling公司, 鼠抗、兔抗β-Actin单克隆抗体购自江苏碧云天生物技术公司, HRP标记的羊抗兔IgG及HRP标记的羊抗鼠IgG购自江苏碧云天生物技术公司, 鼠抗ERK1/2、鼠抗P-ERK1/2单克隆抗体购自美国ABZOOM公司, 其他试剂均为进口或国产分析纯.
1.2.1 细胞培养: MGC-803细胞在含有100 mL/L胎牛血清(FBS)的RPMI 1640培养基中贴壁生长, 置于37 ℃, 95%饱和湿度、含50 mL/L CO2的孵箱中培养, 每1-2 d换1次液, 于细胞80%融合时, 用0.25%的胰酶细胞消化液消化, 1:2或1:3传代1次. 根据细胞生长状态, 有时加入青-链霉素双抗.
1.2.2 MTT法检测细胞增殖: 取对数生长期的胃癌MGC-803细胞用0.25%胰酶消化, 含100 mL/L胎牛血清的RPMI 1640液配制成单细胞悬液. 以1.0×107个/L接种于96孔培养板(每孔200 μL), 观察细胞贴壁, 70%-80%融合后, 换不含胎牛血清的RPMI 1640培养液同步化24 h后, 加入不同的处理因素继续培养, 倒置显微镜下动态观察细胞生长情况. 在孵育结束前4 h每孔加入5 g/L的MTT溶液20 μL, 培养4 h后吸弃孔内培养液, 每孔各加入DMSO 150 μL, 37 ℃孵育15 min后振荡混匀, 用酶联免疫检测仪测定吸光度值(A570), 通过与对照组相比得到实验组的增殖情况. 实验重复3次, 每组设6个复孔, 统计数据取A值均值.
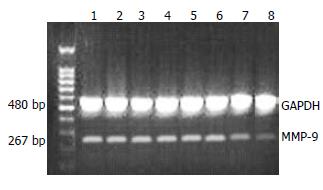
1.2.3 RT-PCR检测mRNA表达: 取对数生长期的胃癌细胞MGC-803于37 ℃, 含50 mL/L CO2的孵箱中培养, 待细胞长至70%-80%融合状态时, 更换为无血清的RPMI 1640培养基同步化饥饿细胞24 h, 然后加入不同的处理因素继续培养至实验所需时间后, 收集细胞, TRIzol总RNA提取试剂提取细胞总RNA, 常规合成cDNA第一链, 以此第一链为模版, PCR扩增MMP-9及RECK mRNA片段, 同时扩增三磷酸甘油醛脱氢酶(GAPDH)作为内参照, 目的基因和内参引物序列和反应条件见表1, 2, 扩增产物应用凝胶电泳检测. AlphaImager 2200凝胶分析系统图像分析各组目的产物及GAPDH灰度值, 以二者的比值代表目的产物的表达量. 每组实验重复3次.
| 基因 | 引物序列 | 扩增产物(bp) |
| GAPDH | 5'CATCCTGCGTCTGGACCT3' | 480 |
| 5'TCAGGAGGAGCAATGATCTTG3' | ||
| MMP-9 | 5'TGGATGTGAGCATCCCTAGGG3' | 267 |
| 5'AGTGTCCGAGGAAGATACTTG3' | ||
| RECK | 5'TGGAGTCACTGTACACCCTC3' | 209 |
| 5'CGGACATCCGCTAAACAGGT3' |
| 基因 | 反应条件 | |||||
| 预变性 | 变性 | 退火 | 延伸 | 循环数 | 末次延伸 | |
| GAPDH | 94 ℃, 4 min | 94 ℃, 30 s | 55 ℃, 30 s | 72 ℃, 30 s | 30 | 72 ℃, 10 min |
| MMP-9 | 94 ℃, 3 min | 94 ℃, 30 s | 58 ℃, 30 s | 72 ℃, 1 min | 30 | 72 ℃, 10 min |
| RECK | 94 ℃, 3 min | 94 ℃, 30 s | 43 ℃, 30 s | 72 ℃, 1 min | 30 | 72 ℃, 10 min |
1.2.4 Western blot检测蛋白定量表达: 取对数生长期的胃癌细胞MGC-803于37 ℃, 含50 mL/L CO2的孵箱中培养, 待细胞长至70%-80%融合状态时, 更换为无血清的RPMI 1640培养基同步化饥饿细胞24 h, 然后按分组加入不同的处理因素继续培养至实验所需时间后, 收集细胞, 提取总蛋白, BCA法测定蛋白含量, 每个泳道蛋白的溶液体积20 μL, 上样于SDS-PAGE进行电泳分离后, 转移至硝酸纤维素膜, 用5%无脂牛奶(用TBST配制), 在4 ℃冷室中摇动封闭过夜. 一抗(MMP-9、RECK、P-ERK1/2、ERK1/2)效价均为1:500, β-actin效价为1:1 000室温下脱色摇床上摇动孵育2 h后, TBST洗膜4次, 每次15 min, 随后加HRP标记的二抗(羊抗小鼠效价为1:2 000)室温下脱色摇床上摇动孵育1 h. 用TBST洗膜6次, 每次15 min. 加入化学发光剂显影. 将胶片进行扫描或拍照, 用凝胶图像处理系统分析目标带的相对分子质量和净光密度值. 每组实验重复3次.
统计学处理 各组实验数据以mean±SD表示, 采用SPSS16.0统计软件进行单因素方差分析(One-way ANOVA), 组间均数比较采用LSD检验, P<0.05认为有统计学意义.
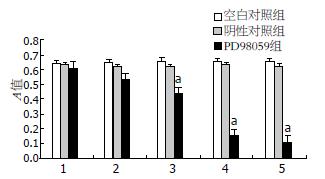
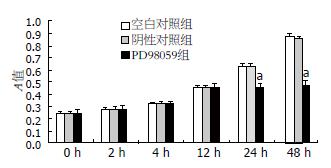
用不同浓度的PD98059(终末浓度为5、10、25、50、100 μmol/L)处理人胃癌细胞MGC-803 24 h, 可见其增殖活性(A值)在25、50、100 μmol/L作用浓度点, 随着PD98059处理浓度的增高, 其抑制作用逐渐增强, 与空白对照组和阴性对照组相比较, 差异有统计学意义(P<0.05); 用PD98059(25 μmol/L)处理人胃癌细胞MGC-803不同时间(2、4、12、24、48 h), 可见其增殖活性(A值)在24、48 h作用时间点, 随着PD98059处理时间的延长, 其抑制作用逐渐增加, 组间比较差异有统计学意义(P<0.05). 由此提示PD98059显著抑制胃癌MGC-803细胞的生长, 其作用的有效浓度为25 μmol/L, 在此浓度下处理有效时间为24 h, 其对癌细胞的抑制率随着作用浓度的升高和时间的延长而呈部分上升趋势(图1, 2).
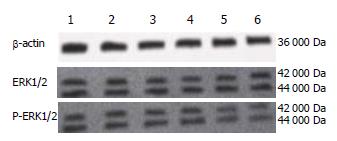
Western blot实验采用25 μmol/L PD98059作用于MGC-803细胞不同时间(2、4、12、24、48 h)和不同浓度的PD98059(5、10、25、50、100 μmol/L)作用24 h时, 通过Western blot法检测, 观察其对MGC-803细胞内P-ERK1/2和ERK1/2蛋白表达水平的影响, 以ERK磷酸化程度作为衡量ERK1/2信号转导通路活性指标. 读取各组P-ERK1/2、ERK1/2及内参β-actin蛋白的灰度值, 以P-ERK1/2/β-actin、ERK1/2/β-actin灰度比值进行P-ERK1/2、ERK1/2蛋白表达水平的相对半定量分析. 显示不同浓度PD98059(5、10、25、50、100 μmol/L)处理细胞24 h后, P-ERK1/2蛋白表达浓度依赖性下降, 组间比较差异有统计学意义(P<0.05), 其有效浓度为25 μmol/L. 当PD98059浓度为100 μmol/L时, P-ERK1/2蛋白的表达抑制达到最大; 而ERK1/2蛋白表达浓度变化不明显, 组间比较差异无统计学意义(图3). 采用25 μmol/L PD98059分别处理细胞2、4、12、24和48 h后, P-ERK1/2蛋白表达浓度依赖性下降, 组间比较差异有统计学意义(P<0.05), 在25 μmol/L浓度下处理有效时间为24 h, 其后对P-ERK1/2的抑制随着作用时间的延长而呈上升趋; 而ERK1/2蛋白表达浓度变化不明显, 组间比较差异无统计学意义(图4).
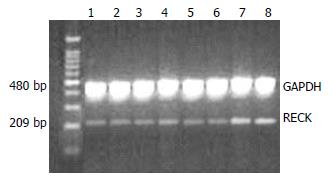
RT-PCR法分析25 μmol/L PD98059处理胃癌MGC-803细胞不同时间后, RECK和MMP-9 mRNA表达的变化情况, 灰度扫描定量分析显示25 μmol/L PD98059处理细胞不同时间后, RECK mRNA表达呈时间依赖性增加(12、24、48 h), 与空白对照组及DMSO阴性对照组比较, 差异有统计学意义(P<0.05, 图5). MMP-9 mRNA的表达呈时间依赖性下降(12、24、48 h), 与空白对照组及DMSO阴性对照组比较, 差异有统计学意义(P<0.05, 图6).
Western blot法检测25 μmol/L PD98059处理胃癌MGC-803细胞不同时间后, MMP-9和RECK基因蛋白表达水平的变化情况, 灰度扫描定量分析显示25 μmol/L PD98059处理细胞0、2、4、12、24和48 h后, RECK基因蛋白表达呈时间依赖性增加(12-48 h), MMP-9蛋白表达呈时间依赖性下降(12-48 h), 与空白对照组及DMSO阴性对照组比较, 差异有统计学意义(P<0.05, 图7, 8).
据《2009年中国卫生统计年鉴》统计, 2004-2005年胃癌的死亡率高达24.71/10万, 在前10位恶性肿瘤死亡率中排名第3, 其年患病率和死亡率均是世界平均水平的2倍多. 胃癌作为最常见的消化系恶性肿瘤之一, 缺乏特异性症状而早期就诊困难, 单纯手术切除效果欠佳, 必须加以化疗及放化疗联合的综合治疗来提高患者的5年生存率. 化疗在改善胃癌患者预后, 降低术后复发率, 延长生存期等方面有特别重要的作用[15]. 从ERK1/2-RECK-MMP-9为靶点, 容易得到一个治疗胃癌的新思路-即通过抑制ERK1/2的表达和活性诱导RECK上调、抑制MMPs来治疗胃癌, 为寻找高效低毒性的化疗药物提供一些实验依据.
ERK1/2可调节蛋白或催化新陈代谢反应的关键酶, 是介导细胞反应的重要信号系统, 涉及调节细胞的许多生物学行为[16]. 由Ras蛋白激活, 以磷酸化和去磷酸化的方式对外来刺激信号作出应答. PD98059是ERK1/2信号通路中的一种细胞渗透性和选择性的特异性阻断剂[17].
我们采用不同浓度的PD98059对体外培养的胃癌MGC-803细胞的生长影响进行研究, 结果表明阻断ERK1/2信号转导途径可以显著抑制胃癌MGC-803细胞的生长增殖, 其作用的有效浓度为25 μmol/L, 在此浓度下处理有效时间为24 h. 其对胃癌MGC-803细胞的抑制率随着作用浓度的升高和时间的延长而呈上升趋势. 鉴于以上研究, 我们可以证实Ras-Raf-MEK-ERK1/2 通路是调控胃癌细胞增殖的主要信号传导途径. PD98059对ERK1/2活化的阻断作用存在剂量和时间上的依赖关系. 我们用Western blot法检测ERK1/2及P-ERK1/2作为衡量ERK1/2信号转导途径的活性指标. 结果显示P-ERK1/2蛋白水平表达下调, 并且呈部分剂量和时间上的依赖性, 组间比较差异有显著性(P<0.05); 而ERK1/2蛋白表达浓度变化不明显, 组间比较差异无显著性(P>0.05). 上述结果充分证明ERK1/2信号通路通过磷酸化活化转录因子而调控特定的下游基因的表达. PD98059只能抑制下游ERK的活化, 而不能下调其表达水平.
MMPs是一组锌离子依赖性内切酶, 能够降解细胞外基质中的各种蛋白成分, 是唯一已知的能够降解纤维胶原的酶类. 大量研究表明MMPs在细胞外基质(extracellular matrix, ECM)成分降解和调节肿瘤血管生成的过程中都发挥了重要作用[5-7]: (1)破坏局部组织结构, 促进肿瘤生长; (2)破坏基底膜屏障, 利于肿瘤转移; (3)通过对ECM的改建, 促进肿瘤新生血管的形成. 目前已发现并定性的人源MMPs有23种[18], 其中MMP-9是引起ECM降解的最重要的酶类之一, 又称"明胶酶B"或"Ⅳ型胶原酶B", 相对分子质量为92 000, 是已发现的MMPs中相对分子质量最大的酶. 其底物包括变性的Ⅰ型胶原、天然Ⅳ、Ⅴ、Ⅶ、Ⅹ、和Ⅺ型胶原、纤维蛋白原、层粘连蛋白、巢蛋白、蛋白多糖连接蛋白及多功能蛋白聚糖等. 与其他MMPs家族成员相比, Ⅴ型胶原样功能域为MMP-9所特有. 他的调节主要通过基因转录、酶原激活及MMP-9生理性抑制物(TIMP-1)3个水平实现. MMPs的表达受多种机制的调控, 其中活化后的MAPK可通过调节转录因子活化蛋白-1(AP-1)和Ets转录因子而调控MMP-9基因的表达[19].
RECK基因是新发现的一种MMPs抑制剂, 全称RECK基因, 是1998年Takahashi等[20]在v-Ki-ras转染的细胞株NIH3T3中通过表达克隆的方法分离出来的一种转录抑制基因. RECK基因在多种正常人体组织中均表达, 在前列腺、卵巢、睾丸、小肠中转录产物最丰富, 其次为肺、甲状腺、骨骼肌和胸腺, 在脑、心、胰腺中含量较少, 而在肿瘤组织中表达下降甚至不表达, 其表达可抑制肿瘤的侵袭转移能力[10]. 有研究表明, RECK中的K23基因序列能够非竞争性抑制MMP-9的分泌及活性, 抑制裸鼠肺癌模型中肿瘤的生长和转移[21]. 张勇等[22]的研究通过脂质体介导RECK真核表达载体转染人肝癌细胞株HepG2, 检测外源性的RECK基因抑制MMP-9的活性, 降低肝癌细胞HepG2的体外侵袭能力. 国内外多项研究证实, 结肠直肠癌[23]、脑垂体瘤[24]、肺癌[25]、胰腺癌[26]、骨肉瘤[27]、食管癌[28]、胃癌[29]、肝癌[30]、乳腺癌[31]等多种肿瘤中, RECK是影响肿瘤转移及侵袭能力的独立因素, 他负调节于MMP-2、MMP-9等, 抑制肿瘤细胞的跨膜和远处转移, RECK基因作为预测各类癌症预后的分子标志物有较大的临床意义. 目前的研究表明[14], RECK基因的表达受到癌基因Ras的调控, 激活的Ras基因抑制RECK的表达, 从而促进侵袭和转移. Ras/Raf/MEK/ERK1/2通路(ERK1/2信号传导通路)是一个典型的将细胞外信号向细胞核内传递并刺激核内转录增加的级联反应, ERK1/2在该信号通路中具有枢纽作用.
本实验结采用Western blot法和RT-PCR法检测, 用PD98059阻断ERK1/2信号转导通路, 可以上调RECK蛋白及mRNA的表达, 并且在25-100 μmol/L浓度范围内, 对RECK的增长率随着剂量的增加和时间的延长呈上升趋势. 通过不同浓度的ERK1/2抑制剂PD98059处理体外培养的胃癌MGC-803细胞(不同时间)的RECK表达变化进行研究, 证实了RECK的表达受到ERK1/2信号转导途径在内的多种机制的调控. 不同浓度的MAPK(ERK1/2)特异性抑制剂PD98059对体外培养的胃癌MGC-803细胞的MMP-9表达变化进行研究, 结果表明, 阻断ERK1/2信号转导通路可以下调MMP-9蛋白及mRNA的表达, 并且在25-100 μmol/L浓度范围内, 对MMP-9的抑制率随着剂量的增加和时间的延长呈上升趋势. 我们的结果进一步证实了MMP的表达受到包括ERK1/2信号转导途径在内的多种机制的调控, 从而影响恶性肿瘤的生物学行为.
目前, 对于胃癌确切的病因学、发病机制仍未完全明了. 可以肯定的是, 胃癌的浸润和转移是患者主要的死亡原因. 总之, 我们认为在胃癌中, PD98059通过抑制ERK1/2的磷酸化来抑制细胞生长增殖, 在转录水平上调RECK表达和在转录后水平下调MMP-9表达, 从而抑制肿瘤细胞的侵袭和转移, 并且找出PD98059作用于胃癌细胞的有效浓度是25 μmol/L, 在这个浓度下处理的有效时间为24 h, 为RECK作为靶向治疗胃癌提供新的实验数据. 本实验研究进一步证实了ERK1/2信号转导通路是RECK的上游信号途径之一, ERK1/2信号通路的激活下调RECK基因的表达, 使得其对MMP-9表达的调控失衡, 引起恶性肿瘤侵袭和转移. 同时也证明了, ERK1/2抑制剂应该是非常有效的抗胃癌药物, 然如何降低其毒性、应用于临床仍然任重道远. RECK、 MMP-9是否存在其他信号通路介导调控胃癌细胞侵袭转移有待进一步的研究.
近年胃癌的治疗技术虽有明显提高, 但其5年生存率仍低于20%, 癌细胞侵袭转移是制约临床治疗效果的常见因素, 是涉及许多基因变化的一系列复杂过程.
郑鹏远, 教授, 郑州大学第二附属医院消化科
目前, 对于胃癌确切的病因学、发病机制仍未完全明了. RECK、 MMP-9是否存在其他信号通路介导调控胃癌细胞侵袭转移有待进一步的研究.
RECK这种新型的膜表面锚定的MMP抑制基因, 是影响肿瘤转移及侵袭能力的独立因素, 且其下降的幅度与肿瘤侵袭转移能力成明显正相关. Kazal基序逆向诱导半胱氨酸丰富蛋白(reversion-inducing-cysteine-rich protein with kazal motifs, RECK)基因, 是1998年Takahashi等在v-Ki-ras转染的细胞株NIH3T3中通过表达克隆的方法分离出来的一种转录抑制基因.
PD98059可以通过抑制ERK1/2信号途径, 上调RECK的表达, 下调MMP-9的表达, 从而抑制人胃癌MGC-803细胞的增殖、生长.
本文设计合理, 逻辑性强, 结论中肯, 具有一定的理论意义值.
编辑: 李薇 电编:张洋
| 1. | Bulanov D. [Gastric cancer - current state of the problem. Part I. Epidemiology. Pathology. Classification. Staging]. Khirurgiia (Sofiia). 2007;48-59. [PubMed] |
| 2. | Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [PubMed] [DOI] |
| 3. | Sutter AP, Fechner H. Gene therapy for gastric cancer: is it promising? World J Gastroenterol. 2006;12:380-387. [PubMed] |
| 4. | Ghajar CM, George SC, Putnam AJ. Matrix metalloproteinase control of capillary morphogenesis. Crit Rev Eukaryot Gene Expr. 2008;18:251-278. [PubMed] |
| 5. | Johansson N, Ahonen M, Kähäri VM. Matrix metalloproteinases in tumor invasion. Cell Mol Life Sci. 2000;57:5-15. [PubMed] [DOI] |
| 6. | Curran S, Murray GI. Matrix metalloproteinases in tumour invasion and metastasis. J Pathol. 1999;189:300-308. [PubMed] [DOI] |
| 7. | Okada A. [Roles of matrix metalloproteinases and tissue inhibitor of metalloproteinase (TIMP) in cancer invasion and metastasis]. Gan To Kagaku Ryoho. 1999;26:2247-2252. [PubMed] |
| 8. | Uzgare AR, Kaplan PJ, Greenberg NM. Differential expression and/or activation of P38MAPK, erk1/2, and jnk during the initiation and progression of prostate cancer. Prostate. 2003;55:128-139. [PubMed] [DOI] |
| 9. | Menakongka A, Suthiphongchai T. Involvement of PI3K and ERK1/2 pathways in hepatocyte growth factor-induced cholangiocarcinoma cell invasion. World J Gastroenterol. 2010;16:713-722. [PubMed] [DOI] |
| 10. | Meng N, Li Y, Zhang H, Sun XF. RECK, a novel matrix metalloproteinase regulator. Histol Histopathol. 2008;23:1003-1010. [PubMed] |
| 11. | Oshima T, Kunisaki C, Yoshihara K, Yamada R, Yamamoto N, Sato T, Makino H, Yamagishi S, Nagano Y, Fujii S. Clinicopathological significance of the gene expression of matrix metalloproteinases and reversion-inducing cysteine-rich protein with Kazal motifs in patients with colorectal cancer: MMP-2 gene expression is a useful predictor of liver metastasis from colorectal cancer. Oncol Rep. 2008;19:1285-1291. [PubMed] |
| 12. | Clark JC, Thomas DM, Choong PF, Dass CR. RECK--a newly discovered inhibitor of metastasis with prognostic significance in multiple forms of cancer. Cancer Metastasis Rev. 2007;26:675-683. [PubMed] [DOI] |
| 13. | Chang HC, Cho CY, Hung WC. Silencing of the metastasis suppressor RECK by RAS oncogene is mediated by DNA methyltransferase 3b-induced promoter methylation. Cancer Res. 2006;66:8413-8420. [PubMed] [DOI] |
| 14. | Gysin S, Lee SH, Dean NM, McMahon M. Pharmacologic inhibition of RAF--& gt; MEK--& gt; ERK signaling elicits pancreatic cancer cell cycle arrest through induced expression of p27Kip1. Cancer Res. 2005;65:4870-4880. [PubMed] [DOI] |
| 15. | Fatourou E, Papaziogas B. Double endoscopic intraluminal surgery: superior to ESD for early gastric cancer? Surg Endosc. 2010;24:2349-2350. [PubMed] [DOI] |
| 16. | Black EJ, Walker M, Clark W, MacLaren A, Gillespie DA. Cell transformation by v-Jun deactivates ERK MAP kinase signalling. Oncogene. 2002;21:6540-6548. [PubMed] [DOI] |
| 17. | Alessi DR, Cuenda A, Cohen P, Dudley DT, Saltiel AR. PD 098059 is a specific inhibitor of the activation of mitogen-activated protein kinase kinase in vitro and in vivo. J Biol Chem. 1995;270:27489-27494. [PubMed] [DOI] |
| 18. | Visse R, Nagase H. Matrix metalloproteinases and tissue inhibitors of metalloproteinases: structure, function, and biochemistry. Circ Res. 2003;92:827-839. [PubMed] [DOI] |
| 19. | Tsang KJ, Crowe DL. Retinoic acid and extracellular matrix inhibition of matrix metalloproteinase 9 expression is mediated by the mitogen activated protein kinase pathway. Int J Oncol. 2001;18:369-374. [PubMed] |
| 20. | Takahashi C, Sheng Z, Horan TP, Kitayama H, Maki M, Hitomi K, Kitaura Y, Takai S, Sasahara RM, Horimoto A. Regulation of matrix metalloproteinase-9 and inhibition of tumor invasion by the membrane-anchored glycoprotein RECK. Proc Natl Acad Sci U S A. 1998;95:13221-13226. [PubMed] [DOI] |
| 21. | Chang CK, Hung WC, Chang HC. The Kazal motifs of RECK protein inhibit MMP-9 secretion and activity and reduce metastasis of lung cancer cells in vitro and in vivo. J Cell Mol Med. 2008;12:2781-2789. [PubMed] [DOI] |
| 22. | 张 勇, 郑 启昌, 卢 昕, 秦 涛. 转染RECK基因对肝癌细胞生物学行为的影响. 中国普外基础与临床杂志. 2006;13:150-153. |
| 23. | Asano T, Tada M, Cheng S, Takemoto N, Kuramae T, Abe M, Takahashi O, Miyamoto M, Hamada J, Moriuchi T. Prognostic values of matrix metalloproteinase family expression in human colorectal carcinoma. J Surg Res. 2008;146:32-42. [PubMed] [DOI] |
| 24. | Yoshida D, Nomura R, Teramoto A. Regulation of cell invasion and signalling pathways in the pituitary adenoma cell line, HP-75, by reversion-inducing cysteine-rich protein with kazal motifs (RECK). J Neurooncol. 2008;89:141-150. [PubMed] [DOI] |
| 25. | Takemoto N, Tada M, Hida Y, Asano T, Cheng S, Kuramae T, Hamada J, Miyamoto M, Kondo S, Moriuchi T. Low expression of reversion-inducing cysteine-rich protein with Kazal motifs (RECK) indicates a shorter survival after resection in patients with adenocarcinoma of the lung. Lung Cancer. 2007;58:376-383. [PubMed] [DOI] |
| 26. | Lee H, Lim C, Lee J, Kim N, Bang S, Lee H, Min B, Park G, Noda M, Stetler-Stevenson WG. TGF-beta signaling preserves RECK expression in activated pancreatic stellate cells. J Cell Biochem. 2008;104:1065-1074. [PubMed] [DOI] |
| 27. | Kang HG, Kim HS, Kim KJ, Oh JH, Lee MR, Seol SM, Han I. RECK expression in osteosarcoma: correlation with matrix metalloproteinases activation and tumor invasiveness. J Orthop Res. 2007;25:696-702. [PubMed] [DOI] |
| 28. | 李 晟磊, 刘 宗文, 赵 秋民, 于 金霞, 赵 志华, 高 冬玲, 庞 霞, 陈 奎生, 张 云汉. 食管鳞癌组织中RECK mRNA和蛋白的表达及意义. 中国肿瘤临床. 2007;34:1280-1286. |
| 29. | Song SY, Son HJ, Nam E, Rhee JC, Park C. Expression of reversion-inducing-cysteine-rich protein with Kazal motifs (RECK) as a prognostic indicator in gastric cancer. Eur J Cancer. 2006;42:101-108. [PubMed] [DOI] |
| 30. | Furumoto K, Arii S, Mori A, Furuyama H, Gorrin Rivas MJ, Nakao T, Isobe N, Murata T, Takahashi C, Noda M. RECK gene expression in hepatocellular carcinoma: correlation with invasion-related clinicopathological factors and its clinical significance. Reverse-inducing--cysteine-rich protein with Kazal motifs. Hepatology. 2001;33:189-195. [PubMed] [DOI] |