修回日期: 2010-11-24
接受日期: 2010-12-01
在线出版日期: 2011-01-18
选择高效低毒的药物及组合是提高实体瘤疗效的关键问题之一. 由于肿瘤异质性、种族和个体的差异, 对化疗药物的有效率及毒性各不相同. 仅依赖群体研究结果数据的循证医学标准化疗难以完全指导临床实践, 在药物遗传学和(或)基因组学检测指导下的"个体化化疗"被日益重视. 本文以结直肠肿瘤为例, 就氟尿嘧啶类药物疗效预测标志物的相关研究进展综述如下.
引文著录: 苏洋, 张俊, 朱正纲. 氟尿嘧啶类药物的疗效预测标志物的研究进展. 世界华人消化杂志 2011; 19(2): 170-176
Revised: November 24, 2010
Accepted: December 1, 2010
Published online: January 18, 2011
Selection of high-efficacy and low-toxicity drugs is key to improving the efficacy of chemotherapy for solid tumors. Because of tumor heterogeneity and ethnic/individual differences, the efficiency and toxicity of chemotherapy drugs vary across individuals. Since standard chemotherapy regimens developed based on population data can not completely meet clinical needs, increasing attention has been directed towards individualized chemotherapy based on drug genetics and/or genomics testing. In this paper, we review the advances in identifying predictive markers for response to fluoropyrimidine-based chemotherapy for colorectal cancer.
- Citation: Su Y, Zhang J, Zhu ZG. Advances in identifying predictive markers for response to fluoropyrimidine-based chemotherapy for colorectal cancer. Shijie Huaren Xiaohua Zazhi 2011; 19(2): 170-176
- URL: https://www.wjgnet.com/1009-3079/full/v19/i2/170.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i2.170
选择高效低毒的药物及组合是提高实体瘤疗效的关键问题之一. 由于肿瘤异质性、种族和个体的差异, 对化疗药物的有效率及毒性各不相同. 仅依赖群体研究结果数据的循证医学标准化疗难以完全指导临床实践, 在药物遗传学和(或)基因组学检测指导下的"个体化化疗"被日益重视. 本文以结直肠肿瘤为例, 就氟尿嘧啶类药物疗效预测标志物的相关研究进展综述如下.
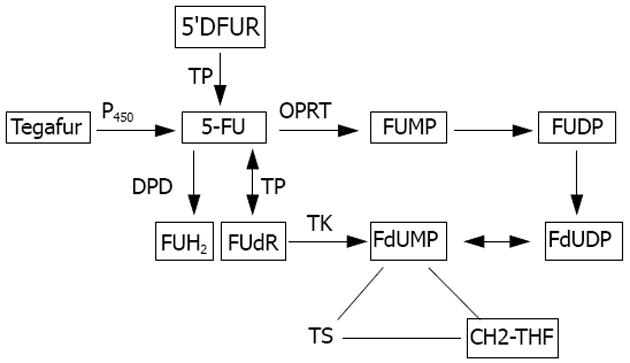
氟尿嘧啶类药物包括5-氟尿嘧啶(5-FU)、5'-2'-脱氧尿苷、替加氟(tegafur)、卡培他滨(capecitabine)和替吉奥(S-1)等[1]. 5-FU是尿嘧啶类似物, 主要作用于细胞周期S期, 在细胞内转化为3种活性代谢产物: 氟尿嘧啶脱氧核苷(FdUMP)、氟脱氧尿苷三磷酸(FdUTP)和氟尿嘧啶三磷酸(FUTP).
5-FU在乳清酸磷酸核糖转移酶(orotate phosphoribosyl transferase, OPRT)作用下, 次第转化为氟尿嘧啶核苷(FuMP)和FdUMP, 后者与胸腺嘧啶合成酶(thymidylate synthase, TS)和亚叶酸(CH2-THF)结合, 形成稳定的三联复合物, 抑制TS活性, 阻止脱氧尿嘧啶核苷(dUMP)与胸腺嘧啶磷酸化酶(thymidine phosphorylase, TP)结合后转化为脱氧胸腺嘧啶核苷(dTMP), 从而使DNA合成受限[2](图1). 二氢嘧啶脱氢酶(DPD)为5-FU的限速酶, 在DPD的催化下5-FU失活转变为FUH2.
由以上代谢途径可知, 在氟尿嘧啶类化疗药物作用过程中, TP是5-FU的合成酶, DPD是5-FU的代谢酶, 而TS是5-FU的靶酶, 上述三种酶类的表达水平与活性高低与5-FU化疗敏感性和不良反应直接相关.
TS是5-FU发挥细胞毒作用的主要靶酶, 5-FU的代谢产物FdUMP与TS结合形成复合物, 干扰dUMP与TS结合, 由此抑制胸腺嘧啶合成, 造成细胞周期阻滞, 并诱导细胞凋亡. Soong等[3]利用免疫组织化学染色技术, 检测了945例结直肠癌组织中TS表达, 结果显示: Ⅱ期结直肠癌中TS低表达是不良预后因素(风险比为1.96, 95%CI: 1.09-2.63, P = 0.019). Ⅲ期结直肠癌患者TS表达水平低倾向于预后较差(风险比为1.39, 95%CI: 0.92-2.13, P = 0.124). 但在接受5-FU化疗的Ⅲ期结直肠癌患者中, TS表达水平与预后无明显相关性(风险比为0.81, 95%CI: 0.49-1.33, P = 0.415). Leichman等[4]通过PCR测定46例接受5-FU/LV化疗的转移性结直肠癌患者肿瘤中TS mRNA表达, 发现TS mRNA低表达者和高表达者的中位生存期分别为13.6 mo和8.2 mo(P = 0.02), 据此认为TS mRNA表达水平与5-FU/LV化疗的有效率和总生存有关.
Qiu等[5]进行了一项Meta荟萃分析, 该分析共包含1 112例来自24个研究中心且接受5-FU为基础化疗的结直肠癌患者, 分析提示: 原发肿瘤TS低表达者对5-FU化疗的敏感性较高. 可见TS表达水平可作为结直肠癌患者接受5-FU治疗的疗效预测标志物和预后判断标志物. TS酶活性越高, 肿瘤对5-FU的化疗敏感性越低, 且预后也越差.
TS的编码基因位于第18号染色体短臂, Horie等[6]发现, 高加索人和亚裔人的TS基因5'端增强子区域存在28 bp串联重复序列多态性, 含2次重复者为2R, 3次重复者为3R. 其相应的3种TS基因型分别为3R/3R、2R/3R和2R/2R. Lecomte等[7]回顾性分析了90例接受5-FU为基础的辅助化疗或姑息化疗的结直肠癌组织TS酶表达, 发现基因型为2R/2R、2R/3R和3R/3R者, 发生3/4度毒性的比例分别为43%、18%和4%(P<0.02). Martinez-Balibrea等[8]在2009年ASCO会议上报道了接受伊立替康联合5-FU作为一线化疗的晚期结直肠癌患者中, TS表达与疗效的关系, 149例患者均使用伊立替康联合5-FU团注单周方案(FUIRI)或伊立替康联合5-FU静脉持续输注双周方案(FOLFIRI), 发现TS基因型为2R/2R、2R/3R和3R/3R者的有效率分别为79.3%、52.5%和52.5%(风险比为3.5; 95%CI: 1.3-9.1; P = 0.009). 提示TS基因型为3R/3R的纯合型者, 虽然毒性反应发生风险较低, 但对化疗的敏感性也同样低于2R/3R杂合型及2R/2R纯合型者.
Ulrich等[9]进一步发现, TS mRNA 3'端非翻译区的1 494 bp处存在1个6个碱基缺失/插入多态性, 形成+6 bp/+6 bp、+6 bp/-6 bp和-6 bp/-6 bp 3种基因型, -6 bp与TS mRNA表达水平下降有关. Lurje等[10]随访了接受含5-FU方案化疗的318例转移性结直肠癌患者, 发现TS基因型为+6 bp/+6 bp或+6 bp/-6 bp者与-6 bp/-6 bp者中位总生存期分别为13 mo和18 mo(P = 0.023).
Uchida等[11]开展了一项Ⅰ期临床研究, 使用固定剂量奥沙利铂(130 mg/m2第1天)联合渐增剂量卡培他滨(1 200-1 300 mg/m2/d1-5, d8-12)的3 wk方案治疗91例无法切除的进展期结直肠或小肠腺癌, 同时用RT-PCR技术检测TS mRNA表达. 结果显示, TS表达水平与化疗有效率和疾病稳定率相关(P = 0.042, 0.047), 肿瘤组织标本中TS mRNA/β-actin表达水平高于中位值(2.07)与低于中位值的患者相比, 相同时间内疾病进展的概率明显提高(43% vs 17%, P = 0.047), 中位总生存时间更短(294 d vs 417 d, P = 0.042), 但TS mRNA表达水平与治疗失败时间(time to treatment failure, TTF)间无明显相关(P>0.05). 提示对TS mRNA低表达的进展期结直肠癌患者, 接受奥沙利铂联合卡培他滨方案可降低早期疾病进展风险并延长总生存; 但TS mRNA表达水平与TTF间无明显相关.
Gustavsson等[12]给予141例结直肠癌患者5-FU为基础的化疗, 并用RT-PCR技术检测了肿瘤组织标本中TP mRNA表达, 发现TP低表达者预后较好(P = 0.052), 且致疾病进展时间(time to progression, TTP)较长(风险比为2.64, P<0.001).
尽管如此, 目前尚未就TP mRNA表达作为5-FU疗效预测因子达成共识, 主要原因包括: (1)mRNA高表达并未直接转化为蛋白质水平的高表达, 基于细胞株的体外研究结果难以反映人体内的代谢; (2)5-FU激活通路并非仅限于TP酶; (3)TP在结构上与血小板衍生内皮细胞生长因子(platelet-derived endothelial cell growth factor, PD-ECGF)属同一物质, 而后者为促进血管生成的重要细胞因子. 有研究显示: 出现淋巴结/血管侵犯及肿瘤浸润深度与TP高表达有关. 因此TP高表达者接受5-FU治疗疗效较差, 在很大程度上是由于TP在促肿瘤血管形成上所起的作用超过了其在催化形成5-FU上所起的作用. 故TP高表达作为提示肿瘤恶性程度指标的意义, 可能大于其作为5-FU疗效预测因子的意义.
作为一种口服的新型氨基甲酸酯氟尿嘧啶类药物, 卡培他滨主要在肝脏和肿瘤组织首先通过羧酸酯酶转化为5'-脱氧-5-氟胞苷(5'-DFCR), 然后再经胞苷脱氨酶转化为5'-脱氧-氟尿苷(5'-DFUR), 再经肿瘤细胞内的TP作用转化为5-FU[13]. 由于骨髓中胞苷脱氨酶和TP表达低, 使卡培他滨在肠黏膜, 血液和骨髓中转化为5-FU的量较少, 减轻了胃肠道和血液学毒性. 而多数肿瘤组织内TP酶含量高于血浆和正常组织, 这种肿瘤内激活的药理机制使卡培他滨在肿瘤组织内更多代谢为5-FU, 约为血浆和正常组织的数倍至数十倍; 提高了化疗有效性并减少了骨髓和胃肠道不良反应.
二氢嘧啶脱氢酶(dihydropyrimidine dehydrogenase, DPD)是5-FU分解过程中的关键酶, 体内80%以上的5-FU均通过DPD代谢失活. DPD活性下降或失活导致5-FU毒性增加. DPD酶在不同肿瘤组织中的表达水平也各不相同. 正常组织中DPD酶的活性可预测5-FU的毒性, 肿瘤组织中DPD酶的活性可以预测5-FU的疗效.
Salonga等[14]对33例接受5-FU化疗的晚期结直肠癌患者, 通过定量RT-PCR技术测定DPD mRNA、TS mRNA和TP mRNA, 发现疗效较好者的DPD表达水平范围窄于疗效差者, 分别为0.63×10-3-2.5×10-3和0.2×10-3-16×10-3(P = 0.019). 现已界定, 使用RT-PCR技术所测定的DPD酶表达临界值为2.5×10-3, 高于此值提示5-FU疗效差, 低于此值提示5-FU可能有效. 2009年WCGIC上ESMO/WCGIC专家委员会公布了关于晚期结直肠癌分子标志物和生物学特性的专家讨论共识, 其中将DPD作为5-FU潜在的化疗毒性及疗效预测标志物, 即DPD低表达者, 5-FU的化疗毒性较大但疗效较好.
迄今已发现20余种DPD基因(DPYD)突变与DPD活性降低有关, 并影响5-FU毒性. van Kuilenburg[15]发现, 剪切位点突变IVS14+1G→A, 即14内含子5'剪切位点处碱基GT突变为AT,可导致DPD失活; 这也是目前发现最为常见的导致5-FU严重毒性的基因突变位点. 1996年发现的第一例带有剪切位点突变IVS14+1G→A的杂合子个体, 就是接受5-FU化疗后发生严重毒性的患者[16]. Podoltsev等[17]在2009年ASCO会议上公布对227例接受5-FU/卡培他滨化疗的白色人种中DPYD基因突变检测结果, 也显示DPYD突变(IVS14+1G→A)者发生严重不良反应的概率明显增加(P = 0.006), 建议对拟接受5-FU/卡培他滨治疗的患者, 应检测其DPYD突变状态, 并以此指导5-FU/卡培他滨的用量调整. 除上述剪切位点突变外, DPYD的其他突变导致DPD酶活性丧失也可导致5-FU毒性增加[18].
总之, DPD mRNA表达水平降低, 可造成DPD酶活性降低, 最终导致5-FU体内清除受阻、半衰期延长、分解减弱而毒性也相应增强. 尽管替吉奥和优福定等药物尝试使用DPD酶抑制剂, 试图提高5-FU疗效, 但全身添加DPD酶抑制剂的不良反应, 如何预测这类药物的疗效等, 尚待进一步明确.
OPRT催化5-FU转化为FuMP和FdUMP. 替吉奥是一种口服氟尿嘧啶类药物, 由替加氟、吉美嘧啶及奥替拉西以1∶0.4∶1.1的摩尔比复方而成. 替加氟是5-FU的前体药物, 吉美嘧啶是DPD酶抑制剂, 可逆性抑制肝脏DPD酶活性, 阻止5-FU降解, 使5-FU在血浆和组织中的浓度得以维持更长时间[19]. 奥替拉西能抑制肠道黏膜细胞内OPRT, 阻断5-FU磷酸化, 减少胃肠道不良反应. 在日本开展的多项临床研究已验证了该药物在东方胃癌人群中的疗效和安全性, 1999年日本批准用于治疗晚期胃癌. 尽管添加DPD酶抑制剂(CDHP)可保持体内较高浓度的5-FU, 但很难做到仅局限于肿瘤区域高浓度. 此外, 全身DPD酶抑制会导致不良反应增多. FLAGS研究(关于在欧美人群中使用S-1治疗晚期胃癌的三期随机对照临床研究)显示含S-1方案与含5-FU方案相比无生存优势, 有学者提出影响FLAGS研究得出阴性结果的主要原因与催化替加氟转化为5-FU的细胞色素P450酶2A6(CYP 2A6)基因多态性密切相关, 该基因在不同人种, 不同个体间差异较大, 可能是造成S-1治疗窗较窄的原因.
优福定是替加氟与尿嘧啶(uracil)按1∶4摩尔比混合而成的复合物. 替加氟为5-FU的衍生物, 在体内细胞色素P450酶作用下转变为5-FU, 作用与5-FU相同, 在体内干扰DNA、RNA及蛋白质的合成, 其毒性为5-FU的1/7-1/4, 化疗指数为5-FU的2倍, 对骨髓及免疫功能影响较轻. 活化5-氟尿嘧啶为5-氟尿嘧啶脱氧核苷酸需要胸苷磷酸酶, 通过以下3条通路涉及: OPRT、尿苷磷酸化酶及TP, 其中OPRT起了重要作用. Ichikawa等[20]通过PT-PCR技术检测37例接受优福定和LV联合化疗的转移性结直肠癌组织OPRT mRNA、TP mRNA和DPD mRNA表达水平, 发现OPRT mRNA水平高者的中位生存期明显长于低者(12.5 mo vs 8.5 mo, P = 0.0019). TP mRNA水平低者中位生存期长于TP mRNA水平高者(14 mo vs 7.4 mo, P = 0.0002). 对化疗有效者肿瘤组织中的OPRT/DPD比值高于无效者(4.3 vs 1.3, P = 0.003). 由此可见, OPRT酶高表达预示着结直肠肿瘤对UFT+LV的化疗敏感性高, OPRT/DPD值较高者提示对UFT+LV化疗疗效较好.
Koopman等[21]进行的CAIRO是一项Ⅲ期、随机、回顾性研究, 对进展期结直肠癌患者化疗的疗效和预后预测因子进行了分析, 803例进展期结直肠癌患者随机分为A组(一线: 卡培他滨, 二线: 伊立替康, 三线: 奥沙利铂联合卡培他滨)和B组(一线: 伊立替康联合卡培他滨, 二线: 奥沙利铂联合卡培他滨), 结果显示, 2组共556例可评价病例, 肿瘤基质中OPRT高表达者中位总生存期(overall survival, OS)明显长于低表达者[21.5 mo(95%CI: 17.9-27.3) vs 17.2 mo(95%CI 15.1-18.6), P = 0.036], 无进展生存期(progression-free survival, PFS)亦如此. 然而, DPD低表达者PFS和OS均长于高表达者[8.9 mo(95%CI: 8.3-9.9) vs 7.2 mo(95%CI: 6.5-8.1), P = 0.006; 21.5 mo(95%CI: 17.9-26.5) vs 16.9 mo(95%CI: 13.0-19.1), P = 0.04]. 据此提出OPRT及DPD可作为卡培他滨单药或联合伊立替康化疗的疗效预测因子.
微卫星(microsatellite)DNA是广泛分布于原核和真核生物基因组中短的串联重复序列, 多位于基因非编码区以及染色体的近端粒区. 在人群中表现为高度多态性主要是由于重复序列长度的数目不同, 正常个体体细胞在生长发育过程中其长度(或重复序列的重复次数)保持不变. 产生微卫星不稳定性(microsatellite instability, MSI)的原因主要是DNA复制过程中滑动或修复时滑动链与互补链碱基错配, 导致一个或几个重复单位的插入或缺失. 由于重复拷贝数发生大的变化而使某些重要功能的基因发生功能改变, 其中涉及到的重要基因是错配修复基因hMHL1、hMSH2、hMSH6等[22].
错配修复基因可查出并纠正DNA复制及DNA损伤过程中出现的未配或错配的碱基, 控制复制和重组的精确性. 该基因突变后可表现为MSI增加以及活性基因的高突变. 如果MSI发生于控制生长和增殖的基因(如BAX和TGFβ), 导致肿瘤发生. 细胞DNA错配修复系统基因突变, 使DNA复制过程中出现的错误无法纠正, 导致基因突变率升高, 微卫星序列和其他序列突变的累积致使MSI的发生, 促进恶变的过程, 最终形成MSI型结肠癌[23]. 错配修复系统功能丧失是MSI型结肠癌形成过程中的早期分子生物学事件.
根据MSI的程度, 可将肿瘤可分成3类: MSI低频型(low-frequency MSI, MSI-L)、微卫星稳定型(microsatellite stability, MSS)、MSI高频型(high-frequency MSI, MSI-H).
Ribic等[24]检测了570例Ⅱ、Ⅲ期结肠癌标本的MSI, 其中95例为高频微卫星不稳定型. 在未接受辅助化疗的287例患者中, MSI-H患者的5年生存率高于MSI-L或MSS患者(死亡风险比为0.31, 95%CI: 0.14-0.72, P = 0.004). 对接受含5-FU方案辅助治疗者, MSI-H与总体生存期间无关联(死亡风险比为1.07, 95%CI: 0.62-1.86, P = 0.80). 多因素分析结果显示, 在接受含氟尿嘧啶药物辅助化疗方案的结肠癌患者中, 仅MSS或MSI-L者总体生存期有所提高(死亡风险比为0.72, 95%CI: 0.53-0.99, P = 0.04); 而MSI-H者接受含氟尿嘧啶药物辅助化疗则有害无益. MSI状态与结肠癌辅助治疗获益与否关系显著(P = 0.01). 根据错配修复蛋白状态, 有助于选择个体化的辅助化疗方案, 以5-FU为基础的术后辅助化疗对错配修复蛋白缺失患者无效, 应避免对这类患者施行不必要的治疗.
继2009 ASCOGI之后, 2009 WCGIC进一步细化报道了PETACC-3研究的分子分析[25], 他是迄今为止病例最多的一项肠癌标志物研究. 分析了1 564例Ⅱ/Ⅲ期结肠癌患者肿瘤组织 P53、TS、SMAD4、MSI、18qLOH、hTERT、KRAS和BRAF等分子标志物的突变率及其预后价值, 结果发现, 某些标志物在Ⅱ/Ⅲ期结肠癌的突变率确实有显著差异, 对不同期别的结肠癌预后预测价值也不尽相同. MSI的高发率只与Ⅱ期结肠癌的预后不良明显相关(P = 0.004), 对Ⅲ期则无预后价值(P = 0.06). MSI-H是Ⅱ期和Ⅲ期结肠癌无复发生存(recurrence-free survival, RFS)和OS的强力预测标志物, 而这种预测价值即使在患者接受5-FU为基础的辅助化疗后仍然显著存在, 即无论Ⅱ期或Ⅲ期肠癌, 也无论患者是否接受5-FU+/-伊立替康的辅助治疗, MSI-H与MSI-L/S患者群体间的生存均存在显著差异. 该研究结果还提示, 无论MSI状态如何, 伊立替康加入辅助治疗均不会改变生存, 显示MSI状态只与5-FU相关[26](表1).
| MSI-H vs MSI-L/S | 5-FU/CPT-11 vs 5-FU | |||||
| HR(95%CI) | 5-FU(n = 633) | 5-FU/CPT-11(n = 621) | 两组 | MSI-H(n = 190) | MSI-L/S(n = 1 064) | |
| Ⅱ期 | RFS | 0.22(0.05-0.94) | 0.29(0.09-0.96) | 0.26(0.11-0.65) P = 0.004 | 1.68(0.28-10.05) | 1.25(0.76-2.06) |
| OS | 0.17(0.02-1.26) | 0.14(0.02-1.03) | 0.153(0.037-0.631) P = 0.009 | 1.14(0.07-18.2) | 1.30(0.71-2.39) | |
| Ⅲ期 | RFS | 0.59(0.34-1.02) | 0.82(0.48-1.40) | 0.69(0.47-1.01) P = 0.060 | 1.17(0.56-2.43) | 0.85(0.68-1.08) P = 0.180 |
| OS | 0.54(0.28-1.07) | 0.85(0.45-1.58) | 0.674(0.426-1.07) P = 0.090 | 1.34(0.56-3.24) | 0.88(0.67-1.15) P = 0.330 | |
| 全部 | RFS | 0.43(0.26-0.71) | 0.57(0.35-0.92) | 0.49(0.35-0.70) P = 0.00008 | 1.24(0.63-2.43) | 0.94(0.76-1.15) |
| OS | 0.38(0.20-0.71) | 0.53(0.29-0.96) | 0.45(0.29-0.69) P = 0.0003 | 1.33(0.58-3.08) | 0.95(0.74-1.22) | |
微小RNA(microRNA, miRNA)是一类长度为18-25 nt的单链RNA, 其本身不具有开放阅读框, 不编码任何蛋白质. miRNA既可能是抑癌基因亦可能是致癌基因, miRNA在肿瘤组织中表达降低被认为是抑癌基因, miRNA在肿瘤组织中过表达被认为是致癌基因.
Boni等[27]将61例无法手术切除的转移性结直肠癌患者纳入研究, 给予5-FU联合伊立替康方案化疗, 且入组的患者均为高加索人, 检测了miRNA的18个单核苷酸多态性(single nucleotide polymorphism, SNP)与疗效的关系. rs7372209位于pri-miR26a-1基因的SNP与化疗有效率和TTP有关(P = 0.041, 0.017), 即CC和CT基因型与TT基因型患者相比, 有效率较高, TTP较长. 另外, rs1834306位于pri-miR-100基因的SNP与较长的TTP有关(P = 0.04). 因此, miRNA多态性可作为转移性结直肠癌患者行5-FU联合伊立替康化疗后临床疗效的预测因子.
2009年世界胃肠肿瘤大会上, 达成了对结直肠癌患者个体化治疗的共识, 强调根据治疗目的和各种标志物信息制定个体化的多学科综合治疗方案. 在化学治疗领域, TS、TP、DPD、OPRT及MSI检测有助于预测氟尿嘧啶类药物的疗效及判断预后.
结直肠癌患者术后接受5-FU为基础的化疗, TS mRNA低表达、TS基因型为2R/2R、DPD mRNA低表达或MSS/MSI-L者化疗敏感性高, 预后好. 若接受UFT化疗, OPRT mRNA高表达者化疗有效率高. 但目前尚未将TP mRNA表达水平作为5-FU化疗的疗效预测因子, TP高表达作为提示肿瘤恶性程度指标的意义可能大于其作为5-FU疗效预测因子的意义. 除此之外, 一些特定分子的表达在预测5-FU疗效上亦起到一定作用, 如APRIL是一种新型的5-FU耐药预测标志物[28], TRAIL-R1低表达且TRAIL-R3高表达的结直肠癌患者5-FU化疗的疗效差[29].
总之, 如何根据不同分期及预后或疗效/毒性预测标志物来指导临床用药, 尚需要大样本的回顾性和前瞻性随机对照研究予以证实, 相信随着一些临床试验结果的陆续报道, 高效、低毒、效价比合理、遵循循证医学证据的个体化治疗将会得到进一步发展, 结直肠癌患者的总体5年生存率将会有明显的提高.
选择高效低毒的药物及组合是提高实体瘤疗效的关键问题之一. 由于肿瘤异质性、种族和个体的差异, 对化疗药物的有效率及毒性各不相同. 仅依赖群体研究结果数据的循证医学标准化疗难以完全指导临床实践, 在药物遗传学和(或)基因组学检测指导下的"个体化化疗"被日益重视.
刘宝瑞, 教授, 南京大学医学院附属鼓楼医院肿瘤中心
尽管替吉奥和优福定等药物尝试使用DPD酶抑制剂, 试图提高5-FU疗效, 但全身添加DPD酶抑制剂的不良反应, 如何预测这类药物的疗效等, 尚待进一步明确.
Ribic等检测了570例Ⅱ、Ⅲ期结肠癌标本的微卫星的不稳定性(MSI), 其中95例为高频微卫星不稳定型. 在未接受辅助化疗的287例患者中, MSI-H患者的5年生存率高于MSI-L或MSS患者(死亡风险比为0.31, 95%CI: 0.14-0.72, P = 0.004).
本文科学性一般, 具有一定的可读性和参考价值.
编辑: 李薇 电编:何基才
| 1. | Serdar MA, Sertoğlu E, Uyanık M, Tapan S, Akın O, Cihan M. Determination of 5-fluorouracil and dihydrofluorouracil levels by using a liquid chromatography-tandem mass spectrometry method for evaluation of dihydropyrimidine dehydrogenase enzyme activity. Cancer Chemother Pharmacol. 2010; Nov 24. [Epub ahead of print]. [PubMed] |
| 2. | Hur H, Kang J, Kim NK, Min BS, Lee KY, Shin SJ, Keum KC, Choi J, Kim H, Choi SH. Thymidylate Synthase Gene Polymorphism Affects the Response to Preoperative 5-Fluorouracil Chemoradiation Therapy in Patients With Rectal Cancer. Int J Radiat Oncol Biol Phys. 2010; Oct 5. [Epub ahead of print]. [PubMed] |
| 3. | Soong R, Shah N, Salto-Tellez M, Tai BC, Soo RA, Han HC, Ng SS, Tan WL, Zeps N, Joseph D. Prognostic significance of thymidylate synthase, dihydropyrimidine dehydrogenase and thymidine phosphorylase protein expression in colorectal cancer patients treated with or without 5-fluorouracil-based chemotherapy. Ann Oncol. 2008;19:915-919. [PubMed] [DOI] |
| 4. | Leichman CG, Lenz HJ, Leichman L, Danenberg K, Baranda J, Groshen S, Boswell W, Metzger R, Tan M, Danenberg PV. Quantitation of intratumoral thymidylate synthase expression predicts for disseminated colorectal cancer response and resistance to protracted-infusion fluorouracil and weekly leucovorin. J Clin Oncol. 1997;15:3223-3229. [PubMed] |
| 5. | Qiu LX, Tang QY, Bai JL, Qian XP, Li RT, Liu BR, Zheng MH. Predictive value of thymidylate synthase expression in advanced colorectal cancer patients receiving fluoropyrimidine-based chemotherapy: evidence from 24 studies. Int J Cancer. 2008;123:2384-2389. [PubMed] [DOI] |
| 6. | Horie N, Aiba H, Oguro K, Hojo H, Takeishi K. Functional analysis and DNA polymorphism of the tandemly repeated sequences in the 5'-terminal regulatory region of the human gene for thymidylate synthase. Cell Struct Funct. 1995;20:191-197. [PubMed] [DOI] |
| 7. | Lecomte T, Ferraz JM, Zinzindohoué F, Loriot MA, Tregouet DA, Landi B, Berger A, Cugnenc PH, Jian R, Beaune P. Thymidylate synthase gene polymorphism predicts toxicity in colorectal cancer patients receiving 5-fluorouracil-based chemotherapy. Clin Cancer Res. 2004;10:5880-5888. [PubMed] [DOI] |
| 8. | Martinez-Balibrea E, Abad A, Valladares M, Martinez-Villacampa M, Aranda E, Marcuello E, Benavides M, Martinez-Cardús A, Ginés A, Manzano JL. Pharmacogenetic analysis of TS and UGT1A polymorphisms predictive for response and toxicity in Spanish patients with advanced colorectal cancer treated with first-line irinotecan and 5-fluorouracil. 2009 ASCO Annual Meeting Proceedings. J Clin Oncol. 2009;27:Abstract 4066. |
| 9. | Ulrich CM, Bigler J, Velicer CM, Greene EA, Farin FM, Potter JD. Searching expressed sequence tag databases: discovery and confirmation of a common polymorphism in the thymidylate synthase gene. Cancer Epidemiol Biomarkers Prev. 2000;9:1381-1385. [PubMed] |
| 10. | Lurje G, Pohl A, Yang D, Zhang W, Husain H, Hendifar AE, Ashouri S, Ning Y, Iqbal S, El-Khoueiry A. Thymidylate Synthase 1494del6bp polymorphism is a prognostic factor in patients with metastatic colon cancer. : Gastrointestinal Cancers Symposium 2008; Abstract 408. |
| 11. | Uchida K, Danenberg PV, Danenberg KD, Grem JL. Thymidylate synthase, dihydropyrimidine dehydrogenase, ERCC1, and thymidine phosphorylase gene expression in primary and metastatic gastrointestinal adenocarcinoma tissue in patients treated on a phase I trial of oxaliplatin and capecitabine. BMC Cancer. 2008;8:386. [PubMed] [DOI] |
| 12. | Gustavsson B, Kaiser C, Carlsson G, Wettergren Y, Odin E, Lindskog EB, Niyikiza C, Ma D. Molecular determinants of efficacy for 5-FU-based treatments in advanced colorectal cancer: mRNA expression for 18 chemotherapy-related genes. Int J Cancer. 2009;124:1220-1226. [PubMed] [DOI] |
| 13. | Miwa M, Ura M, Nishida M, Sawada N, Ishikawa T, Mori K, Shimma N, Umeda I, Ishitsuka H. Design of a novel oral fluoropyrimidine carbamate, capecitabine, which generates 5-fluorouracil selectively in tumours by enzymes concentrated in human liver and cancer tissue. Eur J Cancer. 1998;34:1274-1281. [PubMed] [DOI] |
| 14. | Salonga D, Danenberg KD, Johnson M, Metzger R, Groshen S, Tsao-Wei DD, Lenz HJ, Leichman CG, Leichman L, Diasio RB. Colorectal tumors responding to 5-fluorouracil have low gene expression levels of dihydropyrimidine dehydrogenase, thymidylate synthase, and thymidine phosphorylase. Clin Cancer Res. 2000;6:1322-1327. [PubMed] |
| 15. | van Kuilenburg AB. Dihydropyrimidine dehydrogenase and the efficacy and toxicity of 5-fluorouracil. Eur J Cancer. 2004;40:939-950. [PubMed] [DOI] |
| 16. | Wei X, McLeod HL, McMurrough J, Gonzalez FJ, Fernandez-Salguero P. Molecular basis of the human dihydropyrimidine dehydrogenase deficiency and 5-fluorouracil toxicity. J Clin Invest. 1996;98:610-615. [PubMed] [DOI] |
| 17. | Podoltsev NA, Saif MW, Yale Cancer Center, Yale University School of Medicine, New Haven, CT. Dihydropyrimidine dehydrogenase gene (DPYD) polymorphism among Caucasian patients (pts) with 5-FU and capecitabine (CAP)-related toxicity. 2009 ASCO Annual Meeting. J Clin Oncol. 2009;27:Abstract e14588. |
| 18. | Tibbetts MD, Zheng L, Lenardo MJ. The death effector domain protein family: regulators of cellular homeostasis. Nat Immunol. 2003;4:404-409. [PubMed] [DOI] |
| 19. | Shirasaka T, Nakano K, Takechi T, Satake H, Uchida J, Fujioka A, Saito H, Okabe H, Oyama K, Takeda S. Antitumor activity of 1 M tegafur-0.4 M 5-chloro-2,4-dihydroxypyridine-1 M potassium oxonate (S-1) against human colon carcinoma orthotopically implanted into nude rats. Cancer Res. 1996;56:2602-2606. [PubMed] |
| 20. | Ichikawa W, Uetake H, Shirota Y, Yamada H, Takahashi T, Nihei Z, Sugihara K, Sasaki Y, Hirayama R. Both gene expression for orotate phosphoribosyltransferase and its ratio to dihydropyrimidine dehydrogenase influence outcome following fluoropyrimidine-based chemotherapy for metastatic colorectal cancer. Br J Cancer. 2003;89:1486-1492. [PubMed] [DOI] |
| 21. | Koopman M, Venderbosch S, van Tinteren H, Ligtenberg MJ, Nagtegaal I, Van Krieken JH, Punt CJ. Predictive and prognostic markers for the outcome of chemotherapy in advanced colorectal cancer, a retrospective analysis of the phase III randomised CAIRO study. Eur J Cancer. 2009;45:1999-2006. [PubMed] [DOI] |
| 22. | Solomon CH, Pho LN, Burt RW. Current status of genetic testing for colorectal cancer susceptibility. Oncology (Williston Park). 2002;16:161-171; discussion 176, 179-180. [PubMed] |
| 23. | Alazzouzi H, Domingo E, González S, Blanco I, Armengol M, Espín E, Plaja A, Schwartz S, Capella G, Schwartz S Jr. Low levels of microsatellite instability characterize MLH1 and MSH2 HNPCC carriers before tumor diagnosis. Hum Mol Genet. 2005;14:235-239. [PubMed] [DOI] |
| 24. | Ribic CM, Sargent DJ, Moore MJ, Thibodeau SN, French AJ, Goldberg RM, Hamilton SR, Laurent-Puig P, Gryfe R, Shepherd LE. Tumor microsatellite-instability status as a predictor of benefit from fluorouracil-based adjuvant chemotherapy for colon cancer. N Engl J Med. 2003;349:247-257. [PubMed] [DOI] |
| 25. | Roth AD, Tejpar S, Yan P, Fiocca R, Klingbiel D, Delorenzi M, Labianca R, Cunningham D, Van Cutsem E, Bosman F. Correlation of molecular markers in colon cancer with stage-specific prognosis: Results of the translational study on the PETACC 3 - EORTC 40993-SAKK 60-00 trial. 2009;Abstract 288. |
| 26. | Tejpar S, Bosman F, Delorenzi M, Fiocca R, Yan P, Klingbiel D, Dietrich D, Van Cutsem E, Labianca R, Roth A. Microsatellite instability (MSI) in stage II and III colon cancer treated with 5FU-LV or 5FU-LV and irinotecan (PETACC 3-EORTC 40993-SAKK 60/00 trial). 2009 ASCO Annual Meeting. J Clin Oncol. 2009;27:Abstract 4001. |
| 27. | Boni V, Zarate R, Villa JC, Bandrés E, Gomez MA, Maiello E, Garcia-Foncillas J, Aranda E. Role of primary miRNA polymorphic variants in metastatic colon cancer patients treated with 5-fluorouracil and irinotecan. Pharmacogenomics J. 2010; Jun 29. [Epub ahead of print]. [PubMed] |
| 28. | Petty RD, Samuel LM, Murray GI, MacDonald G, O'Kelly T, Loudon M, Binnie N, Aly E, McKinlay A, Wang W. APRIL is a novel clinical chemo-resistance biomarker in colorectal adenocarcinoma identified by gene expression profiling. BMC Cancer. 2009;9:434. [PubMed] [DOI] |
| 29. | Granci V, Bibeau F, Kramar A, Boissière-Michot F, Thézénas S, Thirion A, Gongora C, Martineau P, Del Rio M, Ychou M. Prognostic significance of TRAIL-R1 and TRAIL-R3 expression in metastatic colorectal carcinomas. Eur J Cancer. 2008;44:2312-2318. [PubMed] [DOI] |