修回日期: 2010-11-22
接受日期: 2010-12-01
在线出版日期: 2011-01-18
目的: 比较荧光原位杂交(FISH)法与免疫组织化学(IHC)染色法检测胃癌组织HER-2基因状态的一致性.
方法: 选择本课题组前期IHC染色法检测775例胃腺癌标本中HER-2蛋白表达为(2+)及(3+)的病例, 应用FISH法对HER-2基因扩增情况进行验证.
结果: FISH结果显示, 86例HER(3+)标本中, 60例存在HER-2基因扩增, 符合率69.77%; 26例阴性病例中10例为多倍体, 占38.46%. 43例HER-2(2+)的病例中, 6例(13.95%)存在HER-2基因扩增; 37例阴性病例中20例为多倍体, 占54.05%. 全组扩增效果不满意率1.97%(3/152).
结论: IHC可作为HER-2状态的初步筛查方法, 对于IHC检测HER-2(3+)及HER-2(2+)拟行靶向治疗的病例仍有必要进一步行FISH检测, 以确定HER-2基因状态, 同时在评价HER-2基因状态时, 要考虑17号染色体多体的影响因素.
引文著录: 钟山, 余英豪, 黄红浪, 刘伟, 陈娟. 荧光原位杂交法对胃癌组织HER-2基因状态的检测. 世界华人消化杂志 2011; 19(2): 132-137
Revised: November 22, 2010
Accepted: December 1, 2010
Published online: January 18, 2011
AIM: To compare immunohistochemistry (IHC) and fluorescence in situ hybridization (FISH) for detection of HER-2/neu gene status in gastric cancer.
METHODS: HER-2 protein expression was examined by IHC in 775 gastric adenocarcinoma specimens. The amplification of HER-2 gene in gastric cancer specimens which were demonstrated to be HER-2 (2+) and (3+) by IHC was detected by FISH.
RESULTS: There are 60 cases of gene amplification in 86 HER-2 (3+) specimens (69.77%), and in 26 cases of HER-2 (3+) specimens without gene amplification, 10 (38.46%) cases of chromosome 17 polyploidy were detected. However, there are only 6 cases of gene amplification in 43 HER-2 (2+) specimens (13.95%), and in 37 cases of HER-2 (2+) specimens without gene amplification, 20 (54.05%) cases of chromosome 17 polyploidy were detected.
CONCLUSION: IHC can be used for initial detection of HER-2 gene status. HER-2 (3+) and HER-2 (2+) cases should be further detected by FISH to analyze HER-2 gene status. Chromosome 17 polyploid should be considered in the evaluation of HER-2 gene status.
- Citation: Zhong S, Yu YH, Huang HL, Liu W, Chen J. Evaluation of HER-2 gene status in gastric cancer by fluorescence in situ hybridization. Shijie Huaren Xiaohua Zazhi 2011; 19(2): 132-137
- URL: https://www.wjgnet.com/1009-3079/full/v19/i2/132.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i2.132
胃癌病例诊断时大部分都已处于晚期, 且治疗效果多欠理想. 随着靶向药物在胃癌中大规模临床试验的开展, 为胃癌的治疗提供了新的思路. 人类表皮生长因子受体2(human epidermal growth factor-2, HER-2)基因作为胃癌靶向治疗靶点的作用也因此成为学术界关注的焦点. 伴随而来的是基因检测准确性的问题. 本课题组前期采用免疫组织化学(immunohistochemistry, IHC)染色法对大宗胃癌病例HER-2蛋白表达情况进行了研究, 初步获得了我国胃癌人群HER-2蛋白表达的数据[1]. 本文拟采用荧光原位杂交(fluorescence in situ hybridization, FISH)法对经IHC证实HER-2表达(2+)以上的病例进行验证, 了解IHC与FISH两种方法检测胃癌组织HER-2基因状态的一致性, 以期寻找出检测胃癌组织中HER-2基因状态的最佳实验方法, 为临床更进一步实施靶向治疗提供指导性意见.
本课题组前期对2006-01/2009-08中国人民解放军南京军区福州总医院病理科经手术切除, 病理证实为胃腺癌标本775例进行了HER-2蛋白的IHC染色检测. 本实验选择前期经IHC检测为HER-2(3+)病例88例, HER-2(2+)病例44例, HER-2(+)病例10例, HER-2(-)病例10例共152例行FISH检测. IHC染色方法、所用试剂及IHC结果判断参照相关文献[1]. 原位杂交试剂包括: DNA FISH探针、2×SSC缓冲液、蛋白酶K、10% NP-40、DAPI复染剂等均购自北京金菩嘉医疗科技公司.
1.2.1 FISH实验步骤: 在IHC染色的标本切片中选取实验区域, 对照切片划出蜡块实验部分; 从蜡块中切取5 μm切片3张, 置于防脱玻片上; 将组织切片置于烤箱中(65 ℃)烘烤过夜; 二甲苯脱蜡和梯度酒精水化; 酸性亚硫酸钠还原30-40 min(水浴50 ℃); 两缸2×SSC缓冲液洗2遍, 每缸各5 min; 蛋白酶K消化(水浴37 ℃)(消化时间需要镜下DAPI复染后判断, 时间15-30 min, 视具体病例而定, 含有黏液、纤维多的组织及细胞小的病例需要消化的时间更长); 两缸2×SSC缓冲液洗2遍, 每缸各5 min; 依次过700 mL/L乙醇、850 mL/L乙醇、1000 mL/L乙醇各3 min, 自然晾干; 配制探针: 将探针盒离心, 取2 μL探针加8 μL缓冲液, 震荡, 离心, 制成10 μL探针混合物; 探针与样本杂交: 将10 μL探针混合物滴加于玻片杂交区, 加盖盖玻片, 用进口橡皮胶封边, 将玻片置于杂交盒中过夜杂交; 次日, 取出切片, 除去封边胶, 放进46 ℃水浴箱中2×SSC漂洗2次, 每次10 min; 然后放进46 ℃水浴箱中10% NP-40中漂洗1次, 5 min; 后移至700 mL/L中漂洗1次, 3 min, 取出切片, 自然晾干; 加10 μL DAPI复染剂, 盖上盖玻片, 放置10 min. 立即荧光显微镜下计数信号.
1.2.2 结果判断: 计数30个细胞, 统计Ratio值(Ratio值 = 30个细胞核中红信号总数/30个细胞核中绿信号总数). Ratio<1.8为阴性结果, 提示该样本无HER-2基因扩增; Ratio>2.2为阳性结果, 提示样本中HER-2基因发生扩增; Ratio在1.8-2.2, 增加计数细胞至100个, 或重做FISH实验来判断最终结果; 如出现异常细胞聚集, 或出现多个细胞, 每个细胞核中红色信号>10-15个, 则判断为阳性结果. 每个细胞核中绿色信号>2.25个, 判断为染色体多体.
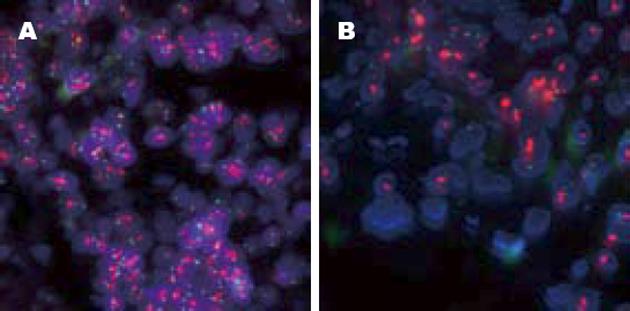
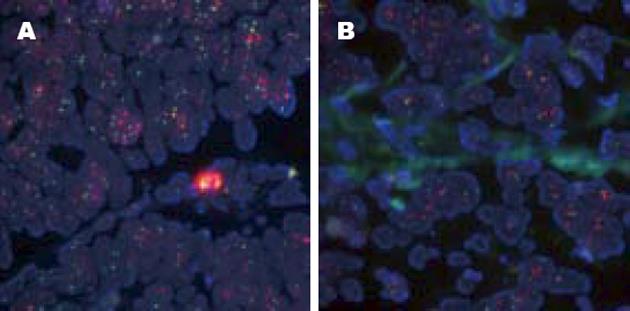
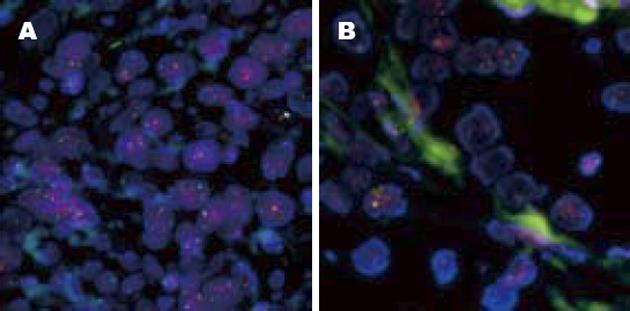
86例IHC(3+)病例中60例FISH检测存在HER-2基因扩增, 阳性符合率为69.77%. 43例IHC(2+)病例中6例FISH检测存在HER-2基因扩增, 阳性符合率为13.95%. 随机挑选的IHC(+)的10例病例中1例存在HER-2基因扩增, IHC(-)的10例病例均未见HER-2基因扩增(图1-3).
26例IHC(3+)而FISH阴性病例中10例为多倍体, 占38.46%; 16例为单倍体, 占61.54%. 37例IHC(2+)而FISH阴性病例中20例为多倍体, 占54.05%; 17例为单倍体, 占45.95%(图1-3).
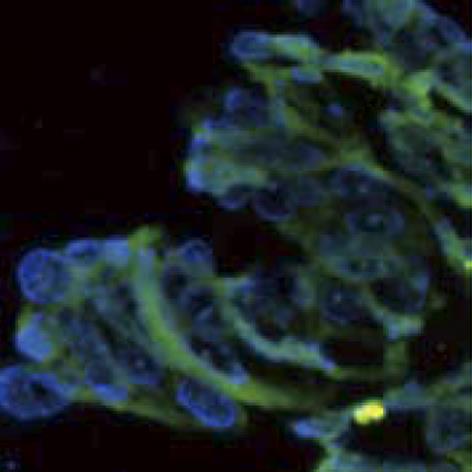
IHC(3+)病例中有2例扩增效果不满意(图4); IHC(2+)1例扩增效果不满意. 总的扩增不满意率为1.97%(3/152).
HER-2系表皮生长因子受体家族的第2个成员. 定位于人类染色体17q21上, 编码相对分子质量为185 000 Da的单链跨膜糖蛋白, 即P185. 包括胞内区、跨膜区和胞外区. HER-2不需要配体结合[2], 是其他HER家族异源二聚体的首选组成部分. 当人体中HER-2基因大量扩增, 会引起其蛋白产物P185的过度表达, HER-2受体异源二聚体形成数量增加, 引起细胞内酪氨酸激酶活性增加, 发生酪氨酸自身磷酸化, 激活多种信号转导途径, 使细胞大量增殖, 同时抑制凋亡, 从而发生癌变[3]. 在乳腺癌、卵巢癌、胃癌、肺腺癌等许多恶性肿瘤中存在HER-2基因扩增或蛋白的过度表达, 其中20%-30%的浸润性乳腺癌患者出现HER-2基因的扩增和/或HER-2蛋白的过表达[4-6]. 文献报道胃癌中HER-2基因的扩增率为7.1%-42.6%[7-13], 过表达率为6.8-34%[7,9,10,13-22]. 由于HER-2基因编码的蛋白位于细胞表面, 容易与抗体接近, 因此适合成为抗肿瘤免疫治疗的靶位. 目前与HER-2相关的靶向治疗药物主要有赫赛汀(Herceptin)和拉帕替尼(lapatinib)等. Herceptin活性成分为曲妥珠单抗(trastuzumab), 是一种重组DNA衍生的人源化单克隆抗体, 选择性的作用于HER-2过度表达的肿瘤细胞. 曲妥珠单抗经美国FDA批准, 目前主要用于晚期转移性乳腺癌的临床治疗及与其他药物联合应用治疗手术后HER-2阳性的乳腺癌. 在胃癌治疗方面, Herceptin在HER-2阳性的胃癌治疗方面的作用也正在得到更进一步的证实. ToGA研究的临床Ⅲ期实验结果显示[23], 在标准化疗药物中添加Herceptin后, 能显著延长HER-2阳性的晚期和不适合手术的胃癌患者的生存期. 不仅使患者的存活期由11.1 mo提高到了13.5 mo, 而且未出现明显的不良反应. 基于ToGA研究结果, 据报道, 欧盟委员会已批准对HER-2阳性转移性胃癌化疗患者使用Herceptin. 罗氏公司也已向FDA提交了Herceptin与化疗药物联合治疗中晚期胃癌的补充性生物制品许可申请. 随着对靶向治疗药物研究的深入, HER-2状态的检测也就显得尤为重要, 针对准备行靶向治疗的病例, 如何获得HER-2状态检测最实用可靠的依据将是临床及病理科所关注的问题.
目前常用的HER-2检测方法主要有IHC和FISH两种. 关于应用FISH检测大宗病例胃癌组织中HER-2基因状态国内还少有报道. 因此应用FISH与IHC等检测HER-2基因状态实验方法的结果是否一致, 可能导致两者出现差异的原因, 以及检测HER-2基因的最合适方法等问题还需进一步探讨.
IHC和FISH方法各有优缺点. IHC技术由于具有简便、廉价、快速等特点, 更易推广, 是目前病理学实验室检测HER-2状态的首选方法. 但该技术存在一些潜在问题, 如组织固定与处理容易使蛋白质受损, 抗原修复过程引起敏感性和特异性的差别, 抗体的批次存在差异, 染色结果的观察具有主观性, 癌组织染色体非整倍体等遗传学特征性改变导致的IHC假阳性问题等使HER-2检测结果存在着一定的不确定性. 与蛋白质相比, DNA的稳定性则好得多. 因此应用FISH检测HER-2基因扩增是目前国际上公认诊断HER-2状态的金标准, 具有快速、准确及灵敏度高等特点. FISH方法运用荧光基团标记特异性的DNA探针, 再将标记了荧光信号的探针与待测样本进行原位杂交, 在荧光显微镜下对荧光信号进行辨别和计数, 最终通过荧光信号的颜色和数目的异常与否, 客观地量化了检测结果. 具有在实验操作过程中受到的影响较小, 可以消除多倍体的干扰, 结果定量判读, 尽量避免了主观上的误差等优点. 据报道, HER-2基因定位在17号染色体上, 17号染色体多体可影响HER-2基因扩增的判读[24]. 17号染色体出现多倍体时, HER-2基因亦同步扩增, 当然这并不是HER-2基因真正扩增, 而是由于17号染色体多体引起, 属于假阳性结果; 因此检测HER-2基因扩增必须同时有17号染色体作为参考, 这样可以避免因为17号染色体多体产生的假阳性结果. 此外, FISH检测还存在实验过程较复杂, 实验时间长, 探针费用较昂贵, 荧光信号容易淬灭等缺点.
关于在胃癌组织中FISH与IHC方法检测HER-2基因状态的对比的大样本实验还比较少. Yano等[9]研究了200例手术切除标本, 认为应用IHC方法有23%病例有HER-2蛋白过表达, FISH方法有27%病例存在HER-2基因扩增, 两者符合率86.7%[(2+)为58.5%, (3+)为88.2%]. Hofmann等[13]分析了168个病例, IHC与FISH的一致性达93.5%, 其中11例病例FISH阳性, 而IHC阴性(0- +)或可疑(2+). 认为系腺上皮基底膜外侧的染色(不完整的膜染色)以及胃癌肿瘤异质性更为常见的原因导致IHC与FISH检测结果的偏差. 另一组[25]关于胃癌IHC与FISH一致性的研究结果为86.9%. 国内宋岩等[26]报道HER-2/neu蛋白过表达的病例中76%存在基因扩增. HER-2研究全国协作组[27]认为在胃癌中HER-2应用IHC方法评分(3+)的病例显色原位杂交(chromogenic in situ hybridization, CISH)基因扩增符合率均>90%, IHC评分(2+)的基因符合率明显降低. 提示胃癌中HER-2评分(3+)过表达主要原因是源于基因扩增. 由于蛋白过表达与基因扩增不相符, 导致IHC检测结果高于CISH检测结果, 可能与17号染色体的多体以及IHC的假阳性等因素有关. 也有其他研究支持17号染色体多体是造成IHC"2+"/"3+"而FISH检测阴性的主要原因[28,29].
本实验应用FISH方法检测经IHC证实为(3+)、(2+)及部分(0)、(+)胃癌HER-2基因状态. 实验显示胃癌组织IHC HER-2(3+)的88例中有2例FISH扩增效果不满意, 60例存在HER-2基因扩增, HER-2基因扩增符合率为69.77%, 低于国外的报道. 在FISH检测阴性的26例病例中, 有10例(38.46%)为多倍体, 16例(61.54%)为单倍体. IHC HER-2(2+)的44例中1例FISH扩增效果不满意, 6例FISH检测存在HER-2基因扩增, 阳性符合率为13.95%. 37例阴性的病例中有20例(54.05%)为多倍体, 17例(45.95%)为单倍体. HER-2蛋白表达与基因扩增的符合率较国外报道低, 考虑可能与本组胃癌中17号染色体多体出现的比例较高, 导致IHC HER-2(3+)及(2+)的病例HER-2基因扩增符合率低于有关国外文献报道. 17号染色体多体在胃癌IHC HER-2(2+)的病例中更多见, 实验结果提示IHC HER-2(2+)的病例有必要再行FISH检测以进一步证实基因扩增情况. 同时由于关于17号染色体多体的判断标准不一, 有些文献以>3个绿色信号/每个细胞核为标准, 有些文献以>2.25个绿色信号/每个细胞核为标准, 本文以>2.25个绿色信号/每个细胞核为标准, 这可能是多倍体百分比率较高的原因之一. 由此可见, 准确评价染色体多体的影响还需要统一的定义[30]. 扩增效果不满意的病例考虑可能与标本未及时固定、固定液配比及蜡块保存情况等因素有关.
由于实验经费等原因, 我们暂时无法将IHC HER-2(0)及(+)的病例全部进行FISH检测. 因此, IHC HER-2(0)及(+)的病例HER-2基因扩增情况还无法确切统计. 我们随机挑选各10例病例行FISH检测, 发现IHC(+)的病例中基因扩增率为10%, 与IHC(2+)病例的扩增率接近. 由此可见, 胃癌中IHC(+)病例基因扩增情况也是值得重视的.
IHC HER-2强阳性表达与FISH检测HER-2基因扩增的结果间存在一定的不一致性, IHC可作为HER-2状态的初步筛查方法, 但对于IHC(2+)及IHC(3+)的胃癌患者, 特别对那些靶向治疗的候选患者, 仍有必要应用FISH方法检测其HER-2基因状态, 为Herceptin等靶向药物的使用提供指导.
抗HER-2单抗Herceptin现已广泛应用于晚期乳腺癌的靶向治疗, 相关文献报道其在胃癌的治疗中也已显示出了一定的疗效. 寻求准确、快速的检测胃癌组织中HER-2状态的方法, 为胃癌的靶向治疗提供可靠的参考依据是临床的迫切需要.
徐宁志, 研究员, 中国医学科学院肿瘤研究所细胞生物与分子生物学实验室
随着靶向药物在胃癌中大规模临床试验的开展, 为胃癌的治疗提供了新的思路. 人类表皮生长因子受体2(HER-2)基因作为胃癌靶向治疗靶点的作用也因此成为学术界关注的焦点.
本文采用大宗病例研究, 综合评价HER-2基因扩增与胃癌HER-2蛋白表达及靶向治疗的关系.
本研究应用IHC检测HER(3+)的标本, HER-2基因扩增率仅为69.77%, 提示IHC虽可作为HER-2状态的初步筛查方法, 但对于IHC检测HER-2(3+/2+)拟行靶向治疗的病例仍有必要进一步行FISH检测.
本文学术性较好, 具有明显的临床指导意义.
编辑: 曹丽鸥 电编:何基才
| 1. | 陈 娟, 李 东石, 余 英豪, 王 烈, 欧阳 学农, 谢 飞来, 熊 喜生. Her-2蛋白在胃癌中的表达及其临床意义. 世界华人消化杂志. 2010;18:1375-1379. [DOI] |
| 2. | Alroy I, Yarden Y. The ErbB signaling network in embryogenesis and oncogenesis: signal diversification through combinatorial ligand-receptor interactions. FEBS Lett. 1997;410:83-86. [PubMed] [DOI] |
| 3. | Hung MC, Lau YK. Basic science of HER-2/neu: a review. Semin Oncol. 1999;26:51-59. [PubMed] |
| 4. | Ménard S, Casalini P, Campiglio M, Pupa S, Agresti R, Tagliabue E. HER2 overexpression in various tumor types, focussing on its relationship to the development of invasive breast cancer. Ann Oncol. 2001;12 Suppl 1:S15-S19. [PubMed] [DOI] |
| 5. | Press MF, Slamon DJ, Flom KJ, Park J, Zhou JY, Bernstein L. Evaluation of HER-2/neu gene amplification and overexpression: comparison of frequently used assay methods in a molecularly characterized cohort of breast cancer specimens. J Clin Oncol. 2002;20:30095-30105. [PubMed] |
| 6. | Slamon DJ, Godolphin W, Jones LA, Holt JA, Wong SG, Keith DE, Levin WJ, Stuart SG, Udove J, Ullrich A. Studies of the HER-2/neu proto-oncogene in human breast and ovarian cancer. Science. 1989;244:707-712. [PubMed] [DOI] |
| 7. | Takehana T, Kunitomo K, Kono K, Kitahara F, Iizuka H, Matsumoto Y, Fujino MA, Ooi A. Status of c-erbB-2 in gastric adenocarcinoma: a comparative study of immunohistochemistry, fluorescence in situ hybridization and enzyme-linked immuno-sorbent assay. Int J Cancer. 2002;98:833-837. [PubMed] [DOI] |
| 8. | Tanner M, Hollmén M, Junttila TT, Kapanen AI, Tommola S, Soini Y, Helin H, Salo J, Joensuu H, Sihvo E. Amplification of HER-2 in gastric carcinoma: association with Topoisomerase IIalpha gene amplification, intestinal type, poor prognosis and sensitivity to trastuzumab. Ann Oncol. 2005;16:273-278. [PubMed] [DOI] |
| 9. | Yano T, Ochiai A, Doi T, Hashizume K, Nakanishi M, Ouchi K, Tanaka Y, Ohtsu A. Expression of HER2 in gastric cancer: comparison between protein expression and gene amplification using a new commercial kit. J Clin Oncol. 2004;22:4053. |
| 10. | Risio M, De Rosa G, Sarotto I, Casorzo L, Capussotti L, Torchio B, Aglietta M, Chiecchio L. HER2 testing in gastric cancer: molecular morphology and storage time-related changes in archival samples. Int J Oncol. 2003;23:1381-1387. [PubMed] |
| 11. | Brien TP, Depowski PL, Sheehan CE, Ross JS, McKenna BJ. Prognostic factors in gastric cancer. Mod Pathol. 1998;11:870-877. [PubMed] |
| 12. | Ishikawa T, Kobayashi M, Mai M, Suzuki T, Ooi A. Amplification of the c-erbB-2 (HER-2/neu) gene in gastric cancer cells. Detection by fluorescence in situ hybridization. Am J Pathol. 1997;151:761-768. [PubMed] |
| 13. | Hofmann M, Stoss O, Shi D, Büttner R, van de Vijver M, Kim W, Ochiai A, Rüschoff J, Henkel T. Assessment of a HER2 scoring system for gastric cancer: results from a validation study. Histopathology. 2008;52:797-805. [PubMed] [DOI] |
| 14. | Koeppen HK, Wright BD, Burt AD, Quirke P, McNicol AM, Dybdal NO, Sliwkowski MX, Hillan KJ. Overexpression of HER2/neu in solid tumours: an immunohistochemical survey. Histopathology. 2001;38:96-104. [PubMed] [DOI] |
| 15. | Allgayer H, Babic R, Gruetzner KU, Tarabichi A, Schildberg FW, Heiss MM. c-erbB-2 is of independent prognostic relevance in gastric cancer and is associated with the expression of tumor-associated protease systems. J Clin Oncol. 2000;18:2201-2209. [PubMed] |
| 16. | Gürel S, Dolar E, Yerci O, Samli B, Oztürk H, Nak SG, Gülten M, Memik F. The relationship between c-erbB-2 oncogene expression and clinicopathological factors in gastric cancer. J Int Med Res. 1999;27:74-78. [PubMed] |
| 17. | Lee KE, Lee HJ, Kim YH, Yu HJ, Yang HK, Kim WH, Lee KU, Choe KJ, Kim JP. Prognostic significance of p53, nm23, PCNA and c-erbB-2 in gastric cancer. Jpn J Clin Oncol. 2003;33:173-179. [PubMed] [DOI] |
| 18. | Ougolkov A, Yamashita K, Bilim V, Takahashi Y, Mai M, Minamoto T. Abnormal expression of E-cadherin, beta-catenin, and c-erbB-2 in advanced gastric cancer: its association with liver metastasis. Int J Colorectal Dis. 2003;18:160-166. [PubMed] |
| 19. | Sanz-Ortega J, Steinberg SM, Moro E, Saez M, Lopez JA, Sierra E, Sanz-Esponera J, Merino MJ. Comparative study of tumor angiogenesis and immunohistochemistry for p53, c-ErbB2, c-myc and EGFr as prognostic factors in gastric cancer. Histol Histopathol. 2000;15:455-462. [PubMed] |
| 20. | Wang YL, Sheu BS, Yang HB, Lin PW, Chang YC. Overexpression of c-erb-B2 proteins in tumor and non-tumor parts of gastric adenocarcinoma--emphasis on its relation to H. pylori infection and clinicohistological characteristics. Hepatogastroenterology. 2002;49:1172-1176. [PubMed] |
| 21. | Pinto-de-Sousa J, David L, Almeida R, Leitão D, Preto JR, Seixas M, Pimenta A. c-erb B-2 expression is associated with tumor location and venous invasion and influences survival of patients with gastric carcinoma. Int J Surg Pathol. 2002;10:247-256. [PubMed] [DOI] |
| 23. | Van Cutsem E, Kang Y, Chung H, Shen L, Sawaki A, Lordick F, Hill J, Lehle M, Feyereislova A, Bang Y. Efficacy results from the ToGA trial: A phase III study of trastuzumab added to standard chemotherapy (CT) in first-line human epidermal growth factor receptor 2 (HER2)-positive advanced gastric cancer (GC). J Clin Oncol. 2009;27:LBA4509. |
| 24. | Hammock L, Lewis M, Phillips C, Cohen C. Strong HER-2/neu protein overexpression by immunohistochemistry often does not predict oncogene amplification by fluorescence in situ hybridization. Hum Pathol. 2003;34:1043-1047. [PubMed] [DOI] |
| 25. | Yano T, Doi T, Ohtsu A, Boku N, Hashizume K, Nakanishi M, Ochiai A. Comparison of HER2 gene amplification assessed by fluorescence in situ hybridization and HER2 protein expression assessed by immunohistochemistry in gastric cancer. Oncol Rep. 2006;15:65-71. [PubMed] |
| 28. | Rossi E, Ubiali A, Cadei M, Balzarini P, Valagussa E, Lucini L, Alpi F, Galletti A, Fontana L, Tedoldi C. HER-2/neu in breast cancer: a comparative study between histology, immunohistochemistry, and molecular technique (FISH). Appl Immunohistochem Mol Morphol. 2006;14:127-131. [PubMed] [DOI] |
| 29. | Chibon F, de Mascarel I, Sierankowski G, Brouste V, Bonnefoi H, Debled M, Mauriac L, MacGrogan G. Prediction of HER2 gene status in Her2 2+ invasive breast cancer: a study of 108 cases comparing ASCO/CAP and FDA recommendations. Mod Pathol. 2009;22:403-409. [PubMed] [DOI] |
| 30. | 杨 莹, 魏 兵, 步 宏. 乳腺癌HER-2检测的现状及存在的问题. 临床与实验病理学杂志. 2010;26:602-605. |