修回日期: 2010-12-03
接受日期: 2010-12-07
在线出版日期: 2011-01-18
目的: 观察类胰蛋白酶抑制剂甲磺酸卡萘司他(NM)对肥大细胞(MC)数量和类胰蛋白酶表达及血清IL-6、IL-8含量的影响.
方法: 40只♂Wistar大鼠按1∶3随机分为空白对照组(A组)和研究组(S组), 造模成功后S组再随机分为3组, 并以不同溶液灌肠: B组(模型对照组, 无菌蒸馏水)、C组(NM组, 10-9 mol/L NM)、D组[5-氨基水杨酸(5-ASA)组, 100 mg/kg 5-ASA]. 以免疫组织化学方法检测远端结肠黏膜MC类胰蛋白酶的表达变化, 以ELISA法检测动物血清中IL-6、IL-8的表达变化.
结果: (1)治疗第1天, A组DAI评分与B、C、D组相比, 差异有显著统计学意义(P<0.01); 实验结束后, B组DAI、HI评分与C、D组相比明显增高(DAI: 6.25±1.67 vs 3.63±1.30, 2.75±0.71; HI: 5.10±0.74 vs 2.30±0.67, 2.00±0.82; 均P<0.01); (2)B组远端结肠黏膜MC数显著高于C、D组(MC: 13.25±1.67 vs 6.37±1.19, 5.00±1.07, 均P<0.05). B组类胰蛋白酶表达量显著低于C、D组(119.22±9.85 vs 150.83±10.06, 140.60±8.93, 均P<0.01); (3)B组血清IL-6、IL-8浓度显著高于C、D组(IL-6: 83.32 ng/L±7.90 ng/L vs 40.09 ng/L±6.20 ng/L, 40.39 ng/L±6.31 ng/L; IL-8: 232.41 ng/L±18.72 ng/L vs 141.05 ng/L±10.33 ng/L, 132.09 ng/L±23.37 ng/L; 均P<0.01). 以上各指标C组与D组比较无统计学差异, 治疗效果相当.
结论: 小剂量类胰蛋白酶抑制剂可以下调结肠黏膜肥大细胞数量、抑制MC类胰蛋白酶表达, 对DSS诱导溃疡性结肠炎大鼠有治疗作用.
引文著录: 林艺娟, 王承党, 庄则豪, 范华, 黄循铷, 刘霞. 肥大细胞及类胰蛋白酶在溃疡性结肠炎大鼠结肠黏膜中的表达. 世界华人消化杂志 2011; 19(2): 126-131
Revised: December 3, 2010
Accepted: December 7, 2010
Published online: January 18, 2011
AIM: To investigate the effects of treatment with nafamostat mesilate (NM), a tryptase inhibitor, on the number of mast cells (MCs) and the expression of MC tryptase in the colonic mucosa of rats with dextran sulfate sodium (DSS)-induced ulcerative colitis.
METHODS: Forty male Wistar rats were randomly divided into control group (group A, n = 10) and experimental group (n = 30). After induction of colitis with DSS, the experimental group were further divided into three groups and intraintestinally given distilled water (group B), 10-9 mol/L NM (group C) and 100 mg/kg 5-ASA (group D), respectively. The expression of MC tryptase in the distal colonic mucosa was assessed by immunohistochemistry. Serum concentrations of IL-6 and IL-8 were measured by ELISA.
RESULTS: On day 1 after treatment, the disease activity index (DAI) score in group B was significantly higher than those in groups C and D (both P < 0.01). On day 7, the DAI (6.25 ± 1.67 vs 3.63 ± 1.3, 2.75 ± 0.71, both P < 0.01) and histological index (HI) scores (5.10 ± 0.74 vs 2.30 ± 0.67, 2.00 ± 0.82; both P < 0.01) in group B were significantly higher than those in groups C and D. The number of mast cells (13.25 ± 1.67 vs 6.37 ± 1.19, 5.00 ± 1.07, both P < 0.01) and average gray scale (AGS) for MC tryptase staining (119.22 ± 9.85 vs 140.60 ± 8.93, 150.83 ± 10.06, both P < 0.01) in the colonic mucosa in group B showed significant differences with those in groups C and D. The levels of serum IL-6 (83.32 ± 7.90 vs 40.09 ± 6.20, 40.39 ± 6.31, both P < 0.01) and IL-8 (232.41 ± 18.72 vs 141.05 ± 10.33, 132.09 ± 23.37, both P < 0.01) in group B were significantly higher than those in groups C and D. No significant differences were found in the above parameters between groups C and D (all P > 0.05).
CONCLUSION: Small-dosage nafamostat mesilate can reduce mast cell number and down-regulate tryptase expression in the colonic mucosa of rats with DSS-induced ulcerative colitis.
- Citation: Lin YJ, Wang CD, Zhuang ZH, Fan H, Huang XR, Liu X. Treatment with nafamostat mesilate reduces mast cell number and down-regulates tryptase expression in experimental ulcerative colitis in rats. Shijie Huaren Xiaohua Zazhi 2011; 19(2): 126-131
- URL: https://www.wjgnet.com/1009-3079/full/v19/i2/126.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i2.126
近年来溃疡性结肠炎(ulcerative colitis, UC)的发病率逐年增高, 但发病机制尚未完全明确, 研究发现肥大细胞(mast cell, MC)可能在其中扮演着重要角色[1,2]. 活化的MC通过分泌组胺、类胰蛋白酶、类糜蛋白酶、肝素和一些细胞因子等炎症介质参与了这类疾病的病理生理过程[3]. 类胰蛋白酶(tryptase)几乎是MC分泌颗粒中所特有的中性蛋白酶, 是MC活化和释放颗粒的特异性标志[4]. 因此类胰蛋白酶抑制剂(tryptase inhibitor, TPI)可能成为炎症性肠病潜在的治疗药物. 本研究旨在观察实验性UC大鼠结肠黏膜MC和类胰蛋白酶变化, 以及TPI对其的影响.
健康清洁级♂Wistar大鼠, 体质量180-220 g, 购于上海斯莱克实验动物有限责任公司[合格证号SCXK(沪)2007-0005], 动物购回后于福建医科大学动物中心网格笼子饲养2 wk, 混合配方饲料喂养, 自由进食、进水. 每日更换饮水和饲料, 保持环境通风和清洁卫生. 葡聚糖硫酸钠(dextran sulfate sodium, DSS, 相对分子质量36 000-50 000, 硫磺含量为18%-20%)为美国MP Biomedicals公司产品; 类胰蛋白酶抑制剂甲磺酸卡萘司他(nafamostat mesilate, NM)为德国默克公司产品; 5-氨基水杨酸(5-ASA)为法国Ethypharm公司产品; MC类胰蛋白酶抗体(AA-1)和SP试剂盒购于福州迈新生物工程有限公司; 大鼠IL-6、IL-8 ELISA试剂盒为Santa Cruz产品. 图像数码采集系统为日本Nikon公司产品, JD801形态学分析系统为南京捷达公司产品.
1.2.1 分组和干预处理: ♂Wistar大鼠40只(180-220 g)根据体质量按照1∶3随机分为2组: 空白对照组(A组, 10只)和实验干预组(S组, 30只): A组大鼠自由饮用无菌蒸馏水, S组大鼠自由饮用3%DSS溶液[5,6]. 第8天, 无动物死亡, S组大鼠按体质量随机分为3组, 每组10只: 模型对照组(B组)、NM组(C组)和5-ASA组(D组). C组和D组大鼠分别接受NM(10-9 mol/L[7])、5-ASA(100 mg/kg[8])灌肠治疗, 每天1次, 每次1 mL溶液, 连续7 d; A组和B组大鼠接受无菌蒸馏水灌肠.
1.2.2 疾病活动指数: 定期观察大鼠体质、粪便性状、隐血情况, 按疾病活动指数(disease activity index, DAI)标准[9]DAI分值.
1.2.3 组织学损伤指数计算: 取远端结肠组织, 常规固定、包埋、切片、HE染色, 每个组织块选取3张切片, 每张切片随机选取3个视野, 在光镜(×400)下观察黏膜层隐窝分支、杯状细胞、炎症细胞、纤维细胞等计算组织学损伤指数(histological index, HI)评分[10], 3张切片×3个视野的平均值为该动物的最后HI评分.
1.2.4 IL-6、IL-8测定: 第15天, 麻醉后处死动物, 取心脏血分离血清, 双抗体夹心ELISA法测定血清IL-6、IL-8浓度.
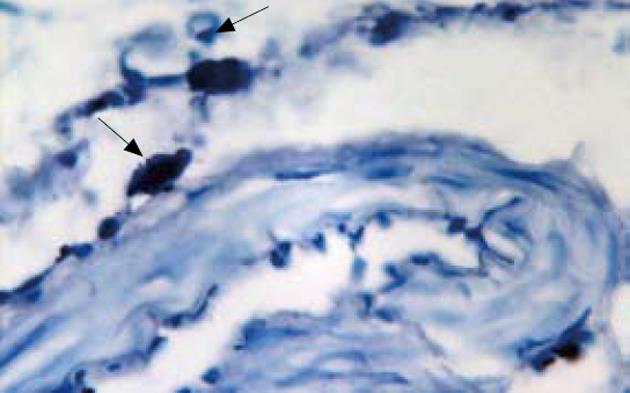
1.2.5 MC染色: 采用甲苯胺蓝改良染色法[11], 染色后每张切片随机选取3个视野, 高倍显微镜(×400)下观察并拍照, 计数MC数量.
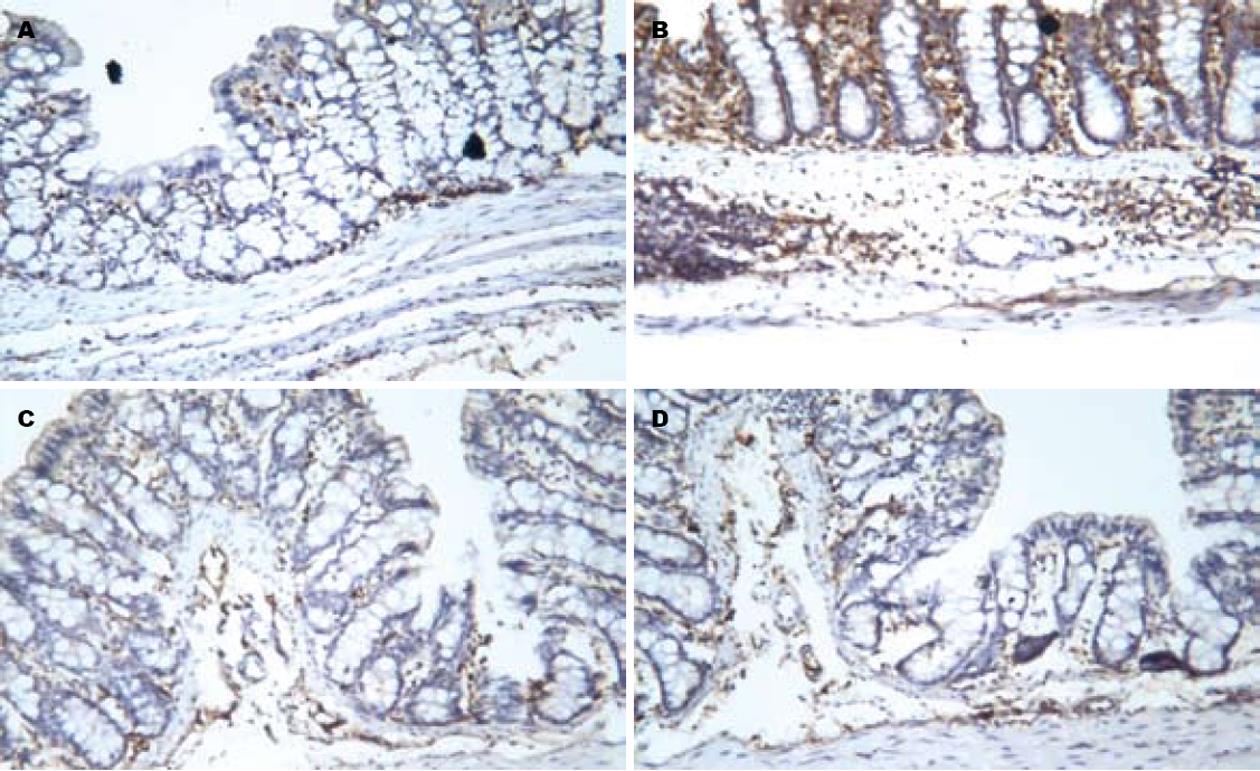
1.2.6 类胰蛋白酶检测: 远端结肠组织常规固定、包埋、切片后, 采用SP免疫组织化学染色, 每个组织块选取3张切片, 在显微镜下(×100)每张切片随机选取3个视野对阳性染色细胞进行观察, 通过图像数码采集系统和JD801形态学分析系统计算平均灰度值, 灰度值与表达水平呈反比, 即灰度值越高则表达水平越低.
统计学处理 数据用mean±SD表示, Levene法进行方差齐性检验, 各组数据采用单因素方差分析(ANOVA), 组间两两比较用LSD-t(方差齐)或Tamhane's T2(方差不齐); 各变量之间相关分析采用双变量相关分析(Bivariate), 对于双变量正态分布资料, 选择积矩相关系数(Pearson相关系数), 对于非双变量正态分布资料, 选择等级相关系数(Spearman相关系数), P≤0.05有统计学意义, 采用SPSS13.0软件进行统计分析.
无动物死亡, A组动物正常, 在前7 d S组动物出现腹泻、体质量下降、肉眼血便等症状. 8 d以后, C组和D组情况有一定程度改善(表1).
A组大鼠结肠黏膜完整, 上皮完整, 腺体排列规则, 结构清楚, 几无炎症细胞浸润. 在第15天时, B组、C组和D组的HI评分高于A组(5.10±0.74, 2.30±0.67, 2.00±0.82 vs 0.60±0.52, P = 0.000), B组评分分别高于C组和D组(均P = 0.000), 而C组和D组之间的差异无统计学意义(P = 0.341).
与B组相比, C组和D组大鼠血清IL-6、IL-8浓度均有降低, 但仍高于A组的水平(表2).
高倍镜下观察(×400)MC胞质呈紫红色, 胞核呈蓝色, 散在于黏膜层和黏膜下层, 邻近血管、淋巴管及末梢神经周围; 小细胞胞质少, 边界清; 大细胞胞质多, 边界不清, 紫红色颗粒围绕细胞核散在分布或呈不规则形状(图1). 各组动物结肠黏膜MC数量组间差异有统计学意义(P = 0.000), 其中B组高于A组(13.25±1.67 vs 2.00±0.76, P = 0.000), C组和D组均低于B组(6.37±1.19, 5.00±1.07 vs 13.25±1.67, 均P = 0.000), 而C组与D组间的差异无统计学意义(P = 0.149).
B组、C组和D组的灰度值均低于A组(119.22±9.85, 140.60±8.93, 150.83±10.06 vs 166.75±9.53, 均P<0.03), B组灰度值均低于C组和D组(均P = 0.000), 而C组与D组间的灰度值差异无统计学意义(P = 0.98, 图2).
各组MC数量与类胰蛋白酶的灰度值存在显著负相关(r = -0.804, P = 0.000); 各组类胰蛋白酶灰度值与IL-6之间存在显著负相关(r = -0.804, P = 0.000); 各组类胰蛋白酶灰度值与IL-8之间存在显著负相关(r = -0.746, P = 0.000).
本研究结论提示C组及D组DAI、HI、类胰蛋白酶(tryptase)阳性率及血清中的IL-6、IL-8水平均显著降低(P<0.05); 而且随着组织中MC数及类胰蛋白酶表达的减少, 相应的血清中IL-6和IL-8水平也随之降低. 因此很可能小剂量类胰蛋白酶抑制剂可以抑制DSS诱导大鼠UC结肠黏膜MC类胰蛋白酶表达、下调MC数量, 对UC可能有治疗作用.
现认为UC是由于敏感个体对肠腔内正常的促炎因子的异常反应导致免疫失调[12], 环境、基因和免疫因素等多因素之间相互复杂的作用启动了该类疾病的发生[12,13], 导致了炎症过程及一系列级联反应, 其结果是持续的、不能控制的炎症和组织损伤[14]. MC很可能是这一系列复杂环节中的关键因子. MC活化后释放介质种类繁多, 类胰蛋白酶是MC活化和释放颗粒的特异性标志[4], 在UC患者结肠组织中检出类胰蛋白酶的显著性增高[15]; 往小鼠结肠内灌注类胰蛋白酶可诱导肠道炎症[16]. 类胰蛋白酶本身也有激活MC的作用, 过敏反应性炎症时可刺激邻近MC脱颗粒、放大MC效应, 进而在很短时间内形成使整个脏器MC均得以激活的瀑布现象[17].
蛋白酶激活受体-2(protease activated receptor 2, PAR-2)是其主要的作用底物. 此酶通过对肠道上皮细胞、平滑肌细胞、神经元、包括MC在内的免疫细胞等胞膜上的PAR-2细胞外袢(N-端)特殊部位的识别, 将其裂解, 形成系锁配体, 激活PAR-2. 活化的MC可通过旁分泌及自分泌两种方式释放类胰蛋白酶等物质, 类胰蛋白酶与结肠黏膜上皮细胞及固有层炎性细胞膜上PAR-2结合, 激活PAR-2受体后的细胞信号转导途径, 引起大量炎症因子释放及炎症细胞浸润, 导致UC局部结肠黏膜组织破坏和病理变化, 其结局是炎症细胞大量浸润和IL-6、IL-8[18,20,21]等炎症因子大量产生(鉴于IL-6、IL-8为二者相互作用后下游产物之一, 故以这两个炎症因子为代表进行检测), 继而出现肠道屏障功能的完整性的破坏, 肠黏膜对肠腔内细菌和个中蛋白酶通透性增加, 导致结肠炎持续加重; 内脏敏感性增高; 肠道平滑肌运动功能障碍[22]等, 这些与肠道炎症可能相辅相成导致UC一系列病理生理改变.
近几年来, TPI已成为治疗MC所致炎症性疾病的新途径, 有着广泛的研发前景. 人们发现TPI可降低气道高反应性从而治疗哮喘[23], 可阻断蛋白酶对结肠黏膜下末梢神经元的活化, 从而缓解肠易激综合征内脏痛觉过敏症状[24], 还可治疗自身免疫性关节炎、牙周炎、肿瘤、荨麻疹、胰腺炎等MC所致炎症性疾病. 在炎症性肠病治疗方面, 人们也开始不断探索. Tremaine等[25]报道对一个急性UC的患者运用APC2059实验性治疗后, 其DAI减少, 目前该药已处于临床二期实验中. 谢华等[26]发现类糜蛋白酶抑制剂可抑制离体人大肠MC IgE依赖性和非依赖性类胰蛋白酶的释放; 目前国内鲜有TPI对UC治疗进行探讨, 基于前人的研究基础, 本研究对DSS所致大鼠结肠炎经NM治疗后的疗效进行评估, 肠道炎症明显改善, 阐述了类胰蛋白酶抑制剂对炎症性肠病(inflammatory bowel disease, IBD)治疗的可行性.
NM化学名为6-脒基-2-萘基-4-胍基苯甲酸酯二甲磺酸盐, 是人工合成的非肽类小分子丝氨酸蛋白酶抑制剂, 具有广谱抑制性, 无抗原性, 相对分子质量小等优点, 是竞争性、可逆性的丝氨酸蛋白酶抑制剂, 该药对不同的丝氨酸蛋白酶抑制作用呈浓度依赖性. Mori等[27]发现小剂量的NM可选择性地抑制类胰蛋白酶的活性, 并对其药代动力学进行研究, 确定其Ki值约为95.3 pmol/L(9.53×10-11 mol/L). 在此基础上, 日本学者对其浓度再次进行摸索, 认为小剂量的NM可选择性抑制类胰蛋白酶, 可明显改善TNBS诱导的大鼠结肠炎模型结肠黏膜炎症[7]. 本研究使用小剂量NM对DSS所致UC的大鼠连续灌肠7 d, 发现该组肠道黏膜炎症细胞浸润、血清中炎症因子水平均较模型组有明显降低, 提示很可能NM对UC有治疗效果.
目前5-ASA如美沙拉嗪灌肠是治疗炎症性肠病尤其是UC的经典治疗药物, 虽然其在治疗IBD炎症中的确切机制尚不明确[28,29], 曾有研究认为5-ASA可抑制人肠MC组胺的释放和前列腺素的产生[30], 本研究在DSS诱导大鼠急性UC模型的基础上, 分别给予TPI和5-ASA连续灌肠7 d, 与模型组对比, 观察到两组的类胰蛋白酶表达均下降了. 基于组胺、前列腺素与类胰蛋白酶均为MC颗粒里的主要成分, 由此推测很可能5-ASA也可抑制MC类胰蛋白酶的产生.
总之, 小剂量的TPI可通过对MC类胰蛋白酶活性的抑制, 使得肠道炎症情况得到改善. 目前国内还很少明确对TPI治疗UC的可行性及前景进行探讨. 一旦该设想可行, 对于IBD患者, 尤其是对柳氮磺吡啶不耐受或激素抵抗患者将是一大福音.
类胰蛋白酶是肥大细胞颗粒所特有的中性蛋白酶, 是肥大细胞活化和释放颗粒的特异性标志, 国内外许多研究都论证了类胰蛋白酶与炎症性肠病的相关性, 在动物肠道炎症模型及溃疡性结肠炎患者结肠组织中均检出类胰蛋白酶显著性增高.
李瑜元, 教授, 广州市第一人民医院内科
Mori等发现小剂量的NM可选择性地抑制类胰蛋白酶的活性, 并对其药代动力学进行研究, 确定其Ki值约为95.3 pM(9.53×10-11 M).
类胰蛋白酶与炎症性肠病的关系及类胰蛋白酶抑制剂NM的疗效国内报道较欠缺. 本课题提示小剂量类胰蛋白酶抑制剂可以下调结肠黏膜肥大细胞数量、抑制肥大细胞类胰蛋白酶表达, 对DSS诱导溃疡性结肠炎大鼠有治疗作用.
本文为类胰蛋白酶抑制剂的临床开发提供理论依据. 若该设想可行, 对于炎症性肠病患者, 尤其是对柳氮磺吡啶不耐受或激素抵抗患者将是一大福音.
本研究内容国内报道较少, 而国外已有一些报道, 故本文有一定创新性, 论文设计和方法合理, 学术价值较好.
编辑: 李军亮 电编: 何基才
| 1. | Rijnierse A, Redegeld FA, Blokhuis BR, Van der Heijden MW, Te Velde AA, Pronk I, Hommes DW, Nijkamp FP, Koster AS, Kraneveld AD. Ig-free light chains play a crucial role in murine mast cell-dependent colitis and are associated with human inflammatory bowel diseases. J Immunol. 2010;185:653-659. [PubMed] [DOI] |
| 2. | Gelbmann CM, Mestermann S, Gross V, Köllinger M, Schölmerich J, Falk W. Strictures in Crohn's disease are characterised by an accumulation of mast cells colocalised with laminin but not with fibronectin or vitronectin. Gut. 1999;45:210-217. [PubMed] |
| 3. | Hibi T, Ogata H. Novel pathophysiological concepts of inflammatory bowel disease. J Gastroenterol. 2006;41:10-16. [PubMed] [DOI] |
| 4. | Abraham WM. Tryptase: potential role in airway inflammation and remodeling. Am J Physiol Lung Cell Mol Physiol. 2002;282:L193-L196. [PubMed] |
| 5. | Egger B, Bajaj-Elliott M, MacDonald TT, Inglin R, Eysselein VE, Büchler MW. Characterisation of acute murine dextran sodium sulphate colitis: cytokine profile and dose dependency. Digestion. 2000;62:240-248. [PubMed] [DOI] |
| 6. | 张 艳丽, 黄 循铷, 王 承党. 小鼠葡聚糖硫酸钠急性溃疡性结肠炎模型的建立和评价. 胃肠病学和肝病学杂志. 2006;15:130-133. |
| 7. | Isozaki Y, Yoshida N, Kuroda M, Handa O, Takagi T, Kokura S, Ichikawa H, Naito Y, Okanoue T, Yoshikawa T. Anti-tryptase treatment using nafamostat mesilate has a therapeutic effect on experimental colitis. Scand J Gastroenterol. 2006;41:944-953. [PubMed] [DOI] |
| 9. | Murano M, Maemura K, Hirata I, Toshina K, Nishikawa T, Hamamoto N, Sasaki S, Saitoh O, Katsu K. Therapeutic effect of intracolonically administered nuclear factor kappa B (p65) antisense oligonucleotide on mouse dextran sulphate sodium (DSS)-induced colitis. Clin Exp Immunol. 2000;120:51-58. [PubMed] [DOI] |
| 10. | Dieleman LA, Palmen MJ, Akol H, Bloemena E, Peña AS, Meuwissen SG, Van Rees EP. Chronic experimental colitis induced by dextran sulphate sodium (DSS) is characterized by Th1 and Th2 cytokines. Clin Exp Immunol. 1998;114:385-391. [PubMed] [DOI] |
| 12. | Dharmani P, Chadee K. Biologic therapies against inflammatory bowel disease: a dysregulated immune system and the cross talk with gastrointestinal mucosa hold the key. Curr Mol Pharmacol. 2008;1:195-212. [PubMed] [DOI] |
| 13. | Endo K, Shiga H, Kinouchi Y, Shimosegawa T. [Inflammatory bowel disease: IBD]. Rinsho Byori. 2009;57:527-532. [PubMed] |
| 14. | Farhadi A, Fields JZ, Keshavarzian A. Mucosal mast cells are pivotal elements in inflammatory bowel disease that connect the dots: stress, intestinal hyperpermeability and inflammation. World J Gastroenterol. 2007;13:3027-3030. [PubMed] |
| 15. | Raithel M, Winterkamp S, Pacurar A, Ulrich P, Hochberger J, Hahn EG. Release of mast cell tryptase from human colorectal mucosa in inflammatory bowel disease. Scand J Gastroenterol. 2001;36:174-179. [PubMed] [DOI] |
| 16. | Cenac N, Coelho AM, Nguyen C, Compton S, Andrade-Gordon P, MacNaughton WK, Wallace JL, Hollenberg MD, Bunnett NW, Garcia-Villar R. Induction of intestinal inflammation in mouse by activation of proteinase-activated receptor-2. Am J Pathol. 2002;161:1903-1915. [PubMed] [DOI] |
| 17. | He SH. Key role of mast cells and their major secretory products in inflammatory bowel disease. World J Gastroenterol. 2004;10:309-318. [PubMed] |
| 18. | Temkin V, Kantor B, Weg V, Hartman ML, Levi-Schaffer F. Tryptase activates the mitogen-activated protein kinase/activator protein-1 pathway in human peripheral blood eosinophils, causing cytokine production and release. J Immunol. 2002;169:2662-2669. [PubMed] |
| 19. | Kim JA, Choi SC, Yun KJ, Kim DK, Han MK, Seo GS, Yeom JJ, Kim TH, Nah YH, Lee YM. Expression of protease-activated receptor 2 in ulcerative colitis. Inflamm Bowel Dis. 2003;9:224-229. [PubMed] [DOI] |
| 20. | He S, Walls AF. Human mast cell tryptase: a stimulus of microvascular leakage and mast cell activation. Eur J Pharmacol. 1997;328:89-97. [PubMed] [DOI] |
| 21. | He S, Peng Q, Walls AF. Potent induction of a neutrophil and eosinophil-rich infiltrate in vivo by human mast cell tryptase: selective enhancement of eosinophil recruitment by histamine. J Immunol. 1997;159:6216-6225. [PubMed] |
| 22. | Kawabata A, Matsunami M, Sekiguchi F. Gastrointestinal roles for proteinase-activated receptors in health and disease. Br J Pharmacol. 2008;153 Suppl 1:S230-S240. [PubMed] [DOI] |
| 23. | Royce SG, Tang ML. The effects of current therapies on airway remodeling in asthma and new possibilities for treatment and prevention. Curr Mol Pharmacol. 2009;2:169-181. [PubMed] [DOI] |
| 24. | Buhner S, Li Q, Vignali S, Barbara G, De Giorgio R, Stanghellini V, Cremon C, Zeller F, Langer R, Daniel H. Activation of human enteric neurons by supernatants of colonic biopsy specimens from patients with irritable bowel syndrome. Gastroenterology. 2009;137:1425-1434. [PubMed] [DOI] |
| 25. | Tremaine WJ, Brzezinski A, Katz JA, Wolf DC, Fleming TJ, Mordenti J, Strenkoski-Nix LC, Kurth MC. Treatment of mildly to moderately active ulcerative colitis with a tryptase inhibitor (APC 2059): an open-label pilot study. Aliment Pharmacol Ther. 2002;16:407-413. [PubMed] [DOI] |
| 27. | Mori S, Itoh Y, Shinohata R, Sendo T, Oishi R, Nishibori M. Nafamostat mesilate is an extremely potent inhibitor of human tryptase. J Pharmacol Sci. 2003;92:420-423. [PubMed] [DOI] |
| 28. | Segars LW, Gales BJ. Mesalamine and olsalazine: 5-aminosalicylic acid agents for the treatment of inflammatory bowel disease. Clin Pharm. 1992;11:514-528. [PubMed] |
| 29. | Kennedy M, Wilson L, Szabo C, Salzman AL. 5-aminosalicylic acid inhibits iNOS transcription in human intestinal epithelial cells. Int J Mol Med. 1999;4:437-443. [PubMed] |
| 30. | Fox CC, Moore WC, Lichtenstein LM. Modulation of mediator release from human intestinal mast cells by sulfasalazine and 5-aminosalicylic acid. Dig Dis Sci. 1991;36:179-184. [PubMed] [DOI] |