修回日期: 2010-12-01
接受日期: 2010-12-07
在线出版日期: 2011-01-18
目的: 研究蟾蜍毒素诱导人胃癌细胞MGC803凋亡及对凋亡因子Livin、caspase-3的影响.
方法: 应用MTT法检测10、20、40、80、160 nmol/L蟾蜍毒素对胃癌细胞MGC803增殖抑制作用; 瑞氏-吉姆萨染色法观察细胞形态学的变化; 流式细胞术分析周期阻滞和细胞凋亡; Western blot法检测Livin、caspase-3蛋白的表达.
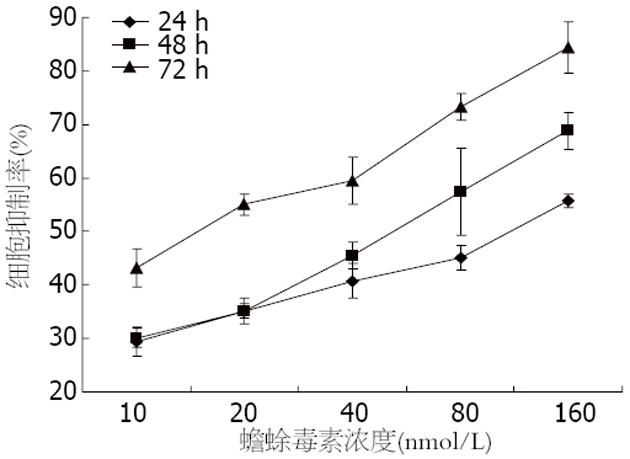
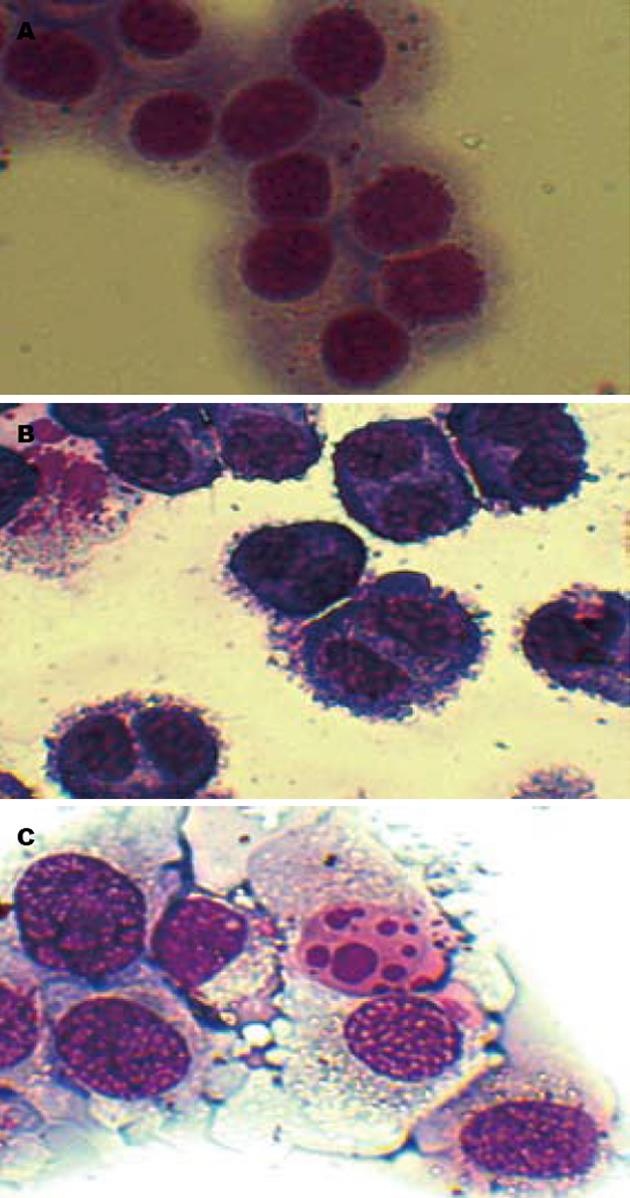
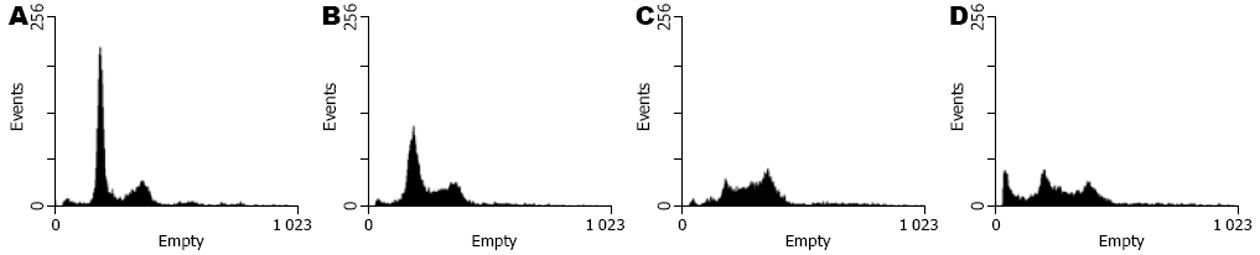
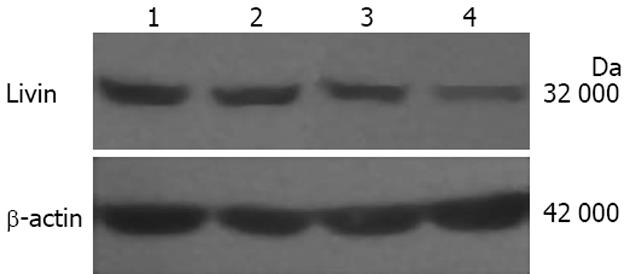
结果: (1)蟾蜍毒素抑制MGC803细胞增殖, 24、48及72 h的IC50分别为105.25 nmol/L、47.92 nmol/L、16.52 nmol/L; (2)10-80 nmol/L蟾蜍毒素能诱导胃癌细胞周期阻滞及凋亡, 形态学表现为出现凋亡小体; (3)流式细胞仪检测到80 nmol/L组亚二倍体凋亡峰(20.83%±2.72% vs 1.67%±0.46%, P = 0.006)及20 nmol/L组细胞周期G2/M期阻滞(37.81%±3.28% vs 20.66%±3.09%, P = 0.003); (4)Western blot显示蟾蜍毒素诱导细胞凋亡过程中, Livin蛋白表达分别下调到对照组的73.29%±6.23%, 60.10%±7.84%和34.70%±5.76%, 同时活化caspase-3.
结论: 蟾蜍毒素诱导胃癌细胞MGC803细胞凋亡可能与下调Livin蛋白、活化caspase-3蛋白有关.
引文著录: 王锴, 郁云龙, 刘阳阳, 李恩泽, 哈敏文, 朱志图. 蟾蜍毒素对人胃癌细胞凋亡的诱导机制. 世界华人消化杂志 2011; 19(2): 116-120
Revised: December 1, 2010
Accepted: December 7, 2010
Published online: January 18, 2011
AIM: To explore the mechanisms by which bufalin induces cell apoptosis in human gastric cancer cell line MGC803.
METHODS: After MGC803 cells were treated with 10, 20, 40, 80, 160 nmol/L of bufalin for different durations, cell growth was measured by MTT assay; cell morphological changes were evaluated by Wright-Giemsa staining and observed under a light microscope; apoptosis was evaluated by flow cytometry; and the expression of livin and caspase-3 was detected by Western blot.
RESULTS: Treatment with bufalin inhibited cell growth, and the 50% inhibitory concentrations (IC50) at 24, 48 and 72 h were 105.25, 47.92 and 16.52 nmol/L, respectively. Treatment with different concentrations of bufalin could efficiently induce apoptosis (80 nmol/L, percentage of cells in the sub-G1 peak: 1.67% ± 0.46% vs 20.83% ± 2.72%, P = 0.006) and cell cycle arrest (20 nmol/L, percentage of cells arrested in the G2/M phase: 20.66% ± 3.09% vs 37.81% ± 3.28%, P = 0.003) of MGC803 cells. The expression of livin protein was down-regulated (73.29% ± 6.23%, 60.10% ± 7.84%, 34.70% ± 5.76% vs 100%, all P < 0.05) and caspase-3 protein was activated in MGC803 cells treated with 10, 20 and 80 nmol/L bufalin.
CONCLUSION: Bufalin induces MGC803 cell apoptosis via mechanisms associated with activation of caspase-3 and inhibition of livin expression.
- Citation: Wang K, Yu YL, Liu YY, Li EZ, Ha MW, Zhu ZT. Mechanisms underlying apoptosis-inducing activity of bufalin in human gastric cancer cell line MGC803. Shijie Huaren Xiaohua Zazhi 2011; 19(2): 116-120
- URL: https://www.wjgnet.com/1009-3079/full/v19/i2/116.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i2.116
胃癌是世界发病率第4位, 死亡率仅次于肺癌的恶性肿瘤[1,2], 早期胃癌治疗以手术为主, 然而多数患者确诊时已达晚期, 以化疗为主的综合治疗是胃癌的主要治疗手段, 但胃癌的化疗方案至今没有金标准, 且化疗并未改善晚期胃癌患者生存率及化疗带来的不良反应一直是临床难题[3-5]. 蟾蜍毒素是中药蟾酥的毒性配基之一, 研究发现蟾蜍毒素具有抗肿瘤的作用[6-8]. 目前国内外关于蟾蜍毒素治疗胃癌的基础研究较少, 本实验采用蟾蜍毒素作用于胃癌MGC803细胞, 观察对胃癌细胞体外生长抑制及诱导凋亡作用, 探讨其作用机制, 旨在为临床化疗方案的选择提供实验依据.
胃癌MGC803细胞株由中国医科大学肿瘤实验室惠赠; 蟾蜍毒素购于Sigma公司, 用无水乙醇配成0.01 mol/L贮存液, -20 ℃冻存,实验时用PBS稀释成所需浓度, 乙醇终浓度<0.01%, 预实验表明, 该浓度乙醇对细胞增殖无影响; RPMI 1640培养基购于Gibco公司; PI、RNase、MTT购于Sigma公司; caspase-3和Livin单克隆抗体购于Santa Cruz公司.
1.2.1 MTT法检测细胞增殖抑制率: 取处于对数生长期的细胞, 常规消化制成单细胞悬液, 调整密度为3×104/mL, 接种于96孔培养板中, 每孔180 μL, 实验组加用10、20、40、80、160 nmol/L的蟾蜍毒素, 对照组加入RPMI 1640培养基, 继续培养24、48、72 h, 终止培养前4 h每孔加入MTT液20 μL, 到预定时间后加DMSO液200 μL, 振荡后酶联免疫检测仪570 nm处测定各孔吸光度值. 按细胞增殖抑制率计算公式计算细胞增殖抑制率, 计算药物抑制细胞增殖50%的浓度(IC50), 每组实验重复3次. 细胞增殖抑制率(%) = 1-(实验组平均A值/对照组平均A值)×100%.
1.2.2 瑞氏-吉姆萨染色: 用10-80 nmol/L蟾蜍毒素处理细胞24 h, 收集处理组及对照组细胞, 使用离心甩片机, 离心频率2 500 r/min离心3 min制成细胞涂片, 用瑞氏-吉姆萨染液染色, 光学显微镜下观察细胞形态变化.
1.2.3 流式细胞术分析细胞周期及凋亡百分率: 分别收集对照组及处理组细胞, 离心频率1 000 r/min离心5 min, 冷PBS洗涤, 加入1 mL 70%的冷乙醇4 ℃过夜, PBS再次离心、洗涤, 加入RNase(10 mg/L)37 ℃孵育30 min后, 加入终浓度为10 g/L的PI, 避光反应30 min后进行流式细胞仪测定, 采用Cell Quest进行细胞各期的百分比分析, 判定凋亡细胞百分率.
1.2.4 Western blot法检测蛋白的表达: 将对照组和处理组的细胞加RIPA裂解液在冰上裂解30 min, 12 000 r/min离心30 min, 取上清, 采用Lowry法进行蛋白定量. 与3×样品缓冲液混合后, 煮沸5 min. 取50 μg蛋白样品在15%的SDS-聚丙烯凝胶中电泳约3 h, 然后转印至硝酸纤维素膜上2 h. 用5%脱脂奶粉封闭1 h, 按预染Marker标记的分子量剪裁转印膜, 分别加入Livin抗体(1∶200)、caspase-3(1∶1 000)抗体及β-actin抗体(1∶1 000), 过夜. TTBS洗4次后加入辣根过氧化物酶标记的二抗(1∶800)作用30 min, ECL法显色后GIS凝胶图像分析系统拍照并分析处理.
统计学处理 所有数据均为3次独立实验结果, 以mean±SD表示, 应用SPSS16.0软件进行t检验, 以P<0.05为差异有统计学意义.
蟾蜍毒素对MGC803增殖有抑制作用, 抑制作用随着药物浓度和作用时间增加而增强, 呈时间-剂量依赖方式, 24、48、72 h的IC50分别为105.25、47.92、16.52 nmol/L, 不同浓度、不同时间点之间抑制率比较, 差异有统计学意义(P<0.01, 表1, 图1).
用20 nmol/L蟾蜍毒素作用细胞24 h后, 瑞氏-吉姆萨染色, 光镜下观察到有明显的M期阻滞, 表现为细胞出现双核及停滞于分裂中期; 40 nmol/L蟾蜍毒素作用细胞24 h, 观察到染色质固缩、胞核碎裂及凋亡小体等典型的凋亡形态(图2).
10-80 nmol/L蟾蜍毒素分别作用细胞24 h后, 流式细胞术检测显示20 nmol/L组G2/M期细胞百分比为37.81%±3.28%, 无明显凋亡; 80 nmol/L组形成凋亡峰, 亚二倍体细胞百分比为20.83%±2.72%, 无明显G2/M周期阻滞(图3, 表2).
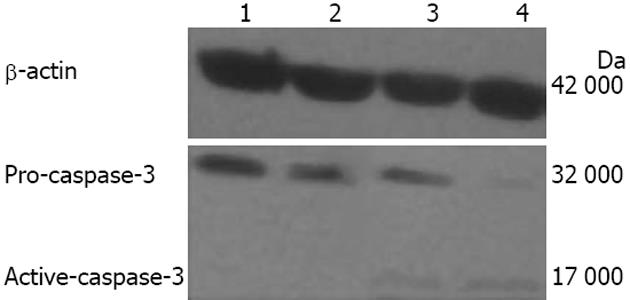
20、40、80 nmol/L蟾蜍毒素作用24 h后, Western blot显示Livin蛋白表达分别下调到对照组的73.29±6.23%, 60.10±7.84%和34.70±5.76%(图4), 20 nmol/L及40 nmol/L组可检测到非活化caspase-3蛋白表达, 而80 nmol/L组可检测到剪切型caspase-3蛋白表达(图5).
蟾蜍毒素是从传统中药蟾酥中提取的蟾毒配基之一, 国内外研究证明蟾蜍毒素可以抑制K562、U937和HL-60等白血病细胞[9-12]以及肝癌、卵巢癌、肺癌等实体瘤细胞[13-15]增殖并诱导其周期阻滞和凋亡, 但尚无蟾蜍毒素诱导胃癌细胞凋亡中与Livin-caspase-3凋亡途径相关的基础研究[16,17]. 本研究采用蟾蜍毒素作用于胃癌MGC803细胞, 发现蟾蜍毒素可抑制细胞增殖, 呈时间剂量依赖效应. 20 nmol/L蟾蜍毒素作用细胞24 h, 可见G2/M细胞比例上升, 提示细胞周期阻滞, 当浓度>20 nmol/L时, 可直接诱导细胞凋亡, 形态学表现为染色质固缩、胞核碎裂及凋亡小体等典型的凋亡形态.
目前认为细胞凋亡发生机制最关键之一是caspase家族蛋白酶的激活[18,19], 而活化的caspase-8, 9, 12均可激活caspase-3. caspase-3和caspase-7通过破坏细胞核纤层, 直接导致细胞结构的破坏最终导致细胞凋亡, caspase-3在细胞凋亡过程中起着非常关键的作用, 被认为是凋亡的执行者[20,21]. 多项研究显示, 胃癌患者组织中caspase-3表达较正常人明显下降, 提示胃癌的发病与caspase-3的表达异常有关[22-24]. 本实验结果显示, 80 nmol/L蟾蜍毒素作用MGC803细胞24 h 可检测到caspase-3 17 000 Da活化亚基, 证实蟾蜍毒素在诱导MGC803细胞凋亡过程中, 裂解活化caspase-3, 提示蟾蜍毒素可通过caspase-3依赖的方式诱导细胞凋亡.
Livin是新发现的凋亡蛋白抑制因子家族的新成员之一[25], Livin BIR结构域为一个新型的锌指结构, 他是与caspase蛋白的结合部位, 可阻止caspase蛋白在细胞凋亡时执行蛋白切除功能, 从而抑制下游caspase-3的活性, 具有拮抗凋亡的作用[26,27], 且Livin已作为判断胃癌恶性程度与预后的标志, 可能成为胃癌治疗的新靶点[28,29]. 在本实验中, 蟾蜍毒素作用细胞24 h后, 随着药物浓度的增加, Livin蛋白的表达分别下调至作用前的73.29%、60.10%及34.70%, 结合检测到caspase-3蛋白的逐渐活化推定蟾蜍毒素通过下调凋亡抑制蛋白Livin的表达, 解除了凋亡抑制因子对caspase-3的抑制, 使caspase-3蛋白裂解活化, 凋亡率随之增加, 这与学者Liu等[30]的研究结果是类似的. 以上实验结果表明, 一定浓度的蟾蜍毒素在体外对MGC803细胞有显著的生长抑制作用, 下调凋亡抑制蛋白Livin及活化caspase-3是其诱导细胞凋亡机制之一, 上述结果为蟾蜍毒素进一步的实验研究提供了一定的理论依据, 但本实验没有对蟾蜍毒素诱导细胞凋亡的更深层次机制以及体内实验是否有类似结论等进行研究, 这有待今后进一步的研究来不断完善.
蟾蜍毒素(Bufalin)研究较多的是诱导白血病细胞分化, 近年发现其对实体瘤细胞凋亡也有重要作用; 凋亡蛋白抑制因子(IAP)家族是近年发现的肿瘤治疗的一个新靶点.
刘云鹏, 教授, 中国医科大学附属第一医院肿瘤内科
通过应用不同浓度蟾蜍毒素作用胃癌MGC803细胞, 发现蟾蜍毒素以时间剂量依赖方式抑制MGC803细胞增殖, 20 nmol/L时引起细胞周期阻滞, >20 nmol/L时诱导细胞凋亡, 同时检测到caspase-3蛋白激活及Livin蛋白下调.
蟾蜍毒素发挥效用的浓度低于其他抗癌药物如顺铂、维甲酸, 具有潜在的临床应用价值, 有望开发为新的抗肿瘤药物.
本研究结果具有一定的创新性, 数据合理可信, 具有潜在的临床应用价值.
编辑: 李薇 电编:何基才
| 1. | Brenner H, Rothenbacher D, Arndt V. Epidemiology of stomach cancer. Methods Mol Biol. 2009;472:467-477. [PubMed] [DOI] |
| 2. | Jemal A, Siegel R, Ward E, Hao Y, Xu J, Thun MJ. Cancer statistics, 2009. CA Cancer J Clin. 2009;59:225-249. [PubMed] [DOI] |
| 3. | Ryu MH, Kang YK. ML17032 trial: capecitabine/cisplatin versus 5-fluorouracil/cisplatin as first-line therapy in advanced gastric cancer. Expert Rev Anticancer Ther. 2009;9:1745-1751. [PubMed] [DOI] |
| 4. | De Vita F, Vecchione L, Galizia G, Di Martino N, Fabozzi T, Catalano G, Ciardiello F, Orditura M. Perspectives in adjuvant therapy of gastric cancer. Oncology. 2009;77 Suppl 1:38-42. [PubMed] [DOI] |
| 7. | 韩 鸿彬, 陈 嘉勇. 华蟾素抗肿瘤作用及其机制的研究进展. 中国肿瘤生物治疗杂志. 2005;12:160-162. |
| 8. | 孟志强, 沈晔华, 杨培英, Robert Newman, 贝文英, 张颖, 葛勇前, Lorenzo Cohen, Razelle Kurzrock, 刘鲁明. 华蟾素治疗肝癌、肺癌、胰腺癌的Ⅰ期临床研究: 初步报道. 中国癌症杂志. 2007;17:376-379. |
| 9. | Chen A, Yu J, Zhang L, Sun Y, Zhang Y, Guo H, Zhou Y, Mitchelson K, Cheng J. Microarray and biochemical analysis of bufalin-induced apoptosis of HL-60 Cells. Biotechnol Lett. 2009;31:487-494. [PubMed] [DOI] |
| 10. | Qu X, Liu Y, Ma Y, Zhang Y, Li Y, Hou K. Up-regulation of the Cbl family of ubiquitin ligases is involved in ATRA and bufalin-induced cell adhesion but not cell differentiation. Biochem Biophys Res Commun. 2008;367:183-189. [PubMed] [DOI] |
| 11. | Cao-Hong , Shibayama-Imazu T, Masuda Y, Shinki T, Nakajo S, Nakaya K. Involvement of Tiam1 in apoptosis induced by bufalin in HeLa cells. Anticancer Res. 2007;27:245-249. [PubMed] |
| 13. | Sun L, Chen T, Wang X, Chen Y, Wei X. Bufalin Induces Reactive Oxygen Species Dependent Bax Translocation and Apoptosis in ASTC-a-1 Cells. Evid Based Complement Alternat Med. 2009; Jul 10. [Epub ahead of print]. [PubMed] |
| 14. | Takai N, Ueda T, Nishida M, Nasu K, Narahara H. Bufalin induces growth inhibition, cell cycle arrest and apoptosis in human endometrial and ovarian cancer cells. Int J Mol Med. 2008;21:637-643. [PubMed] |
| 15. | Han KQ, Huang G, Gu W, Su YH, Huang XQ, Ling CQ. Anti-tumor activities and apoptosis-regulated mechanisms of bufalin on the orthotopic transplantation tumor model of human hepatocellular carcinoma in nude mice. World J Gastroenterol. 2007;13:3374-3379. [PubMed] |
| 16. | Li D, Qu X, Hou K, Zhang Y, Dong Q, Teng Y, Zhang J, Liu Y. PI3K/Akt is involved in bufalin-induced apoptosis in gastric cancer cells. Anticancer Drugs. 2009;20:59-64. [PubMed] [DOI] |
| 18. | Fan TJ, Han LH, Cong RS, Liang J. Caspase family proteases and apoptosis. Acta Biochim Biophys Sin (Shanghai). 2005;37:719-727. [PubMed] [DOI] |
| 20. | Wang Q, Huang Y, Ni Y, Wang H, Hou Y. siRNA targeting midkine inhibits gastric cancer cells growth and induces apoptosis involved caspase-3,8,9 activation and mitochondrial depolarization. J Biomed Sci. 2007;14:783-795. [PubMed] [DOI] |
| 21. | Su CC, Chen GW, Tan TW, Lin JG, Chung JG. Crude extract of garlic induced caspase-3 gene expression leading to apoptosis in human colon cancer cells. In Vivo. 2006;20:85-90. [PubMed] |
| 22. | Soung YH, Lee JW, Kim SY, Park WS, Nam SW, Lee JY, Yoo NJ, Lee SH. Somatic mutations of CASP3 gene in human cancers. Hum Genet. 2004;115:112-115. [PubMed] [DOI] |
| 23. | 吕 晓君, 吴 东瑛, 杨 琳, 张 淑敏, 辛 彦. 胃癌前病变及胃癌组织中survivin和caspase-3蛋白表达的意义. 世界华人消化杂志. 2005;13:1951-1955 [10.11569/wcjd.v13.i16.1951]. |
| 24. | Sun Y, Chen XY, Liu J, Cheng XX, Wang XW, Kong QY, Li H. Differential caspase-3 expression in noncancerous, premalignant and cancer tissues of stomach and its clinical implication. Cancer Detect Prev. 2006;30:168-173. [PubMed] [DOI] |
| 25. | Kasof GM, Gomes BC. Livin, a novel inhibitor of apoptosis protein family member. J Biol Chem. 2001;276:3238-3246. [PubMed] [DOI] |
| 26. | Sanna MG, da Silva Correia J, Ducrey O, Lee J, Nomoto K, Schrantz N, Deveraux QL, Ulevitch RJ. IAP suppression of apoptosis involves distinct mechanisms: the TAK1/JNK1 signaling cascade and caspase inhibition. Mol Cell Biol. 2002;22:1754-1766. [PubMed] [DOI] |
| 27. | Nachmias B, Ashhab Y, Bucholtz V, Drize O, Kadouri L, Lotem M, Peretz T, Mandelboim O, Ben-Yehuda D. Caspase-mediated cleavage converts Livin from an antiapoptotic to a proapoptotic factor: implications for drug-resistant melanoma. Cancer Res. 2003;63:6340-6349. [PubMed] |
| 29. | Yagihashi A, Asanuma K, Tsuji N, Torigoe T, Sato N, Hirata K, Watanabe N. Detection of anti-livin antibody in gastrointestinal cancer patients. Clin Chem. 2003;49:1206-1208. [PubMed] [DOI] |
| 30. | Liu C, Wu X, Luo C, Hu Z, Yin Z, He Y, Du H, Zhang W, Jiang Q, Lin Y. Antisense oligonucleotide targeting Livin induces apoptosis of human bladder cancer cell via a mechanism involving caspase 3. J Exp Clin Cancer Res. 2010;29:63. [PubMed] [DOI] |