修回日期: 2011-06-13
接受日期: 2011-06-21
在线出版日期: 2011-07-08
目的: 研究不同剂量麦冬多糖(MDG-1)对自发性肥胖型二型糖尿病KKay小鼠糖耐量及肠道菌群的影响.
方法: 正常对照组为周龄9-10 wk C57bl/6J小鼠10只, 实验组为KKay糖尿病小鼠26只; 小鼠9 wk开始普通饲料喂养至12 wk, 随后高脂饲料喂养8 wk. 12 wk时测定随机血糖>13.9 mmol/L诊断为糖尿病. 小鼠随机分为正常对照组、空白对照组、MDG-1 75、300 mg/kg及罗格列酮组. 正常对照组与空白对照组每天灌胃蒸馏水(10 mL/kg), 罗格列酮组每天灌胃2 mg/kg. 连续治疗8 wk后, 观察各组动物的一般情况, 测定小鼠0、15、30、60、120 min耐糖血糖值, 并对各组小鼠肠道菌群进行培养, 统计菌群数量.
结果: 不同剂量的麦冬多糖MDG-1均可在不同程度上改善KKay小鼠的多饮、多食等症状, 高剂量组的效果优于低剂量组. 给药8 wk后, MDG-1低、高剂量均可显著降低糖尿病小鼠的空腹血糖值(P<0.05); 各模型组的葡萄糖耐量均不同程度受损, MDG-1 300 mg/kg和阳性药罗格列酮组糖耐量均有不同程度的改善(P<0.05); 糖尿病小鼠肠道内大肠杆菌和链球菌数量显著升高, 而乳酸杆菌和双歧杆菌的数量明显下降, MDG-1 300 mg/kg组可显著降低大肠杆菌和链球菌的数量(P<0.05), 对双歧杆菌的增殖也有显著作用(P<0.05).
结论: 不同剂量的MDG-1可以在不同程度上缓解糖尿病小鼠的糖尿病症状, 改善糖耐量, 调节肠道菌群平衡.
引文著录: 王令仪, 王硕, 王源, 阮克锋, 冯怡. 麦冬多糖MDG-1对糖尿病小鼠糖耐量及肠道菌群的影响. 世界华人消化杂志 2011; 19(19): 2058-2062
Revised: June 13, 2011
Accepted: June 21, 2011
Published online: July 8, 2011
AIM: To investigate the effect of different concentrations of MDG-1, a polysaccharide extracted from Ophiopogon japonicus, on oral glucose tolerance and intestinal microecological balance in KKay mice.
METHODS: Twenty-six KKAy diabetic mice and ten 9-10-week-old C57bl/6J mice were used in this study. KKAy diabetic mice were given a normal diet from week 9 to week 12 and then fed a high-fat diet for 8 weeks. Diabetes was diagnosed when random blood glucose level was more than 13.9 mmol/L at week 12. Mice were randomly divided into five groups: normal control group, blank control group, low-dose MDG-1 group (75 mg/kg), high-dose MDG-1 group (300 mg/kg), and rosiglitazone group. The normal control and blank control groups were treated with distilled water (10 mL/kg), while the rosiglitazone group was treated with rosiglitazone (2 mg/kg). All the drugs were administered by gavage. After 8 weeks of treatment, the general conditions of mice were observed, oral glucose tolerance test (OGTT) was performed, and intestinal flora was cultured and identified.
RESULTS: Both high- and low-dose MDG-1 could improve symptoms, such as over-drinking and over-eating, in KKay mice. High-dose MDG-1 was superior to low-dose MDG-1 in improving symptoms in KKay mice. After 8 weeks of treatment, a significant decrease in blood glucose levels was observed in both the high-dose MDG-1 group and rosiglitazone group (both P < 0.05). Glucose tolerance was decreased in all KKay mice, especially significantly in the high-dose MDG-1 group and rosiglitazone group (all P < 0.05). In KKay mice, the numbers of pathogenic E. coli and Streptococcus increased while those of Lactobacilli and Bacillus bifidus decreased. However, treatment with MDG-1 decreased the numbers of pathogenic E. coli and Streptococcus and increased those of Lactobacilli (all P < 0.05).
CONCLUSION: MDG-1 can improve clinical symptoms and glucose tolerance and modulate intestinal microecological imbalance in KKay mice.
- Citation: Wang LY, Wang S, Wang Y, Ruan KF, Feng Y. Effect of MDG-1 on oral glucose tolerance and intestinal microecological balance in diabetic mice. Shijie Huaren Xiaohua Zazhi 2011; 19(19): 2058-2062
- URL: https://www.wjgnet.com/1009-3079/full/v19/i19/2058.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i19.2058
糖尿病是一种与遗传因素有关又与多种环境因素相关的慢性全身性疾病, 是由于体内胰岛素绝对或相对分泌不足而引起的糖、脂肪、蛋白质、水和电解质等一系列代谢紊乱综合征. 临床上以高血糖为主要特点, 典型病例可出现多尿、多饮、多食、消瘦等表现, 即"三多一少"症状[1]. 随着世界各国社会经济的发展和人民生活水平的提高, 糖尿病患病率逐年升高, 已成为威胁人们健康的重大社会问题. 世界卫生组织和国际糖尿病联盟对全球发出警告, 目前全世界至少有1.71亿人罹患糖尿病, 到2030年人数可能倍增, 达3.66亿人. 大量研究表明, 糖尿病患者肠道内的菌群结构、菌群比例以及菌群的数量均与正常人有异, 肠道内的益生菌数量明显减少, 腐败菌数量显著增加[2,3]. 麦冬为百合科沿阶草属植物麦冬Ophiopogon japonicus(Thunb.)Ker-Gawl. 的干燥块茎. 味甘、微苦, 具有生津润肺、养阴清热的功能, 临床主要用于热病伤津、心烦口渴等症[4]. 麦冬多糖(MDG-1)是从麦冬中分离纯化得到的均一分子量β-D-果聚糖, 平均分子量为3 400, 化学结构为β-D-果聚糖, 以2→1连接的呋喃型果糖为主, 平均每2.8个主链残基上有一个Fruf (2→6)Fruf(2→分支)[5]. 前期药理学研究表明, MDG-1具有一定的降糖和改善胰岛素抵抗的作用, 有文献报道其可抑制瘦素mRNA及其蛋白表达[6], 同时对正常小鼠糖耐量及肠道菌群有改善调节的作用[7], 但其作用机制目前仍不明确. 本文旨在通过考察MDG-1对糖尿病KKay小鼠糖耐量的影响及对肠道菌群的调节情况, 分析探索MDG-1可能的降血糖作用机制, 为该药的进一步研究开发提供依据.
♀KKay小鼠, 26只, 9周龄开始喂饲普通饲料至12周龄, 后高脂饲料喂养8 wk, 于12 wk测定小鼠随机血糖>13.9 mmol/L纳入糖尿病标准, 该32只小鼠均符合纳入标准. 对照组选择9-10周龄C57bl/6J小鼠10只, 上述两种品系小鼠均购自中国医学科学研究院动物研究所, 质量合格证号: SCXK(京)2009-0008. MDG-1, 本实验室制备, 平均分子量为3 400, 纯度>98%, 化学结构为β-D-果聚糖. 罗格列酮(葛兰素史克), 血糖试纸 (强生).
1.2.1 动物分组及受试药物剂量: 小鼠随机分为5组: 正常对照组(n = 10); 空白对照组(n = 6); 罗格列酮组(n = 7); MDG-1低(n = 7)、高剂量组(n = 6). 正常对照组与空白对照组每天灌胃蒸馏水(0.1 mL/10 g); 罗格列酮每天灌胃2 mg/kg, MDG-1组分别按75、300 mg/kg灌胃, 连续给药8 wk.
1.2.2 观察指标: (1)一般状态观察: 观察各组小鼠一般状况, 体质量及饮食情况, 每周测定随机与空腹血糖; (2)糖耐量测定: 实验最后1 wk, 禁食12 h, 于给药后2 h测定各组小鼠空腹血糖值, 随后, 各组小鼠灌服葡萄糖水溶液(1.5 g/kg), 进行口服糖耐量实验, 分别于给糖后15、30、60、120 min测定小鼠血糖值, 计算糖耐量曲线下面积[8]; (3)肠道菌群检测: 以无菌方法取各组小鼠直肠内容物0.05 g, 有氧菌培养稀释10倍, 厌氧菌培养稀释1 000倍. 取菌液20 μL接种于各种培养基上. 37 ℃培养24-48 h后观察实验结果, 计算各组小鼠大肠杆菌、链球菌、乳酸杆菌、双歧杆菌的数量[9]. 进行上述4种细菌的种属鉴定.
统计学处理 所有数据用mean±SD表示, 采用SPSS17.0软件进行分析. 多组间比较采用One-way ANOVA处理, 方差齐使用LSD法, 方差不齐使用Dunnett'T3法.
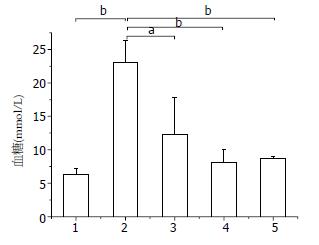
正常对照组C57bl/6J小鼠精神状态良好, 反应灵敏, 皮毛有光泽, 体质量较稳定. 空白对照组KKay小鼠随着周龄的增长逐渐出现精神萎靡, 反应迟钝, 皮毛无光泽, 摄食量、尿量增加, MDG-1治疗组和罗格列酮组、空白对照组有类似情况, 但程度较轻. 同时, MDG-1 300 mg/kg可显著降低糖尿病小鼠的空腹血糖值(P<0.05, 图1). 但对其体质量的影响不甚明显.
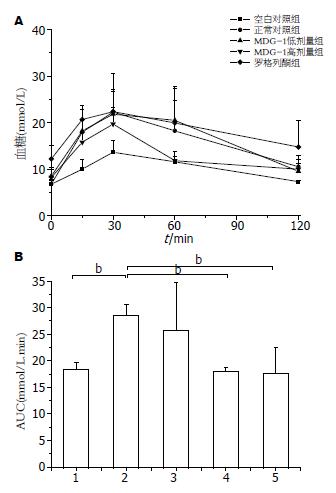
空白对照组与正常对照组比较, 其糖耐量受损较为严重, 各给药剂量组均有不同程度的修复作用, 在30、60 min时, MDG-1 300 mg/kg的血糖下降率分别达到44.07%、50.22%(图2A). MDG-1高剂量组、罗格列酮组与空白对照组比较, 其葡萄糖耐量0-120 min曲线下面积明显减小(P<0.05, 图2B), 基本与正常对照组达到同一水平.
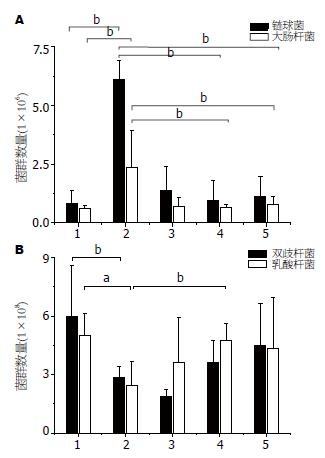
末次给药后, 处死小鼠, 取其直肠段内容物进行细菌培养, 结果显示, 糖尿病小鼠肠道内大肠杆菌与链球菌的数量明显升高, 而乳酸菌和双歧杆菌的数量明显降低, 与正常对照组相比有统计学差异. 给予MDG-1治疗后, 各剂量组对大肠杆菌、链球菌均有一定抑制作用, 同时可以促进双歧杆菌和乳酸菌的增殖(图3).
通常在评价药物降血糖疗效时, 我们会采用空腹血糖或者是随机血糖这样的评价指标用以判断药物的效果. 但有文献报道, 这两者均不能全面的、真正的反应患者的血糖水平[10,11]. 糖耐量减低是2型糖尿病发展过程中的一个中间环节, 其中的大部分人群随后都会发展成糖尿病[12]. 所以防治糖耐量减低也是糖尿病治疗中的一个重要的方面. 口服葡萄糖耐量实验正是一种葡萄糖负荷实验, 用以了解机体对葡萄糖的调节能力, 同时也是监测糖耐量减低的一种方法和手段. 本实验结果显示, 给药8 wk后, MDG-1低、高剂量组和阳性药罗格列酮可显著降低糖尿病小鼠的空腹血糖值; 在口服糖耐量实验中, 给糖2 h后, 各组血糖值均有不同程度的下降, MDG-1 300 mg/kg在给药后30、60 min时, 血糖下降率分别达到44.07%、50.22%, 其曲线下面积也显著降低, 基本接近正常小鼠的水平.
糖尿病患者由于疾病本身的原因, 其饮食受到严格的限制. 尤其是对碳水化合物的摄取更为严格. 由于饮食结构的变化, 往往会导致其肠道内菌群紊乱, 腐败菌大肠杆菌、链球菌的数量明显上升, 益生菌的数量明显减少. 从而促使疾病发生发展. 动物实验表明, 无菌动物接种正常菌群后可以增加葡萄糖的摄入, 提高血中葡萄糖和胰岛素水平[13]. 肖党生等[14]对糖尿病患者肠道菌群进行研究, 实验结果表明糖尿病患者在空腹血糖和糖化血红蛋白升高的同时肠道菌群则出现有害菌、肠杆菌科细菌升高, 而双歧杆菌数量下降. 有实验研究表明, 肠道内存在一种称之为大肠埃希菌的菌群, 其可以产生类胰岛素物质, 可与胰岛素靶细胞结合, 进而封闭胰岛素受体, 使真正的胰岛素不能够与靶细胞接触, 从而导致糖尿病的发生[15]. 如果可以增加益生菌的数量, 使其发生拮抗作用, 可以产生胰岛素样物质的大肠埃希菌减少, 从而可以使糖尿病得到缓解. 本研究结果表明, 给予MDG-1治疗8 wk后, 其腐败菌大肠杆菌、链球菌的数量明显减少, 益生菌中乳酸菌的数量显著增加, 双歧杆菌的数量也呈增长态势. MDG-1可能通过调节机体整体功能, 改善糖耐量减低及菌群失调状况, 进而改善糖尿病小鼠糖代谢及糖尿病症状. 关于MDG-1改善糖尿病的实验证据, 更深层次的作用机制仍需进一步完善.
随着世界各国社会经济的发展和人民生活水平的提高, 糖尿病患病率逐年升高, 已成为威胁人们健康的重大社会问题. 大量研究表明, 糖尿病患者肠道内的菌群结构、菌群比例以及菌群的数量均与正常人有异, 肠道内的益生菌数量明显减少, 腐败菌数量显著增加.
王学美, 研究员, 北京大学第一医院中西医结合研究室
肖党生等对糖尿病患者肠道菌群进行研究, 实验结果表明糖尿病患者在空腹血糖和糖化血红蛋白升高的同时肠道菌群则出现有害菌、肠杆菌科细菌升高, 而双歧杆菌数量下降.
不同剂量的MDG-1可以在不同程度上缓解糖尿病小鼠的糖尿病症状, 改善糖耐量, 调节肠道菌群平衡.
本文选题新颖, 具有一定的临床研究意义和实用价值.
编辑: 李薇 电编:何基才
| 1. | 李 端, 殷 明. 药理学. 第5版. 北京: 人民卫生出版社 2005; 314. |
| 3. | Hansen AK, Ling F, Kaas A, Funda DP, Farlov H, Buschard K. Diabetes preventive gluten-free diet decreases the number of caecal bacteria in non-obese diabetic mice. Diabetes Metab Res Rev. 2006;22:220-225. [PubMed] [DOI] |
| 4. | 齐 建红, 陶 贵荣, 郭 新军, 冯 航, 张 九东. 麦冬多糖的生物活性研究进展. 西安文理学院学报(自然科学版). 2008;11:44-46. |
| 10. | Sorkin JD, Muller DC, Fleg JL, Andres R. The relation of fasting and 2-h postchallenge plasma glucose concentrations to mortality: data from the Baltimore Longitudinal Study of Aging with a critical review of the literature. Diabetes Care. 2005;28:2626-2632. [PubMed] [DOI] |
| 11. | Anand SS, Razak F, Vuksan V, Gerstein HC, Malmberg K, Yi Q, Teo KK, Yusuf S. Diagnostic strategies to detect glucose intolerance in a multiethnic population. Diabetes Care. 2003;26:290-296. [PubMed] [DOI] |
| 13. | Bäckhed F, Ding H, Wang T, Hooper LV, Koh GY, Nagy A, Semenkovich CF, Gordon JI. The gut microbiota as an environmental factor that regulates fat storage. Proc Natl Acad Sci U S A. 2004;101:15718-15723. [PubMed] [DOI] |
| 15. | 康 白. 微生态学原理. 第1版. 大连: 大连出版社 1996; 42. |