修回日期: 2011-06-10
接受日期: 2011-06-15
在线出版日期: 2011-07-08
目的: 研究洋葱水提取物和乙醇提取物中黄酮类化合物的含量及其各自对结肠癌细胞株增殖的抑制作用.
方法: 采用水提取和乙醇提取洋葱后, 用紫外可见分光光度仪检测提取物中黄酮类化合物含量. 体外培养结肠癌细胞株(LoVo cells、SW480 cells、HT-29 cells、HCT-8 cells), 采用不同浓度的黄酮类化合物(0、2.5、5、10、20、40、60、80 mg/L)对其进行干预, WST-8法检测洋葱水提取物和乙醇提取物对结肠癌细胞株增殖的抑制作用.
结果: 洋葱水提取物中黄酮类化合物含量较乙醇提取物高. WST-8法检测洋葱水提取物和乙醇提取物对结肠癌细胞株的抑制作用具有剂量和时间依赖性, 且72 h时水提取物较乙醇提取物对结肠癌细胞株(SW480)增殖抑制(%)更显著(10 mg/L: 37.77±5.84 vs 17.36±5.24; 20 mg/L: 52.35±5.72 vs 24.15±5.54; 40 mg/L: 68.17±7.76 vs 32.79±6.02; 60 mg/L: 71.08±8.16 vs 47.55±2.45; 80 mg/L: 76.00±5.87 vs 60.35±6.61, 均P<0.05).
结论: 洋葱水提取物和乙醇提取物对体外培养的结肠癌细胞株的增殖有明显抑制作用, 其作用机制有待进一步研究.
引文著录: 周阿成, 金黑鹰, 谈瑄忠, 钱晓磊, 张春霞, 何勇山, 王水明. 洋葱提取物对结肠癌细胞增殖的抑制作用. 世界华人消化杂志 2011; 19(19): 2011-2015
Revised: June 10, 2011
Accepted: June 15, 2011
Published online: July 8, 2011
AIM: To determine the contents of flavonoids in water and alcohol extracts of Allium cepa and to investigate their inhibitory effect on the proliferation of colorectal cancer cells.
METHODS: The contents of flavonoids extracted from Allium cepa with water and alcohol were determined by ultraviolet-visible spectroscopy. Colorectal cancer cells (Lovo cells, SW480 cells, HT-29 cells and HCT-8 cells) were cultured in vitro and incubated with different concentration of flavonoids (0, 2.5, 5, 10, 20, 40, 60, 80 mg/L). Cell proliferation was tested by WST-8 assay.
RESULTS: The content of flavonoids was higher than in the water extract of Allium cepa than in the alcohol extract. Both the water and alcohol extracts of Allium cepa inhibited the proliferation of colorectal cancer cells in a dose- and time-dependent manner. The water extract of Allium cepa had a more significant inhibitory effect on cell proliferation than the alcohol extract (10 mg/L: 37.77 ± 5.84 vs 17.36 ± 5.24; 20 mg/L: 52.35 ± 5.72 vs 24.15 ± 5.54; 40 mg/L: 68.17 ± 7.76 vs 32.79 ± 6.02; 60 mg/L: 71.08 ± 8.16 vs 47.55 ± 2.45; 80 mg/L: 76.00 ± 5.87 vs 60.35 ± 6.61, all P < 0.05).
CONCLUSION: Allium cepa extracts can significantly inhibit the proliferation of colorectal cancer cells.
- Citation: Zhou AC, Jin HY, Tan XZ, Qian XL, Zhang CX, He YS, Wang SM. Allium cepa extracts inhibit the proliferation of colorectal cancer in vitro. Shijie Huaren Xiaohua Zazhi 2011; 19(19): 2011-2015
- URL: https://www.wjgnet.com/1009-3079/full/v19/i19/2011.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i19.2011
洋葱(allium cepa)是一种常见的食物, 其具有抑癌作用的成分主要包括含硫化合物和黄酮类化合物[1], 前者具有挥发性, 能够发出刺激性味道, 后者无挥发性, 实验主要提取黄酮类化合物. 回顾性调查研究发现, 摄入洋葱对胃癌、结直肠癌及前列腺癌等具有预防作用[2]. Taché等[3]发现洋葱的摄入能够减少大鼠结肠中畸形腺隐窝(aberrant crypt foci, ACF)的数目和大小. 本实验分别用纯净水和500 mL/L乙醇对洋葱进行提取, 研究提取物对结肠癌细胞增殖的抑制作用.
洋葱选择紫皮洋葱(购于南京夫子庙农贸市场); 芦丁购于中国药品生物制品检定所; 酒精检测条购于常州赛德瑞尔生物科技有限公司; 双光束紫外可见分光光度仪购于北京普析通用仪器有限责任公司(型号TV-1900); 结肠癌细胞株(LoVo细胞、SW480细胞、HT-29细胞、HCT-8细胞)购自中科院细胞所; CCK-8购自Dojindo公司(编号Cat#CK04-13); 胎牛血清购于Invitrogen公司(编号Gibco® Cat#10437028).
1.2.1 洋葱黄酮类化合物的检测及提取: (1)测定波长的选择. 精密称取干燥至恒重的芦丁对照品11.80 mg, 置100 mL量瓶中, 用无水乙醇溶解后, 再用500 mL/L的乙醇溶定容至刻度, 摇匀, 即为对照品溶液(0.118 g/L). 精密吸取对照品溶液5 mL, 置于25 mL量瓶中, 加1% AlCl3溶液4 mL, 用500 mL/L乙醇定容至刻度, 摇匀, 放置15 min. 在190-550 nm扫描; (2)标准曲线的绘制. 按照表1精密吸取一定量的对照品溶液, 于相应的容量瓶中, 分别加入16、4、8、8、4 mL的AlCl3, 用500 mL/L乙醇定容至相应刻度, 摇匀, 放置15 min; (3)热水煎煮法. 取一定量新鲜紫皮洋葱, 洗净后放入粉碎机中粉碎, 用10倍体积的水溶液煮沸回流1 h, 用100目的滤网过滤, 将滤渣按照上述方式再提取2次, 合并3次滤液, 在水浴锅(温度95 ℃)中加热浓缩, 浓缩至1 000 mL左右用滤纸过滤, 所得滤液在190-550 nm扫描; (4)乙醇回流法. 取一定量新鲜紫皮洋葱, 洗净后放入粉碎机中粉碎, 用8倍体积的500 mL/L乙醇煮沸回流1.5 h, 用100目的滤网过滤, 将滤渣按照上述方式提取2次, 合并3次滤液, 在水浴锅(温度95 ℃)中加热浓缩, 浓缩至1 000 mL左右用滤纸过滤, 所得滤液继续在水浴锅中加热, 使其中的乙醇完全挥发, 用酒精检测条检测溶液, 确定酒精完全挥发. 此样品溶液在190-550 nm扫描.
| 取样量(mL) | 容量瓶体积(mL) | 芦丁浓度(g/L) | 吸光度(A) |
| 5 | 100 | 0.00590 | 0.208 |
| 2 | 25 | 0.00944 | 0.317 |
| 5 | 50 | 0.01180 | 0.415 |
| 10 | 50 | 0.02360 | 0.832 |
| 10 | 25 | 0.04720 | 1.641 |
1.2.2 WST-8法检测洋葱提取物对结肠癌细胞株增殖的抑制作用: 将LoVo细胞、SW480细胞、HT-29细胞、HCT-8细胞分别以5×103的数目分别接种于96板中, 每种细胞种48个孔, 并将孔周围的孔中加100 μL不含细胞的培养基. 24 h后且细胞状态正常时, 将每种细胞48孔分为16小组, 每组3个孔, 并分别将孔中的培养基添加至200 μL分别含黄酮类化合物终浓度为0(对照组), 2.5、5.0、10.0、20.0、40.0、60.0、80.0 mg/L(实验组)水提取物和乙醇提取物的完全培养基, 其中乙醇提取物加入DMSO(浓度低于0.01%)溶解, 放置于37 ℃、50 mL/L CO2细胞培养箱, 孵育24、72 h. 细胞孵育到达24、72 h时, 按照100 μL加入10 μLCCK-8溶液的比例, 在孔中加入CCK-8反应液. 在37度培养箱中放置1h后, 利用酶标仪读取450 nm波长处的吸光度(A值). 抑制率 = [1-(加药组A值-空白对照A值)/(对照组A值-空白对照A值)]×100%.
统计学处理 应用SPSS17.0统计软件处理数据, 计量资料采用mean±SD表示, 采用单因素方差分析(ANOVA)进行检验, 应用LSD法进行两两比较, P<0.05为差异有统计学意义.
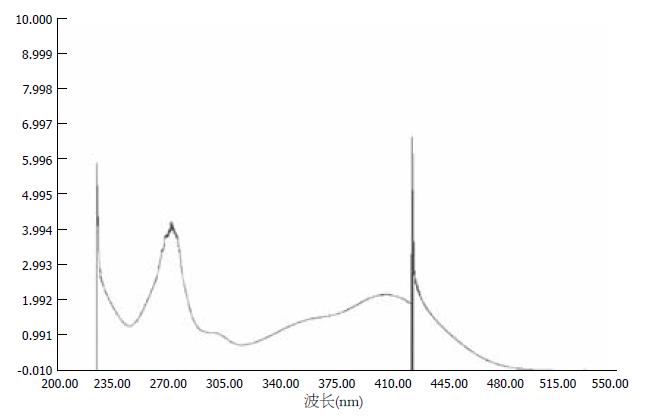
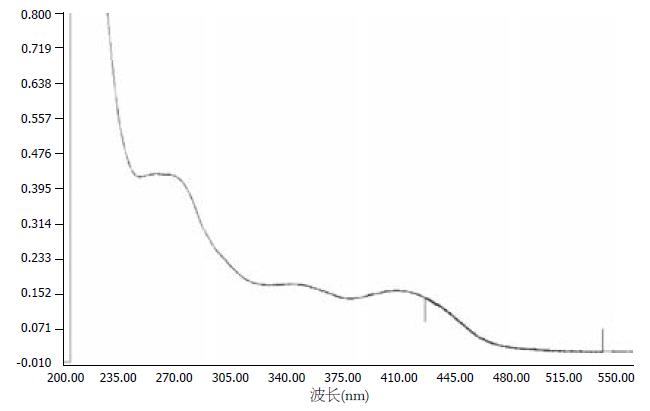
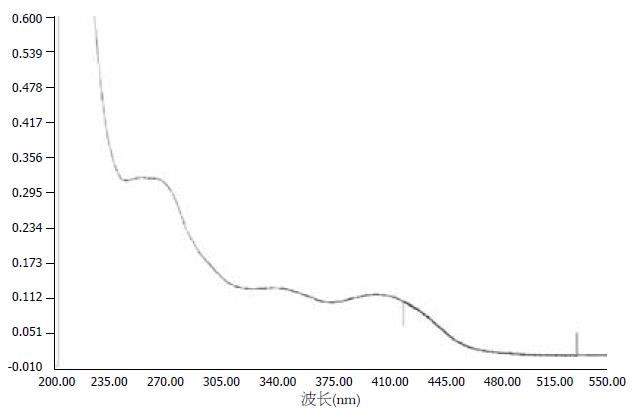
芦丁对照品溶液270 nm处有最大吸收(图1), 水提物和醇提物均在270 nm有最大吸收(图2, 3). 不同浓度的芦丁对照品在270 nm波长处测定吸光度(表1). 以吸光度A为纵坐标, 芦丁浓度C(g/L)为横坐标, 绘制标准曲线. 结果表明, 芦丁标准品溶液在浓度在0.0059-0.0472范围内, 浓度和吸光度线性关系良好. 得到回归方程: Y = 34.841X+0.0001, 相关系数R = 0.9998.
每克紫皮洋葱的热水煎煮法提取的黄酮类化合物(1.891 mg±0.075 mg)较500 mL/L乙醇回流法提取的黄酮类化合物(1.474 mg±0.226 mg)含量高, 两者间有统计学差异(P = 0.039).
WST-8法检测不同浓度的洋葱水提取物和乙醇提取物对LoVo细胞、SW480细胞、HT-29细胞、HCT-8细胞增殖的抑制作用, 结果显示随着黄酮类化合物浓度的增加, 24 h与72 h时LoVo细胞、SW480细胞、HT-29细胞、HCT-8细胞的增殖抑制率均逐渐升高, 均在含黄酮类化合物浓度为80 mg/L时抑制率达到最高, 且在72 h较24 h抑制率高, 说明洋葱的水提物和乙醇提取物(黄酮类化合物浓度在0-80 mg/L之间)对LoVo细胞、SW480细胞、HT-29细胞、HCT-8细胞增殖的抑制作用具有剂量依赖性和时间依赖性(表2, 3). 洋葱提取物对不同细胞的IC50同样可以反映洋葱的水提取物和乙醇提取物在72 h较24 h对细胞增殖抑制较显著(表4).
| 浓度(mg/L) | 24 h | 72 h | ||||||
| LoVo | SW480 | HT-29 | HCT-8 | LoVo | SW480 | HT-29 | HCT-8 | |
| 2.5 | 3.15±2.23 | 4.48±10.95 | 7.90±10.72 | 3.79±4.63 | 2.50±2.25 | 11.82±10.63 | 13.69±5.46 | 1.40±7.15 |
| 5.0 | 6.78±2.80 | 8.36±11.77a | 14.45±5.14 | 10.13±3.31a | 9.49±3.87 | 33.27±8.42 | 14.36±3.05 | 19.59±4.50 |
| 10.0 | 10.84±3.35 | 13.67±6.60a | 19.27±3.76 | 22.36±1.40 | 9.85±1.36 | 37.77±5.84 | 17.04±2.04 | 23.25±3.58 |
| 20.0 | 13.34±2.67 | 17.53±7.78a | 21.65±1.31 | 34.62±2.32 | 16.12±1.93 | 52.35±5.72 | 21.82±5.90 | 34.54±5.34 |
| 40.0 | 17.83±1.63a | 20.84±7.80a | 22.23±2.13 | 37.51±0.58a | 34.51±5.26 | 68.17±7.76 | 25.02±15.42 | 54.51±5.15 |
| 60.0 | 24.34±2.54a | 32.79±4.69a | 24.20±2.41a | 49.75±4.89 | 56.37±2.31 | 71.08±8.16 | 49.15±5.64 | 57.02±6.76 |
| 80.0 | 30.37±2.05a | 41.69±0.89a | 32.25±3.70a | 52.50±3.39a | 66.43±2.76 | 76.00±5.87 | 56.25±2.09 | 69.87±3.52 |
| 浓度(mg/L) | 24 h | 72 h | ||||||
| LoVo | SW480 | HT-29 | HCT-8 | LoVo | SW480 | HT-29 | HCT-8 | |
| 2.5 | 2.40±0.95 | 3.90±1.69a | 2.67±2.65 | 2.84±2.31 | 12.59±7.03 | 9.41±2.88 | 4.05±6.91 | 10.09±5.31 |
| 5.0 | 5.56±1.21a | 8.24±2.97 | 6.78±0.67 | 10.22±7.49 | 17.66±2.80 | 13.28±11.96 | 6.24±13.51 | 13.02±6.02 |
| 10.0 | 6.97±0.79a | 12.03±4.67 | 8.44±1.82 | 21.40±1.27 | 20.36±3.54 | 17.36±5.24 | 8.28±9.01 | 22.66±8.12 |
| 20.0 | 8.71±1.15a | 14.71±3.82 | 14.90±10.27 | 27.42±5.99 | 21.52±4.60 | 24.15±5.54 | 10.64±10.88 | 26.52±7.74 |
| 40.0 | 11.87±0.93a | 18.02±4.14a | 16.37±5.59 | 29.68±5.95 | 25.49±3.47 | 32.79±6.02 | 36.57±12.85 | 38.37±1.70 |
| 60.0 | 17.00±2.06a | 21.94±4.81a | 24.25±11.29 | 30.30±4.17a | 39.53±2.18 | 47.55±2.45 | 42.63±14.22 | 44.82±5.99 |
| 80.0 | 22.34±2.61a | 29.91±3.43a | 27.72±13.86 | 33.59±2.39a | 53.90±1.81 | 60.35±6.61 | 50.04±8.89 | 47.37±2.71 |
| 细胞 | 24 h | 72 h | ||
| 水 | 乙醇 | 水 | 乙醇 | |
| LoVo | 426.120 | 1 246.504 | 55.106 | 141.085 |
| SW480 | 193.312 | 618.633 | 17.005 | 71.438 |
| HT-29 | 94.883 | 463.346 | 17.005 | 84.062 |
| HCT-8 | 62.612 | 223.163 | 35.823 | 92.338 |
洋葱的水提取物在24 h对LoVo细胞、SW480细胞、HT-29细胞、HCT-8细胞的增殖抑制作用较乙醇提取物显著; 且水提取物在72 h对SW480细胞、HT-29细胞、HCT-8细胞的增殖抑制作用较乙醇提取物显著, 但在72 h含黄酮类化合物在2.5-20.0 mg/L时, 乙醇提取物对LoVo细胞的增殖抑制较水提取物显著(表5, 6).
| 浓度(mg/L) | 水提物 | 醇提物 | ||||||
| LoVo | SW480 | HT-29 | HCT-8 | LoVo | SW480 | HT-29 | HCT-8 | |
| 2.5 | 3.15±2.23 | 4.48±10.95 | 7.90±10.72 | 3.79±4.63 | 2.40±0.95 | 3.90±1.69 | 2.67±2.65 | 2.84±2.31 |
| 5.0 | 6.78±2.80 | 8.36±11.77 | 14.45±5.14 | 10.13±3.31 | 5.56±1.21 | 8.24±2.97 | 6.78±0.67 | 10.22±7.49 |
| 10.0 | 10.84±3.35 | 13.67±6.60 | 19.27±3.76a | 22.36±1.40 | 6.97±0.79 | 12.03±4.67 | 8.44±1.82 | 21.40±1.27d |
| 20.0 | 13.34±2.67 | 17.53±7.78 | 21.65±1.31 | 34.62±2.32d | 8.71±1.15 | 14.71±3.82 | 14.90±10.27 | 27.42±5.99 |
| 40.0 | 17.83±1.63a | 20.84±7.80 | 22.23±2.13 | 37.51±0.58d | 11.87±0.93 | 18.02±4.14 | 16.37±5.59 | 29.68±5.95d |
| 60.0 | 24.34±2.54a | 32.79±4.69a | 24.20±2.41 | 49.75±4.89ad | 17.00±2.06 | 21.94±4.81 | 24.25±11.29 | 30.30±4.17 |
| 80.0 | 30.37±2.05a | 41.69±0.89a | 32.25±3.70 | 52.50±3.39ad | 22.34±2.61 | 29.91±3.43 | 27.72±13.86 | 33.59±2.39 |
| 浓度(mg/L) | 24 h | 72 h | ||||||
| LoVo | SW480 | HT-29 | HCT-8 | LoVo | SW480 | HT-29 | HCT-8 | |
| 2.5 | 2.50±2.25 | 11.82±10.63 | 13.69±5.46 | 1.40±7.15 | 12.59±7.03 | 9.41±2.88 | 4.05±6.91 | 10.09±5.31 |
| 5.0 | 9.49±3.87a | 33.27±8.42 | 14.36±3.05 | 19.59±4.50 | 17.66±2.80 | 13.28±11.96 | 6.24±13.51 | 13.02±6.02 |
| 10.0 | 9.85±1.36a | 37.77±5.84ad | 17.04±2.04 | 23.25±3.58 | 20.36±3.54 | 17.36±5.24 | 8.28±9.01 | 22.66±8.12 |
| 20.0 | 16.12±1.93 | 52.35±5.72ad | 21.82±5.90 | 34.54±5.34 | 21.52±4.60 | 24.15±5.54 | 10.64±10.88 | 26.52±7.74 |
| 40.0 | 34.51±5.26 | 68.17±7.76a | 25.02±15.42 | 54.51±5.15a | 25.49±3.47 | 32.79±6.02 | 36.57±12.85 | 38.37±1.70 |
| 60.0 | 56.37±2.31a | 71.08±8.16a | 49.15±5.64 | 57.02±6.76 | 39.53±2.18 | 47.55±2.45 | 42.63±14.22 | 44.82±5.99 |
| 80.0 | 66.43±2.76a | 76.00±5.87a | 56.25±2.09 | 69.87±3.52a | 53.90±1.81 | 60.35±6.61 | 50.04±8.89 | 47.37±2.71 |
洋葱的提取物对不同细胞的增殖抑制作用的比较显示, 水提取物在24 h含黄酮类化合物浓度在20-80 mg/L时, 对HCT-8细胞的增殖抑制显著高于其他3组细胞, 具有统计学差异(P<0.05); 乙醇提取物在24 h含黄酮类化合物浓度在5-80 mg/L时, 对HCT-8细胞的增殖抑制高于其他3组细胞, 且在10和40 mg/L具有统计学差异(P<0.05), 水提取物在72 h含黄酮类化合物浓度在5-80mg/L时, 对SW480细胞的增殖抑制率高于其他3组细胞, 在10和20 mg/L具有统计学差异(P<0.05, 表5, 6).
近年来, 国外的多项回顾性研究发现, 洋葱的摄入能够减少多种肿瘤的发生率, 包括口腔癌、卵巢癌、前列腺癌、乳腺癌等[4-6]. 2006年Gonzalez等[7]进行的一项前瞻性研究发现, 增加洋葱的摄入能够降低消化系肿瘤的发生率. 尤其在结直肠肿瘤方面, 多项回顾性研究发现, 洋葱的摄入能减少结直肠肿瘤的发生率[2,8]. 洋葱发挥抗癌作用主要为黄酮类化合物[9], 尤其是其中的槲皮素, 能够通过多种途径抑制结直肠肿瘤细胞的增殖[10]. 尉艳霞等[11]研究发现, 洋葱水提物和乙醇提取物均能够抑制肝癌细胞的增殖. 陈凤秀等[12]发现洋葱中黄酮类化合物能够抑制HCT116结肠癌细胞的增殖. 本研究旨在探讨洋葱的水提取物和乙醇提取物对结肠癌细胞株的抑制作用比较. 紫外可见分光光度仪检测发现热水煎煮法较乙醇回流法所得黄酮类化合物含量较高, 与尉艳霞等[11]的结果一致, 但黄酮类化合物的总量较尉艳霞等[11]的高, 可能的原因是洋葱的品种不同. WST-8法检测发现含不同浓度的黄酮类化合物的水提取物和乙醇提取物对LoVo细胞、SW480细胞、HT-29细胞、HCT-8细胞增殖均有抑制作用, 且具有剂量和时间依赖性, 从不同提取物对细胞的IC50同样可以发现72 h较24 h对细胞的增殖抑制较显著. 洋葱的水提取物在24 h对LoVo细胞、SW480细胞、HT-29细胞、HCT-8细胞的增殖抑制作用较乙醇提取物显著; 同样水提物在72 h对SW480细胞、HT-29细胞、HCT-8细胞的增殖抑制作用较乙醇提取物显著, 但在含黄酮类化合物浓度在2.5-20.0 mg/L时, 乙醇提取物对LoVo细胞的增殖抑制较水提取物显著, LoVo细胞是由于错配修复基因缺失引起的微卫星不稳定的结肠癌细胞, 该结果推测乙醇提取物对微卫星不稳定的结肠癌细胞具有更显著的抑制作用. 本实验结果还显示洋葱的水提取物和乙醇提取物在24 h对HCT-8细胞的增殖抑制较其他3组细胞明显, HCT-8细胞由于回盲肠腺癌细胞分化, 结果推测洋葱的水提物和醇提取在短时间对回盲肠腺癌细胞的抑制更为显著; 在72 h水提物对SW480细胞的增殖抑制率较其他3组细胞显著, SW480细胞来自结肠癌原发灶, 推测洋葱水提取物可能在长时间下对原发性结肠癌的抑制更为显著.
通过本实验, 我们推断, 洋葱提取物对LoVo细胞、SW480细胞、HT-29细胞、HCT-8细胞的增殖具有抑制作用, 其中水提取物对结肠癌细胞株的抑制作用相对较高, 但是其具体作用机制目前不明确. 洋葱的提取物对其他肿瘤是否有抑制作用以及在体作用需进一步深入研究.
洋葱是一种常见的食物, 其具有抑癌作用的成分主要包括含硫化合物和黄酮类化合物. 近年来, 国外的多项回顾性研究发现, 洋葱的摄入能够减少多种肿瘤的发生率, 包括口腔癌、卵巢癌、前列腺癌、乳腺癌等.
沈克平, 主任医师, 上海龙华医院肿瘤五科
回顾性研究发现, 摄入洋葱能够减少多种肿瘤的发生, 尤其是消化系肿瘤, 陈凤秀等研究发现, 洋葱黄酮类物质能够抑制结肠癌细胞HCT116细胞的增殖, 增加细胞的凋亡.
本文通过不同的提取方法研究洋葱提取物对不同结肠癌细胞的增殖抑制作用, 为在体研究提供依据.
洋葱水提取物和乙醇提取物对体外培养的结肠癌细胞株的增殖有明显抑制作用, 其作用机制有待进一步研究.
本文观察了洋葱提取物对结肠癌细胞增殖的作用, 为结肠癌药食疗提供了依据, 有较重要的科学意义.
编辑: 李薇 电编:何基才
| 2. | Izzo AA, Capasso R, Capasso F. Eating garlic and onion: a matter of life or death. Br J Cancer. 2004;91:194. [PubMed] [DOI] |
| 3. | Taché S, Ladam A, Corpet DE. Chemoprevention of aberrant crypt foci in the colon of rats by dietary onion. Eur J Cancer. 2007;43:454-458. [PubMed] [DOI] |
| 4. | Galeone C, Pelucchi C, Levi F, Negri E, Franceschi S, Talamini R, Giacosa A, La Vecchia C. Onion and garlic use and human cancer. Am J Clin Nutr. 2006;84:1027-1032. [PubMed] |
| 5. | Hsing AW, Chokkalingam AP, Gao YT, Madigan MP, Deng J, Gridley G, Fraumeni JF. Allium vegetables and risk of prostate cancer: a population-based study. J Natl Cancer Inst. 2002;94:1648-1651. [PubMed] |
| 6. | Galeone C, Pelucchi C, Dal Maso L, Negri E, Montella M, Zucchetto A, Talamini R, La Vecchia C. Allium vegetables intake and endometrial cancer risk. Public Health Nutr. 2009;12:1576-1579. [PubMed] [DOI] |
| 7. | Gonzalez CA, Riboli E. Diet and cancer prevention: where we are, where we are going. Nutr Cancer. 2006;56:225-231. [PubMed] [DOI] |
| 8. | Millen AE, Subar AF, Graubard BI, Peters U, Hayes RB, Weissfeld JL, Yokochi LA, Ziegler RG. Fruit and vegetable intake and prevalence of colorectal adenoma in a cancer screening trial. Am J Clin Nutr. 2007;86:1754-1764. [PubMed] |
| 9. | 张 京春, 陈 可毅. 洋葱-全球性保健食品. 国外医学·中医中药分册. 2003;25:335-337. |