修回日期: 2011-06-22
接受日期: 2011-06-28
在线出版日期: 2011-07-08
目的: 探讨选择性COX-2抑制剂塞莱昔布对CCl4诱导的大鼠肝纤维化的作用.
方法: 5-6周龄的♂SD大鼠50只, 随机分为6组. A组(肝纤维化模型组): 10只, 50% CCl4橄榄油溶液1 mL/kg, 每周2次皮下注射, 同时给予生理盐水灌胃; B组(早期治疗组): 10只, 造模同时给予塞莱昔布15 mg/kg溶于生理盐水中灌胃, 每天1次; C组(中期治疗组): 10只, 造模同时给予生理盐水灌胃, 第3周起改为塞莱昔布灌胃; D组(晚期治疗组): 10只, 造模同时给予生理盐水灌胃, 第5周起改为塞莱昔布灌胃; E组: 5只, 给予相同体积的橄榄油皮下注射, 同时给予相同剂量的塞莱昔布灌胃; F组: 5只, 给予相同体积的橄榄油皮下注射和生理盐水中灌胃. 上述处置共8 wk. 实验结束后腹主动脉取血, 取肝组织, 检测血清谷丙转氨酶(ALT)、透明质酸(HA)、层粘连蛋白(LN)水平; 病理组织学HE染色及Masson染色观察肝纤维化严重程度并评分, 免疫组织化学方法检测肝组织Ⅰ胶原、α-SMA、COX-1、COX-2的表达.
结果: A组与F组相比, 可见显著的肝纤维化改变(P<0.01); 与A组相比, B组病理染色可见肝纤维化程度明显减轻(P<0.01), 血清ALT、HA、LN水平明显降低(100.4 U/L±8.7 U/L vs 287.8 U/L±9.6 U/L, 189.6 μg/L±83.0 μg/L vs 382.6 μg/L±136.0 μg/L, 71.4 μg/L±4.6 μg/L vs 108.7 μg/L±9.8 μg/L, 均P<0.01), 免疫组织化学示Ⅰ型原、α-SMA、COX-2阳性表达面积减少(P<0.01); B组、C组、D组间两两比较, 各项指标差异有统计学意义(P<0.05); E组与F组比较无显著性差异; COX-1阳性表达各组间无显著性差异.
结论: COX-2在肝纤维化的形成过程中发挥重要作用; 选择性COX-2抑制剂塞莱昔布具有抗肝纤维的作用, 并呈时间依赖性, 越早给药效果越好, 其机制可能是抑制肝星状细胞的活化和炎症反应.
引文著录: 田丰, 王琳, 张亚杰. 选择性环氧合酶-2抑制剂塞莱希布对大鼠肝纤维化的作用. 世界华人消化杂志 2011; 19(19): 2002-2010
Revised: June 22, 2011
Accepted: June 28, 2011
Published online: July 8, 2011
AIM: To investigate whether celecoxib, a selective cyclooxygenase-2 (COX-2) inhibitor, protects from carbon tetrachloride (CCl4)-induced liver fibrosis in rats.
METHODS: Fifty male SD rats were randomly divided into six groups. Group A (n = 10) was subcutaneously injected with 50% 1 mL/kg CCl4 olive oil solution, twice per week, to induce hepatic fibrosis and intragastrically given saline. Groups B (n = 10), C (n = 10) and D (n = 10) were also subjected to induction of hepatic fibrosis and intragastrically given celecoxib 15 mg/kg once daily from day 1, week 3, and week 5 after CCl4 injection. Group E (n = 5) was subcutaneously injected with equal volume of olive oil and intragastrically given the same dose of celecoxib, while group F (n = 5) was subcutaneously injected with equal volume of olive oil and intragastrically given saline. The treatment lasted for 8 weeks. At the end of the experiment, blood samples were collected to measure serum ALT, HA and LN levels, while hepatic tissue samples were taken to evaluate the degree of liver fibrosis by HE staining and to detect the expression of type I collagen, alpha SMA, COX-1, and COX-2 by immunohistochemistry.
RESULTS: Compared to group F, significant hepatic fibrosis was observed in group A (P < 0.01). Compared to group A, liver fibrosis was significantly reduced (P < 0.01), serum ALT, HA and LN levels significantly decreased (100.4 U/L ± 8.7 U/L vs 287.8 U/L ± 9.6 U/L, 189.6 μg/L ± 83.0 μg/L vs 382.6 μg/L ± 136.0 μg/L, 71.4 μg/L ± 4.6 μg/L vs 108.7 μg/L ± 9.8 μg/L, all P < 0.01), and the areas positive for type I collagen, alpha SMA, and COX-2 were reduced (all P < 0.01). The above parameters showed significant differences among groups B, C and D (all P < 0.05). No significant differences were observed in the above parameters between groups E and F. COX-1-positive area showed no significant difference among each group.
CONCLUSION: COX-2 plays an important role in liver fibrogenesis. Celecoxib can reduce or prevent liver fibrosis in a time-dependent manner probably by inhibiting hepatic stellate cell activation and inflammation.
- Citation: Tian F, Wang L, Zhang YJ. Selective COX-2 inhibitor celecoxib inhibits liver fibrogenesis in rats. Shijie Huaren Xiaohua Zazhi 2011; 19(19): 2002-2010
- URL: https://www.wjgnet.com/1009-3079/full/v19/i19/2002.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i19.2002
肝纤维化是各种慢性肝病向肝硬化、肝癌发展所共有的病理改变和必经途径, 因而在我国抗肝纤维化治疗尤为重要. 肝纤维化形成实质是细胞外基质(extracellular matrix, ECM)的生成超过肝脏的降解能力导致过多的ECM在肝脏的沉积[1]. 目前认为活化的肝星状细胞(hepatic stellate cell, HSC)是肝纤维化ECM的主要来源. 抑制HSC活化是治疗肝纤维化的关键之一[1,2]. 近年来发现在肝纤维化及肝硬化组织中环氧合酶-2(cyclooxygenase-2, COX-2)的表达是明显升高的, 而正常肝组织表达甚微[3-5]. 因此, 推测COX-2可能在肝纤维化形成过程中起关键作用, 选择性COX-2抑制剂可能有抗肝纤维化的作用. 为了进一步探讨COX-2在肝纤维化形成过程中的作用及其对HSC活化的影响与机制, 我们采取CCl4诱导大鼠肝纤维化形成, 同时给予选择性的COX-2抑制剂塞莱昔布(celecoxib)进行干预研究.
CCl4由沈阳化学试剂厂生产; 选择性COX-2抑制剂塞莱昔布美国辉瑞公司生产; 透明质酸(hyaluronic acid, HA)、层粘连蛋白(laminin, LN)放免试剂盒由上海海军医学研究所提供; Ⅰ、Ⅲ型胶原、α-SMA免疫组织化学试剂盒购自武汉博士德公司; COX-1、COX-2多克隆抗体购自美国Santa Cruz公司.
1.2.1 造模及分组: 5-6周龄的♂SD大鼠(中国医科大学实验动物中心提供)50只, 质量180-240 g, 按昼夜时程, 在室温及稳定湿度条件下, 用平衡饲料喂养1 wk后, 随机分为6组, 给予以下处理. A组: 10只, 50% CCl4橄榄油溶液1 mL/kg, 每周2次皮下注射, 同时给予生理盐水灌胃, 每天1次; B组: 10只, 50% CCl4橄榄油皮下注射同时给予塞莱昔布15 mg/kg[6]溶于生理盐水中灌胃, 每天1次; C组: 10只, 50% CCl4橄榄油溶液皮下注射同时给予生理盐水灌胃, 第3周改为塞莱昔布灌胃; D组: 10只, 50% CCl4橄榄油溶液皮下注射同时给予生理盐水灌胃, 第5周改为塞莱昔布灌胃; E组: 5只, 给予相同体积的橄榄油皮下注射同时给予塞莱昔布灌胃; F组: 5只, 给予相同体积的橄榄油皮下注射和生理盐水中灌胃, 共8 wk. 大鼠正常进食和饮水, 每周称量体质量以调整给药剂量. 实验结束后, 禁食24 h, 用10%水合氯醛(5 mL/kg)腹腔注射麻醉, 腹主动脉取血, 分离血清, -20 ℃保存; 用锋利的手术刀于肝脏中叶取1块肝组织, 置于40 g/L甲醛中.
1.2.2 肝脏组织病理学检测: 取肝中叶组织一块, 用40 g/L甲醛溶液固定, 石蜡包埋, 3 μm厚切片, 常规HE及Masson染色, 肝纤维化分期按Scheuer's分期系统[4], 肝组织炎症与纤维化程度由有经验的病理医生进行评分.
1.2.3 血清学检测: 谷丙转氨酶(ALT)检测用自动生物化学分析仪进行; HA、LN检测采用放射免疫分析法进行.
1.2.4 α-SMA、Ⅰ型胶原、COX-1、COX-2免疫组织化学及半定量分析: 采用肝组织常规脱石蜡水化; 自来水冲洗; 3%过氧化氢溶液浸泡20 min, 去除内源性过氧化物酶; PBS液(pH7.4)冲洗3次, 每次3-5 min; 40%火力微波修复抗原10 min, 自然冷却至40 ℃; PBS液冲洗; 加一抗(抗大鼠Ⅰ型胶原、α-SMA、COX-1、COX-2抗体, 1:160稀释), 置37 ℃温箱2 h; PBS液冲洗; 加羊抗大鼠IgG-HRP, 37 ℃孵育20 min; PBS液冲洗; 加配制的DAB溶液, 显色后封片. 另外以结肠癌作阳性对照, 阳性表达在细胞的胞质中, 一抗用PBS液代替以作阴性对照. 阳性细胞表达半定量分析: 用病理图像分析仪进行分析, 每张切片选取四周及中央5个区域, 取该区域中阳性反应最多的视野, 10倍物镜下测定阳性反应面积比(阳性面积/肝组织面积×100%), 取平均值.
统计学处理 数据用mean±SD表示, 用SPSS11.0统计分析软件进行分析, 各组间均数比较用方差分析, P<0.05有统计学意义.
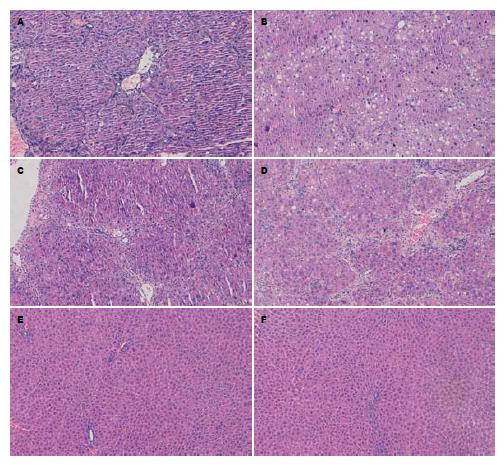
大鼠肝组织HE染色及Masson染色, A组与F组相比, A组可见明显的肝硬化组织学改变, 汇管区结缔组织增多, 形成粗大的纤维间隔并且与邻近的汇管区和中央静脉区相连, 正常肝小叶结构完全破坏, 有再生结节和假小叶形成, 形成典型的肝硬化病理改变(图1A); 与A组相比, B组肝纤维化程度明显减轻, COX-2抑制剂B组大鼠肝组织可见少量肝纤维化形成, 呈明显脂肪变性、碎片样坏死伴有少量炎症细胞浸润(图1B), 与A组比较有显著差异(P<0.01). C组和D组可见汇管区扩大, 纤维增多, 小的纤维间隔形成, 大部分标本汇管-汇管、汇管-中央静脉区纤维间隔的延伸以至连接, 正常肝小叶结构部分毁损(图1C, D). E组和F组可见正常的肝组织结构, 肝小叶结构清楚, 肝细胞索排列整齐、规则, 无纤维化(评分为0), 两组间比较没有明显差异(P>0.05, 图1E, F); 总之, 与A组相比, B组能减轻肝纤维化程度, 越早给药纤维化程度越低(表1).
| 分组 | n | Scheuer's评分 | ALT(U/L) | HA(µg/L) | LN(µg/L) |
| A组 | 10 | 3.90±0.20d | 287.8±9.6d | 382.6±136.0d | 108.7±9.8d |
| B组 | 10 | 1.28±0.20df | 100.4±8.7df | 189.6±83.0df | 71.4±4.6df |
| C组 | 10 | 2.45±0.30ad | 150.7±6.9ad | 234.6±75.0ad | 80.3±7.2ad |
| D组 | 10 | 3.21±0.20ad | 200.8±7.5ad | 308.8±102.0ad | 90.7±5.6ad |
| E组 | 5 | 0.00±0.00 | 28.3±5.9 | 115.7±28.0 | 50.4±5.6 |
| F组 | 5 | 0.00±0.00 | 27.9±5.9 | 114.9±25.0 | 51.2±6.7 |
A组、B组、C组、D组的ALT、HA、LN水平均较E组、F组升高, B组的ALT、HA、LN指标明显低于A组, 差异有显著性(P<0.01); B组、C组、D组之间的ALT、HA、LN指标进行两两比较, 各组间差异有显著性(P<0.05), 提示越早给药纤维化程度越低, 其作用呈时间依赖性, E组与F组比较未见显著差异, 提示塞莱昔布对肝脏无明显损害(表1).
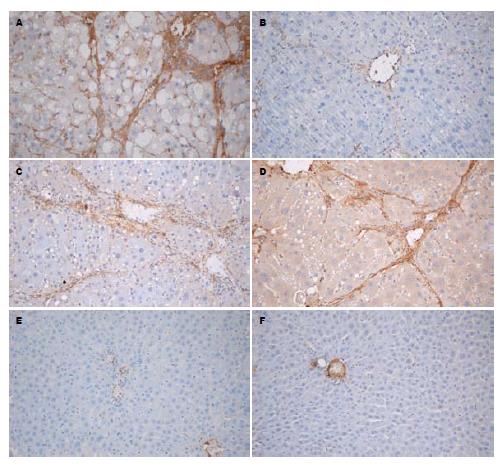
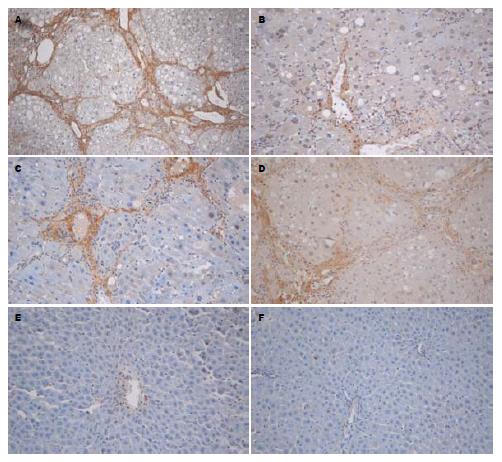
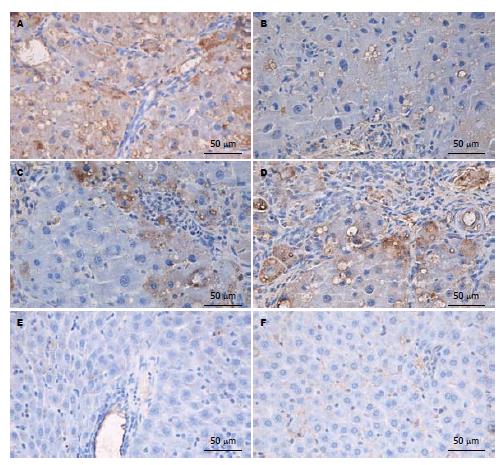
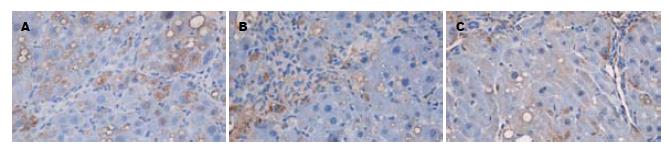
E组, F组可见血管壁少量α-SMA阳性表达, E组与F组之间无显著差异(P>0.05), A组α-SMA阳性表达细胞明显增多, 胞质呈棕黄色, 有的细胞有2-3个较长突起, 主要分布于门静脉, 汇管区, 纤维间隔和邻近肝窦, 与E组、F组比较有显著差异(P<0.01); B组汇管区, 纤维间隔和邻近肝窦阳性表达面积显著减少, 胞质阳性染色显著减轻, 与A组比较, 差异有显著统计学意义(P<0.01). C组、D组与A组比较, 胞质阳性染色略有减轻, 差异有统计学意义(P<0.05, 图2); B组、C组、D组各组间差异有统计学意义(P<0.05, 表2). Ⅰ型胶原阳性表达面积变化与α-SMA结果是一致的, 且随着给药时间的延长, 肝纤维化的抑制作用越明显, 呈时间依赖性(表2, 图3). 在E组及F组大鼠肝组织中COX-2无表达, 在肝纤维化模型组中大量表达, B组COX-2阳性表达面积明显少于A组(P<0.01), B组、C组、D组COX-2阳性表达各组间比较有明显差异(P<0.05, 表2, 图4); 各组均有少量COX-1阳性表达, 但各组间COX-1阳性表达无显著性差异(P>0.05, 图5).
COX是前列腺素类(prostaglandins, PGs)物质在体内合成的限速酶. COX在体内有两种同工酶: 即COX-1和COX-2, 两者的氨基酸序列有61%的同源性, 一级结构的差异引起二、三级结构的不同, 从而影响两种酶的活性和功能. 其中COX-1为结构酶, 在生理状态下表达于绝大多数组织和器官, 主要参与正常生理过程, 如保护胃黏膜、扩张肾血管等; COX-2是可诱导的酶, 在正常组织或器官中不表达或极少量表达, 但在病理状态下很多因素如细胞因子、内毒素及致癌物可诱导其高表达[7,8], 催化花生四烯酸合成PGs, 如血栓素2(thromboxane 2, TXA2)、PGD2、PGE2、PGF2、PGI2等参与炎症反应, 近年来发现在各种慢性炎症疾病中COX-2的表达明显升高[9]. 国外研究证实[10-12]: COX-1在正常肝组织和肝纤维化组织中均有少量表达; COX-2在正常肝组织中无表达, 在肝纤维化组织中却显著高表达, 合成大量PGE2, 进一步激活HSC, 产生大量ECM促进肝硬化的形成; COX-2在肝组织中高表达与炎症和纤维化水平呈显著的正相关; 高表达的COX-2引起TXA2合成增加, 导致肝脏局部微循环对缩血管物质反应性增高, 是肝硬化门脉高压形成的重要因素, 可见COX-2通过多种途径导致肝硬化极其并发症的产生. 此外[13], 在肝硬化的基础上, COX-2通过提高炎症坏死反应、促进细胞增殖和血管生成、抑制凋亡而促进肝癌的发生. 总之, 在肝纤维化、肝硬化、肝癌的发生、发展过程中起作用的是COX-2, 而非COX-1. 本研究结果提示, COX-2在肝纤维化的形成过程中表达增加, 选择性抑制剂塞莱昔布具有减轻或阻止肝纤维生成的作用, 且随着给药时间的延长, 肝纤维化的抑制作用越明显. 因此, COX-2介导的信号途径可能具有重要的促肝纤维化形成的作用. 即往研究证实[14,15]: 非选择性COX抑制剂可以抑制HSC的激活, 从而阻止肝纤维化的发生, 但同时导致胃溃疡、出血、肾功能损害等严重不良反应, 这主要是由于COX-1被抑制所致; Yamamoto等[10]证实, 单独使用选择性COX-2抑制剂即可达到显著的抗肝纤维化和降低门脉压力作用, 且无上述不良反应产生. 可见, 选择性COX-2抑制剂是一种有前途的抗肝纤维化、抑制肝硬化和肝癌发生的药物.
目前已经明确HSC是肝脏纤维生成过程中ECM的主要来源, HSC要产生ECM必须经历活化的过程, HSC的活化是肝纤维化形成过程中的中心事件[1]. 如何通过有效的药物抑制HSC活化, 一直是抗肝纤维化治疗的关键环节[1,2]. 本实验在利用CCl4诱导的肝硬化大鼠模型时, 给予高度选择性的COX-2抑制剂塞莱昔布(每日15 mg/kg)可在体内抑制α-SMA的表达, 后者是HSC活化的标志物, 说明COX-2具有促进HSC活化的作用. 另外, 选择性COX-2抑制剂具有抗血管生成作用[16], 从理论上推测选择性COX-2抑制剂有减轻肝窦毛细血管化的作用. Cheng等[17]在体外细胞培养研究表明, 选择性COX-2抑制剂NS-398能抑制HSC的活化, 进而减少活化产物胶原的产生, 涂传涛等[18]研究选择性COX-2抑制剂能改善肝硬化门脉高压. 日本学者利用其他肝硬化动物模型的体内研究, 也同样证实COX-2具有活性HSC的作用[10]. 但是也有研究认为COX-2抑制剂对肝纤维化可能有促进作用[6,19], 对于COX-2抑制剂对肝纤维化的作用影响当前尚存在争议, 然而我们及其他学者研究证实: COX-2抑制剂具有抗肝纤维化作用[20-26]. 但COX-2抑制剂抗肝纤维化生成的具体分子机制还不十分清楚.
转化生长因子β1(transforming growth factor β1, TGF-β1)是目前研究最深入的与肝脏疾病密切相关的细胞因子. 现已证明, TGF-β1在肝纤维化的发生中占有重要地位. 其促肝纤维化的机制包括: 诱导肝细胞凋亡, 抑制肝细胞再生,并影响其功能; 活化HSC, 增加ECM合成和抑制ECM降解; 调节ECM受体的表达, 增加了细胞与基质的黏附, 有利于ECM在肝内沉积, 促进了肝纤维化乃至肝硬化形成. 国外研究结果证实[27], TGF-β1随炎症和纤维化进展而呈逐渐升高趋势, 其升高与肝病的严重程度一致. 目前, 国内外已将TGF-β1作为一种客观、无创的肝纤维化指标用于临床. 近来研究表明[28], TGF-β1在促进COX-2表达中发挥着重要的作用, 他是通过促进IL-1和TNF-α的转录而间接促进COX-2表达的, 由此可见, COX-2是TGF-β1下游的肝纤维化调控因子. 针对TGF-β1在肝纤维化发生中的重要作用, 有人提出通过拮抗其活性来进行抗纤维化治疗, 但是, TGF-β1作用的靶细胞种类多、效果复杂, 因此完全阻断其表达或活性的后果是难以预料的. 例如, 去除TGF-β1基因的小鼠因失去对炎症过程的抑制而在出生后很快死于全身性炎症[29]. 而通过抑制TGF-β1下游的肝纤维化调控因子COX-2活性, 可能是更特异、更有效、更安全的抗肝纤维化手段.
消化系炎症、溃疡、肿瘤和肝纤维化是中国致残、致死的常见疾病, COX-2在其中均有较高表达, 且与其发生发展密切相关, 合理阻遏COX-2的合成, 减少以上疾病的发生率, 已成为现阶段研究的热点. 总之, 本研究进一步证实COX-2在肝纤维化形成过程中具有重要作用,应用COX-2抑制剂塞莱昔布能够抑制HSC活化, 降低血清中ALT、HA、LN水平, 减少Ⅰ型胶原形成及α-SMA表达, 延缓或减轻肝纤维化的发生发展, 越早给药效果越好. 如何下调肝组织COX-2的基因表达或抑制COX-2的活性可能是重要的抗肝纤维化策略之一.
感谢周卓、马颖及马铁同志在本实验中给予的大力帮助.
肝纤维化是各种慢性肝病向肝硬化、肝癌发展所共有的病理改变和必经途径, 因而在我国抗肝纤维化治疗尤为重要. 近年来发现在肝纤维化及肝硬化组织中COX-2的表达是明显升高的, 而正常肝组织表达甚微. 因此, 推测COX-2可能在肝纤维化形成过程中起关键作用, 选择性COX-2抑制剂塞莱昔布可能有抗肝纤维化的作用. 但COX-2抑制剂塞莱昔布抗肝纤维化生成的具体分子机制还不十分清楚.
吴俊华, 副主任医师, 南京大学医学院功能评价中心
COX-2抑制剂塞莱昔布抗肝纤维化生成的具体分子机制是国内外研究的热点, 存在广泛争议, 以动物实验和体外实验居多, 其具体分子机制已经成为研究热点.
Cheng等的体外细胞培养研究表明, 选择性COX-2抑制剂NS-398能抑制HSC的活化, 进而减少活化产物胶原的产生.
本实验从血清学, 病理组织学和免疫组织化学方面全面检测了肝纤维化相关指标和Ⅰ胶原、α-SMA、COX-1、COX-2表达, 并且组间进行多重比较, 为COX-2抑制剂塞莱昔布具有抗肝纤维化作用提供重要理论依据.
本实验为肝纤维化的临床治疗提供了心得思路和可靠的理论依据, 如何下调肝组织COX-2的基因表达或抑制COX-2的活性可能是重要的抗肝纤维化策略之一. 如果应用于临床, 必将给我国这样一个肝炎、肝硬化、肝癌大国带来广泛的社会效益和经济效益.
本文选题恰当, 内容详实, 有一定的临床参考意义.
编辑: 曹丽鸥 电编:何基才
| 3. | Nakamura T, Akiyoshi H, Saito I, Sato K. Adenovirus-mediated gene expression in the septal cells of cirrhotic rat livers. J Hepatol. 1999;30:101-106. [PubMed] [DOI] |
| 4. | Scheuer PJ. Classification of chronic viral hepatitis: a need for reassessment. J Hepatol. 1991;13:372-374. [PubMed] [DOI] |
| 5. | Dooley S, Hamzavi J, Breitkopf K, Wiercinska E, Said HM, Lorenzen J, Ten Dijke P, Gressner AM. Smad7 prevents activation of hepatic stellate cells and liver fibrosis in rats. Gastroenterology. 2003;125:178-191. [PubMed] [DOI] |
| 6. | Hui AY, Leung WK, Chan HL, Chan FK, Go MY, Chan KK, Tang BD, Chu ES, Sung JJ. Effect of celecoxib on experimental liver fibrosis in rat. Liver Int. 2006;26:125-136. [PubMed] [DOI] |
| 7. | Graupera M, García-Pagán JC, Abraldes JG, Peralta C, Bragulat M, Corominola H, Bosch J, Rodés J. Cyclooxygenase-derived products modulate the increased intrahepatic resistance of cirrhotic rat livers. Hepatology. 2003;37:172-181. [PubMed] [DOI] |
| 8. | Tsugawa K, Hashizume M, Migou S, Kishihara F, Kawanaka H, Tomikawa M, Sugimachi K. A selective cyclo-oxygenase-2 inhibitor, NS-398, may improve portal hypertension without inducing gastric mucosal injury. J Gastroenterol Hepatol. 1999;14:642-651. [PubMed] [DOI] |
| 9. | Caceres A. [Considerations on neuropsychology]. Rev Neuropsiquiatr. 1968;31:56-62. [PubMed] |
| 10. | Yamamoto H, Kondo M, Nakamori S, Nagano H, Wakasa K, Sugita Y, Chang-De J, Kobayashi S, Damdinsuren B, Dono K. JTE-522, a cyclooxygenase-2 inhibitor, is an effective chemopreventive agent against rat experimental liver fibrosis1. Gastroenterology. 2003;125:556-571. [PubMed] [DOI] |
| 11. | Kondo M, Yamamoto H, Nagano H, Okami J, Ito Y, Shimizu J, Eguchi H, Miyamoto A, Dono K, Umeshita K. Increased expression of COX-2 in nontumor liver tissue is associated with shorter disease-free survival in patients with hepatocellular carcinoma. Clin Cancer Res. 1999;5:4005-4012. [PubMed] |
| 12. | Cheng J, Imanishi H, Iijima H, Shimomura S, Yamamoto T, Amuro Y, Kubota A, Hada T. Expression of cyclooxygenase 2 and cytosolic phospholipase A(2) in the liver tissue of patients with chronic hepatitis and liver cirrhosis. Hepatol Res. 2002;23:185-195. [PubMed] [DOI] |
| 13. | Mohammed NA, Abd El-Aleem SA, El-Hafiz HA, McMahon RF. Distribution of constitutive (COX-1) and inducible (COX-2) cyclooxygenase in postviral human liver cirrhosis: a possible role for COX-2 in the pathogenesis of liver cirrhosis. J Clin Pathol. 2004;57:350-354. [PubMed] [DOI] |
| 14. | Denda A, Endoh T, Kitayama W, Tang Q, Noguchi O, Kobayashi Y, Akai H, Okajima E, Tsujiuchi T, Tsutsumi M. Inhibition by piroxicam of oxidative DNA damage, liver cirrhosis and development of enzyme-altered nodules caused by a choline-deficient, L-amino acid-defined diet in rats. Carcinogenesis. 1997;18:1921-1930. [PubMed] [DOI] |
| 15. | Mathew NT, Meyer JS, Ott EO. Increased cerebral blood volume in benign intracranial hypertension. Neurology. 1975;25:646-649. [PubMed] |
| 16. | Masferrer JL, Leahy KM, Koki AT, Zweifel BS, Settle SL, Woerner BM, Edwards DA, Flickinger AG, Moore RJ, Seibert K. Antiangiogenic and antitumor activities of cyclooxygenase-2 inhibitors. Cancer Res. 2000;60:1306-1311. [PubMed] |
| 17. | Cheng J, Imanishi H, Liu W, Iwasaki A, Ueki N, Nakamura H, Hada T. Inhibition of the expression of alpha-smooth muscle actin in human hepatic stellate cell line, LI90, by a selective cyclooxygenase 2 inhibitor, NS-398. Biochem Biophys Res Commun. 2002;297:1128-1134. [PubMed] [DOI] |
| 19. | Liu H, Wei W, Li X. Celecoxib exacerbates hepatic fibrosis and induces hepatocellular necrosis in rats treated with porcine serum. Prostaglandins Other Lipid Mediat. 2009;88:63-67. [PubMed] [DOI] |
| 20. | Paik YH, Kim JK, Lee JI, Kang SH, Kim DY, An SH, Lee SJ, Lee DK, Han KH, Chon CY. Celecoxib induces hepatic stellate cell apoptosis through inhibition of Akt activation and suppresses hepatic fibrosis in rats. Gut. 2009;58:1517-1527. [PubMed] [DOI] |
| 21. | 涂 传涛, 王 吉耀, 郭 津生. 选择性COX-2抑制剂、PGE1对肝硬化大鼠VEGF和CTGF表达的影响. 胃肠病学和肝病学杂志. 2009;18:69-72. |
| 22. | Horrillo R, Planagumà A, González-Périz A, Ferré N, Titos E, Miquel R, López-Parra M, Masferrer JL, Arroyo V, Clària J. Comparative protection against liver inflammation and fibrosis by a selective cyclooxygenase-2 inhibitor and a nonredox-type 5-lipoxygenase inhibitor. J Pharmacol Exp Ther. 2007;323:778-786. [PubMed] [DOI] |
| 24. | 胡 迎宾, 田 德安, 王 家駹, 刘 南植. 环氧合酶-2在大鼠酒精性肝炎中的表达及作用机制. 胃肠病学和肝病学杂志. 2004;13:105-107. |
| 25. | 唐 保东, 徐 雅, 刘 思纯, 马 博. 选择性COX-2抑制剂塞来昔布对肝星状细胞增殖及活化的影响. 胃肠病学和肝病学杂志. 2007;16:468-470. |
| 26. | 易 辉, 王 新, 苗 继延, 杜 静平, 潘 阳林, 刘 娜, 张 宇梅, 樊 代明. 选择性环氧合酶-2抑制剂对大鼠酒精性肝损伤的保护作用. 中华肝脏病杂志. 2003;11: 663-666. |
| 27. | Kropf J, Schurek JO, Wollner A, Gressner AM. Immunological measurement of transforming growth factor-beta 1 (TGF-beta1) in blood; assay development and comparison. Clin Chem. 1997;43:1965-1974. [PubMed] |
| 28. | Diaz A, Chepenik KP, Korn JH, Reginato AM, Jimenez SA. Differential regulation of cyclooxygenases 1 and 2 by interleukin-1 beta, tumor necrosis factor-alpha, and transforming growth factor-beta 1 in human lung fibroblasts. Exp Cell Res. 1998;241:222-229. [PubMed] [DOI] |
| 29. | Letterio JJ, Böttinger EP. TGF-beta knockout and dominant-negative receptor transgenic mice. Miner Electrolyte Metab. 1998;24:161-167. [PubMed] [DOI] |