修回日期: 2011-06-22
接受日期: 2011-06-28
在线出版日期: 2011-07-08
目的: 研究P21对POLD1基因的调控通路, 以探索阻断癌细胞恶性增殖的机制.
方法: 实验主要分3组: 阴性对照组(转染空载体pXJ41-neo的803-pXJ细胞)、空白对照组(胃癌细胞MGC-803)、实验组(转染P21重组真核表达质粒pXJ41-p21的803-p21细胞). MTT实验分析细胞增殖变化, 流式细胞仪检测细胞凋亡水平, 实时荧光定量PCR技术检测基因表达水平的变化, Western blot分析蛋白表达差异.
结果: MTT实验显示, 与空白对照和阴性对照组相比, 实验组细胞增殖受到明显抑制, 凋亡率(%)增高(11.36±0.51 vs 7.39±0.17, 7.69±0.47, F = 85.338, 均P<0.05). 实验组P21 mRNA表达水平显著提高(2.15±0.23 vs 1.05±0.11, 1.00±0.00, F = 59.054, 均P<0.05), POLD1则显著下调(0.45±0.07 vs 1.09±0.13, 1.00±0.00, F = 49.907, 均P<0.05); P21、P125蛋白表达变化与基因变化相一致. cyclin E、Rb1基因表达均上调, CDK2基因表达下调, c-myc基因表达则变化不大.
结论: P21抑制了胃癌细胞的增殖、促进其凋亡, 同时抑制了POLD1基因的表达, 这种抑制作用可能通过CDK2、cyclin E、Rb1等细胞周期因子实现.
引文著录: 阮细玲, 李永继, 吴琼, 廖柳凤, 徐恒. P21对胃癌细胞MGC-803的增殖抑制及对POLD1基因表达的调控. 世界华人消化杂志 2011; 19(19): 1990-1995
Revised: June 22, 2011
Accepted: June 28, 2011
Published online: July 8, 2011
AIM: To investigate whether and how P21 regulates POLD1 expression in human gastric cancer cell line MGC-803 and to find new clues to blocking the malignant proliferation of cancer cells.
METHODS: MGC-803 cells were divided into three groups: blank control group (untransfected cells), negative control group (cells transfected with an empty vector pXJ41-neo), and experimental group (cells transfected with a eukaryotic expression plasmid pXJ41-p21). After transfection, cell proliferation was detected by MTT assay; cell apoptosis was detected by flow cytometry; and the mRNA and protein expression was detected by quantitative real-time PCR and Western blot, respectively.
RESULTS: Compared to the two control groups, cell proliferation was significantly inhibited, cell apoptosis was increased (11.36 ± 0.51 vs 7.39 ± 0.17, 7.69 ± 0.47, F = 85.338, P < 0.05), and the mRNA and protein expression of POLD1 was inhibited in the experimental group. In addition, the relative expression levels of cyclin E and Rb1 increased, that of CDK2 decreased, and that of c-myc showed little change in the experimental group when compared to the two control groups.
CONCLUSION: P21 can suppress cell proliferation and promote apoptosis in human gastric cancer cell line MGC-803. P21 can also suppress POLD1 expression possibly by regulating the expression of CDK2, cyclin E, Rb1 or other cell cycle factors in MGC-803 cells.
- Citation: Ruan XL, Li YJ, Wu Q, Liao LF, Xu H. P21 suppresses cell proliferation and down-regulates POLD1 expression in human gastric cancer cell line MGC-803. Shijie Huaren Xiaohua Zazhi 2011; 19(19): 1990-1995
- URL: https://www.wjgnet.com/1009-3079/full/v19/i19/1990.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i19.1990
据DePamphilis[1]报道, 使细胞周期任一时期DNA复制减少或增加都可能导致严重的后果, 产生癌症、先天性缺陷及发育异常等人类遗传性疾病. DNA聚合酶δ(DNA polymerase δ, polδ)是唯一与细胞周期相关、在DNA复制中起主导作用的DNA复制酶[2], 其催化亚基P125具有5'-3'聚合酶和3'-5'外切酶两种活性, 编码该亚其的基因称为POLD1[3]. 而P21是目前已知具有最广泛激酶抑制活性的细胞周期抑制蛋白[4,5], 他可以阻滞细胞周期进程, 抑制DNA的复制. 据此我们推测他可能参与了对POLD1基因的表达调控, 并研究其可能的调控模式, 从这种新的调控网络与胃癌细胞内DNA复制的关系来寻找阻断癌细胞恶性增殖的又一途径.
MGC-803细胞购自中国科学院上海生物细胞研究所; pXJ41-neo载体由新加坡国立大学王跃教授惠赠, pXJ41-p21是将P21的cDNA构建入pXJ41-neo载体获得的真核表达载体, 由北京师范大学桑建利教授惠赠; DMEM培养基, Hyclone公司; 胎牛血清, 杭州四季青公司; 高效真核转染试剂Vigofect, 威格拉斯生物技术有限公司; Annexin V/PI凋亡检测试剂盒, 南京凯基生物科技公司; TRIzol, Invitrogen公司; 逆转录试剂盒, Fermentas公司; 荧光定量PCR试剂盒, 天根生化科技有限公司; 兔抗人P21抗体C19、山羊抗人DNA聚合酶δ(P125)抗体C20为Santa Cruz产品; 远红外荧光标记的山羊抗兔、兔抗山羊二抗, 美国KPL公司
1.2.1 细胞培养: 人胃癌细胞系MGC-803培养于含100 mL/L胎牛血清的高糖DMEM培养基, 37 ℃、50 mL/L CO2条件下培养.
1.2.2 细胞转染: 转染前1 d将MGC-803细胞转种于6孔板, 汇合度为70%-80%. 转染前1 h给细胞换用无血清DMEM培养基. 转染试剂Vigofect与质粒比例为3 μL:5 μg制备转染复合物, 15 min后均匀滴入6孔板细胞, 培养箱培养6 h, 换用完全培养基. 转染后48 h收获细胞.
1.2.3 MTT法分析细胞增殖: 对数生长期细胞接种于96孔板, 2×103/孔, 每组细胞均做5个复孔, 第2天转染pXJ41-p21、pXJ41-neo质粒到细胞, 分别于转染0、24、48、72 h加入20 μL MTT溶液, 继续培养4 h后, 小心吸尽培养液, 每孔加入150 μL DMSO, 酶标仪检测490 nm处吸光度值(A值), 最后绘制生长曲线.
1.2.4 细胞凋亡检测: 细胞经胰酶消化后, 计数板计数细胞, 每管取1×106细胞, 预冷的PBS洗细胞3次, 用200 μL Buffer重悬细胞, 每管分别加入5 μL Annexin V-FITC、5 μL PI, 避光孵育20 min, 流式细胞仪上机检测.
1.2.5 荧光定量PCR检测基因表达: 应用Primer Premier 5.0软件设计引物, 各基因的引物序列见表1. 提取细胞总RNA, 各取1 μg进行逆转录得到cDNA, ABI 7500荧光定量PCR仪上进行反应, 反应体系为: 9 μL PCR mix、9 μL去离子水、1 μL引物、 1 μL cDNA. 以GAPDH为内参, PCR条件为: 95 ℃预变性2 min, 95 ℃变性20 s、 60 ℃退火30 s、72 ℃延伸31 s, 40个循环, 采用比较Ct法, 7500 Software v2.0.5分析数据.
| 基因 | 引物序列 | 产物长度(bp) |
| GAPDH | 上游引物 5'-AACGGATTTGGTCGTATTG-3' | 210 |
| 下游引物 5'-CTGGAAGATGGTGATGGG-3' | ||
| p21 | 上游引物 5'-ATTCAGCATTGTGGGAGGAG-3' | 131 |
| 下游引物 5'-TGGACTGTTTTCTCTCGGCT-3' | ||
| POLD1 | 上游引物 5'-GCTCCGCTCCTACACGCTCAA-3' | 109 |
| 下游引物 5'-GGTCTGGTCGTTCCCATTCTGC-3' | ||
| cyclin E | 上游引物 5'-CAGGGTATCAGTGGTGCGACAT-3' | 181 |
| 下游引物 5'-TTCTTTGCTCGGGCTTTGTCC-3' | ||
| Rb1 | 上游引物 5'-GACCCAGAGCAGGACAGCG-3' | 177 |
| 下游引物 5'-ACCTCCCAATACTCCATCCACA-3' | ||
| CDK2 | 上游引物 5'-GGCCTAGCTTTCTGCCATTC-3' | 188 |
| 下游引物 5'-CCCAGGAGGATTTCAGGAGC-3' | ||
| c-myc | 上游引物 5'-CGAGGAGAATGTCAAGAGGCG-3' | 176 |
| 下游引物 5'-CTGCTTGGACGGACAGGATGT-3' |
1.2.6 Western blot分析蛋白表达: RIPA裂解液提取细胞总蛋白, 测定浓度后, 取50 μg蛋白样品, 加入上样缓冲液煮沸5 min变性后上样电泳. 100 mA电流条件下转膜2 h, 5%脱脂奶粉封闭2 h. 4 ℃摇床孵育一抗(P21、P125一抗稀释度分别为1:500、1:2 000)过夜, PBST洗膜3次, 10 min每次, 室温孵育二抗(二抗稀释度均为1:5 000)1 h, PBST洗膜3次, 10 min每次, PBS洗1次(10 min), 最后用LI-COR Odyssey红外荧光扫描成像系统扫描PVDF膜, Odyssey V3.0软件分析图像及数据.
统计学处理 SPSS13.0统计软件进行统计学分析, 采用ANOVA单因素方差分析, 并用LSD法进行两两比较, 结果用mean±SD表示, 检验水准α = 0.05, 以P<0.05为差异有统计学意义.
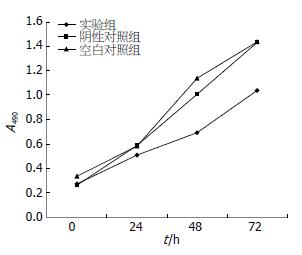
与阴性对照组803-pXJ细胞、空白对照组MGC-803细胞相比, 实验组803-p21细胞490 nm处的A值在转染后24 h差异无统计学意义(0.51±0.10 vs 0.41±0.09, 0.58±0.14, F = 1.744, 均P>0.05), 但在48、72 h时差异具有统计学意义(0.69±0.08 vs 1.01±0.18, 1.14±0.07, F = 11.333; 1.04±0.16 vs 1.43±0.13, 1.44±0.17, F = 6.706, 均P<0.05), 即实验组细胞生长受到明显抑制(图1).
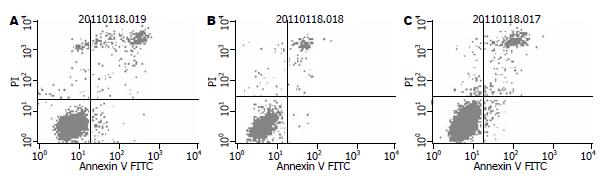
与阴性对照组803-pXJ细胞、空白对照组MGC-803细胞相比, 实验组803-p21细胞凋亡率增高(11.36±0.51 vs 7.39±0.17, 7.69±0.47, F = 85.338, 均P<0.05, 图2).
2.3.1 p21基因和POLD1基因: 与对照组相比较,实验组细胞p21基因的相对表达量增加, 说明重组质粒在细胞内成功表达p21基因, 而POLD1基因表达受抑制.
2.3.2 CDK2等细胞周期因子基因表达的变化: 与对照组相比, 实验组cyclin E、Rb1表达上调; CDK2基因表达受到抑制; c-myc基因表达在各组间差异无统计学意义(表2).
| 分组 | CDK2 | cyclin E | c-myc | Rb1 |
| 实验组 | 0.64±0.13 | 1.34±0.09 | 1.07±0.03 | 1.90±0.16 |
| 阴性对照组 | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 |
| 空白对照组 | 1.10±0.09 | 1.11±0.16 | 1.04±0.16 | 1.05±0.15 |
| F值 | 21.670 | 18.047 | 0.436 | 50.540 |
| P值 | <0.05 | <0.05 | >0.05 | <0.05 |
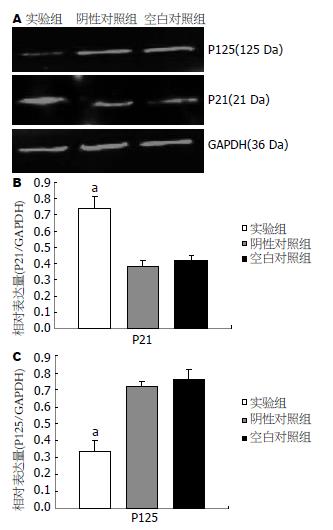
2.3.3 Western blot分析蛋白表达: P21蛋白表达水平增高(0.64±0.04 vs 0.40±0.07, 0.45±0.06, F = 13.788, 均P<0.05), P125表达受抑制(0.12±0.01 vs 0.19±0.15, 0.20±0.00, F = 14.378, 均P<0.05, 图3).
DNA复制是由多种蛋白及酶(包括DNA聚合酶)严格调控的过程[6], 真核生物DNA聚合酶至少包括6种: DNA聚合酶α、β、γ、δ、ε及ζ[7]. polδ是DNA聚合酶B家族的成员, 他在DNA复制、修复、重组及跨损伤修复等均发挥重要作用[8,9]. 人类Polδ全酶至少由4种亚基组成: P125、P66、P50及P12[10]. 其中催化亚基P125由POLD1基因编码[11].
Sanefuji等[12]通过免疫组织化学的方法显示肝癌细胞核内P125的表达阳性率显著高于正常肝组织, 并且P125的表达与细胞的分化及血管侵袭的程度有关. 欧贤红等[13]通过RT-PCR及Western blot的方法也发现肝癌组织POLD1基因及P125蛋白的表达明显高于癌旁组织. 提示P125的高表达可能与肿瘤的发生、发展有重要的关系.
p53是一个重要的肿瘤抑制基因[14], Li和 Lee[15]通过Northern blot及EMSA等实验证实野生型p53通过与Sp1竞争性结合POLD1启动子上的P4序列而抑制POLD1基因mRNA表达水平. 作为p53基因的最重要的下游基因之一, p21基因的表达产物P21蛋白可以通过依赖或不依赖P53的途径发挥其细胞周期阻滞、DNA修复、细胞分化及凋亡等功能[16]. 一方面, 他可以通过直接结合cyclin-CDK复合物而抑制其活性, 使Rb蛋白不能发生磷酸化, E2F不能释放, 从而使细胞周期停滞在G1期, DNA复制受抑制[5]. 另外他可以通过紧密结合增殖细胞核抗原(proliferating cell nuclear antigen, PCNA), 影响PCNA与polδ的相互结合, 进而直接抑制DNA复制[17]. 石磊等[18]研究发现乳腺癌细胞系MCF7内P21抑制POLD1基因的表达, 胃癌细胞内是否也存在这种抑制作用, 具体机制如何, 目前尚不清楚.
本研究通过将P21重组真核表达质粒pXJ41-p21转染到胃癌细胞MGC-803内, 使细胞高表达p21基因, 从而探讨了P21对胃癌细胞增殖和凋亡的影响, 及P21对POLD1基因的表达调控作用.
细胞凋亡结果显示, 高表达p21基因的胃癌细胞凋亡水平升高, 说明p21基因具有有促凋亡作用. 目前对于P21与细胞凋亡的关系还没有达成一致. P21的抑制凋亡作用与其胞质定位有关, 细胞质内的P21可抑制凋亡相关蛋白及减少对CDK2、PCNA的抑制作用从而起到抗细胞凋亡作用[19]. 而P21的促凋亡作用可能通过依赖或者不依赖P53的途径, 但其具体机制目前仍不清楚, 可能与DNA修复体系的成员相互作用或对P21的调节作用有关[20]. 最近研究表明, 对于无DNA损伤的P53激活的p21基因, 并不影响细胞凋亡[21].
MTT实验表明, 高表达p21基因的胃癌MGC-803细胞增殖速度受到明显抑制, 且邱荣元等[22]、谭晓虹等[23]证实野生型P21抑制了肝癌细胞的增殖. Plasilova等[24]干扰间充质干细胞P21表达后, 细胞生长明显比对照组快. 这些共同说明了野生型p21基因对细胞增殖的较广泛抑制作用.
更重要的是, p21基因高表达的胃癌MGC-803细胞POLD1基因表达在mRNA和蛋白水平都下调了, 即P21抑制了POLD1基因的表达. 以上结果表明, P21抑制癌细胞生长的同时也抑制了POLD1基因的表达. POLD1基因表达产物P125表达下调后, polδ的5'-3'聚合酶活性将不能充分发挥, DNA复制过程将受到影响, 从而细胞生长也受影响. 表明P21对POLD1的调控作用与DNA复制、细胞增殖等关系密切.
为了更深入地探讨P21对POLD1基因调控的可能机制, 我们通过荧光定量PCR的方法, 分析了P21高表达后其他细胞周期因子表达的变化, 以找到与P21对POLD1的调控机制相关的因子.
已知P21的N末端具有保守的CDK2/cyclin E结合位点, 使CDK2活性被抑制[25,26]. 但CDK2蛋白的缺失并不会阻滞细胞周期进程[27], CDK2缺失的情况下, P21可以与CDK1结合[28]. 据此我们推测P21对POLD1的调控与CDK2/cyclin E有关,但不应该是唯一的通路. 已有实验表明, 非磷酸化的pRb在G1期可以与P125结合[29], 而我们研究发现, P21可以上调Rb1基因的表达, 这为P21通过Rb1而间接调控POLD1的表达提供了一定的依据.
有文献[30-32]报道c-Myc可以下调p21基因的表达, 但反过来, P21对c-Myc的表达是否有影响未为可知. 我们的研究显示, P21对c-myc基因表达的影响并不明显. 他可能不作为P21对POLD1基因表达调控的一个间接因子.
总之, 我们的实验结果表明, P21影响了胃癌细胞的增殖及凋亡, 同时他可能通过影响CDK2/cyclin E、Rb1的基因表达而间接抑制POLD1基因的表达, 并且我们推测P21对癌细胞的增殖抑制作用可能与他对POLD1的抑制有关, 这需要我们作进一步的实验来证实, 且更深入研究P21对POLD1基因表达调控的具体通路显得非常重要, 可为抑制肿瘤细胞增殖提供一种新的思路.
P21是目前已知具有最广泛激酶抑制活性的细胞周期抑制蛋白, 他可以阻滞细胞周期进程, 抑制DNA的复制. 而DNA聚合酶δ是唯一与细胞周期相关、在DNA复制中起主导作用的DNA复制酶. 认识两者的关系有助于更深入理解DNA复制.
陈国忠, 副主任医师, 广西中医学院第一附属医院消化内科; 杜雅菊, 主任医师, 哈尔滨医科大学附属第二医院消化内科
有文献报道, 肝癌组织POLD1基因及P125蛋白的表达明显高于癌旁组织, 提示P125的高表达可能与肿瘤的发生、发展有重要的关系.
胃癌细胞内P21对POLD1基因的表达调控关系尚无报道. 而且调控的具体机制仍不清楚, 本文已筛选出一些相关因子, 为后续的研究奠定了基础.
P21对POLD1基因的表达调控与细胞周期、DNA复制关系密切, 可能为抑制癌细胞的恶性增殖提供一种新的思路.
本文创新性较好, 研究方法先进, 数据可靠, 具有较好的科学意义.
编辑: 李薇 电编:何基才
| 1. | DePamphilis ML. DNA Replication and Human Disease. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY. 2006;. |
| 3. | Chang LS, Zhao L, Zhu L, Chen ML, Lee MY. Structure of the gene for the catalytic subunit of human DNA polymerase delta (POLD1). Genomics. 1995;28:411-419. [PubMed] [DOI] |
| 6. | Balakrishnan L, Gloor JW, Bambara RA. Reconstitution of eukaryotic lagging strand DNA replication. Methods. 2010;51:347-357. [PubMed] [DOI] |
| 7. | Hindges R, Hübscher U. DNA polymerase delta, an essential enzyme for DNA transactions. Biol Chem. 1997;378:345-362. [PubMed] |
| 8. | Sweasy JB, Lauper JM, Eckert KA. DNA polymerases and human diseases. Radiat Res. 2006;166:693-714. [PubMed] [DOI] |
| 9. | Schmitt MW, Venkatesan RN, Pillaire MJ, Hoffmann JS, Sidorova JM, Loeb LA. Active site mutations in mammalian DNA polymerase delta alter accuracy and replication fork progression. J Biol Chem. 2010;285:32264-32272. [PubMed] [DOI] |
| 10. | Liu L, Mo J, Rodriguez-Belmonte EM, Lee MY. Identification of a fourth subunit of mammalian DNA polymerase delta. J Biol Chem. 2000;275:18739-18744. [PubMed] [DOI] |
| 11. | Yang CL, Chang LS, Zhang P, Hao H, Zhu L, Toomey NL, Lee MY. Molecular cloning of the cDNA for the catalytic subunit of human DNA polymerase delta. Nucleic Acids Res. 1992;20:735-745. [PubMed] [DOI] |
| 12. | Sanefuji K, Taketomi A, Iguchi T, Sugimachi K, Ikegami T, Yamashita Y, Gion T, Soejima Y, Shirabe K, Maehara Y. Significance of DNA polymerase delta catalytic subunit p125 induced by mutant p53 in the invasive potential of human hepatocellular carcinoma. Oncology. 2010;79:229-237. [PubMed] [DOI] |
| 14. | Jerry DJ, Tao L, Yan H. Regulation of cancer stem cells by p53. Breast Cancer Res. 2008;10:304. [PubMed] [DOI] |
| 15. | Li B, Lee MY. Transcriptional regulation of the human DNA polymerase delta catalytic subunit gene POLD1 by p53 tumor suppressor and Sp1. J Biol Chem. 2001;276:29729-29739. [PubMed] [DOI] |
| 16. | Gartel AL. p21(WAF1/CIP1) and cancer: a shifting paradigm? Biofactors. 2009;35:161-164. [PubMed] [DOI] |
| 17. | Waga S, Hannon GJ, Beach D, Stillman B. The p21 inhibitor of cyclin-dependent kinases controls DNA replication by interaction with PCNA. Nature. 1994;369:574-578. [PubMed] [DOI] |
| 18. | 石 磊, 徐 恒, 朱 晓宇, 孙 建华, 宋 楠萌, 李 莉, 桑 建利. p21对DNA聚合酶δ表达的抑制及其对MCF7细胞增殖和恶性表型的影响. 自然科学进展. 2006;16:672-678. |
| 19. | Abbas T, Dutta A. p21 in cancer: intricate networks and multiple activities. Nat Rev Cancer. 2009;9:400-414. [PubMed] [DOI] |
| 21. | Xia M, Knezevic D, Vassilev LT. p21 does not protect cancer cells from apoptosis induced by nongenotoxic p53 activation. Oncogene. 2011;30:346-355. [PubMed] [DOI] |
| 24. | Plasilova M, Schonmeyr B, Fernandez J, Clavin N, Soares M, Mehrara BJ. Accelerating stem cell proliferation by down-regulation of cell cycle regulator p21. Plast Reconstr Surg. 2009;123:149S-157S. [PubMed] [DOI] |
| 25. | Zhang H, Xiong Y, Beach D. Proliferating cell nuclear antigen and p21 are components of multiple cell cycle kinase complexes. Mol Biol Cell. 1993;4:897-906. [PubMed] |
| 26. | Fotedar R, Bendjennat M, Fotedar A. Functional analysis of CDK inhibitor p21WAF1. Methods Mol Biol. 2004;281:55-71. [PubMed] |
| 27. | Merrick KA, Wohlbold L, Zhang C, Allen JJ, Horiuchi D, Huskey NE, Goga A, Shokat KM, Fisher RP. Switching cdk2 on or off with small molecules to reveal requirements in human cell proliferation. Mol Cell. 2011;42:624-636. [PubMed] [DOI] |
| 28. | Satyanarayana A, Hilton MB, Kaldis P. p21 Inhibits Cdk1 in the absence of Cdk2 to maintain the G1/S phase DNA damage checkpoint. Mol Biol Cell. 2008;19:65-77. [PubMed] [DOI] |
| 29. | Krucher NA, Zygmunt A, Mazloum N, Tamrakar S, Ludlow JW, Lee MY. Interaction of the retinoblastoma protein (pRb) with the catalytic subunit of DNA polymerase delta (p125). Oncogene. 2000;19:5464-5470. [PubMed] [DOI] |
| 30. | Jung P, Menssen A, Mayr D, Hermeking H. AP4 encodes a c-MYC-inducible repressor of p21. Proc Natl Acad Sci U S A. 2008;105:15046-15051. [PubMed] [DOI] |
| 31. | Hwang-Verslues WW, Sladek FM. Nuclear receptor hepatocyte nuclear factor 4alpha1 competes with oncoprotein c-Myc for control of the p21/WAF1 promoter. Mol Endocrinol. 2008;22:78-90. [PubMed] [DOI] |
| 32. | Wang Z, Liu M, Zhu H, Zhang W, He S, Hu C, Quan L, Bai J, Xu N. Suppression of p21 by c-Myc through members of miR-17 family at the post-transcriptional level. Int J Oncol. 2010;37:1315-1321. [PubMed] |