修回日期: 2011-06-05
接受日期: 2011-06-15
在线出版日期: 2011-06-28
目的: 探讨检测人粪便中抑瘤素M型受体(OSMR)基因和组织因子途径抑制子2(TFPI2)基因甲基化对于结直肠癌及腺瘤诊断的可行性及临床意义.
方法: 从60例结直肠癌患者和17例腺瘤患者及30名正常对照者的粪便中分别提取DNA, 应用甲基化特异性PCR方法检测人粪便中OSMR和TFPI2基因的甲基化状态.
结果: 结直肠癌患者粪便中OSMR及TFPI2基因甲基化检出率分别高于腺瘤患者和正常对照者[OSMR: 35%(21/60) vs 12%(2/17), 7%(2/30); TFPI2: 70%(42/60) vs 18%(3/17), 3%(1/30); 均P<0.01]. 二者联合检测甲基化检出率为81.7%(49/60), 特异性90%.
结论: 检测粪便中OSMR和TFPI2基因甲基化在结直肠癌诊断和筛查中有潜在的应用价值.
引文著录: 许志伟, 李建生, 张金平. 人粪便中OSMR和TFPI2基因甲基化在结直肠癌诊断中的意义. 世界华人消化杂志 2011; 19(18): 1950-1953
Revised: June 5, 2011
Accepted: June 15, 2011
Published online: June 28, 2011
AIM: To study the feasibility and clinical significance of detection of oncostatin M receptor (OMSR) and tissue factor pathway inhibitor 2 (TFPI2) gene methylation in stool DNA in patients with colorectal cancer.
METHODS: Stool samples were collected from 60 patients with colorectal cancer, 17 patients with colorectal polyps, and 30 normal controls. The methylation of OMSR and TFPI2 in stool DNA was detected by methylation-specific PCR (MSP).
RESULTS: The detection rates of OSMR and TFPI2 methylation in stool DNA were significantly higher in patients with colorectal cancer than in those with colorectal polyps and normal controls [OSMR: 35% (21/60) vs 12% (2/17), 7% (2/30); TFPI2: 70% (42/60) vs 18% (3/17), 3% (1/30); all P < 0.01]. The sensitivity and specificity of combined detection of OSMR and TFPI2 methylation in stool DNA in the diagnosis of colorectal cancer were 81.7% and 90%, respectively.
CONCLUSION: Detection of OSMR and TFPI2 methylation in stool DNA is a promising approach to the diagnosis of colorectal cancer.
- Citation: Xu ZW, Li JS, Zhang JP. Detection of OSMR and TFPI2 gene methylation in stool DNA for diagnosis of colorectal cancer. Shijie Huaren Xiaohua Zazhi 2011; 19(18): 1950-1953
- URL: https://www.wjgnet.com/1009-3079/full/v19/i18/1950.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i18.1950
结直肠癌是常见的消化系恶性肿瘤. 在美国, 结直肠癌发病率在癌症发病率中位居第3, 并在癌症死亡率中排第2位[1], 我国结直肠癌的发病率呈逐年上升的趋势. 在癌组织未转移时, 5年生存率为90%, 局部转移时生存率为68%, 如发生远处转移, 生存率仅为10%[2], 事实上, 由于早期检测的发展, 发达国家在过去20年中结直肠癌5年生存率有所提高[1]. 粪便DNA检测, 由于其具有易取样, 灵敏度及特异性好, 无痛等特点, 美国癌症协会、美国胃肠病学院等在其结直肠癌筛查指南中均明确地将粪便DNA检测作为推荐的筛查方法[1,3]. 寻找提高结直肠癌诊断灵敏度和特异性的简便方法并验证其可行性是我们的目标. 本文采用甲基化特异性PCR技术联合检测结直肠癌患者OSMR基因和TFPI2基因甲基化, 探讨其在结直肠癌检测中的意义[4-6].
选取2009-05/2010-09收治的结直肠癌患者60例, 17例腺瘤患者为研究对象, 均经内镜病理证实. 病例入选标准[7]: (1)不伴其他部位肿瘤; (2)未经任何治疗; (3)收集粪便前5 d内未进行任何侵入性操作, 包括结肠镜、灌肠等. 另选择30例年龄匹配的结肠镜检查阴性者为正常对照组. 粪便标本于术前或内镜检查前收集, 收集后立即送至实验室, 分装后置-70 ℃冰箱保存.
1.2.1 粪便DNA的提取: 称取约0.2 g粪便, 按QIAamp DNA Stool Mini Kit(Qiagen)说明书提取总DNA. 提取出来的DNA最终保存在200 μL的AE缓冲液中, 并置于-20 ℃冰箱中.
1.2.2 DNA的亚硫酸氢盐修饰和纯化: 使用EpiTect Bisulfite Kit(Qiagen, 德国)试剂盒进行DNA的亚硫酸氢盐修饰和纯化, 产物置-20 ℃冰箱保存备用.
1.2.3 甲基化特异性PCR方法扩增: TFPI2引物, MF: 5'-GTTCGTTGGGTAAGGCGTTC-3', MR: 5'-CCCGAACTTTACGAACGAACG-3', UF: 5'-CCCACATAAAACAAACACCCAAACCA-3', UR: 5'-TGGTTTGTTGGGTAAGGTGTTTG-3', OSMR引物, MF: 5'-TAGGAGTAGCGTTGCGCGC-3', MR: 5'-CCCGAACTTTACGAACGAACG-3', UF: 5'-GGGTAGGAGTAGTGTTGTGTGT-3', UR: 5'-CCTCACAACCCAAACTTTACAAACAAACA-3', PCR反应体系为PCR反应体20 μL, 包括: 10×coralload PCR Buffer 2 μL, 5×Q-Solution 4 μL, dNTP mix 0.4 μL, 上下游引物各0.6 μL, Taq DNA Polymerase 0.1 μL, 双蒸水9.1 μL, cDNA 4 μL. 扩增程序: 95 ℃预变性10 min进入循环, 循环温度及时间为95 ℃变性45 s, OSMR甲基化引物与非甲基化引物退火温度分别为68 ℃ 45 s, 69 ℃ 45 s, TFPI2甲基化引物与非甲基化引物退火温度均为50 ℃ 45 s, 共30个循环, 终末72 ℃延伸10 min.
统计学处理 应用SPSS13.0统计软件. 组间比较采用χ2检验.
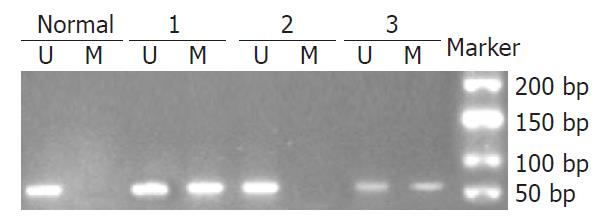
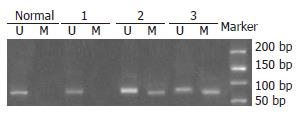
OSMR基因甲基化结直肠癌癌组织与腺瘤组和正常对照组比较, 差异有统计学意义(P = 0.065, P = 0.004, 图1, 2, 表1); 腺瘤组与正常对照组比较, 差异无统计学意义(P = 0.613). TFPI2甲基化癌组织与腺瘤组和正常对照组比较, 差异有统计学意义(P = 0.00, P = 0.00); 腺瘤组与正常对照组比较, 差异无统计学意义(P = 0.128).
OSMR甲基化与组织分化程度有关(P = 0.016). TFPI2甲基化与组织分化程度及Duke分期有关(P = 0.035, P = 0.042, 表2).
| 临床病理特征 | n | OMSR甲基化n(%) | χ2值 | P值 | TFPI2甲基化n(%) | χ2值 | P值 |
| 性别 | |||||||
| 男 | 37 | 12(32) | 0.280 | 0.597 | 24(64) | 1.212 | 0.271 |
| 女 | 23 | 9(39) | 18(78) | ||||
| 分化状态 | |||||||
| 高、中分化 | 38 | 9(24) | 5.833 | 0.016 | 23(61) | 4.429 | 0.035 |
| 低分化 | 22 | 12(55) | 19(86) | ||||
| Dukes分期 | |||||||
| AB期 | 28 | 8(29) | 1.146 | 0.284 | 16(57) | 4.133 | 0.042 |
| CD期 | 32 | 13(41) | 26(81) | ||||
| 病变部位 | |||||||
| 右半结肠 | 19 | 5(26) | 1.940 | 0.164 | 11(58) | 1.94 | 0.164 |
| 左半结肠 | 41 | 16(39) | 31(76) |
TFPI2基因甲基化阳性的42例结直肠癌组织中, OSMR基因甲基化表达14例; TFPI2甲基化阴性的18例中, OSMR基因甲基化阳性7例. 二者联合检测甲基化检出率为81.7% (49/60), 特异性90%.
肿瘤是由多种因素引起, 其中甲基化状态的改变是其中之一, 这种变化一方面是基因组整体甲基化水平的降低, 另一方面为CpG岛局部甲基化水平的异常升高, 以上原因可能造成基因组的不稳定和抑癌基因的不表达[8]. 抑癌基因启动子区CpG岛甲基化, 从而造成抑癌基因关闭可能与肿瘤的发生有关, 因此肿瘤甲基化研究目前主要集中于抑癌基因[9], 在结直肠癌发展中, 很早就发生基因启动子相关的CpG岛甲基化[10], 暗示其可能成为结直肠癌检测和监视的有用的分子标志物.
TFPI2是广谱丝氨酸蛋白酶抑制物, 抑制肿瘤细胞细胞外基质的降解, 在体外抑制集落形成和增殖. 一般认为, TFPI2功能丧失会使细胞容易进入侵袭程序, 其构成了在后来癌症发展中的一个重要角色[11]. 在Glöckner等[6]的研究中, 结直肠组织中腺瘤甲基化达95%以上, 癌组织为100%. 我们对结直肠癌及腺瘤患者粪便进行检测, 结直肠癌患者粪便甲基化敏感性为70%(42/60), 特异性97%, 腺瘤敏感性18%(3/17). TFPI2基因甲基化与Dukes分期、肿瘤分化程度有关, CD期的检出率高于AB期(P<0.05), 低分化组肿瘤的检出率高于高、中分化组. 在17例腺瘤患者中, 检测到了3例存在TFPI2基因甲基化, 与正常对照组比较, 检出率并无明显区别(P>0.05), 这与上述报道中在组织中95%的检出率存在巨大的差异, 这可能与腺瘤组织脱落到粪便中的细胞较少有关. 有研究表明, TFPI2甲基化同样存在于胰腺癌及胃癌等消化系及非消化系组织, 其是否能导致粪便检测阳性还有待进一步研究.
OSM是IL-6家族成员, 主要由活化的单核细胞和淋巴细胞产生, 这个多功能的细胞因子能够在多种肿瘤细胞中, 如乳腺癌、卵巢癌、肺癌、黑色素瘤和骨肉瘤等, 引起生长抑制、分化和凋亡[12]. OSM通过gp130和OSMR异二聚合成物调节生物学效应[13], 目前有研究表明, 在转移的黑色素瘤细胞中, OSM失去对细胞生长的控制是由于异常的组蛋白修饰导致OSMR基因的表观遗传改变[14], 癌组织中OSMR的水平是降低的. Deng等[4]的研究中表明, 甲基化存在于88/98(90%)的结直肠癌组织中, 34/38(89%)的腺瘤组织中, 13/40(33%)的胃癌组织中和1/5(20%)的胰腺癌组织中, 而在正常结直肠黏膜, 非癌组织或非消化系统肿瘤检测不到或非常少见. 我们检测到了21/60(35%)结直肠癌患者粪便基因甲基化, 同时我们检测到2/17(12%)的腺瘤患者的粪便基因甲基化, 腺瘤检出率明显低于在组织中的检出率, 这也可能是由于粪便中腺瘤细胞脱落较少引起. 本研究显示OSMR基因甲基化在低分化组阳性率高于高、中分化组(P<0.05), 而与性别、Duke分期及部位无关.
以往的研究表明[15], 单一基因的检测敏感性较低, 多基因联合检测能有效提高检测的阳性率, 在以往的研究中, TFIP2基因甲基化检测结直肠癌具有较高的敏感性, 而OSMR基因甲基化对消化系肿瘤的检测具有较高的特异性, 我们尝试将二者结合, TFPI2检测阴性18例患者中, OSMR基因甲基化检测到了7例, 二者联合检测检出率为81.7%(49/60), 特异性90%. 在研究中, 我们也体会到粪便基因检测的特殊性, 并且检测过程较为繁琐和耗时, 如何优化粪便处理、简化检测程序有重要意义. 在未来, 对指标进行进一步筛选, 降低检测成本, 并寻找敏感性更高的指标, 或在已有的指标中进一步优化和组合, 从而进一步提高检测阳性率和特异性对于基因检测在结直肠癌筛查中的应用也十分重要.
我国结直肠癌的发病率和死亡率不断上升, 结直肠癌的早期诊断对于其治疗十分重要, 传统诊断手段均存在各种不足, 而粪便DNA检测有许多特殊优点, 对其进行研究具有十分重要的意义.
王振宁, 教授, 中国医科大学附属第一医院肿瘤外科
有国外相关研究表明, OSMR和TFPI2甲基化广泛存在于癌组织和腺瘤之中, 对其进行检测有可能获得较高的敏感性.
OSMR甲基化研究在国内尚未见到相关报道, 国外文献也很少. 本研究首次将粪便OSMR和TFPI2基因进行联合检测甲基化, 发现其对于结直肠癌的诊断具有较高的敏感性和特异性.
将粪便DNA甲基化检测用于结直肠癌的诊断, 可能对于降低结直肠癌的死亡率有积极作用.
本文可读性较好, 有一定的临床价值.
编辑: 曹丽鸥 电编:何基才
| 1. | Levin B, Lieberman DA, McFarland B, Smith RA, Brooks D, Andrews KS, Dash C, Giardiello FM, Glick S, Levin TR. Screening and surveillance for the early detection of colorectal cancer and adenomatous polyps, 2008: a joint guideline from the American Cancer Society, the US Multi-Society Task Force on Colorectal Cancer, and the American College of Radiology. CA Cancer J Clin. 2008;58:130-160. [PubMed] [DOI] |
| 2. | Salazar R, Roepman P, Capella G, Moreno V, Simon I, Dreezen C, Lopez-Doriga A, Santos C, Marijnen C, Westerga J. Gene expression signature to improve prognosis prediction of stage II and III colorectal cancer. J Clin Oncol. 2011;29:17-24. [PubMed] [DOI] |
| 3. | Dominic OG, McGarrity T, Dignan M, Lengerich EJ. American College of Gastroenterology Guidelines for Colorectal Cancer Screening 2008. Am J Gastroenterol. 2009;104:2626-2627; author reply 2628-2629. [PubMed] [DOI] |
| 4. | Deng G, Kakar S, Okudiara K, Choi E, Sleisenger MH, Kim YS. Unique methylation pattern of oncostatin m receptor gene in cancers of colorectum and other digestive organs. Clin Cancer Res. 2009;15:1519-1526. [PubMed] [DOI] |
| 5. | Kim MS, Louwagie J, Carvalho B, Terhaar Sive Droste JS, Park HL, Chae YK, Yamashita K, Liu J, Ostrow KL, Ling S. Promoter DNA methylation of oncostatin m receptor-beta as a novel diagnostic and therapeutic marker in colon cancer. PLoS One. 2009;4:e6555. [PubMed] [DOI] |
| 6. | Glöckner SC, Dhir M, Yi JM, McGarvey KE, Van Neste L, Louwagie J, Chan TA, Kleeberger W, de Bruïne AP, Smits KM. Methylation of TFPI2 in stool DNA: a potential novel biomarker for the detection of colorectal cancer. Cancer Res. 2009;69:4691-4699. [PubMed] [DOI] |
| 7. | Zou H, Harrington JJ, Klatt KK, Ahlquist DA. A sensitive method to quantify human long DNA in stool: relevance to colorectal cancer screening. Cancer Epidemiol Biomarkers Prev. 2006;15:1115-1119. [PubMed] [DOI] |
| 8. | De Smet C, Loriot A. DNA hypomethylation in cancer: Epigenetic scars of a neoplastic journey. Epigenetics. 2010; 5 [Epub ahead of print]. [PubMed] |
| 9. | Wu Ct JR. Genes, genetics, and epigenetics: a correspondence. Science. 2001;293:1103-1105. [PubMed] [DOI] |
| 10. | Shames DS, Minna JD, Gazdar AF. DNA methylation in health, disease, and cancer. Curr Mol Med. 2007;7:85-102. [PubMed] [DOI] |
| 11. | Takada H, Wakabayashi N, Dohi O, Yasui K, Sakakura C, Mitsufuji S, Taniwaki M, Yoshikawa T. Tissue factor pathway inhibitor 2 (TFPI2) is frequently silenced by aberrant promoter hypermethylation in gastric cancer. Cancer Genet Cytogenet. 2010;197:16-24. [PubMed] [DOI] |
| 12. | Chipoy C, Brounais B, Trichet V, Battaglia S, Berreur M, Oliver L, Juin P, Rédini F, Heymann D, Blanchard F. Sensitization of osteosarcoma cells to apoptosis by oncostatin M depends on STAT5 and p53. Oncogene. 2007;26:6653-6664. [PubMed] [DOI] |
| 13. | Underhill-Day N, Heath JK. Oncostatin M (OSM) cytostasis of breast tumor cells: characterization of an OSM receptor beta-specific kernel. Cancer Res. 2006;66:10891-10901. [PubMed] [DOI] |
| 14. | Lacreusette A, Nguyen JM, Pandolfino MC, Khammari A, Dreno B, Jacques Y, Godard A, Blanchard F. Loss of oncostatin M receptor beta in metastatic melanoma cells. Oncogene. 2007;26:881-892. [PubMed] [DOI] |
| 15. | Richter S. Fecal DNA screening in colorectal cancer. Can J Gastroenterol. 2008;22:631-633. [PubMed] |