修回日期: 2011-05-30
接受日期: 2011-06-08
在线出版日期: 2011-06-28
目的: 探讨人肝细胞癌组织中PTEN、Akt和pAkt蛋白的表达及其预后价值.
方法: 应用免疫组织化学方法检测78例肝细胞癌组织及21例正常肝组织中PTEN、Akt和pAkt蛋白的表达, 分析其与肝细胞癌临床病理特征及预后的关系.
结果: 在肝细胞癌组织中, PTEN蛋白的表达率显著低于正常肝组织(42.3% vs 90.5%, P<0.05), Akt及pAkt蛋白的表达率显著高于正常肝组织(66.7% vs 33.3%; 43.6% vs 9.5%, 均P<0.05). PTEN蛋白的表达水平与肿瘤直径、门静脉癌栓、侵及周围脏器或淋巴结转移及TNM分期有关(均P<0.05); Akt及pAkt蛋白的表达水平与肿瘤直径、侵及周围脏器或淋巴结转移及TNM分期有关(均P<0.05). PTEN与Akt蛋白表达呈负相关(r = -0.385, P = 0.000), 与pAkt蛋白表达呈负相关(r = -0.334, P = 0.003). PTEN蛋白高表达患者术后生存率明显高于低表达患者(P = 0.000), Akt、pAkt蛋白高表达患者术后生存率明显低于低表达患者(P = 0.000). COX模型多因素分析结果显示, TNM分期及pAkt蛋白的表达是影响肝细胞癌预后的独立因素.
结论: 肝细胞癌组织中PTEN、Akt及pAkt的表达失调与肝细胞癌的恶性生物学行为密切相关, pAkt可以作为评价患者预后的指标.
引文著录: 张萌, 彭利, 乔治斌, 何宏涛, 周烨, 徐卓. PTEN、Akt和pAkt蛋白在肝细胞癌组织中的表达及其与预后的关系. 世界华人消化杂志 2011; 19(18): 1904-1910
Revised: May 30, 2011
Accepted: June 8, 2011
Published online: June 28, 2011
AIM: To explore the expression of phosphatase and tensin homology deleted on chromosome ten (PTEN), Akt and pAkt proteins in hepatocellular carcinoma (HCC) and to elucidate their clinical significance.
METHODS: Immunohistochemical analysis was performed to detect the expression of PTEN, Akt and pAkt proteins in 78 specimens of hepatocellular carcinoma and 21 specimens of normal liver tissues. The relationship of their expression with clinicopathological and prognostic parameters was analyzed.
RESULTS: The rate of PTEN overexpression was significantly lower in HCC than in normal liver tissue (42.3% vs 90.5%, P < 0.05), while the rates of Akt and pAkt overexpression were significantly higher in HCC than in normal liver tissue (66.7% vs 33.3%; 43.6% vs 9.5%, both P < 0.05). PTEN expression was correlated with tumor size, cancer embolus of the portal vein, tumor invasion, lymph node metastasis and TNM stage. Akt and pAkt expression was correlated with tumor size, invasion, lymph node metastasis and TNM stage. PTEN expression was negatively correlated with Akt (r = -0.385, P = 0.000) and pAkt (r =- 0.334, P = 0.003) expression in HCC. Patients with low PTEN expression or high Akt and pAkt expression had a significantly worse survival time than those with high PTEN expression or low Akt and pAkt expression (P = 0.000). A multivariate analysis based on the COX regression model demonstrated that TNM stage and pAkt expression were independent prognostic factors for HCC.
CONCLUSION: The expression of PTEN, Akt and pAkt proteins is closely related to the malignant biological behavior of HCC. pAkt can be used as a key factor for predicting prognosis in HCC patients.
- Citation: Zhang M, Peng L, Qiao ZB, He HT, Zhou Y, Xu Z. Clinical significance of expression of PTEN, Akt and pAkt in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2011; 19(18): 1904-1910
- URL: https://www.wjgnet.com/1009-3079/full/v19/i18/1904.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i18.1904
肝细胞癌为我国常见恶性肿瘤之一, 为我国第2位恶性肿瘤致死病因[1]. 第10号染色体缺失的磷酸酶张力蛋白同源物基因(phosphatase and tensin homology deleted on chromosome ten, PTEN)是迄今为止发现的第1个具有双重磷酸酶活性的抑癌基因[2], 位于人类第10号染色体上[3], 在诱导细胞周期阻滞和细胞凋亡以及细胞黏附, 迁移、分化等诸方面均发挥至关重要的作用[4]. 磷脂酰肌醇-3-激酶/蛋白激酶B(phosphatidylinositol-3-kinase/protein kinase B, PI3K/Akt)信号转导通路是重要的"凋亡抑制"通路[5], Akt的过度活化可以通过调节多种下游底物, 促进肿瘤细胞增殖、抑制凋亡并参与放、化疗抵抗[6]. 研究发现[7], PTEN可抑制PI3K/Akt通路, 降低磷酸化Akt(pAkt)水平, 从而发挥其抑癌作用. 本实验采用免疫组织化学方法联合检测肝细胞癌组织及正常肝组织中PTEN、Akt及pAkt蛋白的表达, 分析其与肝细胞癌临床病理特征及预后的关系, 初步探讨他们在肝细胞癌中表达的意义及预后价值.
收集河北医科大学第四医院肝胆外科2004-10/2007-12手术切除并经病理证实的随访资料完整的肝细胞癌标本78例. 所有患者术前均未经过任何抗肿瘤治疗. 男71例, 女7例, 年龄30-73(中位年龄56)岁. 标本切除离体立即固定于40 g/L中性甲醛溶液, 石蜡包埋. 78例肝细胞癌组织中, 36例直径≤5 cm, 42例直径>5 cm; 侵及邻近脏器或淋巴结转移共12例, 未侵及邻近脏器或无淋巴结转移66例; 有门静脉瘤栓9例, 无门静脉瘤栓69例; 66例为单发肿瘤, 12例为肝内多发肿瘤. 临床分期根据TNM分期, Ⅰ期2例, Ⅱ期31例, Ⅲ期44例、Ⅳ期1例. 另取肝血管瘤患者之肝组织21例作为对照. 由两位有经验病理医师进行病理组织学诊断. PTEN兔抗人单克隆抗体、pAkt(pS473)兔抗人单克隆抗体均购自美国Epitomics公司, Akt兔抗人多克隆抗体购自美国Cell Signaling Technology公司. 即用型非生物素免疫组织化学EliVisionTM super检测试剂盒(KIT-9922)、即用型快捷免疫组织化学MaxVisionTM 2试剂盒(KIT-5920)均购自福州迈新生物技术开发有限公司.
1.2.1 免疫组织化学染色检测PTEN、Akt和pAkt的表达: 采用免疫组织化学一步法(EliVisionTM super检测试剂盒). 切片均用2% APES处理, 4 µm连续切片. 使用橘橼酸盐缓冲液抗原热修复. PTEN和pAkt抗体以1:100稀释; Akt抗体以1:75稀释. 以PBS代替一抗作为阴性对照; 以已知阳性的甲状腺癌切片作为PTEN的阳性对照; 已知阳性的乳腺癌切片作为Akt的阳性对照; 已知阳性的宫颈癌切片作为pAkt的阳性对照.
1.2.2 结果判定: 根据阳性细胞所占比例并参照相关文献进行结果判定. 每个切片观察10个高倍镜视野, 每高倍镜视野计数100个肿瘤细胞, 综合判断阳性细胞染色数和染色强度. PTEN蛋白参照文献[7]判定标准, 根据阳性细胞所占比例分为: 阳性细胞<30%为低表达; 阳性细胞≥30%为高表达. Akt蛋白参照文献[8]改良后判定标准, 根据阳性细胞所占比例分为: 阳性细胞<10%为低表达; 阳性细胞≥10%为高表达. pAkt蛋白参照文献[9]判定标准, 根据阳性细胞所占比例分为: 阳性细胞<20%为低表达; 阳性细胞≥20%为高表达.
1.2.3 随访: 纳入本研究的所有病例均有完整随访资料, 研究自手术之日起, 至本研究结束(2010-01-01)止, 随访时间单位为月, 研究终点(阳性结局)定义为患者因肝细胞癌或相应并发症死亡, 研究结束时仍未出现阳性结局者定为删失. 本研究随访时间1.0-61.3(中位随访时间26.1) mo.
统计学处理 计数资料阳性率之间的比较采用χ2检验及Fisher确切概率计算法; 相关分析采用Spearman相关分析, 生存分析采用Kaplan-Meier生存曲线, 并经Log-rank检验. 多因素分析采用COX模型. 所有统计学结果均采用SPSS17.0软件进行处理. P<0.05认为差异有统计学意义.
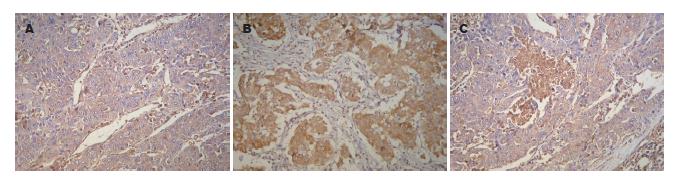
PTEN蛋白阳性表达部位在胞质, 呈棕黄色或棕褐色细颗粒; Akt、pAkt蛋白阳性染色均为棕黄色或棕褐色粗颗粒状, 定位于胞质, 阴性染色为均一淡黄色细颗粒状(图1). Akt、pAkt蛋白在肝细胞癌组织中的高表达率分别为66.7%和43.6%, 21例正常肝组织中的高表达率分别为33.3%和9.5%, 差异有统计学意义(P<0.05, 表1). PTEN在肝细胞癌组织中的高表达率为42.3%, 在正常肝组织中的高表达率为90.5%, 差异有统计学意义(P<0.05, 表1).
| 组织类型 | n | PTEN | Akt | pAkt | |||||||||
| 低 | 高 | χ2值 | P值 | 低 | 高 | χ2值 | P值 | 低 | 高 | χ2值 | P值 | ||
| 肝细胞癌 | 78 | 45(57.7) | 33(42.3) | 15.395 | 0 | 26(33.3) | 52(66.7) | 7.635 | 0.007 | 44(56.4) | 34(43.6) | 8.297 | 0.004 |
| 正常肝组织 | 21 | 2(9.5) | 19(90.5) | 14(66.7) | 7(33.3) | 19(90.5) | 2(9.5) | ||||||
在肝细胞癌组织中, PTEN与Akt蛋白的表达呈显著负相关(r = -0.385, P = 0.000), 与pAkt蛋白的表达呈显著负相关(r = -0.334, P = 0.003, 表2).
| Akt蛋白表达 | r值 | P值 | pAkt蛋白表达 | r值 | P值 | ||||
| 低 | 高 | 低 | 高 | ||||||
| PTEN蛋白表达 | 低 | 8 | 37 | -0.385 | 0.000 | 19 | 26 | -0.334 | 0.003 |
| 高 | 18 | 15 | 25 | 8 | |||||
PTEN蛋白的表达水平与肿瘤直径、有否门静脉癌栓、是否侵及周围脏器或淋巴结转移有关(P<0.05); PTEN蛋白的高表达率在TNM分期各组之间差异有统计学意义(P<0.01), 分期越晚表达率越低. PTEN蛋白表达在患者年龄、性别、肿瘤数目各组之间差异无统计学意义(P>0.05). Akt及pAkt蛋白的表达水平均与肿瘤直径、是否侵及周围脏器或淋巴结转移有关(P<0.05), Akt及pAkt蛋白的高表达率在TNM分期各组之间差异有统计学意义(P<0.01), 分期越晚表达率越高. Akt及pAkt蛋白表达在患者年龄、性别、肿瘤数目、有否门静脉癌栓各组之间差异无统计学意义(P>0.05, 表3).
| 临床病理特征 | n | PTEN | Akt | pAkt | |||||||||
| 低 | 高 | χ2值 | P值 | 低 | 高 | χ2值 | P值 | 低 | 高 | χ2值 | P值 | ||
| 年龄(岁) | |||||||||||||
| ≤50 | 19 | 11(57.9) | 8(42.1) | 0.000 | 1.000 | 8(42.1) | 11(57.9) | 0.870 | 0.407 | 11(57.9) | 8(42.1) | 0.023 | 1.000 |
| >50 | 59 | 34(57.6) | 25(42.4) | 18(30.5) | 41(69.5) | 33(55.9) | 26(44.1) | ||||||
| 性别 | |||||||||||||
| 男 | 71 | 41(57.7) | 30(42.3) | 0.000 | 1.000 | 25(35.2) | 46(64.8) | 0.490 | 0.484 | 41(57.7) | 30(42.3) | 0.129 | 0.720 |
| 女 | 7 | 4(57.1) | 3(42.9) | 1(14.3) | 6(85.7) | 3(42.9) | 4(57.1) | ||||||
| 肿瘤直径(cm) | |||||||||||||
| ≤5 | 36 | 11(30.6) | 25(69.4) | 20.171 | 0.000 | 20(55.6) | 16(44.4) | 14.857 | 0.000 | 30(83.3) | 6(16.7) | 19.709 | 0.000 |
| >5 | 42 | 34(81.0) | 8(19.0) | 6(14.3) | 36(85.7) | 14(33.3) | 28(66.7) | ||||||
| 肿瘤数目 | |||||||||||||
| 单发 | 66 | 40(60.6) | 26(39.4) | 1.492 | 0.341 | 22(33.3) | 44(66.7) | 0.000 | 1.000 | 38(57.6) | 28(42.4) | 0.237 | 0.754 |
| 多发 | 12 | 5(41.7) | 7(58.3) | 4(33.3) | 8(66.7) | 6(50.0) | 6(50.0) | ||||||
| 门脉癌栓 | |||||||||||||
| 有 | 9 | 9(100.0) | 0(0.0) | 5.630 | 0.018 | 1(11.1) | 8(88.9) | 1.272 | 0.259 | 2(22.2) | 7(77.8) | 3.392 | 0.066 |
| 无 | 69 | 36(52.2) | 33(47.8) | 25(36.2) | 44(63.8) | 42(60.9) | 27(39.1) | ||||||
| 有无转移 | |||||||||||||
| 有 | 12 | 12(100.0) | 0(0.0) | 10.400 | 0.001 | 0(0.0) | 12(100.0) | 5.429 | 0.020 | 3(25.0) | 9(75.0) | 5.690 | 0.026 |
| 无 | 66 | 33(50.0) | 33(50.0) | 26(39.4) | 40(60.6) | 41(62.1) | 25(37.9) | ||||||
| TNM分期 | |||||||||||||
| Ⅰ | 2 | 0(0.0) | 2(100.0) | 26.901 | 0.000 | 2(100.0) | 0(0.0) | 20.213 | 0.000 | 2(100.0) | 0(0.0) | 24.152 | 0.000 |
| Ⅱ | 31 | 8(25.8) | 23(74.2) | 18(58.1) | 13(41.9) | 27(87.1) | 4(12.9) | ||||||
| Ⅲ | 44 | 36(81.8) | 8(18.2) | 6(13.6) | 38(86.4) | 15(34.1) | 29(65.9) | ||||||
| Ⅳ | 1 | 1(100.0) | 0(0.0) | 0(0.0) | 1(100.0) | 0(0.0) | 1(100.0) | ||||||
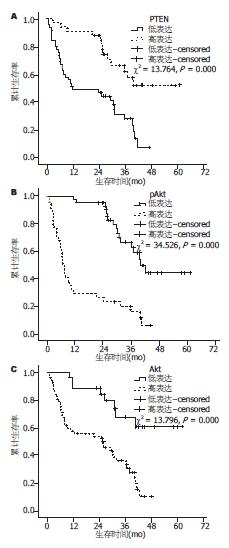
PTEN蛋白高表达组患者术后生存率明显高于低表达组, 差异有统计学意义(P = 0.000). Akt、pAkt蛋白高表达组患者术后生存率明显低于低表达组, 差异均有统计学意义(P = 0.000, 表4). 将肝细胞癌患者的肿瘤直径、肿瘤数目、有否门静脉癌栓、是否侵及周围脏器或淋巴结转移、TNM分期及PTEN、Akt及pAkt蛋白的表达水平等因素纳入Cox模型, 结果显示TNM分期和pAkt蛋白的表达是影响肝细胞癌预后的独立因素(表5, 图2).
| n | 生存率(%) | 平均生存期(mo) | 95%CI | P值 | |||
| 1年 | 3年 | 5年 | |||||
| PTEN蛋白表达 | |||||||
| 低 | 45 | 51.1 | 31.0 | 6.9 | 21.17±2.51 | 16.25-26.08 | 0.000 |
| 高 | 33 | 90.9 | 62.0 | 52.0 | 44.28±3.62 | 37.18-51.38 | |
| Akt蛋白表达 | |||||||
| 低 | 26 | 88.5 | 67.7 | 61.0 | 47.20±4.06 | 39.25-55.15 | 0.000 |
| 高 | 52 | 57.7 | 33.6 | 10.6 | 22.74±2.35 | 18.13-27.35 | |
| pAkt蛋白表达 | |||||||
| 低 | 44 | 97.7 | 66.6 | 44.4 | 44.54±2.91 | 38.85-50.23 | 0.000 |
| 高 | 34 | 29.4 | 16.1 | 6.1 | 14.43±2.53 | 9.47-19.39 | |
| 因素 | β值 | 标准误 | χ2值 | 相对危险度 | 95%CI | P值 |
| TNM 分期 | 1.181 | 0.342 | 11.919 | 3.257 | 1.666-6.366 | 0.001 |
| pAkt蛋白表达 | 1.260 | 0.327 | 14.891 | 3.526 | 1.859-6.687 | 0.000 |
PTEN的发现是继p53基因后肿瘤抑制基因领域的又一重要里程碑, PTEN蛋白具有脂质磷酸酶与蛋白磷酸酶两种活性, 脂质磷酸酶活性是PTEN抑制肿瘤的主要功能基础[10]. 人体多种正常组织中均存在PTEN蛋白的表达, 但在相应的肿瘤组织中表达降低或缺失. 本实验结果显示: PTEN蛋白在肝细胞癌组织中的表达水平显著降低, 同Fabregat等[11]研究结果相一致. 结合患者的临床病理指标研究发现, PTEN蛋白在肿瘤直径>5 cm组、门静脉癌栓组、侵及周围脏器或淋巴结转移组的表达水平显著降低, 且TNM分期越晚PTEN蛋白表达水平越低, 说明PTEN蛋白的低水平表达与肝细胞癌的侵袭、转移及临床分期有密切联系, 进一步研究发现, PTEN蛋白低表达组患者预后较差. Tachibana等[12]通过对食管癌的检测发现, 晚期食管癌患者肿瘤组织中PTEN蛋白表达下调并且与病理分期和预后明显相关, 国内学者对消化系统肿瘤的研究也得出相似观点[13-15]. 目前研究发现, PTEN蛋白表达降低的主要原因并非PTEN基因突变所致, 某些基因外机制如启动子甲基化可使PTEN在未检测到突变的情况下表达缺失[16,17], 翻译后的异常调控也可引发PTEN蛋白的降解[18], PTEN蛋白在细胞内的定位也会影响其活性[19].
PTEN通过多种途径发挥肿瘤抑制作用[20,21], 其中最重要的就是抑制PI3K/Akt通路[22]. Akt是该通路的中心环节, 可被PI3K激活成为具有磷酸激酶活性的pAkt[23]. pAkt通过磷酸化作用激活或抑制其多种下游靶蛋白, 如: Bad、caspase9、NF-κB、mTOR、P21等, 是重要的抗凋亡调节因子[24,25]. 多种肿瘤组织如非小细胞肺癌、胃癌、甲状腺癌、卵巢癌、乳腺癌都有Akt的过度表达和活化[26-29]. 本实验发现Akt和pAkt蛋白在肝细胞癌组织中呈显著高表达, 二者在肿瘤直径>5 cm组和侵及周围脏器或淋巴结转移组表达水平均明显升高, 且TNM分期越晚表达率越高, Akt、pAkt蛋白高表达组患者术后生存率显著降低, 提示二者的高表达与肝细胞癌的侵袭转移及预后有关. Yamamoto等[30]对胰腺癌的研究也得出类似结果: 高表达pAkt蛋白的胰腺癌患者5年生存率明显降低, pAkt蛋白是胰腺癌独立的预后因子.
本研究进一步分析发现, PTEN与pAkt蛋白的表达呈负相关, 提示在肝细胞癌组织中, PTEN蛋白的表达下调或缺失有可能导致Akt的过度活化. 目前研究认为, PTEN抑制PI3K/Akt通路的相关分子机制主要是PTEN通过其脂质磷酸酶活性降解PI3K/Akt通路间的信使3, 4, 5三磷酸磷脂酰肌醇(phosphatidylinositol-3, 4, 5-trisphosphate, PIP3), 维持pAkt的低水平, 从而抑制PI3K/Akt通路及其下游效应分子的有效活化[31,32]. 本实验多因素分析显示pAkt蛋白的表达是影响肝细胞癌预后的独立因素, 而PTEN不能独立判断患者预后, 我们推测与非PI3K依赖的Akt磷酸化激活途径有关. Remy等[33]发现并命名了一种新的Akt结合蛋白Ft1, 可以直接和Akt结合并促进其磷酸化, Anai等[34]发现的一种特异性Akt结合蛋白在体内外均可增强和维持Akt的磷酸化.
总之, 肝细胞癌的发生发展是一个复杂的、多因素参与的过程, PTEN、Akt和pAkt在其中发挥重要作用, 有助于评价患者的预后, 以PTEN和PI3K/Akt信号通路作为靶点可望为肝细胞癌的分子靶向治疗提供新的思路.
肝细胞癌临床症状出现晚、发展迅速, 治疗效果差, 预后不佳, 是我国恶性肿瘤防治研究的重点. 深入研究肝细胞癌发生发展、侵袭转移的机制, 对有效的评估患者预后有重要的临床意义.
陈光, 教授, 吉林大学第一医院消化器官外科
PI3K/Akt通路在肿瘤细胞增殖、凋亡和放、化疗抵抗方面起重要作用, 是重要的"凋亡抑制"通路. 提高PTEN活性能够拮抗PI3K/Akt信号通路, 而PTEN基因的突变或表达缺失将导致Akt的过度活化, 有学者称此为PTEN-PI3K/Akt信号转导通路. 目前以这条信号通路为靶点的肿瘤治疗策略正在广泛的研究中.
Yamamoto等研究表明, 42.6%和45.9%的胰腺癌组织表达高强度的Akt、pAkt蛋白, 二者表达呈正相关; 二者的表达均与年龄、性别等临床病理特征无关; 高表达pAkt蛋白的胰腺癌患者5年生存率(14.1%)明显低于低表达pAkt的患者(57.0%), Cox模型分析显示pAkt蛋白的高表达是胰腺癌独立的预后因子.
本实验联合检测肝细胞癌组织及正常肝组织中PTEN、Akt及pAkt蛋白的表达, 紧密结合患者预后, 提出pAkt蛋白的表达和TNM分期是影响肝细胞癌预后的独立因素.
本文重点研究了PTEN、Akt及pAkt蛋白的表达与肝细胞癌临床病理特征及预后的关系, 其结果对评价患者的预后提供了参考, 也为肝细胞癌的分子靶向治疗提供了一定的实验基础.
本文有助于评价患者的预后, 指导临床诊治及评估, 具有较好的临床意义及实用价值.
编辑: 李薇 电编:何基才
| 2. | Keniry M, Parsons R. The role of PTEN signaling perturbations in cancer and in targeted therapy. Oncogene. 2008;27:5477-5485. [PubMed] [DOI] |
| 3. | Steck PA, Pershouse MA, Jasser SA, Yung WK, Lin H, Ligon AH, Langford LA, Baumgard ML, Hattier T, Davis T. Identification of a candidate tumour suppressor gene, MMAC1, at chromosome 10q23.3 that is mutated in multiple advanced cancers. Nat Genet. 1997;15:356-362. [PubMed] [DOI] |
| 4. | Chu EC, Tarnawski AS. PTEN regulatory functions in tumor suppression and cell biology. Med Sci Monit. 2004;10:RA235-RA241. [PubMed] |
| 6. | Osaki M, Oshimura M, Ito H. PI3K-Akt pathway: its functions and alterations in human cancer. Apoptosis. 2004;9:667-676. [PubMed] [DOI] |
| 7. | Hamada K, Sasaki T, Koni PA, Natsui M, Kishimoto H, Sasaki J, Yajima N, Horie Y, Hasegawa G, Naito M. The PTEN/PI3K pathway governs normal vascular development and tumor angiogenesis. Genes Dev. 2005;19:2054-2065. [PubMed] [DOI] |
| 8. | Nam SY, Lee HS, Jung GA, Choi J, Cho SJ, Kim MK, Kim WH, Lee BL. Akt/PKB activation in gastric carcinomas correlates with clinicopathologic variables and prognosis. APMIS. 2003;111:1105-1113. [PubMed] [DOI] |
| 9. | Malik SN, Brattain M, Ghosh PM, Troyer DA, Prihoda T, Bedolla R, Kreisberg JI. Immunohistochemical demonstration of phospho-Akt in high Gleason grade prostate cancer. Clin Cancer Res. 2002;8:1168-1171. [PubMed] |
| 10. | Vazquez F, Matsuoka S, Sellers WR, Yanagida T, Ueda M, Devreotes PN. Tumor suppressor PTEN acts through dynamic interaction with the plasma membrane. Proc Natl Acad Sci U S A. 2006;103:3633-3638. [PubMed] [DOI] |
| 11. | Fabregat I, Roncero C, Fernández M. Survival and apoptosis: a dysregulated balance in liver cancer. Liver Int. 2007;27:155-162. [PubMed] [DOI] |
| 12. | Tachibana M, Shibakita M, Ohno S, Kinugasa S, Yoshimura H, Ueda S, Fujii T, Rahman MA, Dhar DK, Nagasue N. Expression and prognostic significance of PTEN product protein in patients with esophageal squamous cell carcinoma. Cancer. 2002;94:1955-1960. [PubMed] [DOI] |
| 16. | Mirmohammadsadegh A, Marini A, Nambiar S, Hassan M, Tannapfel A, Ruzicka T, Hengge UR. Epigenetic silencing of the PTEN gene in melanoma. Cancer Res. 2006;66:6546-6552. [PubMed] [DOI] |
| 17. | Wiencke JK, Zheng S, Jelluma N, Tihan T, Vandenberg S, Tamgüney T, Baumber R, Parsons R, Lamborn KR, Berger MS. Methylation of the PTEN promoter defines low-grade gliomas and secondary glioblastoma. Neuro Oncol. 2007;9:271-279. [PubMed] [DOI] |
| 18. | Wang X, Trotman LC, Koppie T, Alimonti A, Chen Z, Gao Z, Wang J, Erdjument-Bromage H, Tempst P, Cordon-Cardo C. NEDD4-1 is a proto-oncogenic ubiquitin ligase for PTEN. Cell. 2007;128:129-139. [PubMed] [DOI] |
| 19. | Whiteman DC, Zhou XP, Cummings MC, Pavey S, Hayward NK, Eng C. Nuclear PTEN expression and clinicopathologic features in a population-based series of primary cutaneous melanoma. Int J Cancer. 2002;99:63-67. [PubMed] [DOI] |
| 20. | Leslie NR, Yang X, Downes CP, Weijer CJ. The regulation of cell migration by PTEN. Biochem Soc Trans. 2005;33:1507-1508. [PubMed] [DOI] |
| 21. | Gautam A, Li ZR, Bepler G. RRM1-induced metastasis suppression through PTEN-regulated pathways. Oncogene. 2003;22:2135-2142. [PubMed] [DOI] |
| 22. | Capodanno A, Camerini A, Orlandini C, Baldini E, Resta ML, Bevilacqua G, Collecchi P. Dysregulated PI3K/Akt/PTEN pathway is a marker of a short disease-free survival in node-negative breast carcinoma. Hum Pathol. 2009;40:1408-1417. [PubMed] [DOI] |
| 24. | Song G, Ouyang G, Bao S. The activation of Akt/PKB signaling pathway and cell survival. J Cell Mol Med. 2005;9:59-71. [PubMed] [DOI] |
| 25. | Carnero A. The PKB/AKT pathway in cancer. Curr Pharm Des. 2010;16:34-44. [PubMed] [DOI] |
| 26. | Lim WT, Zhang WH, Miller CR, Watters JW, Gao F, Viswanathan A, Govindan R, McLeod HL. PTEN and phosphorylated AKT expression and prognosis in early- and late-stage non-small cell lung cancer. Oncol Rep. 2007;17:853-857. [PubMed] |
| 27. | Ringel MD, Hayre N, Saito J, Saunier B, Schuppert F, Burch H, Bernet V, Burman KD, Kohn LD, Saji M. Overexpression and overactivation of Akt in thyroid carcinoma. Cancer Res. 2001;61:6105-6111. [PubMed] |
| 28. | Levine DA, Bogomolniy F, Yee CJ, Lash A, Barakat RR, Borgen PI, Boyd J. Frequent mutation of the PIK3CA gene in ovarian and breast cancers. Clin Cancer Res. 2005;11:2875-2878. [PubMed] [DOI] |
| 29. | Dillon RL, White DE, Muller WJ. The phosphatidyl inositol 3-kinase signaling network: implications for human breast cancer. Oncogene. 2007;26:1338-1345. [PubMed] [DOI] |
| 30. | Yamamoto S, Tomita Y, Hoshida Y, Morooka T, Nagano H, Dono K, Umeshita K, Sakon M, Ishikawa O, Ohigashi H. Prognostic significance of activated Akt expression in pancreatic ductal adenocarcinoma. Clin Cancer Res. 2004;10:2846-2850. [PubMed] [DOI] |
| 31. | Sharrard RM, Maitland NJ. Regulation of protein kinase B activity by PTEN and SHIP2 in human prostate-derived cell lines. Cell Signal. 2007;19:129-138. [PubMed] [DOI] |
| 32. | Alexiou GA, Voulgaris S. The role of the PTEN gene in malignant gliomas. Neurol Neurochir Pol. 2010;44:80-86. [PubMed] |
| 33. | Remy I, Michnick SW. Regulation of apoptosis by the Ft1 protein, a new modulator of protein kinase B/Akt. Mol Cell Biol. 2004;24:1493-1504. [PubMed] [DOI] |
| 34. | Anai M, Shojima N, Katagiri H, Ogihara T, Sakoda H, Onishi Y, Ono H, Fujishiro M, Fukushima Y, Horike N. A novel protein kinase B (PKB)/AKT-binding protein enhances PKB kinase activity and regulates DNA synthesis. J Biol Chem. 2005;280:18525-18535. [PubMed] [DOI] |