修回日期: 2011-06-01
接受日期: 2011-06-15
在线出版日期: 2011-06-28
目的: 探讨慢性HBV感染者血浆和肝组织中E-选择素的表达与机体细胞免疫功能间的关系及临床意义.
方法: 研究对象为270例慢性HBV感染者(其中慢性肝炎101例, 肝硬化121例, 肝癌48例)和281名健康对照者. 采用酶联免疫吸附实验(ELISA)检测各组血浆可溶性E-选择素水平, 流式细胞术检测CD3+、CD4+、CD8+以及NK细胞百分数, 免疫组织化学染色(IHC)检测肝脏组织E-选择素表达情况.
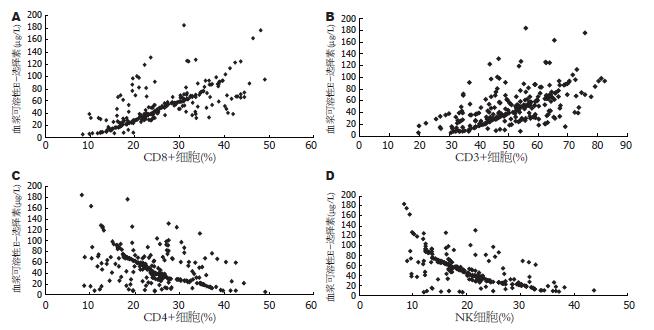
结果: 慢性肝炎组和肝硬化组血浆可溶性E-选择素水平(μg/L)明显高于肝癌组和对照组(68.94±34.09, 43.39±18.00 vs 16.69±8.27, 13.96±7.50, 均P<0.01), 且慢性肝炎组血浆可溶性E-选择素水平明显高于肝硬化组(P<0.01); 肝脏组织中慢性肝炎组血管内皮细胞中E-选择素阳性表达率为83.3%, 肝硬化组阳性表达率为57.1%, 前者阳性率明显高于后者(χ2 = 6.242, P = 0.012), 而对照组和肝癌患者肝组织未见E-选择素表达; 慢性肝炎组CD4+细胞(%)、NK细胞(%)与对照组相比显著降低(29.11±6.79 vs 37.02±7.05; 23.57±7.33 vs 27.37±7.03, 均P<0.01), 肝硬化组和肝癌组CD3+细胞、CD4+细胞、CD8+细胞以及NK细胞与对照组相比均显著降低(均P<0.01); 慢性HBV感染者血浆可溶性E-选择素水平与CD3+细胞、CD8+细胞呈正相关(r = 0.548, 0.715; 均P<0.01), 与CD4+细胞、NK细胞呈负相关(r = -0.429, -0.672; 均P<0.01).
结论: 慢性HBV感染者存在不同程度的免疫功能失调, 慢性肝炎和肝硬化患者血浆和肝组织中E-选择素的高表达与免疫失调、肝脏炎症程度密切相关, E-选择素检测可能作为一个有效的辅助指标来评价肝脏炎症程度.
引文著录: 张克惠, 缪希莉, 伍仕敏. E-选择素在慢性HBV感染者中的表达与T淋巴细胞亚群变化的关系及其临床意义. 世界华人消化杂志 2011; 19(18): 1892-1898
Revised: June 1, 2011
Accepted: June 15, 2011
Published online: June 28, 2011
AIM: To evaluate serum and hepatic levels of E-selectin in patients with chronic HBV infection and to analyze their relationship with T lymphocyte subsets and natural killer (NK) cells.
METHODS: Serum samples from 270 patients with chronic HBV infection, including 101 patients with chronic hepatitis, 121 with liver cirrhosis and 48 with hepatocellular carcinoma, and from 281 healthy controls, were used in this study. Circulating levels of soluble E-selectin were measured by enzyme-linked immunosorbent assay (ELISA). T lymphocyte subsets and NK cells were measured by flow cytometry (FCM). Immunohistochemistry (IHC) was used to detect the expression of E-selectin in liver tissue specimens from patients with chronic HBV infection.
RESULTS: Serum levels of soluble E-selectin were higher in patients with chronic hepatitis or liver cirrhosis than in those with hepatocellular carcinoma and healthy controls (68.94 ± 34.09, 43.39 ± 18.00 vs 16.69 ± 8.27, 13.96 ± 7.50, all P < 0.01). Immunohistochemistry analysis showed that the positive rates of E-selectin expression in endothelial cells in patients with chronic hepatitis and those with liver cirrhosis were 83.3% and 57.1% (χ2 = 6.242, P = 0.012), respectively, and no positive E-selectin staining was detected in patients with hepatocellular carcinoma or healthy controls. The percentages of CD4+ T cells and NK cells decreased significantly in patients with chronic HBV infection than in controls (29.11 ± 6.79 vs 37.02 ± 7.05; 23.57 ± 7.33 vs 27.37 ± 7.03, both P < 0.01). The percentages of CD3+, CD8+, CD4+ T cells and NK cells decreased significantly in patients with liver cirrhosis or hepatocellular carcinoma than in controls (all P < 0.01). Soluble E-selectin levels were positively related to the percentages of CD3+ and CD8+ cells (r = 0.548, 0.715; both P < 0.01), but negatively related to the percentages of CD4+ cells and NK cells (r = -0.429, -0.672; both P < 0.01).
CONCLUSION: Varying degrees of immune dysfunction is present in patients with chronic HBV infection, and high expression of E-selectin is associated with the development of chronic hepatitis and liver cirrhosis. These results suggest that E-selectin can be used as a useful marker for evaluation of hepatic inflammatory activity.
- Citation: Zhang KH, Miu XL, Wu SM. Changes in plasma levels of soluble E-selectin, T lymphocyte subsets and NK cells in patients with chronic HBV infection. Shijie Huaren Xiaohua Zazhi 2011; 19(18): 1892-1898
- URL: https://www.wjgnet.com/1009-3079/full/v19/i18/1892.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i18.1892
慢性乙型肝炎病毒(hepatitis B virus, HBV)感染是严重危害人类健康的重要传染病之一. 机体感染HBV后, 可发展为慢性乙型肝炎(chronic hepatitis B, CHB)、肝硬化(liver cirrhosis, LC), 甚至肝癌(hepatocellular carcinoma, HCC). 因而, 慢性HBV感染后阻止其肝脏炎症的进一步发展非常重要. HBV本身并不直接导致肝脏损伤, 许多研究表明, 机体过度的免疫应答, 尤其是CD8+细胞毒性T淋巴细胞(CD8 positive cytotoxic T lymphocytes, CTL)与HBV感染的肝细胞间的免疫应答, 是导致肝细胞损伤的主要原因[1-3]. 近年来, 细胞黏附分子在肝脏疾病中的作用越来越被大家所重视. CHB以炎症和淋巴细胞浸润为特征, 炎症过程中淋巴细胞与内皮细胞的黏附、渗出及与肝细胞的黏附均由细胞黏附分子介导[4-8]. 这些特殊的细胞黏附分子, 包括E-选择素、细胞间黏附分子1(intercellular adhesion molecule-1, ICAM-1)和血管间黏附分子1(vascular cell adhesion molecule-1, VCAM-1)等. 虽然E-选择素仅表达于活化的血管内皮细胞表面, 但其在黏附起始阶段起着至关重要的作用: 没有E-选择素的表达启动淋巴细胞和内皮组织的结合, ICAM-1和VCAM-1就不会发挥促进炎性细胞迁徙至炎症中心的作用[9-11]. 作为启动淋巴细胞和血管内皮细胞黏附的重要分子, 尽管有研究表明E-选择素在炎症性肝脏疾病中表达增加[8,12,13], 但他们血浆/血清中浓度的增加是否反映着其组织中的过度表达, 以及其表达与免疫失调是否存在关系尚未报道. 在本研究中, 我们检测不同临床结局的慢性HBV感染者血浆和组织中E-选择素的表达情况, 并分析其与T淋巴细胞亚群、NK细胞间的关系及临床意义, 探讨其可否作为一个有效的辅助指标来评价肝脏损坏程度.
全部研究对象均来自2008-09/2010-06武汉市医疗救治中心和武汉市普爱医院门诊或住院患者, 均HBsAg阳性, 共270例. (1)病例组: CHB患者101例, 其中男60例, 女41例; 年龄17-65(平均39±14)岁; LC患者121例, 其中男91例, 女30例; 年龄23-68(平均41±12)岁; HCC患者(48例, 其中男39例, 女9例; 年龄25-71(平均46±15)岁. 所有病例选择均符合2005年中华医学会肝病与感染病学分会制定的《慢性乙型肝炎防治指南》[14]的诊断标准, 并排除其他肝炎病毒感染以及酒精性肝病、药物性肝病、脂肪肝、自身免疫性肝炎等, 排除混合(重叠)感染. 所有病例均除外心、脑、肾、肺等器官疾病及高血压、糖尿病等. HCC病例的选择符合2001年中国抗癌协会肝癌专业委员会修订的肝癌临床诊断标准. 其中, CHB、LC和HCC患者肝脏组织来自武汉市医疗救治中心病例收集期间住院患者的肝脏穿刺样本, 新鲜组织冻存-70 ℃冰箱中, 甲醛溶液固定组织储存于4 ℃. 其中CHB(大多为慢性重症肝炎)患者36例[平均年龄(40±15)岁, 其中男24例, 女12例]、LC患者42例[平均年龄(41±12)岁, 其中男28例, 女14例], HCC患者8例[平均年龄(54±10)岁, 其中男5例, 女3例]. 正常肝脏组织18例[平均年龄(38±12)岁, 其中男10例, 女8例], 为病例收集期间武汉市普爱医院因肝血管瘤住院手术者, 血管瘤旁边的肝脏组织视为相对正常肝脏组织; (2)健康对照组: 281名, 为病例收集期间的健康体检者, 其中男206例, 女75例; 年龄16-66(平均年龄40±15)岁, 排除肝脏、肾脏、内分泌和心脑血管疾病者.
1.2.1 血浆可溶性E-选择素水平测定: 采用ELISA法检测血浆可溶性E-选择素的水平, 试剂由奥地利Bender MedSystems公司提供, 严格按试剂说明操作, 在芬兰雷勃酶标仪450 nm波长处检测A值, 通过标准曲线得出标本血浆可溶性E-选择素含量. 该试剂盒检测灵敏度为0.4 μg/L, 实验中批内和批间变异低于15%.
1.2.2 T淋巴细胞亚群检测: 用EDTA-K2抗凝管抽取清晨空腹静脉血2 mL, 应用流式细胞仪(Beckman Coulter EPICS-XL, 美国)检测CD3+、CD4+、CD8+和NK细胞百分比. 试剂购自Beckman Coulter公司, 严格按说明操作, 具体步骤为: 取100 μL全血加入试管中, 加单抗CD4-FITC/CD8-PE/CD3-PC5或CD3-FITC/CD16+CD56- PE 20 μL, 室温避光孵育20 min; 加入溶血素Optilyse C 500 μL, 室温避光孵育10 min, 弃上清; 加入PBS 500 μL, 室温避光孵育10 min, 弃上清; 加入1 mL PBS悬浮细胞后, 上机检测.
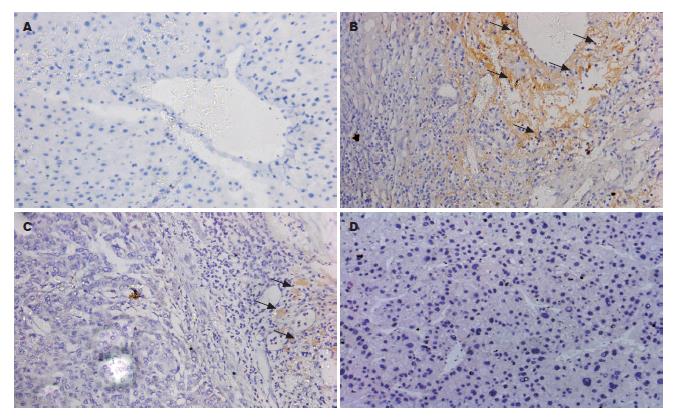
1.2.3 肝组织免疫组织化学染色: 鼠抗人E-选择素单抗购自法国Immunotech公司. LSAB试剂盒购自DAKO公司. 染色步骤参照ABC法及LSAB试剂盒说明, 显色底物为二氨基联苯胺. 免疫组织化学结果判断: 血管内皮细胞出现棕黄色染色为E-选择素阳性, 阳性程度则根据着色强度及阳性细胞百分比综合判断.
统计学处理 计量资料用以mean±SD表示, 以One-way ANOVA分析各组别之间的差异, 两组间比较采用LSD检验; 标本间阳性率的比较采用χ2检验; 两者间线性关系分析采用线性回归分析. 以上统计分析均采用SPSS11.5统计软件, P<0.05为有统计学意义.
HCC组(16.69±8.27) μg/L血浆可溶性E-选择素水平与对照组(13.96±7.50) μg/L相比较, 差异无统计学意义; CHB组(68.94±34.09) μg/L、LC组(43.39±18.00) μg/L与对照组相比, 明显增高, 差异有统计学意义; 且两组之间相比较, 亦有统计学差异, CHB组血浆E-选择素水平明显高于LC组(表1).
| 分组 | n | E-选择素(µg/L) | CD3+(%) | CD4+(%) | CD8+(%) | NK(%) |
| 对照组 | 281 | 13.96±7.50 | 63.39±9.22 | 37.02±7.05 | 32.51±8.24 | 27.37±7.03 |
| CHB组 | 101 | 68.94±34.09b | 61.84±8.70 | 29.11±6.79b | 30.92±7.76 | 23.57±7.33b |
| LC组 | 121 | 43.39±18.00bd | 46.95±8.56bd | 23.83±7.29bd | 21.56±6.89bd | 19.73±6.23bd |
| HCC组 | 48 | 16.69±8.27d | 47.98±7.54bd | 21.12±6.27bd | 23.85±6.47bd | 21.54±6.44b |
CHB组CD4+细胞、NK细胞百分数与对照组相比, 明显降低, 差异有统计学意义(均P<0.01); LC组和HCC组CD3+细胞、CD4+细胞、CD8+细胞以及NK细胞百分数与对照组相比, 明显降低, 差异有统计学意义(均P<0.01); LC组CD3+细胞、CD4+细胞、CD8+细胞以及NK细胞百分数与CHB组相比, 明显降低, 差异有统计学意义(均P<0.01); HCC组CD3+细胞、CD4+细胞和CD8+细胞百分数与CHB组相比, 明显降低, 差异有统计学意义(均P<0.01, 表1).
CHB患者(大部分为重症患者)肝脏组织中大量炎性细胞聚集处可见血管内皮细胞膜E-选择素表达强阳性, 部分LC患者肝组织中可见内皮细胞E-选择素弱阳性表达, 而对照组和HCC患者肝组织未见E-选择素表达. 其中, 在36例CHB患者中27例肝组织中E-选择素表达呈强阳性, 3例E-选择素表达弱阳性, 阳性率为83.3%; 42例LC患者肝组织中23例可见E-选择素弱阳性表达, 阳性率为57.1%; 两组间阳性率相比较, 差异有显著性(χ2 = 6.242, P = 0.012), CHB患者肝组织E-选择素表达明显高于LC患者(图1).
270例慢性HBV感染者血浆可溶性E-选择素水平与CD3+细胞、CD8+细胞呈正相关(r = 0.548, P<0.01; r = 0.715, P<0.01), 与CD4+细胞、NK细胞呈负相关(r = -0.429, P<0.01; r = -0.672, P<0.01, 图2).
机体感染HBV后的肝损伤主要由宿主对HBV的免疫应答所致, 但因免疫系统的复杂性, 某些病理机制尚未完全清楚. 许多免疫分子, 如CD8+ CTL、CD4+ T淋巴细胞、NK细胞、调节T淋巴细胞(regulatory T-cell, Treg cell)、树突状细胞(dendritic cells, DC)、Fas、Perforin等等均参与此过程[1-3,15-19]. 肝脏炎症过程中, 淋巴细胞黏附至内皮组织是其迁徙至炎症组织的重要环节, 近年来的研究表明E-选择素在此过程中发挥着重要作用[4-11]. 已报道CHB时大量可溶性E-选择素存在外周[8,12,13], 促进淋巴细胞从外周迁移至肝脏组织, 诱导肝组织炎症, 但他们血浆/血清中浓度的增加是否反映着其组织中的过度表达, 以及其表达与免疫失调是否存在某种联系尚未报道.
我们的研究表明, 在CHB、LC患者中, 血浆可溶性E-选择素水平明显高于对照组和肝癌组, 与Cervello等[12]和Yan等[13]的研究一致. 血浆可溶性E-选择素水平变化通常反映细胞表型转换和蛋白水解酶裂解的变化, 是炎症活动的标志[20]. 我们以往的研究证实, 慢性HBV感染者存在E-选择素A561C基因多态性, 其通过上调E-选择素的表达, 促进白细胞和内皮细胞的黏附, 导致局部炎症加剧, 而与此同时炎症组织释放IL-1及TNF-α等细胞因子, 反过来刺激可溶性E-选择素表达进一步增加, 最后启动炎症黏附和浸润[21]. 本研究进一步显示, CHB组血浆可溶性E-选择素水平明显高于LC组. 肝脏组织免疫组织化学染色显示: 慢性重症肝炎患者肝脏组织中大量炎性细胞聚集处可见血管内皮细胞膜E-选择素表达强阳性, 部分LC患者肝组织中可见E-选择素弱阳性表达, 前者E-选择素表达阳性率和强弱明显高于后者, 而对照组和肝癌患者肝脏组织未见明显E-选择素的表达. 这些结果表明, 慢性HBV感染者E-选择素的表达与肝脏炎症程度相关, 其在血浆中的可溶性表达与在组织中的表达一致. 但是, 亦研究表明E-选择素除了介导白细胞在血管内皮表面的黏附以外, 还与多种肿瘤细胞的转移关系密切[22-25], 有些HCC患者肿瘤组织中新形成的小血管周围内皮细胞中可见E-选择素的明显表达[24]. 而在本研究中, 我们收集的肝癌患者肝脏组织未见明显E-选择素的表达, 可能与取材、肿瘤的组织学类型及样本例数少有关.
机体在清除细胞内HBV的过程中, CD4+ T淋巴细胞、CTL、NK细胞、NKT细胞等免疫细胞发挥着重要作用[15-19,26-35]. CD4+ T淋巴细胞识别可溶性抗原, 通过分泌IL-2等细胞因子促进CTL的活化与增殖, 诱导B淋巴细胞分泌抗体, 具有免疫调节作用; 而CTL的活化, 要求识别经靶细胞处理过的抗原, 需要依赖活化的CD4+ T淋巴细胞所分泌的IL-2作用, 才能分化为具特异杀伤性的效应T淋巴细胞, 他是决定HBV清除状态的关键细胞亚群. 本研究通过流式细胞术检测发现, 随着病情发展, 从CHB组到LC、肝癌组, CD4+ T淋巴细胞逐渐下降, LC组、肝癌组CD3+ T淋巴细胞、CD8+ CTL亦明显下降, 以LC组最为显著. 这表明, 慢性HBV感染者存在不同程度的免疫功能低下, 随着病情进展, 免疫功能愈加紊乱. 我们的研究对象中, 肝硬化患者病程都在10年以上, 肝功能中度至重度异常, CD3+、CD4+、CD8+ T淋巴细胞显著降低, 其中作为效应细胞的CD8+CTL下降最为明显, 表明长期针对HBV的免疫应答使得CTL细胞大量消耗, 细胞免疫衰退较慢性肝炎严重得多, 此时病毒复制没有慢性肝炎活跃, 肝脏炎症程度减轻而纤维化程度增加. 同LC患者一样, 肝癌患者长期的病程中, 机体CD3+、CD4+ T淋巴细胞及CD8+ CTL亦大量消耗, 机体免疫功能低下, 此时肿瘤细胞浸润, 肝脏结构破坏.
NK细胞是机体天然免疫的主要承担者, 也是获得性细胞免疫的核心调节细胞. 本组试验结果显示, 在慢性HBV感染者中, 随着病情的进展和延续, 从CHB组到LC, NK细胞不断减少. 有研究表明NK细胞减少与CTL功能丧失有关[27,33], 而CTL反应对疾病的转归起着决定性作用, 因此推测NK细胞减少可能与HBV感染后疾病的慢性化相关. 而肝癌组NK细胞较之慢性肝炎组无差异, 可能是肿瘤细胞的免疫逃逸导致NK细胞无法识别并清除肿瘤细胞.
上述T淋巴细胞亚群和NK细胞的变化表明慢性HBV感染者存在不同程度的免疫功能失调, 进一步线性回归分析显示, 慢性HBV感染者血浆可溶性E-选择素水平与CD3+、CD8+ T淋巴细胞呈正相关, 与CD4+ T淋巴细胞、NK细胞呈负相关, 表明E-选择素的表达与免疫功能失调密切相关. 肝脏炎症组织中浸润的CTL、CD4+ T淋巴细胞大部分来源于外周血[36,37], 因此我们推测, 慢性肝炎、LC时外周及肝脏组织高表达的E-选择素促进大量淋巴细胞从外周血迁移至肝脏组织, 并促进其与内皮细胞的黏附, 从而加剧肝脏炎症反应, 导致肝脏损坏.
慢性HBV感染作为一种由遗传、免疫和环境因素共同作用所致的复杂的感染性疾病, 其病理机制尚未完全清楚. 本研究结果显示: 慢性HBV感染者存在不同程度的免疫功能失调, 慢性肝炎和LC患者血浆和肝组织中E-选择素的高表达与免疫失调、肝脏炎症程度密切相关, 因而E-选择素检测可以作为一个有效的辅助指标来评价肝脏的炎症程度. 本研究为更加深入地了解慢性HBV感染的发病机制、寻找新的阻止肝脏炎症的治疗方案提供了新的依据.
慢性HBV感染是一种由遗传、免疫和环境因素共同作用所致的复杂的感染性疾病, 机体过度的免疫应答是导致肝脏炎症的主要原因. 而肝脏炎症过程中淋巴细胞与内皮细胞的黏附、渗出及与肝细胞的黏附由细胞黏附分子介导, 其中E-选择素在黏附起始阶段起着至关重要的作用.
李君文, 研究员, 军事医学科学院卫生学环境医学研究所
本研究发现, 慢性HBV感染者存在不同程度的免疫功能失调, 其血浆和肝脏组织中E-选择素的表达与免疫失调、肝脏炎症程度密切相关, 可以作为一个有效的辅助指标来评价肝脏的炎症程度.
本文研究E-选择素的表达与免疫失调的关系, 为更深入了解慢性HBV感染的发病机制、寻找新的阻止肝脏炎症的治疗方案提供依据.
本文方法可靠, 思路清晰, 具有一定的创新性.
编辑: 李薇 电编:何基才
| 1. | Chisari FV, Ferrari C. Hepatitis B virus immunopathogenesis. Annu Rev Immunol. 1995;13:29-60. [PubMed] [DOI] |
| 2. | Kao JH, Chen DS. Global control of hepatitis B virus infection. Lancet Infect Dis. 2002;2:395-403. [PubMed] [DOI] |
| 3. | Sing G, Butterworth L, Chen X, Bryant A, Cooksley G. Composition of peripheral blood lymphocyte populations during different stages of chronic infection with hepatitis B virus. J Viral Hepat. 1998;5:83-93. [PubMed] [DOI] |
| 4. | Bevilacqua MP, Nelson RM, Mannori G, Cecconi O. Endothelial-leukocyte adhesion molecules in human disease. Annu Rev Med. 1994;45:361-378. [PubMed] [DOI] |
| 5. | Shimizu Y, Newman W, Tanaka Y, Shaw S. Lymphocyte interactions with endothelial cells. Immunol Today. 1992;13:106-112. [PubMed] [DOI] |
| 6. | Jung MC, Pape GR. Immunology of hepatitis B infection. Lancet Infect Dis. 2002;2:43-50. [PubMed] [DOI] |
| 7. | Springer TA. Traffic signals for lymphocyte recirculation and leukocyte emigration: the multistep paradigm. Cell. 1994;76:301-314. [PubMed] [DOI] |
| 8. | Kaplanski G, Farnarier C, Payan MJ, Bongrand P, Durand JM. Increased levels of soluble adhesion molecules in the serum of patients with hepatitis C. Correlation with cytokine concentrations and liver inflammation and fibrosis. Dig Dis Sci. 1997;42:2277-2284. [PubMed] [DOI] |
| 9. | Leeuwenberg JF, Smeets EF, Neefjes JJ, Shaffer MA, Cinek T, Jeunhomme TM, Ahern TJ, Buurman WA. E-selectin and intercellular adhesion molecule-1 are released by activated human endothelial cells in vitro. Immunology. 1992;77:543-549. [PubMed] |
| 10. | Wolf D, Hallmann R, Sass G, Sixt M, Küsters S, Fregien B, Trautwein C, Tiegs G. TNF-alpha-induced expression of adhesion molecules in the liver is under the control of TNFR1--relevance for concanavalin A-induced hepatitis. J Immunol. 2001;166:1300-1307. [PubMed] |
| 11. | Sharar SR, Winn RK, Harlan JM. The adhesion cascade and anti-adhesion therapy: an overview. Springer Semin Immunopathol. 1995;16:359-378. [PubMed] [DOI] |
| 12. | Cervello M, Virruso L, Lipani G, Giannitrapani L, Soresi M, Carroccio A, Gambino R, Sanfililippo R, Marasà L, Montalto G. Serum concentration of E-selectin in patients with chronic hepatitis, liver cirrhosis and hepatocellular carcinoma. J Cancer Res Clin Oncol. 2000;126:345-351. [PubMed] [DOI] |
| 13. | Yan MX, Mao HT, Liu Q, Wang WQ, Li YQ. Elevated levels of serum soluble E-selectin in patients with chronic hepatitis B: Correlation with T lymphocyte subsets, NK cells and liver inflammation. Hepatol Res. 2006;35:111-117. [PubMed] [DOI] |
| 15. | Rapicetta M, Ferrari C, Levrero M. Viral determinants and host immune responses in the pathogenesis of HBV infection. J Med Virol. 2002;67:454-457. [PubMed] [DOI] |
| 16. | Jan RH, Lin YL, Chen LK, Huang MT, Wang LC, Chiang BL. Hepatitis B virus surface antigen can activate dendritic cells and modulate T helper type immune response. Microbiol Immunol. 2011;55:51-59. [PubMed] [DOI] |
| 17. | Jin Z, Sun R, Wei H, Gao X, Chen Y, Tian Z. Accelerated liver fibrosis in hepatitis B virus transgenic mice: involvement of natural killer T cells. Hepatology. 2011;53:219-229. [PubMed] [DOI] |
| 18. | Chisari FV, Isogawa M, Wieland SF. Pathogenesis of hepatitis B virus infection. Pathol Biol (Paris). 2010;58:258-266. [PubMed] [DOI] |
| 19. | Das A, Maini MK. Innate and adaptive immune responses in hepatitis B virus infection. Dig Dis. 2010;28:126-132. [PubMed] [DOI] |
| 20. | Zheng F, Chevalier JA, Zhang LQ, Virgil D, Ye SQ, Kwiterovich PO. An HphI polymorphism in the E-selectin gene is associated with premature coronary artery disease. Clin Genet. 2001;59:58-64. [PubMed] [DOI] |
| 21. | 伍 仕敏, 杨 华芬, 章 敏, 熊 焰, 韩 小群, 殷 继东, 周 新, 蔡 春林. E-选择素基因多态性及血清可溶性水平与慢性HBV感染临床结局的关系. 世界华人消化杂志. 2009;17:1253-1259. [DOI] |
| 22. | Brodt P, Fallavollita L, Bresalier RS, Meterissian S, Norton CR, Wolitzky BA. Liver endothelial E-selectin mediates carcinoma cell adhesion and promotes liver metastasis. Int J Cancer. 1997;71:612-619. [PubMed] [DOI] |
| 23. | Khatib AM, Kontogiannea M, Fallavollita L, Jamison B, Meterissian S, Brodt P. Rapid induction of cytokine and E-selectin expression in the liver in response to metastatic tumor cells. Cancer Res. 1999;59:1356-1361. [PubMed] |
| 24. | Qian SK, Chen D, Li Y, Yang XW, Deng WJ, Li Q, Lin H, Hu H, Xiao JQ, Chen SW. [Effects of E-selectin and their ligands on the adhesive metastasis of hepatocellular carcinoma]. Zhonghua Ganzangbing Zazhi. 2010;18:440-444. [PubMed] |
| 25. | Zhang BH, Chen H, Yao XP, Cong WM, Wu MC. E-selectin and its ligand-sLeX in the metastasis of hepatocellular carcinoma. Hepatobiliary Pancreat Dis Int. 2002;1:80-82. [PubMed] |
| 26. | Batey RG, Clancy RL, Pang GT, Cao Q. Alcoholic hepatitis as a T-cell mediated disorder: an hypothesis. Alcohol Clin Exp Res. 1999;23:1207-1209. [PubMed] |
| 27. | Sing GK, Li D, Chen X, Macnaughton T, Lichanska AM, Butterworth L, Ladhams A, Cooksley G. A molecular comparison of T lymphocyte populations infiltrating the liver and circulating in the blood of patients with chronic hepatitis B: evidence for antigen-driven selection of a public complementarity-determining region 3 (CDR3) motif. Hepatology. 2001;33:1288-1298. [PubMed] [DOI] |
| 28. | Eyigün CP, Avci IY, Sengül A, Hacibektasoglu A, Van Thiel DH. Immune status of individuals with differing clinical courses of HBV infection. Hepatogastroenterology. 1999;46:1890-1894. [PubMed] |
| 29. | Alatrakchi N, Koziel M. Regulatory T cells and viral liver disease. J Viral Hepat. 2009;16:223-229. [PubMed] [DOI] |
| 31. | Li J, Han Y, Jin K, Wan Y, Wang S, Liu B, Liu Y, Lu S, Huang Z. Dynamic changes of cytotoxic T lymphocytes (CTLs), natural killer (NK) cells, and natural killer T (NKT) cells in patients with acute hepatitis B infection. Virol J. 2011;8:199. [PubMed] [DOI] |
| 32. | 王 九平, 李 新红, 朱 勇, 王 爱莲, 连 建奇, 贾 战生, 谢 玉梅. 慢性乙型肝炎患者T细胞亚群, mIL-2R, sIL-2R, IL-6, IL-8, TNF-α变化及意义. 世界华人消化杂志. 2000;8:763-766. [DOI] |
| 33. | Carotenuto P, Artsen A, Osterhaus AD, Pontesilli O. Reciprocal changes of naïve and effector/memory CD8+ T lymphocytes in chronic hepatitis B virus infection. Viral Immunol. 2011;24:27-33. [PubMed] [DOI] |
| 35. | Yousfi N, Hattaf K, Tridane A. Modeling the adaptive immune response in HBV infection. J Math Biol. 2011; Jan 14. [Epub ahead of print]. [PubMed] |
| 36. | Crispe IN, Mehal WZ. Strange brew: T cells in the liver. Immunol Today. 1996;17:522-525. [PubMed] [DOI] |
| 37. | Abrignani S. Bystander activation by cytokines of intrahepatic T cells in chronic viral hepatitis. Semin Liver Dis. 1997;17:319-322. [PubMed] [DOI] |