修回日期: 2011-05-21
接受日期: 2011-06-02
在线出版日期: 2011-06-18
目的: 评价Runx3基因启动子区CpG岛甲基化状态及Runx3蛋白表达在结肠癌发生中的作用及临床意义.
方法: 应用DNA甲基化特异性PCR(MSP)技术检测结肠癌、结肠腺瘤、正常结肠黏膜Runx3基因CpG岛甲基化状态, 应用免疫组织化学发法检测Runx3蛋白的表达.
结果: MSP方法检测发现Runx3基因CpG岛甲基化在结肠癌组、腺瘤组与正常组之间有显著性差异[23.5%(8/34), 20.6%(7/34) vs 0.0%(0/0), 均P<0.05], 而结肠癌组与腺瘤组之间无显著性差异. 免疫组织化学检测发现结肠癌组中Runx3蛋白表达阳性率较腺瘤组、正常组之间有显著性差异[17.7%(6/34) vs 61.8%(21/34), 76.5%(26/34), 均P<0.05].
结论: Runx3基因启动子区CpG岛甲基化是促进结肠癌发生的重要基因事件, 可能与Runx3蛋白失表达有关.
引文著录: 何绍亚, 韩盛玺, 蒋仁发, 向阳生. Runx3基因甲基化及Runx3蛋白表达在结肠癌发生中的意义. 世界华人消化杂志 2011; 19(17): 1860-1863
Revised: May 21, 2011
Accepted: June 2, 2011
Published online: June 18, 2011
AIM: To detect the methylation and protein expression of the Runx3 gene in sporadic colorectal cancer (SCRC), colonic adenoma, and normal colon tissue and to evaluate their clinical significance in colorectal carcinogenesis.
METHODS: Thirty-four colonic cancer specimens, 34 colonic adenoma specimens, and 34 normal colonic tissue specimens were used in this study. The CpG island methylation status of the Runx3 gene was detected by methylation-specific PCR in these specimens. and the protein expression of Runx3 was detected by immunohistochemistry.
RESULTS: The rates of methylation of the Runx3 gene in colonic cancer and colonic adenoma were significantly higher than that in normal colonic tissue (23.5%, 20.6% vs 0.0%, both P < 0.05). There was no significant difference in the rate of methylation of the Runx3 gene between colonic adenoma and colonic cancer (P > 0.05). The positive rate of Runx3 protein expression was significantly lower in colonic cancer than in colonic adenoma and normal tissue (17.7% vs 61.8%, 76.5%, both P < 0.05).
CONCLUSION: Methylation of the promoter CpG islands of the Runx3 gene is an important genetic event of colon carcinogenesis and may be associated with altered protein expression of Runx3.
- Citation: He SY, Han SX, Jiang RF, Xiang YS. Significance of methylation and protein expression of the Runx3 gene in colon carcinogenesis. Shijie Huaren Xiaohua Zazhi 2011; 19(17): 1860-1863
- URL: https://www.wjgnet.com/1009-3079/full/v19/i17/1860.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i17.1860
DNA甲基化是最常见的表观遗传学改变方式. 他是由S-腺苷甲硫氨酸(S-adenosyl methionine, SAM)提供甲基, 在DNA甲基转移酶(DNA methyltransferse, DNMT)催化下, DNA C-5位的胞嘧啶转变为5-甲基胞嘧啶(5-mC), 发生在转录水平不改变DNA一级结构的碱基修饰方式[1]. 甲基化部位常位于5'-CPG-3'二核苷酸. 基因甲基化广泛存在于不同肿瘤中, 许多研究发现人类原发性恶性肿瘤抑癌基因存在高甲基化. 本研究应用甲基化PCR法(MSP)对结肠癌、结肠腺瘤、正常结肠黏膜Runx3基因CpG岛甲基化率进行检测, 旨在探讨Runx3基因CpG岛甲基化在结肠癌发生中的作用.
收集2008-10/2009-02四川省人民医院手术切除的结肠癌及结肠腺瘤组织标本68例, 正常组织源于肠镜下活检标本34例, 所有病例均经患者同意并签知情同意书, 均为首次诊治患者, 术前未行放疗、化疗或免疫治疗. 其中结肠癌34例, 腺瘤34例, 正常组织34例. 所收集新鲜组织标本均在20 min内保存于-183 ℃液氮中以备用. 结肠癌组织中, 男18例, 女16例, 年龄38-78(平均58±2.5)岁; 结肠腺瘤组织中, 男17例, 女17例, 年龄28-73(平均53±2.7)岁. 正常结肠黏膜组织中, 男18例, 女16例, 年龄38-78(平均58±2.2)岁. TIANamp Genomic DNA Kit为北京天根生物科技有限公司产品; EZ DNA Methylation-Gold Kit试剂盒为北京天漠科技开发有限公司产品; DNA标志物λDNA/Hind Ⅲ、50 bp DNA Labber、2×Taq PCR MasterMix为北京天根生物科技有限公司产品; 兔抗人单克隆抗体Runx3 为中杉生物制品公司产品; DAB Kit为中杉金桥生物公司产品.
1.2.1 引物的合成及制备: DNA序列参照GenBank, PCR引物参照文献[2]设计. Runx3甲基化前导引物序列(methylated-specific forward primers, MF)5'-TTACGAGGGGCGGTCGTACGCGGG-3'; Runx3甲基化反向引物序列(methylated-specific reverse primers, MR)5'-AAAACGACCGACGCGAACGCCTCC-3'; Runx3非甲基化前导引物序列(unmethylated-specific forward primers, UF)5'-TTATGAGGGGTGGTTGTATGTGGG-3'; Runx3非甲基化反向引物序列(unmethylated-specific reverse primers, UR)5'-AAAACAACCAACACAAACACCTCC-3'.
1.2.2 DNA提取: 本研究参照Herman等[3]使用的甲基化特异性PCR方法. 采用TIANamp Genomic DNA Kit提取组织标本DNA. DNA提取: 经EZ DNA甲基化试剂盒-Gold甲基化提取的组织DNA. Runx3M体系: 2×Taq PCRMasterMix 12.5 μL; Runx3 Mf 1 μL; Runx3 Mr 1 μL甲基化处理后的DNA 2.5 μL; ddH2O 8 μL; Runx3基因PCR反应条件: 94 ℃ 10 min预变性, 65 ℃下退火45 s, 72 ℃延伸10 min; 以扩增产物经1%琼脂糖凝胶电泳, 运用Gel Doc 1000凝胶图像成像仪(美国Bio-Rad公司).
1.2.3 免疫组织化学检测Runx3蛋白的表达: 实验步骤按说明书进行. (Runx3抗原修复均采用高压热修复), 采用PBS液代替一抗作为阴性对照,采用已知的阳性片作为阳性对照.
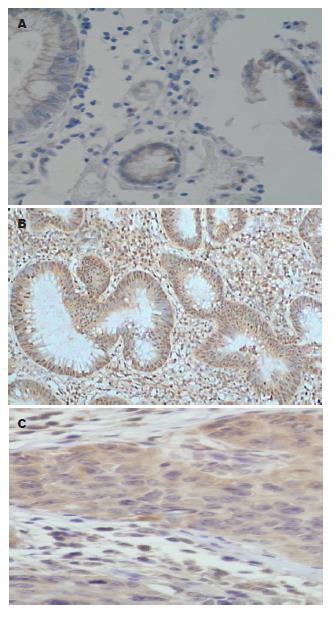
1.2.4 判断标准: 扩增产物如出现在250 bp处显示电泳条带为阳性, 否则为阴性; 经Runx3基因非甲基化引物扩增的DNA产物如出现在240 bp处显示电泳条带为阳性, 否则为阴性[3]. Runx3蛋白在结肠癌组、结肠腺瘤组及正常组中的阳性表达为细胞核阳性, 呈棕黄色, 高倍镜下计数10个高倍视野, 其阳性计数>10%, 判定为阳性.
统计学处理 率的比较采用Fisher确切概率法进行统计学分析, 用SPSS13.0统计学软件对数据进行处理, 检验水准α = 0.05, P<0.05有统计学意义.
Runx3启动子CpG岛甲基化阳性表达率在结肠癌和腺瘤中分别为23.5%(8/34)、20.6%(7/34),正常组织中未测到Runx3基因CpG岛甲基化. 结肠癌组、腺瘤组与正常组比较有显著性差异(P<0.05). 结肠癌组与腺瘤组比较无显著性差异(P>0.05, 表1).
| 分组 | Runx3基因CpG岛甲基化 | |
| 阳性 | 阴性 | |
| 结肠癌组织 | 8 | 26 |
| 腺瘤组织 | 7 | 27 |
| 正常组织 | 0 | 34 |
DNA甲基化与肿瘤发生密切相关, 是抑癌基因失活的机制之一[4]. Runx3基因是新近发现的抑癌基因, 是哺乳动物Runx基因家族中最原始亚型. 对上皮细胞生长、分化起调控作用, 对脊神经节发育和T细胞分化也发挥重要作用. Runx3蛋白是TGF-β信号转导通路中的一个转录因子, 直接与R-Smad(Smad受体)结合, 指导TGF-β1/Smad信号途径中被激活的Smad(一种凋亡因子)复合物从胞质转入胞核靶位点, 加强TGF-β1/Smad复合物和靶位点结合, 促进TGF-β1信号传导, 介导细胞正常凋亡, 协同TGF-β1对上皮细胞生长的负性调控, 在TGF-β1信号传导途径中发挥关键作用[5]. 国外学者研究发现Runx3基因在结肠癌中高甲基化, Runx3基因CpG岛甲基化导致Runx3基因失活与结肠肿瘤发生密切相关[6].
Runx3蛋白缺失会导致TGF-β1信号通路阻断, 细胞对TGF-β1诱导的生长抑制作用和凋亡反应能力下降, β-catenin在胞质内积聚, Wnt信号通路激活, 细胞增殖和凋亡失衡, 遗传学上不稳定的细胞克隆扩增发生癌变, 促进肿瘤发生[7]. 已有研究发现敲除Runx3基因的小鼠其Runx3蛋白表达下降, 小鼠肿瘤发率明显上升[8]. Ku等[9]应用MSP技术对人结肠癌细胞株进行检测, 发现50%的人结肠癌细胞株Runx3蛋白表达下降或不表达. 研究还发现人结肠癌、肝细胞癌、胆管癌、胰腺癌、肺癌、食管癌、内胚窦瘤、乳腺[10-17]等肿瘤中Runx3蛋白阳性表达率较相应正常组织的阳性表达率显著下降. 本研究发现34例结肠癌中有8例Runx3基因CpG岛甲基化, 甲基化率为23.5%(8/34), 与Ku等[9]采用MSP技术检测发现18.4%的结肠癌组织Runx3基因CpG岛甲基化, 正常结肠组织无Runx3基因CpG岛甲基化接近. 与Goel等[18]发现21%(19/91)的结肠癌病例存在Runx3基因CpG岛甲基化, 正常组未发现Runx3基因CpG岛甲基化相似. 本研究还发现正常结肠黏膜Runx3蛋白阳性表达率达76.5%(26/34), 腺瘤组Runx3蛋白阳性表达率为61.8%(21/34), 结肠癌Runx3蛋白阳性表达率只有17.7%(6/34), 结肠癌组明显低于腺瘤组及正常组, 且有显著性差异(P<0.05), 与Chen等[17]的报道相似. 本研究提示Runx3基因CpG岛甲基化可能发生于正常结肠黏膜→结肠腺瘤→结肠腺癌这一发展序列早期阶段, 是结肠癌发生早期分子事件. 结肠癌中Runx3蛋白低表达, 可能与结肠癌Runx3基因CpG岛甲基化有关.
甲基化部位常位于5'-CPG-3'二核苷酸. 基因甲基化广泛存在于不同肿瘤中, 许多研究发现人类原发性恶性肿瘤抑癌基因存在高甲基化.
陈卫昌, 教授, 苏州大学附属第一医院消化内科
单核苷酸多态性与某肿瘤人群易感性关系是近年来的研究热点. 目前研究较多的与结直肠癌易感性的单核苷酸多态性位点有XRCC3 Thr 241Met, CTLA-4+49G>A, MTHFR C677T等, 但各研究结果间存在一定差异.
Zheng等的关于CTLA-4+49G> A单核苷酸多态性与结直肠癌易感性的Meta分析显示, 显性模式下, 野生型个体患结直肠癌的风险是突变型个体的1.24倍.
本文将XRCC3基因Thr241Met位点单核苷酸多态性与结直肠癌易感性关系所有的可能情况进行了假设考虑, 避免了不同表形型模式对两者关系的影响. 同时按人种的区别进行了亚组分析, 避免了不同人种对结果的影响.
本研究结果未显示出该位点多态性与结直肠癌易感性间存相关性与理论之间存在差异. 说明某个或某几个基因的某个或某几个单核苷酸多态性与肿瘤易感性之间的关系可能不足以在较小样本的情况下显现出来, 因此, 需要进一步加大研究的样本量, 同时进行多基因多位点联合检测.
本文写作层次清晰, 统计方法恰当, 其科学性、创新性和可读性能较好地反映我国或国际胃肠病学临床和基础研究的先进水平.
编辑: 曹丽鸥 电编:何基才
| 1. | Esteller M. DNA methylation and cancer therapy: new developments and expectations. Curr Opin Oncol. 2005;17:55-60. [PubMed] [DOI] |
| 2. | Issa JP. CpG island methylator phenotype in cancer. Nat Rev Cancer. 2004;4:988-993. [PubMed] [DOI] |
| 3. | Herman JG, Graff JR, Myöhänen S, Nelkin BD, Baylin SB. Methylation-specific PCR: a novel PCR assay for methylation status of CpG islands. Proc Natl Acad Sci U S A. 1996;93:9821-9826. [PubMed] [DOI] |
| 4. | Esteller M, Corn PG, Baylin SB, Herman JG. A gene hypermethylation profile of human cancer. Cancer Res. 2001;61:3225-3229. [PubMed] |
| 5. | Vogelmann R, Nguyen-Tat MD, Giehl K, Adler G, Wedlich D, Menke A. TGFbeta-induced downregulation of E-cadherin-based cell-cell adhesion depends on PI3-kinase and PTEN. J Cell Sci. 2005;118:4901-4912. [PubMed] [DOI] |
| 6. | Subramaniam MM, Chan JY, Soong R, Ito K, Yeoh KG, Wong R, Guenther T, Will O, Chen CL, Kumarasinghe MP. RUNX3 inactivation in colorectal polyps arising through different pathways of colonic carcinogenesis. Am J Gastroenterol. 2009;104:426-436. [PubMed] [DOI] |
| 7. | Miyazono K, Maeda S, Imamura T. Coordinate regulation of cell growth and differentiation by TGF-beta superfamily and Runx proteins. Oncogene. 2004;23:4232-4237. [PubMed] [DOI] |
| 8. | Soong R, Shah N, Peh BK, Chong PY, Ng SS, Zeps N, Joseph D, Salto-Tellez M, Iacopetta B, Ito Y. The expression of RUNX3 in colorectal cancer is associated with disease stage and patient outcome. Br J Cancer. 2009;100:676-679. [PubMed] [DOI] |
| 9. | Ku JL, Kang SB, Shin YK, Kang HC, Hong SH, Kim IJ, Shin JH, Han IO, Park JG. Promoter hypermethylation downregulates RUNX3 gene expression in colorectal cancer cell lines. Oncogene. 2004;23:6736-6742. [PubMed] [DOI] |
| 10. | Li QL, Ito K, Sakakura C, Fukamachi H, Inoue K, Chi XZ, Lee KY, Nomura S, Lee CW, Han SB. Causal relationship between the loss of RUNX3 expression and gastric cancer. Cell. 2002;109:113-124. [PubMed] [DOI] |
| 11. | Park WS, Cho YG, Kim CJ, Song JH, Lee YS, Kim SY, Nam SW, Lee SH, Yoo NJ, Lee JY. Hypermethylation of the RUNX3 gene in hepatocellular carcinoma. Exp Mol Med. 2005;37:276-281. [PubMed] |
| 12. | Kim WJ, Kim EJ, Jeong P, Quan C, Kim J, Li QL, Yang JO, Ito Y, Bae SC. RUNX3 inactivation by point mutations and aberrant DNA methylation in bladder tumors. Cancer Res. 2005;65:9347-9354. [PubMed] [DOI] |
| 13. | Sato K, Tomizawa Y, Iijima H, Saito R, Ishizuka T, Nakajima T, Mori M. Epigenetic inactivation of the RUNX3 gene in lung cancer. Oncol Rep. 2006;15:129-135. [PubMed] |
| 14. | Hiramatsu T, Osaki M, Ito Y, Tanji Y, Tokuyasu N, Ito H. Expression of RUNX3 protein in human esophageal mucosa and squamous cell carcinoma. Pathobiology. 2005;72:316-324. [PubMed] [DOI] |
| 15. | Vogiatzi P, De Falco G, Claudio PP, Giordano A. How does the human RUNX3 gene induce apoptosis in gastric cancer? Latest data, reflections and reactions. Cancer Biol Ther. 2006;5:371-374. [PubMed] [DOI] |
| 16. | Kato N, Tamura G, Fukase M, Shibuya H, Motoyama T. Hypermethylation of the RUNX3 gene promoter in testicular yolk sac tumor of infants. Am J Pathol. 2003;163:387-391. [PubMed] [DOI] |
| 17. | Chen W, Salto-Tellez M, Palanisamy N, Ganesan K, Hou Q, Tan LK, Sii LH, Ito K, Tan B, Wu J. Targets of genome copy number reduction in primary breast cancers identified by integrative genomics. Genes Chromosomes Cancer. 2007;46:288-301. [PubMed] [DOI] |
| 18. | Goel A, Arnold CN, Tassone P, Chang DK, Niedzwiecki D, Dowell JM, Wasserman L, Compton C, Mayer RJ, Bertagnolli MM. Epigenetic inactivation of RUNX3 in microsatellite unstable sporadic colon cancers. Int J Cancer. 2004;112:754-759. [PubMed] [DOI] |