修回日期: 2011-05-07
接受日期: 2011-05-11
在线出版日期: 2011-06-18
目的: 探讨选择性COX-2抑制剂塞莱昔布对幽门螺杆菌(H. pylori)蛋白质组的影响.
方法: 双向凝胶电泳技术(2-DE)分离塞莱昔布处理前后的H. pylori标准株26695全菌蛋白, 银染法凝胶染色, 图像扫描分析软件识别差异蛋白, 基质辅助激光解吸电离飞行时间质谱(MALD-TOF-MS)、串联质谱(MALDI-TOF-MS/MS)分析差异蛋白; SYBR GreenⅠ实时定量PCR测定差异蛋白基因的表达变化.
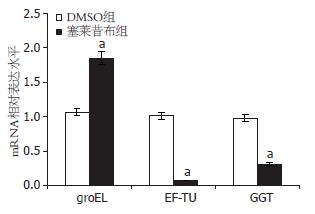
结果: 塞莱昔布处理后, H. pylori标准株26695发现17个蛋白质斑点表达有差异. 7个蛋白质斑点得到阳性鉴定, 分别归为H. pylori的3种蛋白质: 热休克蛋白60(HSP60), 即groEL, 延伸因子(EF-TU), 谷氨酰转肽酶(GGT). 与DMSO溶媒对照相比, 塞莱昔布处理后的H. pylori HSP60(groEL)、EF-TU、GGT表达下调. 实时定量PCR测定显示, 编码H. pylori EF-TU、GGT基因的mRNA水平降低(0.07±0.06 vs 1.01±0.16; 0.31±0.13 vs 0.98±0.01, 均P<0.05), 而编码H. pylori HSP60(groEL)基因的mRNA水平增加(1.85±0.26 vs 1.07±0.27, P<0.05).
结论: 塞莱昔布通过下调H. pylori EF-TU、GGT mRNA的表达减低其蛋白的表达; 而其对HSP60蛋白质表达的下调作用不发生在mRNA转录水平. 塞莱昔布可能通过调节H. pylori致病相关蛋白的表达影响其致病性.
引文著录: 高培培, 王蔚虹, 王静, 李江, 董欣红. 塞莱昔布对幽门螺杆菌蛋白质组的影响. 世界华人消化杂志 2011; 19(17): 1785-1790
Revised: May 7, 2011
Accepted: May 11, 2011
Published online: June 18, 2011
AIM: To perform a proteomic investigation of the effect of celecoxib on Helicobacter pylori (H. pylori).
METHODS: Total proteins of untreated and celecoxib-treated H. pylori 26695 were extracted and separated by 2-dimensionals polyacrylamide gel electrophoresis (2-DE). Differential protein expression was detected using computer-assisted image analysis. Differential proteins were identified by matrix-assisted laser desorption/ionization time-of-flight mass spectrometry (MALDI-TOF-MS) and matrix-assisted laser desorption/ionization time-of-flight-tandem mass spectrometry (MALDI-TOF-MS/MS). The levels of mRNA expression were measured by real-time polymerase chain reaction.
RESULTS: Seventeen differentially expressed spots were detected between untreated and celecoxib-treated H. pylori 26695. Seven spots were positively identified as three proteins: heat shock protein 60 (HSP60), elongation factor TU (EF-TU) and gamma-glutamyltranspeptidase (GGT). The protein expression of HSP60, GGT, and EF-TU, and mRNA expression of GGT and EF-TU were down-regulated (0.07 ± 0.06 vs 1.01 ± 0.16; 0.31 ± 0.13 vs 0.98 ± 0.01, both P < 0.05), while the mRNA expression of HSP60 was up-regulated in the presence of celecoxib (1.85 ± 0.26 vs 1.07 ± 0.27, P < 0.05).
CONCLUSION: Celecoxib could down-regulate the protein expression of HSP60, GGT and EF-TU and mRNA expression of GGT and EF-TU in H. pylori; however, the mRNA expression of HSP60 was up-regulated. These results suggest that celecoxib might interfere with the pathogenicity of H. pylori.
- Citation: Gao PP, Wang WH, Wang J, Li J, Dong XH. Proteomic profiling of Helicobacter pylori treated with celecoxib. Shijie Huaren Xiaohua Zazhi 2011; 19(17): 1785-1790
- URL: https://www.wjgnet.com/1009-3079/full/v19/i17/1785.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i17.1785
服用非甾体抗炎药(non-steroidal anti-inflammatory drugs, NSAIDs)的幽门螺杆菌(Helicobacter pylori, H. pylori)感染者在临床上常见, 二者共同存在时对胃黏膜的致病性及致病机制尚未明确[1,2]. 通常认为, H. pylori和NSAIDs是导致胃黏膜损害的两个独立危险因素, 然而, 在胃内微环境中, NSAIDs和H. pylori共同存在将不可避免地对H. pylori的生物学性状甚至其致病性发生影响. 前期的体外研究显示, 阿司匹林和选择性的COX-2抑制剂塞莱昔布可剂量依赖性抑制H. pylori的生长, 抑制H. pylori尿素酶及空泡毒素的活性[3,4], 降低H. pylori的鞭毛动力, 抑制H. pylori对胃癌上皮细胞株AGS细胞的黏附. 进一步的研究显示, 塞莱昔布可降低H. pylori鞭毛蛋白(flaA、flaB)mRNA表达, 增加尿素酶基因(ureA、ureB)及黏附素基因(babA、sabA、alpA、alpB、hpaA、hopZ)mRNA表达[4]. H. pylori的致病因子包括与定植相关的因子、黏膜损害相关的因子、免疫反应相关的因子等多种复杂的致病因子[5,6]. 为全面了解塞莱昔布对H. pylori多种致病因子及致病性的影响, 本研究应用蛋白质组技术研究塞莱昔布处理后H. pylori全菌蛋白质组的变化, 旨在确定塞莱昔布对H. pylori致病相关蛋白的影响, 为明确NSAIDs和H. pylori共同存在的致病性及致病机制提供线索.
标准菌株H. pylori26695(购自American Type Culture Collection, ATCC)由中国疾病预防控制中心传染病预防控制所张建中教授惠赠. 塞莱昔布由北京医药研究开发中心惠赠, 溶于二甲基亚砜(DMSO)备用.
1.2.1 细菌培养: 将在固体培养基中生长良好的H. pylori26695菌株分别接种于含0.01 mmol/L塞莱昔布及二甲基亚砜(DMSO)(塞莱昔布的溶媒为DSMO, 故研究以同等浓度的DSMO作对照)溶媒对照(1/1 000)的布氏肉汤培养液中, 37 ℃微需氧环境下, 空气摇床70 r/min, 培养24 h后, 用PBS洗涤菌体沉淀3次, 4 ℃, 4 500 r/min×5 min离心, 弃上清, 备用.
1.2.2 提取菌体蛋白: 菌体沉淀内加适量蛋白裂解液, 混匀后冰浴超声5 min(超声2 s, 间隔3 s), 至完全溶解; 加入10 mL/L蛋白酶抑制剂冰上充分裂解1 h; 4 ℃, 35 000 g 15 min离心, 上清备用. BCA法测定蛋白质浓度.
1.2.3 二维电泳: 等电聚焦(IEF)采用18 cm、pH3-10非线性干胶条[7,8], 上样量为150 μg蛋白/胶条, 设置聚焦仪(Amersham Biosciences)程序为: 20 ℃表面温度, 电流强度50 μA/胶条, 30 V、6 h; 60 V、6 h; 100 V、1 h; 600 V、1 h; 1 000 V、1 h; 8 000 V、10 h; 聚焦至VhT 8 000. 将胶条进行两步平衡后, 转至浓度为12.5%的聚丙烯酰胺凝胶, 进行第二项SDS-PAGE电泳: 25 ℃自动泵, 2.5 W/胶, 30 min; 18 W/胶, 4.5 h; 银染. 以ImageMaster 2D Platinum5.0分析软件(Amersham Biosciences)采集图像. 每组样品做3块平行胶, 同一批制备的3组蛋白样品做差异比较, 肉眼观察选取差异点, 用ImageMaster 2D Platinum5.0软件分析获得蛋白点的丰度确认差异的比例, 以2-DE胶上匹配点占蛋白总量的百分比增加或降低至少3倍为差异标准, 切取平行胶中变化一致的差异点, 胰酶(Sigma)进行胶内酶解.
1.2.4 质谱鉴定: ABI 4700基质辅助激光电离解析飞行时间质谱仪(Applied Biosystems, Foster City, CA, USA)分析, Nd: YAG激光器, 335 nm, 200 Hz激光激发, 随后做二级质谱分析, 利用GPS工作站(GPS ExplorerTM v3.6, mascot v2.1)搜索NCBInr数据库, 结合双向凝胶电泳图谱上相应点的表观等电点、相对分子质量、匹配肽段的多少和氨基酸序列的覆盖率等综合分析确定可能的蛋白质.
1.2.5 荧光实时定量RT-PCR: 收集培养48 h的H. pylori26695, 采用TRIzol试剂提取总RNA, 紫外分光光度法测定RNA浓度. 取RNA 2 μg逆转录, 引物设计采用Primer Express3.0软件(Applied Biosystem Perkin-Elmer)(核苷酸序列见表1), 参照质谱鉴定结果, 检测热休克蛋白60(heat shock protein 60, HSP60) mRNA、谷氨酰转肽酶(gamma-glutamyltranspeptidase, GGT) mRNA、延伸因子(elongation factor TU, EF-TU) mRNA、内参16S rRNA表达. 扩增条件: 95 ℃, 10 min, 预变性; 95 ℃, 15 s, 61 ℃, 1 min, 40个循环; 熔解曲线95 ℃, 15 s, 61 ℃, 30 s, 96 ℃, 15 s. 采用2-ΔΔCt法计算mRNA相对表达量.
| 引物名称 | 核苷酸序列(5'→3') |
| groEL-F | CGGTCATTTTCTCAGCGTTTG |
| groEL-R | AAGCTAAGGGCATTGAAGATGAA |
| EF-TU-F | CGCGCACTTCCATTTCTACA |
| EF-TU-R | GTGCCTCACATCGTTGTTTTCTT |
| GGT-F | TCGGCAGCGATATGGATATTC |
| GGT-R | GCACGCATTTGATCCAGATTT |
| 16S rRNA-F | GCGTGGACTACCAGGGTATCTAA |
| 16S rRNA-R | GGCGACCTGCTGGAACATTA |
统计学处理 分析实验结果以mean±SD表示, 采用SPSS13.0统计软件进行独立样本t检验, P<0.05为差异有统计学意义.
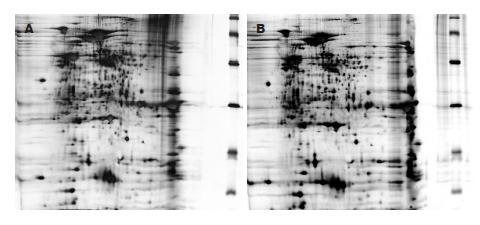
DMSO组和塞莱昔布组中分别可以检测到1 614、1 503个蛋白质点, 两电泳胶所含蛋白质的理论pI值和MW分布范围大致相同, 分别为3 560-9 720 Da和13 380-98 430 Da. 两组2-DE图谱相似, 蛋白质斑点能很好地重叠, 但少数蛋白质含量有差异. 以3个平行处理样品中均存在差异的蛋白质点确定为蛋白表达差异, 发现与DMSO溶媒对照相比, 塞莱昔布处理后, H. pylori26695 2-DE图谱上共有17个蛋白质点表达量减少, 其表达量变化均≥3倍.
分析同一批次内塞莱昔布处理与DMSO对照的差异, 切取3个平行样品中均存在差异的17个蛋白质点, 胶内酶解后经MALDI-TOF-MS, MS-MS鉴定. 以蛋白和离子的置信区间均高于95%, 且至少有两个肽段得分>50或一个肽段得分>60为可信蛋白. 7个蛋白质斑点得到鉴定(表2), 分别归为H. pylori的3种蛋白质: HSP60, 即groEL; EF-TU; GGT. 剩余的10个蛋白质斑点经Mascot搜索NCBInr数据库后未得到阳性结果. 与DMSO对照处理比较, 塞莱昔布处理后H. pylori HSP60(groEL), EF-TU, GGT表达量减少(图1).
| Spot ID | 蛋白鉴定结果 | 变化趋势 | Accession No. | 等电点/分子量(Da) | 序列覆盖率(%) |
| 1021 | HSP60 | 下调 | 397869 | 5.9/33205 | 41 |
| 1070 | HSP60 | 下调 | 397869 | 5.6/31866 | 47 |
| 1255 | HSP60 | 下调 | 397869 | 6.9/25008 | 41 |
| 542 | EF-TU | 下调 | 2494256 | 5.9/52917 | 42 |
| 627 | EF-TU | 下调 | 2494256 | 6.3/48183 | 37 |
| 768 | EF-TU | 下调 | 2494256 | 6.2/41888 | 41 |
| 1349 | Chain B, Crystal Structure of H. pylori | 下调 | 2314270 | 7.7/17905 | 52 |
选择质谱鉴定中与细菌致病性可能有关的蛋白质(HSP60、EF-TU、GGT)RT-PCR检测其mRNA的表达. 塞莱昔布(0.01 mmol/L)处理后, H. pylori EF-TU, GGT的mRNA表达水平各降低39.6%、68.4%(0.07±0.06 vs 1.01±0.16, 0.31±0.13 vs 0.98±0.01, P<0.05); H. pylori HSP60(groEL)蛋白基因mRNA表达水平增加72.9%(1.85±0.26 vs 1.07±0.27, P<0.05, 图2).
临床上服用NSAIDs的H. pylori感染者十分常见, 而NSAIDs和H. pylori共同存在时对胃黏膜的致病性作用尚不清楚. 我们前期研究发现, 体外培养条件下, 选择性COX-2抑制剂塞莱昔布可导致H. pylori形态改变, 破坏细菌胞壁完整性, 显著降低H. pylori的鞭毛动力, 并剂量依赖性地抑制H. pylori对AGS细胞的黏附. 提示在胃内微环境中, 塞莱昔布可能对H. pylori的生长及其致病性产生影响, 而细菌蛋白质表达的改变可能是其致病性改变的基础. 本研究采用2-DE技术比较塞莱昔布处理前后H. pylori全菌蛋白表达谱差异, 确定了3种致病相关蛋白质, 即HSP60、GGT及转录与翻译相关蛋白EF-TU表达发生改变, 为从蛋白质水平上明确塞莱昔布与H. pylori相互作用的致病机制奠定基础.
我们的前期研究结果显示, 0.01 mmol/L的塞莱昔布可抑制H. pylori的生长, 但不影响细菌的活菌数量[9]. 塞莱昔布发挥其解热镇痛抗炎作用时, 血药浓度为0.05 mmol/L, 口服后在胃黏膜的局部浓度可能更高, 因此, 我们推测, 在体内完全可以达到其降低H. pylori HSP60、GGT、EF-TU蛋白表达的浓度, 但仍需体内试验进一步证实. 有研究发现, 服用塞莱昔布的风湿病患者HSP60与H. pylori在人胃黏膜的黏附定植密切相关, 经抗HSP60的单克隆抗体H20处理后, H. pylori对MKN45细胞的黏附性明显降低[10]. GGT是存在于动植物体内的一种催化肽基转移作用的酶, 具有异源多聚、糖基化和跨膜等结构特征, 参与分泌和吸收过程[11,12]. 作为新发现的免疫抑制剂GGT通过诱导细胞周期停滞在G1时相抑制T淋巴细胞的增殖, 进而减弱CD4+ T淋巴细胞对H. pylori的清除作用, 从而增强H. pylori的定植[13]. 本研究发现, 塞莱昔布处理后H. pylori HSP60、GGT蛋白表达下调, 提示在胃内共同存在时, 塞莱昔布可能降低H. pylori的黏附、定植能力, 这也从蛋白质水平证实了我们之前的研究[4].
HSP60是定位于线粒体的高度保守的蛋白质, 人类的HSP60与细菌的HSP60之间有75%的同源性, 可通过交叉免疫反应刺激胃黏膜γ/δ T淋巴细胞活化而导致胃黏膜免疫损伤, 在严重的胃黏膜损害和胃黏膜萎缩的形成发展中发挥启动因子的作用[14]. HSP60通过与细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)和p38丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)[15], 相关的Toll样受体途径诱导炎性介质IL-8释放[16,17], 从而激活NF-κB[18,19], 进而引起炎症反应[20].
有研究发现, 服用NSAIDs的H. pylori感染者胃黏膜中性粒细胞浸润的数量较未服用者减少[21], NSAIDs可抑制H. pylori感染诱导的AGS细胞IL-8产生, 提示服用NSAIDs可减轻H. pylori阳性患者胃黏膜的炎症反应[22]. 我们推测, 服用NSAIDs可能通过下调HSP60的表达, 参与减弱H. pylori感染诱发的胃黏膜局部免疫反应和炎症因子释放对胃黏膜的双重损害. 本研究中, 塞莱昔布处理后, H. pylori HSP60 mRNA和蛋白质表达变化趋势不一致, 可能是翻译后修饰的存在使得塞莱昔布在基因和蛋白质水平上对HSP的表达调节不同. 细菌常见的翻译后修饰有糖基化、磷酸化和乙酰化, 糖基化涉及免疫保护、细胞生长、炎症产生等过程; 磷酸化对信号转导、神经活动、细胞增殖分化和发育等生理病理过程起重要作用[23]; 组蛋白的甲基化和乙酰化与转录调节有关[24], 各种翻译后修饰并不是孤立存在的, 他们之间相互协调、共同发挥作用. SMA(modified spectral alignment)算法及质谱技术可进一步验证发生翻译后修饰的蛋白质及其相关位点[25-27], 目前国内外未见H. pylori HSP60翻译后修饰的相关报道.
一项体内研究也发现, 服用NSAIDs 3 mo以上可逆转H. pylori诱导的胃黏膜损害[21], 另一方面, 研究发现, 服用NSAIDs可逆转H. pylori感染导致的胃黏膜上皮细胞的增殖和凋亡, 使细胞动力学趋于正常[28]. 来自动物模型和流行病学的研究均证实, COX-2上调促血管生长因子的表达, 促进新生血管的生成[29], 诱发细胞的恶性表型改变. 体内外实验发现, COX-2过表达促进胃癌的发生发展[30], COX-2抑制剂可预防胃癌的发生[31,32]. 新近研究显示, H. pylori GGT蛋白介导原发性胃癌上皮细胞和AGS胃癌细胞产生过氧化氢, 从而导致NF-κB的活化和IL-8的上调; HP-nGGT(H. pylori native GGT protein)上调8-羟基脱氧鸟苷(8-OH-dG)的表达, 从而导致DNA氧化应激损伤[33], 进而引起H. pylori感染相关的胃黏膜损害. 我们的研究显示, 塞莱昔布可降低H. pylori GGT的表达, 从而可能拮抗H. pylori感染相关的慢性炎症反应及致癌作用.
EF-TU作为转录与翻译相关蛋白, 负责tRNA向核糖体A位点的移位, 从而参与肽链的延长即核蛋白体循环, 他还可调节GTP酶的水解, 从而影响蛋白翻译的速度和效率[34]. 本研究发现, 塞莱昔布下调H. pylori EF-TU的表达, 且可能通过降低EF-TU的表达, 参与塞莱昔布下调HSP60、GGT的代谢和翻译过程, 进一步证实了HSP60、GGT蛋白质的翻译速率降低, 导致其合成量减少.
本研究的7个差异蛋白质斑点中, 编号是542、627、768的蛋白点为EF-TU, 编号1021、1070、1255的蛋白点为HSP60, 显示同一种蛋白质表现出3种不同的等电点和相对分子质量, 但等电点和相对分子质量的波动范围小, 可能是蛋白质的化学修饰或降解所致, 这种蛋白质的修饰或降解可发生在细胞内执行功能时, 也可发生在样本处理过程中, 如2-DE过程中的温度及某些蛋白质溶解试剂的影响.
总之, 体外塞莱昔布可能通过干扰H. pylori HSP60、GGT、EF-TU表达, 影响H. pylori对胃黏膜上皮细胞的黏附定植能力、炎症反应和细胞的增殖凋亡, 从而影响H. pylori感染后的致病性.
服用非甾体抗炎药(NSAIDs)的幽门螺杆菌(H. pylori)感染者在临床上常见, 二者共同存在时对胃黏膜的致病性及致病机制尚未明确.
杜奕奇, 副教授, 中国人民解放军第二军医大学长海医院消化内科
Wang等研究发现, 体外培养条件下, 阿司匹林剂量依赖性地抑制H. pylori的生长, 并提高H. pylori对抗生素的敏感性.
本研究发现塞莱昔布下调H. pylori EF-TU、GGT的mRNA表达, 上调H. pylori HSP60的mRNA表达, 下调H. pylori HSP60(groEL)、EF-TU、GGT表达量, 从而可能影响H. pylori的致病性.
本文选题恰当, 对于深入了解幽门螺杆菌和NSAIDs这两个相对的胃黏膜损伤因素之间的关系有重要意义.
编辑: 曹丽鸥 电编:何基才
| 1. | Sokić-Milutinović A, Krstić M, Popović D, Mijalković N, Djuranović S, Culafić Dj. [Role of Helicobacter pylori infection and use of NSAIDs in the etiopathogenesis of upper gastrointestinal bleeding]. Acta Chir Iugosl. 2007;54:51-62. [PubMed] [DOI] |
| 2. | Huang JQ, Sridhar S, Hunt RH. Role of Helicobacter pylori infection and non-steroidal anti-inflammatory drugs in peptic-ulcer disease: a meta-analysis. Lancet. 2002;359:14-22. [PubMed] [DOI] |
| 3. | Blauch DN. Java classes for managing chemical information and solving generalized equilibrium problems. J Chem Inf Comput Sci. 2006;42:143-146. [PubMed] [DOI] |
| 4. | Păunescu E, Mihăilescu P, Fonea M, Ciocan A, Serban G, Eliescu A, Serban S, Grigorescu C, Tiţei I, Popescu M. [Remote (2-3 years) results in patients with pulmonary tuberculosis treated in operational conditions in combination with sinerdol-EH]. Rev Ig Bacteriol Virusol Parazitol Epidemiol Pneumoftiziol Pneumoftiziol. 2010;36:137-144. [PubMed] |
| 5. | Atherton JC. The pathogenesis of Helicobacter pylori-induced gastro-duodenal diseases. Annu Rev Pathol. 2006;1:63-96. [PubMed] [DOI] |
| 6. | Tegtmeyer N, Wessler S, Backert S. Role of the cag-pathogenicity island encoded type IV secretion system in Helicobacter pylori pathogenesis. FEBS J. 2011;278:1190-1202. [PubMed] [DOI] |
| 7. | Larsson T, Bergström J, Nilsson C, Karlsson KA. Use of an affinity proteomics approach for the identification of low-abundant bacterial adhesins as applied on the Lewis(b)-binding adhesin of Helicobacter pylori. FEBS Lett. 2000;469:155-158. [PubMed] [DOI] |
| 8. | Enroth H, Akerlund T, Sillén A, Engstrand L. Clustering of clinical strains of Helicobacter pylori analyzed by two-dimensional gel electrophoresis. Clin Diagn Lab Immunol. 2000;7:301-306. [PubMed] |
| 10. | Yamaguchi H, Osaki T, Taguchi H, Hanawa T, Yamamoto T, Kamiya S. Relationship between expression of HSP60, urease activity, production of vacuolating toxin, and adherence activity of Helicobacter pylori. J Gastroenterol. 1998;33 Suppl 10:6-9. [PubMed] |
| 11. | del Bello B, Paolicchi A, Comporti M, Pompella A, Maellaro E. Hydrogen peroxide produced during gamma-glutamyl transpeptidase activity is involved in prevention of apoptosis and maintainance of proliferation in U937 cells. FASEB J. 1999;13:69-79. [PubMed] |
| 12. | Barnes IH, Bagnall MC, Browning DD, Thompson SA, Manning G, Newell DG. Gamma-glutamyl transpeptidase has a role in the persistent colonization of the avian gut by Campylobacter jejuni. Microb Pathog. 2007;43:198-207. [PubMed] [DOI] |
| 13. | Schmees C, Prinz C, Treptau T, Rad R, Hengst L, Voland P, Bauer S, Brenner L, Schmid RM, Gerhard M. Inhibition of T-cell proliferation by Helicobacter pylori gamma-glutamyl transpeptidase. Gastroenterology. 2007;132:1820-1833. [PubMed] [DOI] |
| 14. | Engstrand L, Gustavsson S, Schwan A, Scheynius A. Local and systemic immune response in Helicobacter pylori-associated chronic gastritis before and after treatment. Scand J Gastroenterol. 1993;28:1105-1111. [PubMed] [DOI] |
| 15. | Basak C, Pathak SK, Bhattacharyya A, Mandal D, Pathak S, Kundu M. NF-kappaB- and C/EBPbeta-driven interleukin-1beta gene expression and PAK1-mediated caspase-1 activation play essential roles in interleukin-1beta release from Helicobacter pylori lipopolysaccharide-stimulated macrophages. J Biol Chem. 2005;280:4279-4288. [PubMed] [DOI] |
| 16. | Yamamoto M, Takeda K. Current views of toll-like receptor signaling pathways. Gastroenterol Res Pract. 2010;2010:240365. [PubMed] |
| 17. | Tahara T, Arisawa T, Shibata T, Hirata I, Nakano H. Absence of Common Polymorphisms of Toll Like Receptor 4 (TLR4): Asp299Gly, Thr399Ile in Patients with Gastroduodenal Diseases in Japan. J Clin Biochem Nutr. 2007;40:62-65. [PubMed] [DOI] |
| 18. | Tanigawa T, Watanabe T, Higuchi K, Machida H, Okazaki H, Yamagami H, Watanabe K, Tominaga K, Fujiwara Y, Oshitani N. Lansoprazole, a Proton Pump Inhibitor, Suppresses Production of Tumor Necrosis Factor-alpha and Interleukin-1beta Induced by Lipopolysaccharide and Helicobacter Pylori Bacterial Components in Human Monocytic Cells via Inhibition of Activation of Nuclear Factor-kappaB and Extracellular Signal-Regulated Kinase. J Clin Biochem Nutr. 2009;45:86-92. [PubMed] [DOI] |
| 19. | Luo Y, Pollard JW, Casadevall A. Fcgamma receptor cross-linking stimulates cell proliferation of macrophages via the ERK pathway. J Biol Chem. 2010;285:4232-4242. [PubMed] [DOI] |
| 20. | Zhao Y, Yokota K, Ayada K, Yamamoto Y, Okada T, Shen L, Oguma K. Helicobacter pylori heat-shock protein 60 induces interleukin-8 via a Toll-like receptor (TLR)2 and mitogen-activated protein (MAP) kinase pathway in human monocytes. J Med Microbiol. 2007;56:154-164. [PubMed] [DOI] |
| 21. | Zhang LJ, Wang SY, Huo XH, Zhu ZL, Chu JK, Ma JC, Cui DS, Gu P, Zhao ZR, Wang MW. Anti-Helicobacter pylori therapy followed by celecoxib on progression of gastric precancerous lesions. World J Gastroenterol. 2009;15:2731-2738. [PubMed] [DOI] |
| 22. | Leung AM, Redlak MJ, Miller TA. Aspirin-induced mucosal cell death in human gastric cells: role of a caspase-independent mechanism. Dig Dis Sci. 2009;54:28-35. [PubMed] [DOI] |
| 23. | Huang CH, Wang YT, Tsai CF, Chen YJ, Lee JS, Chiou SH. Phosphoproteomics characterization of novel phosphorylated sites of lens proteins from normal and cataractous human eye lenses. Mol Vis. 2011;17:186-198. [PubMed] |
| 24. | Xiong L, Wang Y. Mapping Post-translational Modifications of Histones H2A, H2B and H4 in Schizosaccharomyces pombe. Int J Mass Spectrom. 2011;301:159-165. [PubMed] [DOI] |
| 25. | Pless O, Kowenz-Leutz E, Dittmar G, Leutz A. A differential proteome screening system for post-translational modification-dependent transcription factor interactions. Nat Protoc. 2011;6:359-364. [PubMed] [DOI] |
| 26. | Chung C, Liu J, Emili A, Frey BJ. Computational refinement of post-translational modifications predicted from tandem mass spectrometry. Bioinformatics. 2011;27:797-806. [PubMed] [DOI] |
| 27. | Viner RI, Zhang T, Second T, Zabrouskov V. Quantification of post-translationally modified peptides of bovine alpha-crystallin using tandem mass tags and electron transfer dissociation. J Proteomics. 2009;72:874-885. [PubMed] [DOI] |
| 28. | Tanigawa T, Watanabe T, Higuchi K, Tominaga K, Fujiwara Y, Oshitani N, Tarnawski AS, Arakawa T. Long-term use of nonsteroidal anti-inflammatory drugs normalizes the kinetics of gastric epithelial cells in patients with Helicobacter pylori infection via attenuation of gastric mucosal inflammation. J Gastroenterol. 2009;44 Suppl 19:8-17. [PubMed] [DOI] |
| 29. | Wu K, Nie Y, Guo C, Chen Y, Ding J, Fan D. Molecular basis of therapeutic approaches to gastric cancer. J Gastroenterol Hepatol. 2009;24:37-41. [PubMed] [DOI] |
| 30. | Mrena J, Wiksten JP, Kokkola A, Nordling S, Ristimäki A, Haglund C. COX-2 is associated with proliferation and apoptosis markers and serves as an independent prognostic factor in gastric cancer. Tumour Biol. 2010;31:1-7. [PubMed] [DOI] |
| 31. | Chakraborti AK, Garg SK, Kumar R, Motiwala HF, Jadhavar PS. Progress in COX-2 inhibitors: a journey so far. Curr Med Chem. 2010;17:1563-1593. [PubMed] [DOI] |
| 32. | Wang WH, Huang JQ, Zheng GF, Lam SK, Karlberg J, Wong BC. Non-steroidal anti-inflammatory drug use and the risk of gastric cancer: a systematic review and meta-analysis. J Natl Cancer Inst. 2003;95:1784-1791. [PubMed] |
| 33. | Gong M, Ling SS, Lui SY, Yeoh KG, Ho B. Helicobacter pylori gamma-glutamyl transpeptidase is a pathogenic factor in the development of peptic ulcer disease. Gastroenterology. 2010;139:564-573. [PubMed] [DOI] |
| 34. | Krab IM, Parmeggiani A. EF-Tu, a GTPase odyssey. Biochim Biophys Acta. 1998;1443:1-22. [PubMed] |