修回日期: 2011-04-14
接受日期: 2011-05-05
在线出版日期: 2011-06-18
目的: 研究鸡尾酒疗法对大鼠肝星状细胞(HSC)的纤维化相关基因表达及蛋白谱的变化, 探讨鸡尾酒疗法抗肝纤维化作用的机制.
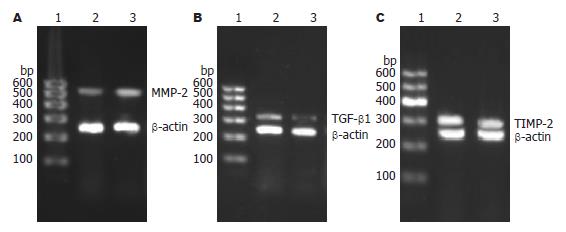
方法: 鸡尾酒作用大鼠HSC-T6细胞株后, 采用半定量RT-PCR法检测细胞中TGF-β1、MMP-2和TIMP-2的mRNA表达水平. 应用SELDI-TOF-MS技术分析HSC-T6细胞蛋白图谱的变化.
结果: HSC-T6细胞经鸡尾酒作用后, 与对照组相比MMP-2 mRNA表达水平明显增强(0.094±0.051 vs 0.023±0.056, P<0.05); TGF-β1和TIMP-2 mRNA表达水平明显降低(0.301±0.025 vs 0.503±0.042; 0.719±0.03 vs 1.204±0.418, 均P<0.05); 鸡尾酒作用后, 表达差异2倍以上的蛋白有35个, 包括32个表达上调的蛋白, 3个表达下调的蛋白.
结论: 鸡尾酒疗法的抗肝纤维化作用可能是通过调节相关基因和蛋白的表达变化来实现.
引文著录: 廖明, 莫财锋, 周怡, 何敏, 卓朗. 鸡尾酒疗法对大鼠肝星状细胞的纤维化相关基因表达和蛋白谱的影响. 世界华人消化杂志 2011; 19(17): 1780-1784
Revised: April 14, 2011
Accepted: May 5, 2011
Published online: June 18, 2011
AIM: To investigate changes in the expression of fibrosis-related genes and proteomic expression profile in rat hepatic stellate cells (HSCs) exposed to the cocktail to explore potential anti-hepatic fibrosis mechanisms of the cocktail therapy.
METHODS: After HSCs were cultured in vitro and exposed to the cocktail for 24 h, the expression of TGF-β1, MMP-2 and TIMP-2 mRNAs and proteomic expression profile were measured by RT-PCR and SELDI-TOF-MS, respectively.
RESULTS: Compared to control cells, the expression level of MMP-2 mRNA significantly increased (0.094 ± 0.051 vs 0.023 ± 0.056, P < 0.05), and those of TGF-β1 and TIMP-2 mRNAs significantly decreased (0.301 ± 0.025 vs 0.503 ± 0.042; 0.719 ± 0.03 vs 1.204 ± 0.418, both P < 0.05) in HSCs exposed to the cocktail. A total of 176 differential proteins were identified between control cells and treated cells, of which 32 were up-regulated and 3 down-regulated.
CONCLUSION: The cocktail therapy exerts anti-hepatic fibrosis activity possibly by regulating the expression of related genes and proteins.
- Citation: Liao M, Mo CF, Zhou Y, He M, Zhuo L. Alterations in fibrosis-related gene expression and proteomic expression profile in rat hepatic stellate cells exposed to the cocktail. Shijie Huaren Xiaohua Zazhi 2011; 19(17): 1780-1784
- URL: https://www.wjgnet.com/1009-3079/full/v19/i17/1780.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i17.1780
迄今为止, 对肝纤维化的治疗尚缺乏理想的治疗方案. 多年来针对肝纤维化的药物治疗在众多离体和动物模型实验中显示了一定的疗效, 主要包括抑制肝星状细胞(hepatic stellate cell, HSC)的药物如干扰素[1], 作用于细胞外基质(extracellular matrix, ECM)和细胞因子的药物[2-6]、抗氧化剂[7]、抗炎制剂[8]等. 但令众多学者困惑的是几乎所有的抗肝纤维化药物在动物模型有效而临床无效或效果很差, 这严重限制了抗肝纤维化药物的临床应用和治疗效果[9,10]. 肝纤维化是一系列复杂的多因素过程, 许多药物由于抗肝纤维化作用靶位单一导致疗效并不理想, 而有些药物不良反应大于治疗作用, 不宜用于临床[11,12]. 因此, 将作用于肝纤维化发生发展不同环节、靶点的药物联合应用即鸡尾酒疗法(Cocktail), 以阻断肝纤维化发展, 达到保护肝脏的目的, 可能是抗肝纤维化药物研究的新方向.
我们前期的研究结果表明, 牛磺酸(taurine)、表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate, EGCG)和三羟基异黄酮(genistein)三者联合应用的鸡尾酒疗法具有抗大鼠肝纤维化的作用[13,14]. 本实验的目的是采用RT-PCR法分析鸡尾酒疗法对肝星状细胞株HSC-T6肝纤维化相关基因转化生长因子β1(transforming growth factor-beta 1, TGF-β1)、基质金属蛋白酶2(matrix metalloproteinase-2, MMP-2)和组织金属蛋白酶抑制因子2(tissue inhibitor of metalloproteinase-2, TIMP-2)表达的影响, 并利用SELDI-TOF-MS技术分析HSC-T6蛋白谱的变化, 以进一步探讨鸡尾酒疗法抗肝纤维化的机制.
肝星状细胞系为HSC-T6, 为SV40转染SD大鼠HSC, 为永生化细胞, 表型为活化的HSC, 具纤维化特性. 细胞由广西医科大学姜海行教授馈赠. EGCG(四川乐山禹伽茶业科技开发有限公司); DMEM(Gibco); 胎牛血清(Hyclone); TRIzol(Invitrogen); 逆转录试剂盒(Fermentas); taurine、genistein、二硫苏糖醇(DTT)、超纯尿素(Urea)、甘氨酸、三羟甲基氨基甲烷(Tris)、3-[(3-胆酰胺丙基)-二乙胺]-1-丙磺酸(CHAPS)、十二烷基磺酸钠(SDS)、硫脲、三正丁基磷(TBP)、pH3-10两性电解质、抑肽酶(Apotinin)、乙腈(Acetonitrile, ACN)、无水醋酸钠(NaAc)、三氟乙酸(TFA)、羟乙基哌嗪乙磺酸(HEPES)、pH7.4磷酸盐缓冲液(PBS)、HPLC水、88%磷酸、950 mL/L乙醇均购于美国Sigma公司. 2×PCR mix(TaKaRa). CO2培养箱(美国Thermo); 高速冷冻离心机(美国Thermo); 相差倒置显微镜(德国Zeiss); PCR仪(美国Bio-Rad); 核酸蛋白测定仪(日本岛津); 凝胶成像分析系统(美国Bio-Rad); 低压电泳仪(美国Bio-Rad); 蛋白芯片飞行时间质谱仪(Ciphergen公司), 蛋白质芯片CM10(Bio-Rad公司) .
1.2.1 细胞培养: 将冷冻保存于超低温冰箱中的HSC-T6复苏后接种于含100 mL/L胎牛血清的高糖DMEM培养液中, 37 ℃、50 mL/L CO2条件下培养. 当细胞呈单层致密状时, 2.5 g/L胰蛋白酶消化后传代. 每次实验均在呈指数生长的细胞种进行.
1.2.2 分组: 分为对照组和鸡尾酒组(taurine 60 mg/L+EGCG 70 mg/L+genistein 14 mg/L), 剂量参见文献廖明等[9].
1.2.3 RT-PCR法检测TGF-β1、MMP-2及TIMP-2 mRNA的表达: 将细胞以5×107/L接种于50 mL培养瓶中, 分为对照组和鸡尾酒组, 培养12 h后, 鸡尾酒组换鸡尾酒培养液继续培养24 h. 采用TRIzol法抽提细胞中总RNA. 用核酸蛋白测定仪测定RNA含量及纯度, 保证A260/A280 = 1.8-2.0. 取RNA 5 μg, 采用M-MuLV逆转录酶将其逆转录成cDNA. 根据NCBI的GenBank基因序列自行设计引物, 引物序列为: β-actin: FP: 5'-AACCCTAAGGCCAACCGTGAAAAG-3', RP': 5'-TCATGAGGTAGTCTGTCAGGT-3', 产物长度: 240 bp; TGF-β1: FP: 5'-ATGGTGGACCGCAACAAC-3', RP: 5'-TGAGCACTGAAGCGAAAGC-3', 产物长度: 329 bp; MMP-2: FP: 5'-TGGAAGCATCAAATCGGACTG-3', RP: 5'-GCAAAGGGCAAACAAAGCA-3', 产物长度: 527 bp; TIMP-2: FP: 5'-CCAAAGCAGTGAGCGAGAA-3', RP: 5'-TCCCAGGGCACAATAAAG TC-3', 产物长度: 262 bp; PCR扩增cDNA, 条件为: 94 ℃预变性5 min, 94 ℃变性30 s, 各自退火温度(MMP-2为55 ℃; TIMP-2、TGF-β1为52 ℃)30 s, 72 ℃延伸30 s, 72 ℃延伸10 min, 总共30个循环; 所有PCR产物在20 g/L琼脂糖凝胶上电泳后, 用凝胶成像系统拍照, Quantity One软件测定灰度值, 灰度值以各产物与β-actin的积分吸光度(A)的比值表示.
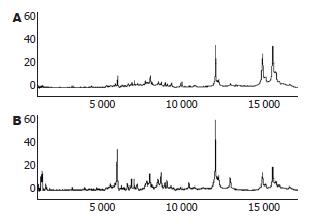
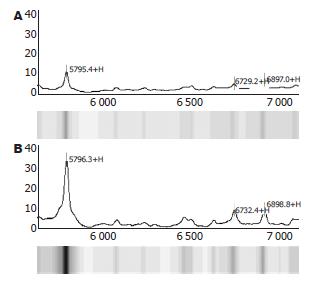
1.2.4 SELDI-TOF-MS分析: 收集培养的细胞, 经超声波破碎, 加入加裂解液裂解, 用快速混匀器混合5 s×2次, 冰上静置30 min, 12 000 r/min 4 ℃离心60 min, 取少量上清用测定总蛋白浓度,其余上清液分装冻存于-80 ℃备用.
将30 μL上述样品加入90 μL CM10 Buffer, 取100 μL加入芯片的每个孔中; 置于振荡器上以200 r/min室温孵育60 min后甩出溶液, 每孔加200 μL CM10缓冲液, 振荡孵育5 min 2次, 最后芯片用20 mmol/L HEPES(pH7.4)淋洗, 晾干芯片. 芯片每孔分2次加SPA 0.5 μL, 2次之间自然晾干.
质谱仪参数设定为激光强度220, 灵敏度8, 优化范围800-20 000质荷比(m/z). 每条芯片取1点用同一正常人血清作内参照, 芯片间CV≤10%. 检测前用ALLINONE多肽标准芯片校正, 系统质量偏差≤0.1%. 原始数据以Proteinchip 3.0软件校正.
统计学处理 基因表达的统计分析: 应用SPSS13.0软件进行统计分析, 数据均以mean±SD表示, 组间比较采用t检验, P<0.05表示存在统计学意义. 蛋白表达的统计分析: 采用Ciphergen Protein Chip软件和Biomarker Wizard软件对芯片检测得到的蛋白质相对含量及蛋白质质荷比数据按数据挖掘要求进行处理, 用Biomarker Wizard Software3.1软件和Biomarker Patterns Software 4.0.1软件对数据进行相关性分析, 比较两组之间蛋白质峰强度时, P<0.05具有统计学意义.
与对照组比较, 鸡尾酒组的MMP-2 mRNA表达明显升高, 差别有统计学意义(0.094±0.051 vs 0.023±0.056, P<0.05); 而TGF-β1和TIMP-2 mRNA表达明显降低, 差别有统计学意义(0.301±0.025 vs 0.503±0.042; 0.719±0.03 vs 1.204±0.418, P<0.05, 图1).
目前认为ECM的过度增多和异常沉积是肝纤维化发生的主要机制[15-17]. 在正常肝脏组织中存在着ECM的合成与降解的动态平衡. 肝纤维化时纤维结缔组织的形成, 是由于各种不同致病因子导致ECM合成与降解的失衡所致. 多项研究表明, TGF-β1是强有力的致纤维化细胞因子[18-20], 在肝纤维化中表达明显增多, 可促进HSC的增殖和活化, 使ECM合成增多, 降解减少, 并存在正反馈放大效应, 促进肝纤维化的进程[21-25]. 在我们的研究当中, 鸡尾酒干预HSC-T6后, 与对照组比较, TGF-β1的mRNA表达量明显降低, 具有统计学意义, 我们推断鸡尾酒可能是通过抑制TGF-β1的表达而发挥抗肝纤维化的作用.
MMPs是ECM降解的主要酶系, 而其TIMPs通过抑制MMPs, 阻止ECM的降解, 从而形成或促进肝纤维化[26-28]. MMP-2初次发现于小鼠转移性肿瘤细胞和兔骨细胞的培养过程中. 较多的研究认为MMP-2在纤维化阶段升高, 而在肝硬化和肝纤维化恢复期逐渐降低[29-31]. 朱跃科等[32]研究发现, 在肝纤维化的形成过程中MMP-2的基因表达、蛋白表达及酶活性均增高. MMP-2的表达与酶活性在肝纤维化逆转过程逐渐降低, 说明MMP-2与肝纤维化的发生发展密切相关, 而TIMP-2在肝纤维化发展过程中表达增强, MMP-2/TIMP-2的比值下降. 在原代培养的HSC早期, TIMP-2不表达, HSC激活后TIMP-2表达增加. 卢明芹等研究发现, 丹酚酸B盐可通过抑制TGF-β1和TIMP-2表达而促进肝纤维化的逆转[33]. 张亚飞等[34]的研究发s现通过抑制TIMP-2的表达, 可间接增强MMP-2的活性, 降低Ⅳ胶原在肝纤维化中的沉积, 减缓肝纤维化的发展. 临床研究发现, 未经干扰素治疗的慢性丙型肝炎患者血清中的TIMP-2水平在6 mo后显著升高, 而经干扰素治疗6 mo后血清中的TIMP-2水平无明显变化[35]. 而且, 在肝硬化及原发性肝癌未转移患者血清中TIMP-2的水平也明显升高[36]. 在用鸡尾酒干扰HSC-T6后, 我们采用RT-PCR法检测MMP-2和TIMP-2的mRNA表达, 结果发现, 与对照相比MMP-2的表达量明显增多, 而TIMP-2表达下降. 因此我们推测鸡尾酒可能是通过抑制调节MMP-2/TIMP-2的表达, 而发挥抗纤维化的作用.
肝脏是主要的蛋白质合成器官, 对肝脏组织蛋白的SELDI-TOF-MS研究可获悉鸡尾酒作用的作用靶点, 发现用于诊断的标志蛋白, 进而探索其作用机制. 本实验采用SELDI-TOF-MS技术研究鸡尾酒作用后HSC-T6后蛋白谱的变化, 发现HSC-T6的蛋白谱发生了明显的改变, 有32个蛋白上调2倍以上, 有3个蛋白下调2倍以上. 推测鸡尾酒疗法可能通过这些蛋白表达的变化, 从而达到抗肝纤维化的作用.
迄今为止, 对肝纤维化的治疗尚缺乏理想的治疗方案. 因为肝纤维化是一系列复杂的多因素过程, 许多药物由于抗肝纤维化作用靶位单一导致疗效并不理想, 而有些药物不良反应大于治疗作用, 不宜用于临床. 因此, 将作用于肝纤维化发生发展不同环节、靶点的药物联合应用即鸡尾酒疗法以阻断肝纤维化发展, 达到保护肝脏的目的, 可能是抗肝纤维化药物研究的新方向.
高润平, 教授, 吉林大学第一医院肝病科
戚合德等发现安络化纤丸联合恩替卡韦用药更有利于阻断或逆转肝纤维化的形成和发展; 曾佑祥等在采用阿米洛利联合苦参素预防大鼠肝纤维化的研究发现, 两者联用有一定的协同作用.
本文在前期研究工作的基础上, 采用RT-PCR法检测鸡尾酒作用大鼠肝星状细胞株HSC-T6后TGF-β1、MMP- 2和TIMP-2的mRNA表达水平, 利用SELDI-TOF-MS技术分析HSC-T6细胞全蛋白图谱的变化, 进一步探讨鸡尾酒疗法的抗肝纤维化作用的机制.
本研究探讨了鸡尾酒疗法对HSC的TGF-β1、MMP-2和TIMP-2的mRNA表达的影响和全蛋白图谱的变化, 为下一步的鸡尾酒疗法的临床前研究奠定基础.
本文科学性和可读性较好, 为研究三者联合应用对肝星状细胞介导肝纤维化的抑制作用奠定实验基础.
编辑: 李薇 电编:何基才
| 1. | Weng H, Mertens PR, Gressner AM, Dooley S. IFN-gamma abrogates profibrogenic TGF-beta signaling in liver by targeting expression of inhibitory and receptor Smads. J Hepatol. 2007;46:295-303. [PubMed] [DOI] |
| 2. | Son G, Iimuro Y, Seki E, Hirano T, Kaneda Y, Fujimoto J. Selective inactivation of NF-kappaB in the liver using NF-kappaB decoy suppresses CCl4-induced liver injury and fibrosis. Am J Physiol Gastrointest Liver Physiol. 2007;293:G631-G639. [PubMed] [DOI] |
| 3. | Seki E, Brenner DA. Toll-like receptors and adaptor molecules in liver disease: update. Hepatology. 2008;48:322-335. [PubMed] [DOI] |
| 4. | Iimuro Y, Brenner DA. Matrix metalloproteinase gene delivery for liver fibrosis. Pharm Res. 2008;25:249-258. [PubMed] [DOI] |
| 5. | Dooley S, Hamzavi J, Ciuclan L, Godoy P, Ilkavets I, Ehnert S, Ueberham E, Gebhardt R, Kanzler S, Geier A. Hepatocyte-specific Smad7 expression attenuates TGF-beta-mediated fibrogenesis and protects against liver damage. Gastroenterology. 2008;135:642-659. [PubMed] [DOI] |
| 6. | Inagaki Y, Higashi K, Kushida M, Hong YY, Nakao S, Higashiyama R, Moro T, Itoh J, Mikami T, Kimura T. Hepatocyte growth factor suppresses profibrogenic signal transduction via nuclear export of Smad3 with galectin-7. Gastroenterology. 2008;134:1180-1190. [PubMed] [DOI] |
| 7. | Comporti M, Signorini C, Arezzini B, Vecchio D, Monaco B, Gardi C. Isoprostanes and hepatic fibrosis. Mol Aspects Med. 2008;29:43-49. [PubMed] [DOI] |
| 8. | Dumont JM, Maignan MF, Janin B, Herbage D, Perrissoud D. Effect of malotilate on chronic liver injury induced by carbon tetrachloride in the rat. J Hepatol. 1986;3:260-268. [PubMed] [DOI] |
| 9. | Bataller R, Brenner DA. Liver fibrosis. J Clin Invest. 2005;115:209-218. [PubMed] |
| 10. | Friedman SL. Mechanisms of hepatic fibrogenesis. Gastroenterology. 2008;134:1655-1669. [PubMed] [DOI] |
| 11. | George J, Roulot D, Koteliansky VE, Bissell DM. In vivo inhibition of rat stellate cell activation by soluble transforming growth factor beta type II receptor: a potential new therapy for hepatic fibrosis. Proc Natl Acad Sci U S A. 1999;96:12719-12724. [PubMed] [DOI] |
| 12. | Préaux AM, Mallat A, Rosenbaum J, Zafrani ES, Mavier P. Pentoxifylline inhibits growth and collagen synthesis of cultured human hepatic myofibroblast-like cells. Hepatology. 1997;26:315-322. [PubMed] [DOI] |
| 14. | 廖 明, 林 兴, 陈 兆霓, 李 彦, 卓 朗. 鸡尾酒疗法对肝纤维化大鼠肝组织中TGF-β1、COLⅠ及COLⅢ表达的影响. 世界华人消化杂志. 2010;18:1867-1872. [DOI] |
| 15. | Giannelli G, Antonaci S. Immunological and molecular aspects of liver fibrosis in chronic hepatitis C virus infection. Histol Histopathol. 2005;20:939-944. [PubMed] |
| 16. | Friedman SL. Mechanisms of disease: Mechanisms of hepatic fibrosis and therapeutic implications. Nat Clin Pract Gastroenterol Hepatol. 2004;1:98-105. [PubMed] |
| 17. | Tsukada S, Parsons CJ, Rippe RA. Mechanisms of liver fibrosis. Clin Chim Acta. 2006;364:33-60. [PubMed] [DOI] |
| 18. | Dooley S, Delvoux B, Lahme B, Mangasser-Stephan K, Gressner AM. Modulation of transforming growth factor beta response and signaling during transdifferentiation of rat hepatic stellate cells to myofibroblasts. Hepatology. 2000;31:1094-1106. [PubMed] [DOI] |
| 19. | Nakamura T, Ueno T, Sakamoto M, Sakata R, Torimura T, Hashimoto O, Ueno H, Sata M. Suppression of transforming growth factor-beta results in upregulation of transcription of regeneration factors after chronic liver injury. J Hepatol. 2004;41:974-982. [PubMed] [DOI] |
| 20. | 廖 丹, 罗 光汉, 吴 继周, 江 建宁, 黄 钰全. TGF-β1和smad4mRNA在慢性肝炎、肝硬化、肝癌癌旁组织的表达及意义. 世界华人消化杂志. 2004;11:2091-2094. [DOI] |
| 21. | Gressner AM, Weiskirchen R, Breitkopf K, Dooley S. Roles of TGF-beta in hepatic fibrosis. Front Biosci. 2002;7:d793-d807. [PubMed] [DOI] |
| 22. | Sanderson N, Factor V, Nagy P, Kopp J, Kondaiah P, Wakefield L, Roberts AB, Sporn MB, Thorgeirsson SS. Hepatic expression of mature transforming growth factor beta 1 in transgenic mice results in multiple tissue lesions. Proc Natl Acad Sci U S A. 1995;92:2572-2576. [PubMed] [DOI] |
| 23. | Kanzler S, Lohse AW, Keil A, Henninger J, Dienes HP, Schirmacher P, Rose-John S, zum Büschenfelde KH, Blessing M. TGF-beta1 in liver fibrosis: an inducible transgenic mouse model to study liver fibrogenesis. Am J Physiol. 1999;276:G1059-G1068. [PubMed] |
| 24. | Schnur J, Oláh J, Szepesi A, Nagy P, Thorgeirsson SS. Thioacetamide-induced hepatic fibrosis in transforming growth factor beta-1 transgenic mice. Eur J Gastroenterol Hepatol. 2004;16:127-133. [PubMed] [DOI] |
| 27. | Albanis E, Friedman SL. Hepatic fibrosis. Pathogenesis and principles of therapy. Clin Liver Dis. 2001;5:315-334, v-vi. [PubMed] [DOI] |
| 28. | Safadi R, Friedman SL. Hepatic fibrosis--role of hepatic stellate cell activation. MedGenMed. 2002;4:27. [PubMed] |
| 30. | 崔 红燕. 基质金属蛋白酶与肝纤维化的研究进展. 国外医学·消化系疾病分册. 2003;23:37-40. |
| 31. | Jia JD, Bauer M, Cho JJ, Ruehl M, Milani S, Boigk G, Riecken EO, Schuppan D. Antifibrotic effect of silymarin in rat secondary biliary fibrosis is mediated by downregulation of procollagen alpha1(I) and TIMP-1. J Hepatol. 2001;35:392-398. [PubMed] [DOI] |
| 34. | 张 亚飞, 聂 青和, 谢 玉梅, 邵 彬, 苟 艳子, 周 永兴. 抑制金属蛋白酶组织抑制因子-2在肝组织中的表达对大鼠肝纤维化发展的影响. 中华肝脏病杂志. 2006;14:138-140. |
| 35. | Ninomiya T, Yoon S, Nagano H, Kumon Y, Seo Y, Kasuga M, Yano Y, Nakaji M, Hayashi Y. Significance of serum matrix metalloproteinases and their inhibitors on the antifibrogenetic effect of interferon-alfa in chronic hepatitis C patients. Intervirology. 2001;44:227-231. [PubMed] [DOI] |
| 36. | Giannelli G, Bergamini C, Marinosci F, Fransvea E, Quaranta M, Lupo L, Schiraldi O, Antonaci S. Clinical role of MMP-2/TIMP-2 imbalance in hepatocellular carcinoma. Int J Cancer. 2002;97:425-431. [PubMed] [DOI] |