修回日期: 2011-05-21
接受日期: 2011-06-02
在线出版日期: 2011-06-18
目的: 探讨H. pylori刺激人胃癌细胞BGC-823后, 对细胞形态以及凋亡抑制基因Survivin和凋亡基因caspase-3 mRNA表达的影响.
方法: 分别用东亚型H. pylori菌株和西方型H. pylori菌株超声提取物, 刺激胃癌细胞BGC-823, 显微镜下直接观察细胞形态的变化. 同时利用荧光定量聚合酶链反应(QRT-PCR)检测胃癌细胞BGC-823凋亡抑制基因Survivin和凋亡基因caspase-3 mRNA的表达水平.
结果: H. pylori刺激胃癌细胞BGC-823后12 h, 出现蜂鸟表型, 呈时间依赖性, 24 h最明显, 东亚型组与西方型组相比, 引起的细胞蜂鸟表型百分率明显增加(29.3%±2.1% vs 8.0%±2.0%, F = 164.73, P<0.05). H. pylori超声提取液刺激胃癌细胞BGC-823后, 在东亚型组和西方型组均出现凋亡抑制基因Survivin mRNA的表达量明显上调, 与对照组相比caspase-3 mRNA的表达量明显下降(P<0.05); 并且东亚型组Survivin mRNA的表达的上调以及caspase-3 mRNA的表达较西方型组均明显下降(P<0.05).
结论: H. pylori超声提取液可诱导胃癌细胞BGC-823发生形态学改变, 并且引起凋亡抑制基因Survivin mRNA表达上调、凋亡基因caspase-3 mRNA表达下降. 东西方型H. pylori菌株之间存在生物活性的差异.
引文著录: 吴莺, 李翔, 周红, 范钰, 张尤历, 沈琰, 何亚龙. 幽门螺杆菌对胃癌细胞BGC-823形态及凋亡相关基因表达的影响. 世界华人消化杂志 2011; 19(17): 1767-1772
Revised: May 21, 2011
Accepted: June 2, 2011
Published online: June 18, 2011
AIM: To investigate the effect of H. pylori extract on cellular morphology and apoptosis-related gene expression in human gastric cancer BGC-823 cells.
METHODS: After BGC-823 cells were treated with ultrasonic extract of the east Asia type or the Western type of H. pylori strain, the changes in cellular morphology were observed by microscopy, and the expression of survivin and caspase-3 mRNAs was detected by fluorescent quantitative polymerase chain reaction (QRT-PCR). The possible correlation between the expression of survivin mRNA and that of caspase-3 mRNA was also analyzed.
RESULTS: Hummingbird phenotype was observed in BGC-823 cells 12 h after stimulation H. pylori extract, which was most obvious at 24 h. The percentage of cells showing hummingbird phenotype was significantly higher in cells treated with the extract of the east Asia type than in those treated with the extract of the Western type (29.3 ± 2.1 vs 8.0 ± 2.0, F = 164.73, P < 0.05). The expression of survivin mRNA was significantly higher and that of caspase-3 mRNA was significantly lower in BGC-823 cells treated with H. pylori extract than in control cells (both P < 0.05). Statistical difference was also noted in the expression of survivin and caspase-3 mRNAs between cells treated with the extract of the east Asia type group and those with the extract of the Western type group.
CONCLUSION: H. pylori extract could induce changes in cellular morphology and expression of survivin and caspase-3 mRNAs in human gastric cancer BGC-823 cells. The extract of the east Asia type of H. pylori has more potent biological activity than that of the Western type.
- Citation: Wu Y, Li X, Zhou H, Fan Y, Zhang YL, Shen Y, He YL. Effect of H. pylori extract on cellular morphology and apoptosis-related gene expression in human gastric cancer BGC-823 cells. Shijie Huaren Xiaohua Zazhi 2011; 19(17): 1767-1772
- URL: https://www.wjgnet.com/1009-3079/full/v19/i17/1767.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i17.1767
幽门螺杆菌(Helicobacter pylori, H. pylori)感染, 增加了胃癌发生的危险性, 主要指远端胃腺癌, 而贲门癌或称近端胃癌与H. pylori感染的关系不大. H. pylori感染的临床结果, 与H. pylori的菌株毒力差异、环境因素及宿主因素相关. H. pylori分为cagA基因阳性菌株和cagA基因阴性菌株, 研究显示[1-6], CagA阳性菌株感染具有更强毒力和胃癌生成的危险性. cagA基因阳性菌株感染与癌前病变及远端胃癌的生成关系更密切. 对H. pylori感染个体以及体外细胞学的研究显示[7-12], H. pylori影响了细胞的凋亡和增殖, 并最终引起癌变. 本研究用cagA基因阳性H. pylori超声提取液刺激胃癌上皮细胞BGC-823, 观察细胞形态学的改变以及对凋亡抑制基因Survivin和凋亡基因caspase-3 mRNA表达的影响, 探讨其可能的分子机制.
H. pylori固体培养基、微需氧环境发生袋、选择性抗生素及厌氧培养罐购自德国Merck公司. 小牛血清为兰州民海生物工程有限公司产品, 无菌羊全血为金坛欣迪公司产品. H. pylori W24菌株由江苏大学附属医院消化科保存, 分离自江苏大学附属医院的胃病患者(1例十二指肠球部溃疡的患者, cagA基因阳性), 并经测序, 确定其基因型为东亚型; 国际标准菌株11637(cagA基因阳性)由江苏大学附属医院实验室保存, 据其公布的基因序列定为西方型(其核酸序列GenBank接受号: AB015416; 蛋白序列GenBank接受号: BAB20926.1)[13].
1.2.1 H. pylori培养及菌体提取物的制备: 将冻存的H. pylori菌接种于哥伦比亚固体琼脂培养基, 加入100 mL/L的新鲜羊血, 在微需氧环境, 37 ℃下培养, 72 h后收集细菌, 经鉴定为H. pylori菌株, 然后将生长良好的H. pylori刮下后用PBS漂洗两遍, 然后将之悬于不含血清的DMEM培养液中, 菌体悬液经超声裂解(100 W, 30 s, 10次, 间隔20 s, 冰浴冷却, 低温离心, 12 000 r/min, 4 ℃), 10 min后, 取上清, -20 ℃保存备用.
1.2.2 细胞培养: 人胃癌上皮细胞株BGC-823由江苏大学生命科学院提供, 含100 mL/L新生小牛血清的DMEM培养基, 于37 ℃、50 mL/L CO2温箱中培养, 2-3 d更换培养基, 待细胞铺满底后, 用2.5 g/L的胰酶消化成单个细胞, 继续培养, 取对数生长期细胞进行实验. BGC-823人胃癌上皮细胞, 为人低分化胃癌细胞, 建自1例62岁的胃癌患者. 3个连续的实验结果为最终结果, 并为观察结果.
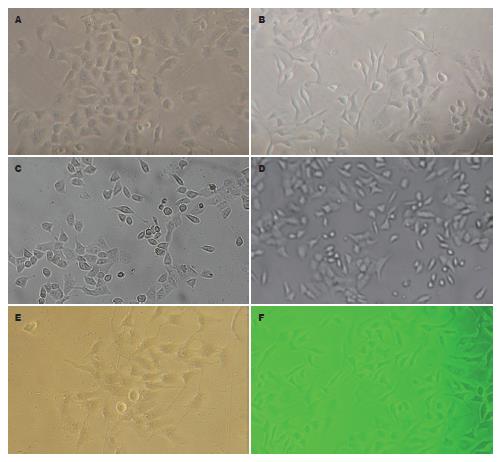
1.2.3 蜂鸟表型观察: 细胞消化计数后, 以每孔3×104个细胞接种6孔板后, 待细胞贴壁后, 加入无血清DMEM培养液的饥饿12 h后, 按每孔加入25 g/L H. pylori超声提取液100 μL, 放培养箱中继续培养, 分别在12、24 h时间位点, 显微镜下直接观察细胞形态的变化, 随机计数200倍视野下100个细胞中的蜂鸟表型数目.
1.2.4 RT-PCR检测相关凋亡基因: 提取各时间段胃癌细胞总RNA, 然后检测吸光度(A)值, 所提取的RNA纯度A260/A280均在1.80以上. 按照逆转录试剂盒说明书, 将细胞的总RNA逆转录成cDNA, 以GAPDH为内参照进行PCR. 引物设计与合成: 参照GenBank中的Survivin和caspase-3的基因全序列设计PCR引物. Survivin引物序列: 上游引物P1: 5'-AGAACTGGCCCTTCTTGGAGG-3'; 下游引物 P2: 5'-CTTTTTATGTTCCTCTATGGGGTC-3', (GenBank登录号: AY795969.1); caspase-3引物序列: 上游引物P1: 5'-CAAACTTTTTCAGAGGGGATCG-3'; 下游引物P2: 5'-GCATACTGTTTCAGCATGGCAC-3', (GenBank登录号: AY219866.1). 引物由上海生工生物工程技术服务有限公司合成. 反应条件均为: 95 ℃ 30 s, 95 ℃ 40 s, 61 ℃-71 ℃ 40 s, 72 ℃ 45 s, 40个循环, 72 ℃ 10 min.
统计学处理 用SPSS13.0统计软件进行检验, 实验数据均以mean±SD进行表示. 多个均数间比较, 用单因素方差分析(One-way ANOVA), 两两比较采用SNK检验, P<0.05表示差异有统计学意义.
H. pylori超声提取液刺激BGC-823细胞12 h后, 细胞开始出现蜂鸟表型, 蜂鸟表型百分率随时间延长而增加, 呈时间依赖性, 24 h最明显(图1), 2个实验组分别与对照组相比, 差异有统计学意义(P<0.05, 表1). 36 h后蜂鸟表型消失, 细胞出现空泡病变, 部分崩解, 形成碎片. 对照组细胞没有出现蜂鸟表型. 实验组中, 东亚型H. pylori刺激组的蜂鸟表型百分率在12、24 h, 与西方型H. pylori刺激组相比, 明显增高, 差异具有统计学意义(12 h, F = 52.00; 24 h, F = 164.73, P<0.05, 表1).
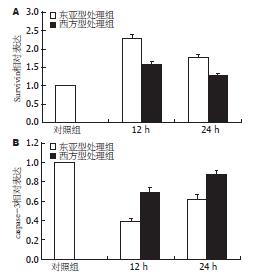
H. pylori超声提取液能够诱导胃癌细胞BGC-823凋亡抑制基因Survivin的mRNA表达量的增加. 刺激12 h时, 凋亡抑制基因Survivin的mRNA表达量最大, 随后, Survivin的mRNA表达量有所下降, 与对照组相比, 差异有统计学意义(P<0.05). 在实验组中, 东亚型组, 与西方型处理组相比, Survivin的mRNA的表达在12 h上调的更明显, 差异有统计学意义(F = 326.260, P<0.05, 图2A).
H. pylori超声提取液能够引起胃癌细胞BGC-823凋亡基因caspase-3的mRNA表达的下调. 在实验组, 刺激12 h时, 凋亡基因caspase-3的mRNA的表达下降最明显, 与对照组相比差异有统计学意义(P<0.05); 随后, caspase-3的mRNA表达有所增加. 而东亚型组, 与西方型处理组相比, caspase-3基因的mRNA表达在12 h下降得更明显, 差异有统计学意义(F = 240.388, P<0.05, 图2B).
cagA基因编码的CagA蛋白, 是H. pylori的主要毒力因子之一, 被注入H. pylori黏附的胃上皮细胞后, 通过Src家族激酶在其保守的C-端酪氨酸磷酸化基序-EPIYA基序上进行酪氨酸磷酸化, 并与细胞磷酸酶SHP-2连接引起其异常的酪氨酸磷酸化, 引起细胞形态学改变蜂鸟表型, 表现为细胞的分散、伪足的延伸, 这种细胞具有肌动蛋白聚合、细胞骨架重排、细胞活力明显增强的特征. 同时CagA还引起Erk信号途径的异常激活, 诱导了cyclin D1, 启动了G1-S过程, 基质金属蛋白酶1(matrix metalloprotease-1, MMP-1)的分泌, 破坏了胃基质[14,15]; CagA蛋白还上调NF-κB转录因子, 经由MAP激酶途径刺激细胞因子的生成, 像IL-8[16]. CagA蛋白的这些作用在胃腺癌的形成中发挥了重要作用. 这些结果显示了H. pylori CagA蛋白是涉及胃腺癌形成的第一个被识别的细菌癌蛋白. CagA的酪氨酸磷酸化以及CagA蛋白与SHP-2的连接, 是蜂鸟表型变化所必需的2个过程[17,18]. 蜂鸟表型的改变, 在cagA基因阳性H. pylori的发病机制中起关键作用[19].
本研究使用的野生菌W24菌株, 分离自镇江的一个十二指肠球部溃疡的患者, PCR测定显示为cagA基因阳性菌株, CagA蛋白序列测定为东亚型; 另一株11637国际标准菌株, 也为cagA基因阳性菌株, GenBank上公布序列显示为西方型[13]. 我们应用这2个来自东西方的H. pylori菌株分别刺激人胃癌细胞BGC-823, 均引起了细胞蜂鸟表型改变, 对照组几乎没有这种改变, 差异有统计学意义. 蜂鸟表型的改变在作用24 h时最明显, 与Zhang等[20]的研究一致. 东亚型菌株, 在不同时间段引起的蜂鸟表型百分率分别是西方型菌株2倍、3倍(12 h, F = 52.00; 24 h, F = 164.73, P<0.05), 显示东亚型菌株, 与西方型菌株相比, 能够引起更多的细胞蜂鸟表型改变.
同为cagA基因阳性的H. pylori菌株之间, 存在生物活性差异, 主要与CagA蛋白的C端酪氨酸磷酸化位点(EPIYA)的数目和氨基酸序列的变化相关. 东亚型H. pylori菌株, 主要来自中国、日本、韩国, 具有相似的CagA蛋白的结构, 即EPIYA-A-B-D型; 西方型H. pylori菌株, 主要来自欧洲、美国、澳大利亚等国家, 具有相似的CagA蛋白结构, 即EPIYA-A-B-C型. 影响与SHP-2连接能力以及CagA蛋白酪氨酸磷酸化能力的主要是CagA蛋白的序列中的EPIYA-C或EPIYA-D. 而东亚型菌株的EPIYA-D, 与西方型菌株的EPIYA-C相比, 具有更强的与SHP-2的连接能力, 以及酪氨酸磷酸化能力, 因而能引起更多的蜂鸟表型改变、更多的IL-8的分泌, 具有更强的生物活性[20-22].
cagA阳性H. pylori的持续感染, 使得胃上皮细胞持续受到不断注入的新CagA蛋白的攻击, 持续受到CagA激活的SHP-2致癌蛋白的异常刺激, 逐渐引起的下游基因表达的改变, 而凋亡相关基因表达的变化, 在胃癌的形成中发挥了重要作用. 在体外实验中, H. pylori能够引起不同胃上皮细胞的凋亡, H. pylori的毒力因子, 包括CagA蛋白, 均能引起凋亡[23-27]. 但是令人信服的分子机制仍未阐明. 一些报道显示, 细胞内蛋白激酶途径[28]或caspase-3[29]与H. pylori, 是引起胃上皮细胞凋亡的主要因素. 多个研究显示线粒体途径, 可能是H. pylori感染引起的胃上皮细胞凋亡的主要信号途径[30,31].
我们用H. pylori超声提取液刺激胃癌细胞BGC-823, 引起了细胞凋亡抑制基因Survivin基因mRNA表达的上调, 凋亡基因caspase-3基因mRNA表达的下降, 与对照组相比, 差异有统计学意义. 这2个基因的变化在H. pylori刺激细胞后12 h最明显, 以后有所恢复. 这个结果反映了H. pylori在这个时间段对胃癌细胞的直接刺激作用, 提示H. pylori的持续刺激可能是造成胃黏膜慢性炎症损伤的基础. Survivin通过触发终端效应器caspase-3和caspase-7而阻止了凋亡. Valenzuela等的体外研究显示, H. pylori感染胃上皮细胞后, Survivin的过表达, 减少了细胞的凋亡[7]. 因此, Survivin在胃黏膜是重要的生存因子. Yu等[32]的研究显示, 在胃癌中Survivin的表达, 与凋亡的减少、COX-2的表达相关. 另一方面, 在非肿瘤组织中, Survivin的表达与H. pylori感染、胃炎密切相关. 应用胃癌和正常黏膜标本的研究显示, 在正常胃黏膜, 没有Survivin基因的表达, 但是有caspase-3基因的mRNA和蛋白表达; 在胃癌和癌症邻近正常组织中, Survivin基因的表达增加; 而在胃癌标本中, 仅有procaspase-3的表达, 而活性caspase-3则完全检测不到, 在癌症邻近正常黏膜, 也没有检测到caspase-3的基因和蛋白表达[32,33]; 伴有较高Survivin表达的胃癌患者, 组织学分级和分期较差, 因此Survivin基因可作为预测预后的指标[34], 控制Survivin基因的表达有助于胃癌的化疗[35]. 因此, caspase-3和Survivin表达水平的变化在正常黏膜向胃癌转化过程中发挥了重要作用.
东亚型菌株, 与西方型菌株相比, 引起凋亡相关基因表达的变化更明显, 具有统计学意义(P<0.05), 显示了东亚型菌株, 与西方型菌株相比, 具有更强的生物学活性.
我们的研究显示, H. pylori超声提取液引起了细胞形态学改变和凋亡相关基因表达的变化, 显示H. pylori在启动胃黏膜炎症和萎缩的同时, 还伴有某些细胞因子的变化, 以及凋亡相关蛋白表达的变化, 如Survivin基因的过表达, 引起细胞的增殖、凋亡抑制和胃癌形成. cagA基因阳性的东西方菌株之间存在生物活性的差异: 东亚型菌株, 与西方型菌株相比, 具有更强的诱导细胞蜂鸟表现改变的能力以及对凋亡相关基因表达变化的影响更大, 因而显示了更强的生物活性. 东西方H. pylori菌株之间的生物学活性差异, 可能是造成东西方地区胃癌发病率不同的原因.
不同幽门螺杆菌(H. pylori)之间存在菌株的毒力差异, 主要与毒力因子的基因型相关. CagA蛋白是H. pylori最主要的毒力因子之一. CagA蛋白的分型主要根据CagA蛋白C端酪氨酸磷酸化位点(EPIYA)的数目和氨基酸主要序列, 分为东亚型和西方型, 并且认为这种东西方菌株之间的毒力差异, 可能与这两个地区不同的胃癌的发病率相关.
郑鹏远, 教授, 郑州大学第二附属医院消化科
胃癌发病机制的研究一直是目前研究的热点. 而凋亡相关基因表达的变化, 在胃癌的形成中发挥了重要作用. 在体外感染过程中, H. pylori引起的凋亡已经研究了一段时间, 但是令人信服的分子机制仍未阐明.
吴莺等的研究显示镇江地区不同H. pylori的cagA基因及其3'可变区结构的变化, 以及不同地区H. pylori cagA基因羧基端可变区及其蛋白序列的差异, 显示CagA蛋白存在东亚型和西方型的差异; Higashi等的研究也显示了CagA蛋白的分型与H. pylori的生物活性相关, 与胃黏膜萎缩、肠化生、胃癌相关, 东亚和西方之间CagA蛋白结构的不同是其功能不同的关键.
H. pylori可以引起体外培养细胞蜂鸟表型改变, 本研究显示东西方H. pylori引起细胞蜂鸟表型的能力存在差异; 进一步的研究显示, 东西方H. pylori引起的细胞凋亡相关基因的mRNA表达也存在差异, 进一步揭示了东西方型H. pylori的生物学功能上的差异.
本文进一步研究东西方H. pylori的生物学差异的原因, 有可能揭示东亚地区胃癌高发的原因, 以及H. pylori的致病机制. 应用CagA蛋白突变体的研究, 可能能够更准确的揭示不同CagA蛋白致病力差异的机制.
本文设计严谨, 方法先进, 具有较好的理论意义.
编辑: 曹丽鸥 电编:何基才
| 1. | Backert S, Schwarz T, Miehlke S, Kirsch C, Sommer C, Kwok T, Gerhard M, Goebel UB, Lehn N, Koenig W. Functional analysis of the cag pathogenicity island in Helicobacter pylori isolates from patients with gastritis, peptic ulcer, and gastric cancer. Infect Immun. 2004;72:1043-1056. [PubMed] [DOI] |
| 2. | Tanaka H, Yoshida M, Azuma T. [The role of CagA in H. pylori infection]. Nippon Rinsho. 2009;67:2245-2249. [PubMed] |
| 3. | Hatakeyama M, Higashi H. Helicobacter pylori CagA: a new paradigm for bacterial carcinogenesis. Cancer Sci. 2005;96:835-843. [PubMed] [DOI] |
| 4. | Hatakeyama M. The role of Helicobacter pylori CagA in gastric carcinogenesis. Int J Hematol. 2006;84:301-308. [PubMed] [DOI] |
| 5. | Hatakeyama M. Helicobacter pylori and gastric carcinogenesis. J Gastroenterol. 2009;44:239-248. [PubMed] [DOI] |
| 6. | Uemura N, Okamoto S, Yamamoto S, Matsumura N, Yamaguchi S, Yamakido M, Taniyama K, Sasaki N, Schlemper RJ. Helicobacter pylori infection and the development of gastric cancer. N Engl J Med. 2001;345:784-789. [PubMed] [DOI] |
| 7. | Valenzuela M, Pérez-Pérez G, Corvalán AH, Carrasco G, Urra H, Bravo D, Toledo H, Quest AF. Helicobacter pylori-induced loss of the inhibitor-of-apoptosis protein survivin is linked to gastritis and death of human gastric cells. J Infect Dis. 2010;202:1021-1030. [PubMed] [DOI] |
| 8. | Matsumoto A, Isomoto H, Nakayama M, Hisatsune J, Nishi Y, Nakashima Y, Matsushima K, Kurazono H, Nakao K, Hirayama T. Helicobacter pylori VacA reduces the cellular expression of STAT3 and pro-survival Bcl-2 family proteins, Bcl-2 and Bcl-XL, leading to apoptosis in gastric epithelial cells. Dig Dis Sci. 2011;56:999-1006. [PubMed] [DOI] |
| 9. | Konturek PC, Konturek SJ, Bielanski W, Kania J, Zuchowicz M, Hartwich A, Rehfeld JF, Hahn EG. Influence of COX-2 inhibition by rofecoxib on serum and tumor progastrin and gastrin levels and expression of PPARgamma and apoptosis-related proteins in gastric cancer patients. Dig Dis Sci. 2003;48:2005-2017. [PubMed] [DOI] |
| 10. | Wu MS, Shun CT, Wang HP, Sheu JC, Lee WJ, Wang TH, Lin JT. Genetic alterations in gastric cancer: relation to histological subtypes, tumor stage, and Helicobacter pylori infection. Gastroenterology. 1997;112:1457-1465. [PubMed] [DOI] |
| 11. | Nardone G, Staibano S, Rocco A, Mezza E, D'armiento FP, Insabato L, Coppola A, Salvatore G, Lucariello A, Figura N. Effect of Helicobacter pylori infection and its eradication on cell proliferation, DNA status, and oncogene expression in patients with chronic gastritis. Gut. 1999;44:789-799. [PubMed] [DOI] |
| 12. | Maor-Kendler Y, Gabay G, Bernheim J, Naftali T, Lesin I, Leichtman G, Pomeranz I, Novis B. Expression of bcl-2 in autoimmune and Helicobacter pylori-associated atrophic gastritis. Dig Dis Sci. 1999;44:680-685. [PubMed] [DOI] |
| 13. | 吴 莺, 张 尤历, 范 钰, 魏 金文, 何 亚龙, 沈 琰, 陈 劲频, 印 亦萍, 王 文兵. 镇江地区H. pylori的cagA基因及其3'可变区结构的变化. 世界华人消化杂志. 2007;15:3147-3151. [DOI] |
| 14. | Chang YJ, Wu MS, Lin JT, Pestell RG, Blaser MJ, Chen CC. Mechanisms for Helicobacter pylori CagA-induced cyclin D1 expression that affect cell cycle. Cell Microbiol. 2006;8:1740-1752. [PubMed] [DOI] |
| 15. | Pillinger MH, Marjanovic N, Kim SY, Lee YC, Scher JU, Roper J, Abeles AM, Izmirly PI, Axelrod M, Pillinger MY. Helicobacter pylori stimulates gastric epithelial cell MMP-1 secretion via CagA-dependent and -independent ERK activation. J Biol Chem. 2007;282:18722-18731. [PubMed] [DOI] |
| 16. | Brandt S, Kwok T, Hartig R, König W, Backert S. NF-kappaB activation and potentiation of proinflammatory responses by the Helicobacter pylori CagA protein. Proc Natl Acad Sci U S A. 2005;102:9300-9305. [PubMed] [DOI] |
| 17. | Stein M, Bagnoli F, Halenbeck R, Rappuoli R, Fantl WJ, Covacci A. c-Src/Lyn kinases activate Helicobacter pylori CagA through tyrosine phosphorylation of the EPIYA motifs. Mol Microbiol. 2002;43:971-980. [PubMed] [DOI] |
| 18. | Naito M, Yamazaki T, Tsutsumi R, Higashi H, Onoe K, Yamazaki S, Azuma T, Hatakeyama M. Influence of EPIYA-repeat polymorphism on the phosphorylation-dependent biological activity of Helicobacter pylori CagA. Gastroenterology. 2006;130:1181-1190. [PubMed] [DOI] |
| 19. | Backert S, Moese S, Selbach M, Brinkmann V, Meyer TF. Phosphorylation of tyrosine 972 of the Helicobacter pylori CagA protein is essential for induction of a scattering phenotype in gastric epithelial cells. Mol Microbiol. 2001;42:631-644. [PubMed] [DOI] |
| 20. | Zhang Y, Argent RH, Letley DP, Thomas RJ, Atherton JC. Tyrosine phosphorylation of CagA from Chinese Helicobacter pylori isolates in AGS gastric epithelial cells. J Clin Microbiol. 2005;43:786-790. [PubMed] [DOI] |
| 21. | Azuma T. Helicobacter pylori CagA protein variation associated with gastric cancer in Asia. J Gastroenterol. 2004;39:97-103. [PubMed] [DOI] |
| 22. | Higashi H, Tsutsumi R, Fujita A, Yamazaki S, Asaka M, Azuma T, Hatakeyama M. Biological activity of the Helicobacter pylori virulence factor CagA is determined by variation in the tyrosine phosphorylation sites. Proc Natl Acad Sci U S A. 2002;99:14428-14433. [PubMed] [DOI] |
| 23. | Konturek PC, Pierzchalski P, Konturek SJ, Meixner H, Faller G, Kirchner T, Hahn EG. Helicobacter pylori induces apoptosis in gastric mucosa through an upregulation of Bax expression in humans. Scand J Gastroenterol. 1999;34:375-383. [PubMed] [DOI] |
| 24. | Ahmed A, Smoot D, Littleton G, Tackey R, Walters CS, Kashanchi F, Allen CR, Ashktorab H. Helicobacter pylori inhibits gastric cell cycle progression. Microbes Infect. 2000;2:1159-1169. [PubMed] [DOI] |
| 25. | Shirin H, Sordillo EM, Oh SH, Yamamoto H, Delohery T, Weinstein IB, Moss SF. Helicobacter pylori inhibits the G1 to S transition in AGS gastric epithelial cells. Cancer Res. 1999;59:2277-2281. [PubMed] |
| 26. | Buti L, Spooner E, Van der Veen AG, Rappuoli R, Covacci A, Ploegh HL. Helicobacter pylori cytotoxin-associated gene A (CagA) subverts the apoptosis-stimulating protein of p53 (ASPP2) tumor suppressor pathway of the host. Proc Natl Acad Sci U S A. 2011;108:9238-9243. [PubMed] [DOI] |
| 27. | Le'Negrate G, Ricci V, Hofman V, Mograbi B, Hofman P, Rossi B. Epithelial intestinal cell apoptosis induced by Helicobacter pylori depends on expression of the cag pathogenicity island phenotype. Infect Immun. 2001;69:5001-5009. [PubMed] [DOI] |
| 28. | Domek MJ, Netzer P, Prins B, Nguyen T, Liang D, Wyle FA, Warner A. Helicobacter pylori induces apoptosis in human epithelial gastric cells by stress activated protein kinase pathway. Helicobacter. 2001;6:110-115. [PubMed] [DOI] |
| 29. | Cho SJ, Kang NS, Park SY, Kim BO, Rhee DK, Pyo S. Induction of apoptosis and expression of apoptosis related genes in human epithelial carcinoma cells by Helicobacter pylori VacA toxin. Toxicon. 2003;42:601-611. [PubMed] [DOI] |
| 30. | Zhang H, Fang DC, Lan CH, Luo YH. Helicobacter pylori infection induces apoptosis in gastric cancer cells through the mitochondrial pathway. J Gastroenterol Hepatol. 2007;22:1051-1056. [PubMed] [DOI] |
| 31. | Galmiche A, Rassow J. Targeting of Helicobacter pylori VacA to mitochondria. Gut Microbes. 2010;1:392-395. [PubMed] [DOI] |
| 32. | Yu J, Leung WK, Ebert MP, Ng EK, Go MY, Wang HB, Chung SC, Malfertheiner P, Sung JJ. Increased expression of survivin in gastric cancer patients and in first degree relatives. Br J Cancer. 2002;87:91-97. [PubMed] [DOI] |
| 33. | Kania J, Konturek SJ, Marlicz K, Hahn EG, Konturek PC. Expression of survivin and caspase-3 in gastric cancer. Dig Dis Sci. 2003;48:266-271. [PubMed] [DOI] |
| 34. | Li YH, Wang C, Meng K, Chen LB, Zhou XJ. Influence of survivin and caspase-3 on cell apoptosis and prognosis in gastric carcinoma. World J Gastroenterol. 2004;10:1984-1988. [PubMed] |
| 35. | Nakamura M, Tsuji N, Asanuma K, Kobayashi D, Yagihashi A, Hirata K, Torigoe T, Sato N, Watanabe N. Survivin as a predictor of cis-diamminedichloroplatinum sensitivity in gastric cancer patients. Cancer Sci. 2004;95:44-51. [PubMed] [DOI] |