修回日期: 2011-04-28
接受日期: 2011-05-05
在线出版日期: 2011-06-08
目的: 探讨食管鳞癌组织中SOX2 mRNA和蛋白的表达及意义.
方法: 应用原位杂交和免疫组织化学法分别检测35例正常食管黏膜组织及84例食管鳞癌组织中SOX2 mRNA和蛋白的表达.
结果: SOX2在正常黏膜组织中mRNA的表达率为8.6%(3/35), 显著低于其在癌组织中的表达率46.4%(39/84), 组间比较差异具有统计学意义(χ2 = 15.504, P<0.05); SOX2蛋白表达与其mRNA表达一致, 在正常黏膜组织中蛋白的表达率为31.4%(11/35), 显著低于其在癌组织中的表达率53.6%(45/84), 组间比较差异具有统计学意义(χ2 = 4.862, P<0.05). 食管鳞癌组织中SOX2 mRNA和蛋白的表达与癌组织的分化程度、浸润深度、TNM分期及有无淋巴结转移均密切相关, 组间比较差异均有统计学意义(均P<0.05). 此外, SOX2 mRNA和蛋白的表达具有明显的正相关关系(γp = 0.399, P<0.05).
结论: 食管鳞癌组织中SOX2 mRNA和蛋白的高表达可能与食管鳞癌的浸润转移密切相关. 同时, 其异常高表达可能与食管癌的恶性转化相关.
引文著录: 陈清江, 张明治. SOX2在食管鳞癌组织中的表达及意义. 世界华人消化杂志 2011; 19(16): 1698-1703
Revised: April 28, 2011
Accepted: May 5, 2011
Published online: June 8, 2011
AIM: To investigate the mRNA and protein expression of SRY-related HMG box 2 (SOX2) in esophageal squamous cell carcinoma (ESCC) and to analyze their significance.
METHODS: The expression of SOX2 mRNA and protein was detected by in situ hybridization and immunohistochemistry in 35 cases of normal esophageal mucosa and 84 cases of ESCC, respectively.
RESULTS: The positive rate of SOX2 mRNA expression in normal mucosa tissue was significantly lower than that in ESCC (8.6% vs 46.4%, χ2 = 15.504, P < 0.05). Similar result was obtained for the expression of SOX2 protein (31.4% vs 53.6%, χ2 = 4.862, P < 0.05). The expression of SOX2 mRNA and protein was significantly associated with tumor differentiation, depth of invasion, TNM stage and lymph node metastasis in ESCC (all P < 0.05). There was a positive correlation between the expression of SOX2 mRNA and that of protein in ESCC (γp = 0.399, P < 0.05).
CONCLUSION: SOX2 mRNA and protein expression might be associated with invasion of ESCC, implying that SOX2 overexpression may be closely related to the malignant transformation of ESCC.
- Citation: Chen QJ, Zhang MZ. Significance of SOX2 mRNA and protein expression in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2011; 19(16): 1698-1703
- URL: https://www.wjgnet.com/1009-3079/full/v19/i16/1698.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i16.1698
SOX(SRY relaled HMG box)是一类SRY(sex determination region of y chromosome)相关基因家族, 编码一系列SOX家族的转录因子, 参与胚胎发育和细胞分子调控[1-3]. SOX2是SOX家族成员之一, 该基因可能参与了多种实体瘤的发生发展过程, 例如在乳腺癌[4]、下咽部鳞癌[5]、肺腺癌[6]、前列腺癌[7]及卵巢癌[8]等疾病中可伴有SOX2的异常表达. 目前, SOX2在食管鳞癌发生发展中的作用国内外少见报道, 本研究采用原位杂交和免疫组织化学2种方法联合检测了食管癌高发区河南省安阳地区的食管癌患者手术切除标本SOX2 mRNA和蛋白的表达情况, 旨在进一步探讨SOX2在食管鳞癌发生发展中的作用, 为寻找检测食管鳞癌的新的分子标记奠定理论基础.
全部84例食管鳞状细胞癌均取自食管癌高发区河南省安阳市肿瘤医院, 所有病例术前均无化疗、放疗及免疫治疗史. 分别取无坏死癌组织及远端正常黏膜组织, 经40 g/L多聚甲醛固定, 常规脱水, 石蜡包埋, 连续切片, 切片厚度4-6 μm, 分别用于HE、免疫组织化学及原位杂交染色. 兔抗人多克隆抗体SOX2购自美国Santa Cruz公司, SP免疫组织化学试剂盒购自北京中杉金桥生物技术开发公司. 原位杂交预杂交液、SA-Bio-AP、BCIP/NBT均购自武汉博士德生物技术有限公司. 原位杂交5'端生物素标记、全硫代修饰探针由北京奥科生物技术有限公司合成. 根据SOX2的GenBank登录号NM_003106, 设计的SOX2探针序列为GCACGGCGCAGCCGCAGATGC; 引物序列为: F: 5'-CCCCTGTGGTTACCTCTTCCTCC-3', R: 5'-GCTGGGACATGTGAAGTCTGCTG-3', 产物大小为135 bp; 根据β-actin的GenBank登录号NM_001101, 设计扩增β-actin的引物序列为: F: 5'-AGATGACCCAGATCATGTTTGAG-3', R: 5'-GACGTAGCACAGCTTCTCCTTAA-3', 产物大小为305 bp.
1.2.1 原位杂交染色和免疫组织化学: 84例标本均经组织学证实为鳞状细胞癌. 其中组织学分级Ⅰ级38例, Ⅱ级27例, Ⅲ级19例; 伴淋巴结转移者37例, 无淋巴结转移者47例; 浸润深度达黏膜下层或浅肌层者30例(浅层), 浸润深度达肌层或外膜层者54例(深层); TNM分期(按1997年UICC的TNM分期): Ⅰ-Ⅱ期39例, Ⅲ-Ⅳ期45例. 原位杂交具体程序如下: 标本经新鲜配制二甲苯脱蜡, 梯度酒精脱水后, 用新鲜配制的0.5% H2O2室温处理30 min, 以灭活内源性过氧化物酶; 3%柠檬酸新鲜配制蛋白酶(0.01 g/L), 37 ℃, 10 min, 消化标本DNA结合蛋白; 每张玻片滴加20 μL不含探针的预杂交液(42 ℃), 预杂交4 h; 加含探针(1 ng/L)的杂交液, 42 ℃湿盒内杂交12 h; 0.1×标准柠檬酸盐(SSC)42 ℃洗后, 加SA-Bio-AP 37 ℃, 10 min; 漂洗后加BCIP/NBT, 避光显色2-4 h. 以不含探针的标本作阴性对照, 以已知阳性结果的乳腺癌组织作阳性对照. 免疫组织化学采用SP法, SOX2抗体稀释, 稀释倍数均为1:200, DAB显色, 苏木素复染. 染色步骤严格按说明书进行, 以PBS液代替一抗作为阴性对照, 以已知阳性的乳腺癌组织作阳性对照.
1.2.2 原位杂交染色及免疫组织化学结果判定: SOX2 mRNA阳性信号呈棕紫蓝色颗粒样物质, 位于细胞质内; 蛋白阳性信号呈浅黄色至棕黄色颗粒, 位于细胞核内. 高倍镜下随机选取5个视野(每个视野观察细胞数不少于200个), 按阳性细胞所占百分比及着色深浅进行结果判定. 采用9分评分制: 按照阳性细胞比例<10%为1分, 10%-50%为2分, >50%为3分; 按染色强弱: 阴性为0分; 淡黄(蓝)色染色为1分; 中度黄(蓝)色染色为2分, 棕黄(紫蓝)色染色为3分. 然后按照" 阳性细胞得分×染色强弱得分" 计总分, 总分<3为阴性, 总分≥3为阳性[9,10].
1.2.3 半定量RT-PCR: 利用TRIzol试剂提取3例食管癌组织和3例正常组织总总RNA, 并用紫外分光光度计测定其浓度, 接着用AMV First Strand DNA Synthesis试剂盒合成cDNA第一链. 具体操作如下: 1 µg提取的总RNA在42 ℃反转录成cDNA, 体系如下: 1 µL AMV逆转录酶, 1 µL随机六聚体, 4 µL 5×缓冲液, 2 µL dNTP(10 mmol/L) and 1 µL Rnase抑制剂(20 U/µL), 然后进行PCR反应, PCR反应体系如下: 1 µL cDNA, 0.5 U LA Taq DNA聚合酶, 2.5 µL 10×LA PCR缓冲液, 2.5 mmol/L dNTP混合物和各50 pmol/L正向和反向引物. PCR反应条件为: 预变性94 ℃ 2 min, 然后94 ℃ 30 s, 60 ℃ 30s, 72 ℃ 50 s, 总共30个循环, 最后72 ℃延伸6 min. β-actin作为对照, 扩增结束后, 取6 µL进行电泳检测, 并用Gene Tools进行mRNA相对表达量分析.
1.2.4 Western blot: 利用组织蛋白裂解缓冲液分别提取3例食管癌组织和3例正常组织总蛋白, 然后将60 µg总蛋白在上样缓冲液中煮5 min, 于10% SDS-PAGE电泳, 然后通过电转移至硝酸纤维素膜上. 硝酸纤维素膜用含5%脱脂奶粉的TBST于室温封闭2 h, 然后分别加一抗(和β-actin)于含5%脱脂奶粉的TBST中, 4 ℃过夜, 第2天, 用TBST洗5 min×3次, 然后分别加合适的二抗作用1 h, 洗5 min×3次, 然后曝光. 最后用Image-Pro Plus5.0软件进行蛋白相对表达量分析.
统计学处理 应用SPSS13.0统计学软件, 行χ2检验和Spearman相关系数分析, 检验水准α = 0.05.
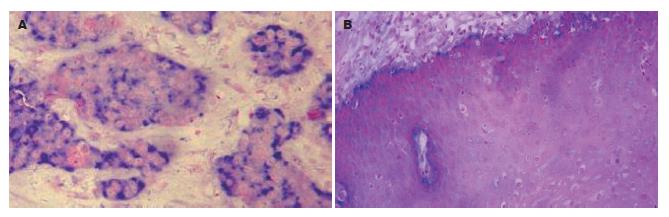
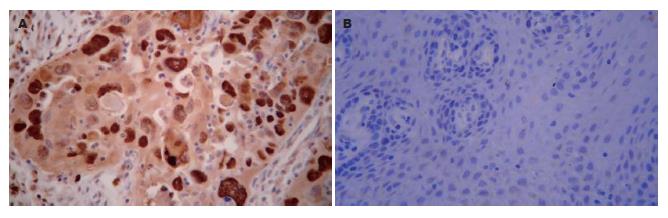
SOX2 mRNA主要定位于细胞质中, 呈蓝紫色颗粒, 主要位于食管鳞状细胞癌组织内(图1). SOX2 mRNA在食管鳞癌组织中高表达, 其阳性率为46.4%, 显著高于正常食管黏膜上皮组织中SOX2 mRNA的表达(8.6%)(表1), 组间表达的差异具有统计学意义(χ2 = 15.504, P<0.05). 此外, SOX2蛋白定位于细胞核内, 呈浅黄色至棕黄色颗粒, 主要位于食管鳞状细胞癌组织内, 正常食管黏膜组织的基底层细胞及上皮角周围偶见少量表达(图2). SOX2蛋白高表达于食管鳞癌组织, 阳性率高达53.6%, 显著高于正常食管黏膜上皮组织中SOX2蛋白的表达(31.4%)(表1), 组间表达的差异具有统计学意义(χ2 = 4.862, P<0.05).
| 部位 | n | SOX2 mRNA | SOX2蛋白 | ||||
| 阳性表达n(%) | χ2值 | P值 | 阳性表达n(%) | χ2值 | P值 | ||
| 正常黏膜上皮 | 35 | 3(8.6) | 15.504 | 0.000 | 11(31.4) | 4.862 | 0.015 |
| 食管鳞癌组织 | 84 | 39(46.4) | 45(53.6) | ||||
SOX2 mRNA及蛋白表达与组织学分级、浸润深度、淋巴结转移和TNM分期均具有明显的相关性(均P<0.05, 表2).
| 病理特征 | n | SOX2 mRNA | SOX2蛋白 | ||||
| 阳性表达n(%) | χ2值 | P值 | 阳性表达n(%) | χ2值 | P值 | ||
| 组织学分级 | |||||||
| Ⅰ | 38 | 9(23.7) | 30.859 | 0.000 | 13(34.2) | 18.704 | 0.000 |
| Ⅱ | 27 | 10(37.0) | 14(51.9) | ||||
| Ⅲ | 19 | 19(100.0) | 18(94.9) | ||||
| 浸润深度 | |||||||
| 浅层 | 30 | 8(26.7) | 7.327 | 0.007 | 10(33.3) | 12.000 | 0.001 |
| 深层 | 54 | 31(57.4) | 35(72.2) | ||||
| 淋巴结转移 | |||||||
| 无 | 47 | 13(27.7) | 15.113 | 0.000 | 18(38.3) | 10.008 | 0.002 |
| 有 | 37 | 26(70.3) | 27(73.0) | ||||
| TNM分期 | |||||||
| Ⅰ、Ⅱ | 39 | 11(28.2) | 9.720 | 0.002 | 12(30.8) | 15.218 | 0.000 |
| Ⅲ、Ⅳ | 45 | 28(62.2) | 33(73.3) | ||||
在45例食管鳞癌组织中, SOX2 mRNA阳性表达39例中, 其蛋白表达阳性占31例, 而SOX2 mRNA表达阴性的45病例中, 其蛋白表达阴性占27例. SOX2 mRNA及蛋白在食管鳞癌组织中的表达强度呈正相关关系(γp = 0.399, P = 0.000, 表3).
| mRNA | n | 蛋白表达 | γp值 | P值 | |
| + | - | ||||
| + | 39 | 31 | 8 | 0.399 | 0.000 |
| - | 45 | 18 | 27 | ||
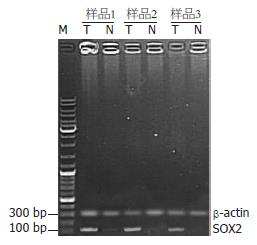
在所选取的3例食管鳞癌组织中SOX2 mRNA的表达明显高于3例对应的正常组织, 其中样品2和3尚未检测到其mRNA的表达(图3), 提示食管鳞癌组织中SOX2 mRNA的高表达可能在食管鳞癌的发生中发挥重要作用.
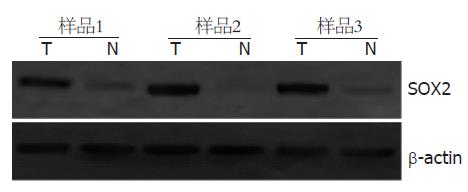
在所选取的3例食管鳞癌组织中SOX2蛋白的表达明显高于3例对应的正常食管组织, 其中样品2中尚未检测到SOX2蛋白的表达(图4), 提示食管鳞癌组织中SOX2 mRNA的高表达可能在食管鳞癌的发生中发挥重要作用.
现有的研究表明, Wnt、Notch、SHH等信号转导通路与多种恶性肿瘤关系密切[11], 转录因子SOX2在这些信号转导通路中起到非常关键的作用[12]. 一个转录因子即可调控数百至上千个下游基因的表达, 因此对SOX2基因的研究可以帮助我们更深入的了解转录因子在信号转导通路中所起到的重要作用. SOX2家族转录因子可参与胚胎发育和细胞分子调控, 所有成员的共同特点是含有一个高度保守的HMGbox(high mobility group box)DNA结合域[13-15]. SOX2基因家族的成员在动物界中广泛存在, 目前已确定了大约30多个SOX家族的成员. SOX基因家族的成员在动物界广泛存在, 从果蝇、两栖类、鸟类、哺乳动物到人类, 都有SOX基因的存在[16]. 作为干细胞转录因子, 参与广泛的发育调节. 近年来发现SOX2在体细胞肿瘤中也有表达. Phi等[17]的研究结果发现, SOX2在未成熟畸胎瘤组织中呈高表达, 可作为分子生物标志物来诊断和分级中枢神经系统源性未成熟畸胎瘤. 另有研究发现, SOX2在基底样表型的散发性乳腺癌组织中有表达[18]. 最近还有实验表明, SOX2在正常胃组织和胃癌组织中均表达, 而在胃肠混合型胃癌中低表达[19]. 然而, 迄今为止, 在国内外少见SOX2在食管鳞癌中的作用的报道, 因此本研究通过原位杂交和免疫组织化学两种技术研究SOX2 mRNA和蛋白在食管鳞癌组织中的表达, 初步探讨其在食管鳞癌发生发展中的可能作用.
本实验研究结果显示, SOX2在正常食管黏膜组织中的mRNA及蛋白表达率及相对含量表达均显著低于其在食管鳞癌组织中的表达, 这一结果提示SOX2高表达的肿瘤其恶性程度更高. 其过高表达可能参与了食管鳞癌组织的癌变过程及研究过程, 并可能与食管鳞癌的浸润转移关系非常密切. 我们的实验结果与国内外关于实体瘤中SOX2的表达的实验结果相类似[4-8], 这就进一步表明了SOX2可能参与了食管鳞状细胞癌的演进过程. 进一步深入的对SOX2基因在食管鳞癌中的作用的探索可作为判断食管癌患者预后的一项指标, 有利于我们进一步的了解食管鳞癌的生物学行为, 为食管癌的早期诊断和治疗提供一个新的分子靶点并为分子靶向治疗食管癌提供理论依据.
总之, 我们分别采取了原位杂交及免疫组织化学技术联合检测了食管鳞癌组织及正常食管黏膜组织中SOX2 mRNA及蛋白的表达, 初步证明了SOX2的过表达可能是导致食管鳞癌发生发展的作用机制之一, 但SOX2的确切的作用机制目前尚不完全清楚. 后续我们将进一步从体外探讨SOX2在食管鳞癌细胞中的作用, 相信对SOX2基因的深入、广泛的研究, 了解其在食管鳞癌的作用机制, 将能够为肿瘤的预后评估及临床治疗提供理论依据.
SOX2是SOX家族成员之一, 该基因可能参与了多种实体瘤的发生发展过程, 例如在乳腺癌、下咽部鳞癌、肺腺癌、前列腺癌及卵巢癌等疾病中可伴有SOX2的异常表达. 目前, SOX2在食管鳞癌发生发展中的作用国内外少见报道.
杜祥, 教授, 复旦大学附属肿瘤医院病理科
Phi等的研究结果发现, SOX2在未成熟畸胎瘤组织中呈高表达, 可作为分子生物标志物来诊断和分级中枢神经系统源性未成熟畸胎瘤.
迄今为止, 在国内外少见SOX2在食管鳞癌中的作用的报道, 因此本研究通过原位杂交和免疫组织化学两种技术研究SOX2 mRNA和蛋白在食管鳞癌组织中的表达, 初步探讨其在食管鳞癌发生发展中的可能作用.
食管鳞癌组织中SOX2 mRNA和蛋白的高表达可能与食管鳞癌的浸润转移密切相关. 同时, 其异常高表达可能与食管癌的恶性转化相关.
本文选题新颖, 具有很好的临床价值.
编辑: 李薇 电编:何基才
| 1. | Kaur G, Delluc-Clavieres A, Poon IK, Forwood JK, Glover DJ, Jans DA. Calmodulin-dependent nuclear import of HMG-box family nuclear factors: importance of the role of SRY in sex reversal. Biochem J. 2010;430:39-48. [PubMed] [DOI] |
| 2. | Zhang L, Zhu T, Lin D, Zhang Y, Zhang W. A second form of Sox11 homologue identified in the orange-spotted grouper Epinephelus coioides: analysis of sequence and mRNA expression patterns. Comp Biochem Physiol B Biochem Mol Biol. 2010;157:415-422. [PubMed] [DOI] |
| 3. | Kim HY, Yoon CH, Kim GH, Yoo HW, Lee BS, Kim KS, Kim EA. A case of campomelic dysplasia without sex reversal. J Korean Med Sci. 2011;26:143-145. [PubMed] [DOI] |
| 4. | Lengerke C, Fehm T, Kurth R, Neubauer H, Scheble V, Müller F, Schneider F, Petersen K, Wallwiener D, Kanz L. Expression of the embryonic stem cell marker SOX2 in early-stage breast carcinoma. BMC Cancer. 2011;11:42. [PubMed] [DOI] |
| 5. | Ge N, Lin HX, Xiao XS, Guo L, Xu HM, Wang X, Jin T, Cai XY, Liang Y, Hu WH. Prognostic significance of Oct4 and Sox2 expression in hypopharyngeal squamous cell carcinoma. J Transl Med. 2010;8:94. [PubMed] [DOI] |
| 6. | Sholl LM, Barletta JA, Yeap BY, Chirieac LR, Hornick JL. Sox2 protein expression is an independent poor prognostic indicator in stage I lung adenocarcinoma. Am J Surg Pathol. 2010;34:1193-1198. [PubMed] [DOI] |
| 7. | Ugolkov AV, Eisengart LJ, Luan C, Yang XJ. Expression analysis of putative stem cell markers in human benign and malignant prostate. Prostate. 2011;71:18-25. [PubMed] [DOI] |
| 8. | Ye F, Li Y, Hu Y, Zhou C, Hu Y, Chen H. Expression of Sox2 in human ovarian epithelial carcinoma. J Cancer Res Clin Oncol. 2011;137:131-137. [PubMed] [DOI] |
| 9. | 王 峰, 王 鹏举, 刘 红涛, 王 艳鸽, 李 晟磊, 陈 奎生, 高 冬玲. 桩蛋白表达下调对食管鳞癌EC9706细胞FAK及MMP-2表达的影响. 世界华人消化杂志. 2010;18:2626-2630. [DOI] |
| 11. | Roussel MF, Hatten ME. Cerebellum development and medulloblastoma. Curr Top Dev Biol. 2011;94:235-282. [PubMed] [DOI] |
| 12. | Shi Y, Sun G, Zhao C, Stewart R. Neural stem cell self-renewal. Crit Rev Oncol Hematol. 2008;65:43-53. [PubMed] [DOI] |
| 13. | Fang X, Yu W, Li L, Shao J, Zhao N, Chen Q, Ye Z, Lin SC, Zheng S, Lin B. ChIP-seq and functional analysis of the SOX2 gene in colorectal cancers. OMICS. 2010;14:369-384. [PubMed] [DOI] |
| 14. | Ikushima H, Todo T, Ino Y, Takahashi M, Miyazawa K, Miyazono K. Autocrine TGF-beta signaling maintains tumorigenicity of glioma-initiating cells through Sry-related HMG-box factors. Cell Stem Cell. 2009;5:504-514. [PubMed] [DOI] |
| 15. | Gontan C, Güttler T, Engelen E, Demmers J, Fornerod M, Grosveld FG, Tibboel D, Görlich D, Poot RA, Rottier RJ. Exportin 4 mediates a novel nuclear import pathway for Sox family transcription factors. J Cell Biol. 2009;185:27-34. [PubMed] [DOI] |
| 17. | Phi JH, Park SH, Paek SH, Kim SK, Lee YJ, Park CK, Cho BK, Lee DH, Wang KC. Expression of Sox2 in mature and immature teratomas of central nervous system. Mod Pathol. 2007;20:742-748. [PubMed] [DOI] |
| 18. | Rodriguez-Pinilla SM, Sarrio D, Moreno-Bueno G, Rodriguez-Gil Y, Martinez MA, Hernandez L, Hardisson D, Reis-Filho JS, Palacios J. Sox2: a possible driver of the basal-like phenotype in sporadic breast cancer. Mod Pathol. 2007;20:474-481. [PubMed] [DOI] |
| 19. | Tsukamoto T, Mizoshita T, Mihara M, Tanaka H, Takenaka Y, Yamamura Y, Nakamura S, Ushijima T, Tatematsu M. Sox2 expression in human stomach adenocarcinomas with gastric and gastric-and-intestinal-mixed phenotypes. Histopathology. 2005;46:649-658. [PubMed] [DOI] |