修回日期: 2011-05-20
接受日期: 2011-05-24
在线出版日期: 2011-06-08
目的: 探讨下调桩蛋白(paxillin)的表达对结直肠癌细胞SW480体外侵袭的影响.
方法: 筛选常见结直肠癌细胞株中paxillin的表达, 发现SW480中表达最多. 构建干扰paxillin表达的特异性短发夹RNA(shRNA), 转染结直肠癌细胞SW480. 将SW480细胞分为3组: 正常SW480组、阴性对照组及paxillin shRNA组, 通过侵袭小室实验观察各组细胞侵袭力的变化.
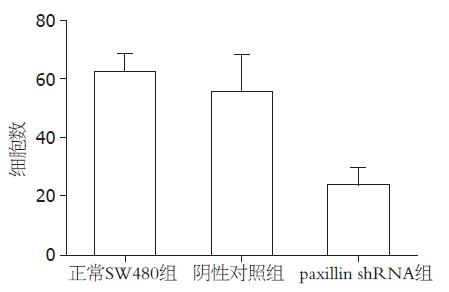
结果: 转染paxillin shRNA后, 结直肠癌细胞SW480中paxillin的表达明显降低. 正常SW480组、阴性对照组及paxillin shRNA组穿透细胞数分别为62.00±6.26, 55.00±13.04和23.33±6.12, 三组差异具有显著性(F = 30.976, P<0.05).
结论: 下调结直肠癌细胞SW480中paxillin蛋白表达可使细胞体外侵袭能力降低.
引文著录: 张全文, 汪欣, 万远廉, 刘玉村, 朱静. 桩蛋白表达下调对结直肠癌细胞SW480侵袭力的影响. 世界华人消化杂志 2011; 19(16): 1693-1697
Revised: May 20, 2011
Accepted: May 24, 2011
Published online: June 8, 2011
AIM: To investigate the effect of short hairpin RNA (shRNA)-mediated down-regulation of paxillin expression on cell invasion in human colorectal adenocarcinoma cell line SW480 in vitro.
METHODS: shRNA targeting the paxillin gene was constructed and transfected into SW480 cells. SW480 cells were divided into three groups: untransfected cells, cells transfected with a control shRNA, and those transfected with a paxillin-specific shRNA. After transfection, the invasion of cells was analyzed by Transwell migration assay.
RESULTS: The expression of paxillin was inhibited in SW480 cells after the transfection of paxillin-specific shRNA. The numbers of cells passing the Transwell membrane were significantly lower in cells transfected with the paxillin-specific shRNA than in untransfected cells and those transfected with control shRNA (23.33 ± 6.12 vs 62.00 ± 6.26, 55.00 ± 13.04, F = 30.976, P < 0.05).
CONCLUSION: Down-regulation of paxillin gene expression reduces cell invasion in human colon adenocarcinoma cell line SW480 in vitro.
- Citation: Zhang QW, Wang X, Wan YL, Liu YC, Zhu J. shRNA-mediated down-regulation of paxillin reduces cell invasion in human colon adenocarcinoma cell line SW480. Shijie Huaren Xiaohua Zazhi 2011; 19(16): 1693-1697
- URL: https://www.wjgnet.com/1009-3079/full/v19/i16/1693.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i16.1693
结直肠癌是最常见的消化系肿瘤, 其发病率在恶性肿瘤中居第5位. 目前, 外科根治性切除是治疗结直肠癌的最有效的办法, 但是对于周围广泛浸润及远处转移的患者, 无法得到根治切除, 预后非常差. 结直肠癌的转移是一个多阶段多基因不断演变的过程, 如何从分子水平来寻找促进结直肠癌转移的关键因素, 从而通过分子生物学手段抑制结直肠癌的转移长期以来备受人们关注. 桩蛋白(paxillin)是整合素信号通路中的一个分子, 主要表达于黏着斑, 介导细胞外信号向胞内的传导, 细胞与细胞外微环境的相互作用[1,2]. 研究表明, paxillin具有动态调节黏着斑、调节细胞的移动和播散等功能[3,4]. 肿瘤的浸润和转移与细胞的黏附力、侵袭力的改变直接相关, 提示paxillin在肿瘤细胞的浸润和转移中起着十分重要的作用[5,6]. 本实验构建paxillin shRNA, 转染结直肠癌细胞SW480, 通过侵袭小室实验观察paxillin shRNA对SW480侵袭力的影响, 初步阐明paxillin在结直肠癌侵袭转移中的可能作用, 并为结直肠癌的转移机制研究提供新的思路, 为其临床分子靶向治疗提供新的理论依据.
结直肠癌Lovo、SW620、SW480、HT-29、Rko细胞株由北京大学第一医院外科实验室提供, DMEM培养基及胎牛血清购自美国Gibco公司, paxillin shRNA及control shRNA购自上海吉玛有限公司. 该公司合成3个paxillin特异性shRNA, 其中paxillin shRNA1的靶序列为: GGGCAGCAACCTTTCTGAACT; paxillin shRNA2的靶序列为: GCTGGAACTGAACGCTGTACA; paxillin shRNA3的靶序列为: GGAGAGTCTCTTGGATGAACT. paxillin及GAPDH抗体均购自美国Abcam公司. 侵袭小室实验所用Matrigel胶购自美国BD公司, 侵袭小室购自美国Costar公司.
1.2.1 结直肠癌细胞株中paxillin表达的检测: 结直肠癌细胞株Lovo、SW620、SW480、HT-29、Rko培养于含100 mL/L胎牛血清、100 kU/L青霉素及100 mg/L链霉素的DMEM培养基中, 置于37 ℃、50 mL/L CO2的培养箱中培养. 待细胞生长至80%-90%融合时, 收集各组细胞, 提取蛋白, 通过Western blot方法检测各组细胞株中paxillin的表达差异.
1.2.2 细胞培养及转染: SW480细胞培养于含100 mL/L胎牛血清、100 kU/L青霉素及100 mg/L链霉素的DMEM培养基中, 置于37 ℃、50 mL/L CO2的培养箱中传代培养, 实验细胞均处于对数生长期. 当SW480细胞生长至80%-90%融合时, 按Lipofectamine 2000转染试剂说明书将对照shRNA和paxillin shRNA分别转染SW480细胞. 转染48 h后收集细胞, 用于后续实验. 实验过程中将细胞分为3组: 正常SW480组、阴性对照shRNA组和paxillin shRNA组.
1.2.3 Western blot: 转染48 h后收集各组细胞, 每组细胞大约5×106个, 每组细胞中加入500 μL裂解缓冲液及0.5 μL蛋白酶抑制剂充分裂解细胞15 min. 然后4 ℃, 12 000 r/min, 离心15 min, 提取上清液即为蛋白提取液. 蛋白浓度用Bradford法进行测定. 取50 μg总蛋白在上样缓冲液中煮5 min, 于10% SDS-PAGE电泳, 然后通过电转移装置200 mA恒流将凝胶中的蛋白转移至硝酸纤维素膜上. 硝酸纤维素膜用含5%脱脂奶粉的TBST于室温封闭2 h, 按照Marker位置裁去多余的膜, 将含目的蛋白的膜放入含2 mL paxillin鼠抗人单克隆抗体稀释液(1:1 000稀释)的杂交袋中, 4 ℃孵育过夜. 第2天用TBST洗10 min×3次, 然后于二抗稀释液中(1:5 000稀释)室温孵育1 h, 洗10 min×3次, 然后曝光. 以目的蛋白与GAPDH蛋白的条带灰度比值作用目的蛋白的相对表达量.
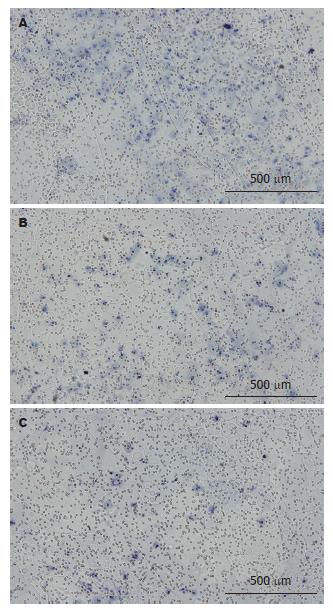
1.2.4 各组细胞侵袭力的检测: 转染48 h后收集各组细胞, 将3组细胞(每组大约104个)分别悬浮在含体积分数为1%胎牛血清的DMEM培养基中, 分别接种至侵袭小室的上层, 小室下层加入含100 mL/L胎牛血清的DMEM培养基, 37 ℃, 50 mL/L CO2的培养箱中孵育24 h. 用棉签轻轻擦去凝胶和膜表面的细胞, 小心取出上室, 放入冰预冷的甲醇固定细胞30 min, 苏木素染色1 min, 梯度乙醇(800、950、1 000 mL/L)脱水, 二甲苯透明. 然后收集Matrigel下层滤膜, 置载玻片上中性树脂封片. 观察6组不同视野下(×100)滤膜中细胞的数量, 评价各组细胞侵袭力的差异.
统计学处理 应用SPSS13.0统计软件进行统计学处理, 行方差分析, 以α = 0.05为检验水准.
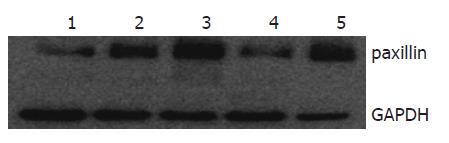
SW480细胞株中桩蛋白paxillin表达最多, Lovo及HT-29细胞株中paxillin表达最少, 故将SW480用于后续的干扰实验(图1).
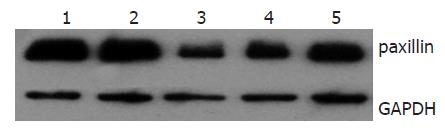
3组paxillin shRNA均降低了SW480中桩蛋白的表达(图2), paxillin shRNA1的干扰效果最好, 因此, 后续实验采用paxillin shRNA1干扰SW480中paxillin蛋白的表达.
桩蛋白paxillin是相对分子质量为68 000 Da的磷酸蛋白, 最早是在v-Src转染的细胞中发现的. paxillin属于LIM蛋白家族, 其N-端含有5个LD模体和一些SH2结合域, 而C-端含有4个LIM结构域[7-9], 这些不同的结构域都可以介导蛋白质-蛋白质之间的相互作用[10], 预示着paxillin在信号传导通路中具有重要的生物学功能. paxillin表达于黏着斑, 通过调节细胞运动、分化及细胞增殖等细胞功能参与胚胎发育、创伤愈合、免疫监视和组织分化等生理过程. paxillin通过生长因子及整合素介导的信号途径, 影响细胞黏着斑[11,12]及细胞骨架的重塑[13], 这些细胞骨架的改变是肿瘤转移的重要分子机制之一. 另外, paxillin可与v-Src、E-6及BCR/ABL-2等多种致瘤蛋白结合[14], 扰乱控制细胞增殖所需的生长因子信号途径. 这些都表明桩蛋白paxillin在肿瘤的发生发展过程中发挥重要的作用. Vadlamudi等[15]发现Heregulin处理的乳腺癌细胞中, paxillin的表达水平上调, 并且在侵袭性乳腺癌细胞系和Ⅲ级以上的乳腺肿瘤中paxillin的上调水平与HER2/3受体的表达水平呈线性相关. 国内外已有文献报道paxillin在食管鳞癌[16]、胃腺癌[17]、结直肠癌[18,19]及原发性肝癌[20]中表达增多. 然而也有人发现paxillin在肺癌[21]、胃腺癌[22]中的表达较癌旁正常组织减少, 这表明paxillin在体内的表达具有组织特异性, paxillin在不同肿瘤及不同病理组织类型中作用并不完全相同.
近年来研究表明, paxillin在细胞迁移[23-25]、增殖[26,27]和凋亡[28,29]中起着十分重要的作用. Yano等[30]2004年发现paxillin在整合素信号介导的细胞黏附及运动中起关键性作用. 蔡辉等[31]发现高转移潜能乳腺癌细胞中paxillin的基因及蛋白表达水平均高于低转移潜能乳腺癌细胞, paxillin与乳腺癌细胞的侵袭和黏附有密切的联系. 本研究中, 我们发现结直肠癌细胞株SW480中paxillin的表达水平最高, 提示SW480细胞株可能属于高转移潜能细胞, 但是我们没有通过相关的实验验证. 我们通过paxillin特异性shRNA干扰结直肠癌细胞株SW480中paxillin蛋白的表达后, paxillin shRNA组细胞穿膜细胞数较正常组及阴性对照组明显减少, 表明抑制paxillin的表达后, SW480细胞体外侵袭能力降低. 提示paxillin有可能参与调节结直肠癌细胞的运动和侵袭, 进一步对其进行深入研究, 可能为结直肠癌的基因治疗提供新的靶点.
然而, 我们的实验仅是细胞学水平, 下步我们希望能够建立稳定转染paxillin shRNA的SW480细胞株, 通过动物实验观察paxillin在活体肿瘤中的具体生物学功能. 但是, 抑制paxillin表达能降低SW480细胞体外侵袭力的研究, 将为临床治疗结直肠癌患者提供分子靶向治疗的理论依据.
桩蛋白(paxillin)是整合素信号通路中的一个分子, 主要表达于黏着斑, 介导细胞外信号向胞内的传导, 细胞与细胞外微环境的相互作用. 研究表明, paxillin具有动态调节黏着斑、调节细胞的移动和播散等功能. 肿瘤的浸润和转移与细胞的黏附力、侵袭力的改变直接相关, 提示paxillin在肿瘤细胞的浸润和转移中起着十分重要的作用.
顾国利, 副主任医师, 中国人民解放军空军总医院普通外科
结直肠癌的转移是一个多阶段多基因不断演变的过程, 如何从分子水平来寻找促进结直肠癌转移的关键因素, 从而通过分子生物学手段抑制结直肠癌的转移长期以来备受人们关注.
Yano等2004年发现paxillin在整合素信号介导的细胞黏附及运动中起关键性作用. 蔡辉等发现高转移潜能乳腺癌细胞中paxillin的基因及蛋白表达水平均高于低转移潜能乳腺癌细胞, paxillin与乳腺癌细胞的侵袭和黏附有密切的联系.
本实验构建paxillin shRNA, 转染结直肠癌细胞SW480, 通过侵袭小室实验观察paxillin shRNA对SW480侵袭力的影响, 初步阐明paxillin在结直肠癌侵袭转移中的可能作用, 并为结直肠癌的转移机制研究提供新的思路, 为其临床分子靶向治疗提供新的理论依据.
本文有一定的科学性、创新性和可读性, 对临床具有一定的指导意义.
编辑: 李军亮 电编:何基才
| 1. | Brown MC, Turner CE. Paxillin: adapting to change. Physiol Rev. 2004;84:1315-1339. [PubMed] [DOI] |
| 2. | Harburger DS, Calderwood DA. Integrin signalling at a glance. J Cell Sci. 2009;122:159-163. [PubMed] [DOI] |
| 3. | Iwasaki T, Nakata A, Mukai M, Shinkai K, Yano H, Sabe H, Schaefer E, Tatsuta M, Tsujimura T, Terada N. Involvement of phosphorylation of Tyr-31 and Tyr-118 of paxillin in MM1 cancer cell migration. Int J Cancer. 2002;97:330-335. [PubMed] [DOI] |
| 4. | Chen HY, Shen CH, Tsai YT, Lin FC, Huang YP, Chen RH. Brk activates rac1 and promotes cell migration and invasion by phosphorylating paxillin. Mol Cell Biol. 2004;24:10558-10572. [PubMed] [DOI] |
| 5. | Aponte M, Jiang W, Lakkis M, Li MJ, Edwards D, Albitar L, Vitonis A, Mok SC, Cramer DW, Ye B. Activation of platelet-activating factor receptor and pleiotropic effects on tyrosine phospho-EGFR/Src/FAK/paxillin in ovarian cancer. Cancer Res. 2008;68:5839-5848. [PubMed] [DOI] |
| 6. | van Zyp JV, Conway WC, Craig DH, van Zyp NV, Thamilselvan V, Basson MD. Extracellular pressure stimulates tumor cell adhesion in vitro by paxillin activation. Cancer Biol Ther. 2006;5:1169-1178. [PubMed] [DOI] |
| 7. | Dawid IB, Breen JJ, Toyama R. LIM domains: multiple roles as adapters and functional modifiers in protein interactions. Trends Genet. 1998;14:156-162. [PubMed] [DOI] |
| 8. | Matthews JM, Visvader JE. LIM-domain-binding protein 1: a multifunctional cofactor that interacts with diverse proteins. EMBO Rep. 2003;4:1132-1137. [PubMed] [DOI] |
| 9. | Kadrmas JL, Beckerle MC. The LIM domain: from the cytoskeleton to the nucleus. Nat Rev Mol Cell Biol. 2004;5:920-931. [PubMed] [DOI] |
| 10. | Turner CE. Paxillin interactions. J Cell Sci. 2000;113 Pt 23:4139-4140. [PubMed] |
| 11. | Downey C, Craig DH, Basson MD. Pressure activates colon cancer cell adhesion via paxillin phosphorylation, Crk, Cas, and Rac1. Cell Mol Life Sci. 2008;65:1446-1457. [PubMed] [DOI] |
| 12. | Digman MA, Brown CM, Horwitz AR, Mantulin WW, Gratton E. Paxillin dynamics measured during adhesion assembly and disassembly by correlation spectroscopy. Biophys J. 2008;94:2819-2831. [PubMed] [DOI] |
| 13. | Efimov A, Schiefermeier N, Grigoriev I, Ohi R, Brown MC, Turner CE, Small JV, Kaverina I. Paxillin-dependent stimulation of microtubule catastrophes at focal adhesion sites. J Cell Sci. 2008;121:196-204. [PubMed] [DOI] |
| 14. | Tumbarello DA, Brown MC, Turner CE. The paxillin LD motifs. FEBS Lett. 2002;513:114-118. [PubMed] [DOI] |
| 15. | Vadlamudi R, Adam L, Tseng B, Costa L, Kumar R. Transcriptional up-regulation of paxillin expression by heregulin in human breast cancer cells. Cancer Res. 1999;59:2843-2846. [PubMed] |
| 16. | 王 雷, 杜 媛鲲, 张 雷, 平 育敏, 孟 宪利. 食管鳞癌和淋巴结组织Paxillin和CD44v6的表达与临床意义. 南京医科大学学报(自然科学版). 2007;27:264-267. |
| 18. | Ayaki M, Komatsu K, Mukai M, Murata K, Kameyama M, Ishiguro S, Miyoshi J, Tatsuta M, Nakamura H. Reduced expression of focal adhesion kinase in liver metastases compared with matched primary human colorectal adenocarcinomas. Clin Cancer Res. 2001;7:3106-3112. [PubMed] |
| 19. | Yang HJ, Chen JZ, Zhang WL, Ding YQ. Focal adhesion plaque associated cytoskeletons are involved in the invasion and metastasis of human colorectal carcinoma. Cancer Invest. 2010;28:127-134. [PubMed] [DOI] |
| 20. | Li HG, Xie DR, Shen XM, Li HH, Zeng H, Zeng YJ. Clinicopathological significance of expression of paxillin, syndecan-1 and EMMPRIN in hepatocellular carcinoma. World J Gastroenterol. 2005;11:1445-1451. [PubMed] |
| 21. | Jackson JL, Young MR. Protein phosphatase-2A regulates protein tyrosine phosphatase activity in Lewis lung carcinoma tumor variants. Clin Exp Metastasis. 2003;20:357-364. [PubMed] [DOI] |
| 23. | Huang C, Rajfur Z, Borchers C, Schaller MD, Jacobson K. JNK phosphorylates paxillin and regulates cell migration. Nature. 2003;424:219-223. [PubMed] [DOI] |
| 24. | Liu ZX, Yu CF, Nickel C, Thomas S, Cantley LG. Hepatocyte growth factor induces ERK-dependent paxillin phosphorylation and regulates paxillin-focal adhesion kinase association. J Biol Chem. 2002;277:10452-10458. [PubMed] [DOI] |
| 25. | Doan AT, Huttenlocher A. RACK1 regulates Src activity and modulates paxillin dynamics during cell migration. Exp Cell Res. 2007;313:2667-2679. [PubMed] [DOI] |
| 26. | Jagadeeswaran R, Surawska H, Krishnaswamy S, Janamanchi V, Mackinnon AC, Seiwert TY, Loganathan S, Kanteti R, Reichman T, Nallasura V. Paxillin is a target for somatic mutations in lung cancer: implications for cell growth and invasion. Cancer Res. 2008;68:132-142. [PubMed] [DOI] |
| 27. | Tatsumi Y, Cho YY, He Z, Mizuno H, Seok Choi H, Bode AM, Dong Z. Involvement of the paxillin pathway in JB6 Cl41 cell transformation. Cancer Res. 2006;66:5968-5974. [PubMed] [DOI] |
| 28. | Sorenson CM. Interaction of bcl-2 with Paxillin through its BH4 domain is important during ureteric bud branching. J Biol Chem. 2004;279:11368-11374. [PubMed] [DOI] |
| 29. | Melendez J, Turner C, Avraham H, Steinberg SF, Schaefer E, Sussman MA. Cardiomyocyte apoptosis triggered by RAFTK/pyk2 via Src kinase is antagonized by paxillin. J Biol Chem. 2004;279:53516-53523. [PubMed] [DOI] |
| 30. | Yano H, Mazaki Y, Kurokawa K, Hanks SK, Matsuda M, Sabe H. Roles played by a subset of integrin signaling molecules in cadherin-based cell-cell adhesion. J Cell Biol. 2004;166:283-295. [PubMed] [DOI] |
| 31. | 蔡 辉, 张 涛, 汤 为学, 李 少林. Paxillin在高、低转移潜能乳腺癌中的表达及意义. 四川大学学报(医学版). 2010;41:91-94. |