修回日期: 2011-05-03
接受日期: 2011-05-11
在线出版日期: 2011-06-08
目的: 研究转化生长因子(TGF-β1)诱导的上皮间质转换(EMT)对人胆囊癌细胞系GBC-SD中侧群(SP)细胞表达的影响.
方法: 在体外培养的GBC-SD中加入TGF-β1后, 相差倒置显微镜下观察细胞形态学变化, Western blot检测E-cadherin、Vimentin的表达改变, 采用流式细胞术检测TGF-β1处理GBC-SD前、后SP细胞亚群的表达比例; 撤去TGF-β1后, 检测细胞形态学变化、E-cadherin和Vimentin的表达改变以及SP细胞亚群的表达比例.
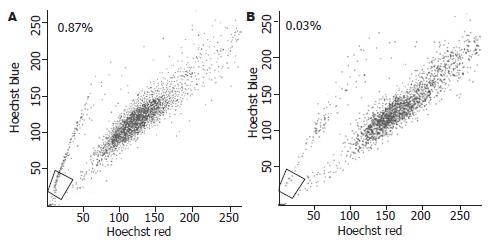
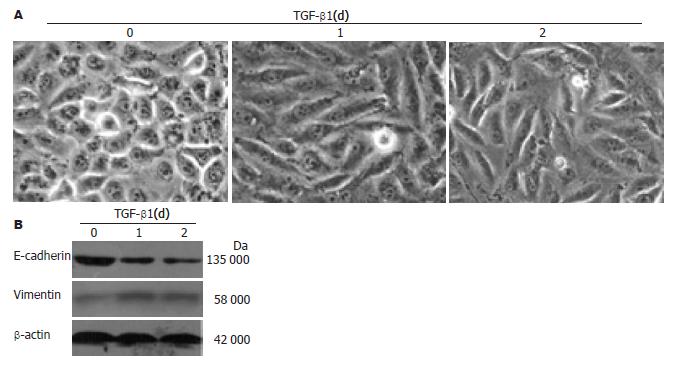
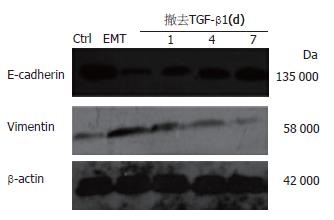
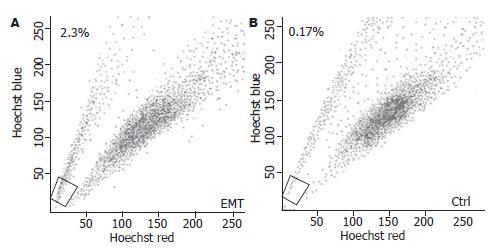
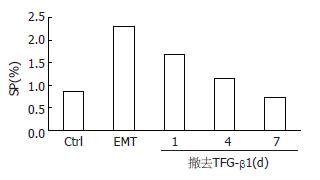
结果: 人胆囊癌细胞系GBC-SD中存在SP细胞, 其比例约为0.87%; TGF-β1可诱导GBC-SD细胞向间质型细胞形态转化, 并上调间质标记蛋白Vimentin和下调上皮标记蛋白E-cadherin的表达, TGF-β1处理后GBC-SD细胞中SP细胞亚群的表达比例增加至2.3%; 撤去TGF-β1后, 发生间质型转化的GBC-SD向上皮细胞形态转化, 间质标记蛋白Vimentin表达下调和上皮标记蛋白E-cadherin表达上调, SP细胞逐渐恢复至TGF-β1诱导前的水平.
结论: TGF-β1诱导的可逆性EMT上调人胆囊癌细胞系GBC-SD中SP细胞亚群的表达, 促进了肿瘤的衍进.
引文著录: 张志发, 秦仁义, 朱峰, 王敏, 李旭, 石程剑. TGF-β1诱导的上皮间质转化对人胆囊癌细胞系GBC-SD中侧群细胞表达的影响. 世界华人消化杂志 2011; 19(16): 1680-1685
Revised: May 3, 2011
Accepted: May 11, 2011
Published online: June 8, 2011
AIM: To investigate the impact of transforming growth factor-β1 (TGF-β1)-induced epithelial-mesenchymal transition (EMT) on side population cells in human gallbladder cancer cell line GBC-SD.
METHODS: GBC-SD cells were allowed to adhere and then incubated with human recombinant TGF-β1 to induce EMT in vitro. Morphological alterations were examined by phase-contrast microscopy, and the expression of EMT-related proteins was detected by Western blot. The percentage of SP cells in GBC-SD cells with and without TGF-β1 was analyzed by flow cytometry. After the removal of TGF-β1, cellular morphological alterations, the expression of EMT-related proteins, and the percentage of SP cells were detected again.
RESULTS: SP cells accounted for approximately 0.87% of GBC-SD cells. TGF-β1 induced morphological transition from epithelial to mesenchymal cells. After treatment with TGF-β1, the expression of epithelial cell marker E-cadherin was decreased, that of mesenchymal cell marker vimentin was increased, and the percentage of SP cells was increased to 2.3%. After removal of TGF-β1, transitioned GBC-SD cells regained the epithelial phenotypes and restored the SP abundance.
CONCLUSION: TGF-β1-induced reversible EMT increases the percentage of SD cells in human gallbladder cancer cell line GBC-SD, suggesting that EMT may promote tumor progression by augmenting the abundance of SP cells.
- Citation: Zhang ZF, Qin RY, Zhu F, Wang M, Li X, Shi CJ. TGF-β1-induced epithelial-mesenchymal transition increases the abundance of side population cells in human gallbladder cancer cell line GBC-SD. Shijie Huaren Xiaohua Zazhi 2011; 19(16): 1680-1685
- URL: https://www.wjgnet.com/1009-3079/full/v19/i16/1680.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i16.1680
侧群(side population, SP)细胞是一类具有外排DNA染料-Hoechst33342, 而在流式细胞术检测下呈弱荧光信号的细胞, 这种外排染料Hoechst 33342的特性多因细胞膜表面高表达ABCG2/BCRP1基因引起[1]. SP细胞广泛存在于正常组织[2]、肿瘤组织[3,4]和肿瘤细胞系中[5-10], 因富集了具有强致瘤能力和耐药特性的肿瘤干细胞而与肿瘤的恶性生物学特性有密切的关系. 上皮间质转化(epithelial to mesenchymal transition, EMT)是上皮细胞表型向间质细胞表型发生的转变, 是哺乳动物胚胎发育过程中常见的生理现象[11-13]. 最近研究发现EMT过程可增加肿瘤组织中肿瘤干细胞的丰度[14-16], 表明EMT在肿瘤的衍进过程中也发挥着重要的作用. 在我们的前期研究中已经证实人胆囊癌细胞系GBC-SD中SP细胞具有肿瘤干细胞的生物学特性[17], 然而, EMT的GBC-SD会对具有干细胞特性的SP细胞亚群产生何种影响尚未见报道. 本文拟以转化生长因子β1(transforming growth factor beta 1, TGF-β1)诱导GBC-SD细胞发生EMT, 观察其对SP细胞丰度的影响, 试图为今后进一步研究胆囊癌转移、复发提供新的理论依据.
人胆囊癌细胞系GBC-SD购自中国科学院上海生物化学与生物学研究所. DNA染料Hoechst33342(Sigma, 美国)、ABCG2转运蛋白阻滞剂Verapamil(Sigma, 美国)、碘化吡啶(PI, Sigma, 美国); TGF-β1(Protech, 英国); E-cadherin(Santa Cruz, 美国)、Vimentin(Sigma, 美国).
1.2.1 细胞培养: 人胆囊癌细胞系GBC-SD用含15 mL/L胎牛血清(FBS, 杭州四季青生物工程材料有限公司), 100 kU/L青霉素, 100 kU/L链霉素双抗(Gibco公司, 美国)的RPMI 1640培养基(Gibco公司, 美国), 在37 ℃、50 mL/L CO2饱和湿度的培养箱中培养, 0.25%胰蛋白酶(Amresco公司, 美国)消化传代, 选用对数生长期细胞进行实验.
1.2.2 流式细胞术检测: 收集单细胞悬液, 调整细胞密度至109个/L. 加入Hoechst33342(1 g/L), 其终浓度为5 mg/L. 避光、37 ℃水浴90 min, 每15 min震荡离心管数次. 对照组于此步骤中加入Verapamil(终浓度为25 μmol/L)同时孵育. 用400目筛网过滤后, 4 ℃、1 000 r/min离心5 min, 弃上清. 用预冷的、含2% FBS的磷酸缓冲液(PBS)洗涤1次. 细胞重悬于上述PBS中, 加入PI至终浓度为1 mg/L, 并避光置于冰浴30 min, 上机(FACS vatage DIVA, Becton Dickison and Co.)进行流式检测SP细胞比例.
1.2.3 EMT实验: GBC-SD细胞以106个/孔种植至铺有无菌盖玻片的6孔板中. 细胞贴壁24 h后, 加入终浓度为10 μg/L TGF-β1. 为了评估TGF-β1的最佳作用时间, 在不同时间点观察细胞形态及E-cadherin、Vimentin的表达水平. 同时, 为了逆转间质上皮转化(mesenchymal to epithelial transition, MET), 将发生EMT的GBC-SD细胞消化后重新种植入6孔板中, 撤去TGF-β1后培养7 d, 间断观察细胞形态及E-cadherin、Vimentin的表达水平.
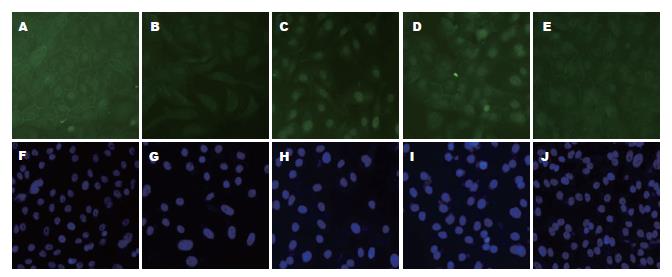
1.2.4 细胞免疫荧光检测: 待上述各组GBC-SD细胞在盖玻片上生长融合至70%时, 取出盖玻片, 以4%的甲醛室温固定30 min; 0.2% Triton X-100透化5 min; 5%的封闭液室温封闭30 min; 加入一抗4 ℃过夜后, 加入二抗避光孵育30 min, 荧光显微镜观察蛋白定位及表达.
1.2.5 Western blot检测E-cadherin、Vimentin的表达: 收集细胞, 加入细胞裂解液, 冰上放置30 min, 12 000 r/min离心15 min, 取上清, 以Bradford法测定蛋白质浓度后置-80 ℃贮存备用. 制备10% SDS-PAGE凝胶, 电泳、转膜、封闭, 一抗(1:200)4 ℃孵育过夜, 二抗(1:5 000)室温孵育1 h, 采用ECL化学发光试剂(Pierce, 美国)于暗室中显色.
统计学处理 应用SPSS11.0软件进行统计分析, 实验数据以mean±SD表示, 各组间比较均采用t检验, P<0.05差异有统计学意义.
人胆囊癌细胞系GBC-SD中存在SP细胞, 其比例为0.87%, 经ABCG2阻滞剂Verapamil阻断后SP细胞比例减少至0.03%(图1).
经10 μg/L TGF-β1作用24 h后, 通过倒置相差显微镜观察到GBC-SD细胞形态发生了明显的变化. GBC-SD细胞由上皮细胞的多边样形态向间质样细胞的梭形形态转变, 且细胞与细胞间的连接变得松散(图2A). GBC-SD细胞上皮标记蛋白E-cadherin表达明显下调, 间质标记蛋白Vimentin表达明显上调(图2B).
将经10 μg/L TGF-β1诱导24 h发生EMT的GBC-SD细胞重新消化种植于培养板中, 撤去TGF-β1后继续培养1 wk, 第1、4、7 d检测GBC-SD细胞形态及与MET相关标记蛋白的变化. 在撤去TGF-β1后, 表达于细胞膜上的上皮细胞标记蛋白E-cadherin表达逐渐升高, 且发生EMT的GBC-SD细胞逐渐恢复上皮细胞形态(图3). 另外, E-cadherin表达上调, 并同时伴有间质标记蛋白Vimentin的下调(图4).
TGF-β1是一类具有多种生物学活性的细胞因子, 调控着细胞增殖、凋亡、分化以及血管形成等重要的生理过程[18]. 更为重要的是, TGF-β1可刺激某些上皮细胞发生EMT[19-22]. EMT是指上皮细胞失去其上皮特征, 获得间质特性的过程. 在正常的成体组织内, EMT多处于静止状态, 但是在某些生理或者病理刺激下又可被激活, 前者主要发生于组织修复, 伤口愈合和器官发育等过程[23,24], 后者则多见于组织纤维化以及肿瘤发生衍进的过程中, 是导致肿瘤发生侵袭转移的重要机制之一[25-27].
在本实验中, 为了研究EMT是否对人胆囊癌细胞系GBC-SD中SP细胞的比例产生影响, 我们首先研究了TGF-β1是否可诱导GBC-SD发生EMT. 结果表明, 在10 μg/L TGF-β1的诱导下, GBC-SD细胞可发生类似EMT的改变. 这与以前的研究结果相似[19-22], 说明TGF-β1可确切的诱导上皮细胞发生EMT. 另外, 为了确定TGF-β1诱导GBC-SD细胞发生EMT的最佳时间, 我们选取不同的时间点观察GBC-SD细胞形态及与EMT相关标记蛋白的变化, 结果显示TGF-β1作用24 h与作用48 h其GBC-SD细胞形态及E-cadherin、Vimentin的表达水平无明显差异, 于是选取TGF-β1处理24 h作为GBC-SD发生EMT的最佳作用时间. 早期的研究表明诱导不同来源的细胞发生EMT的TGF-β1浓度及时间均不相同. 如在乳腺癌细胞系MCF7中, TGF-β1诱导其发生EMT的浓度和时间分别为10 μg/L和72 h[28], 在前列腺癌细胞系PC-3中, TGF-β1的浓度和时间为10 μg/L和24 h[29], 而在肺癌细胞系则分别是5 μg/L和72 h[30]. 因此, 我们推测TGF-β1诱导发生EMT的最佳时间可能与肿瘤细胞的类型、TGF-β1的浓度及细胞的生长环境等因素相关. 基于以上结果, 我们对GBC-SD细胞用10 μg/L TGF-β1处理24 h后, 再次进行Hoechst33342染色发现SP细胞的比例明显增加, 说明EMT可通过上调具有干细胞特性的SP细胞丰度来增加肿瘤的恶性程度. 当前, TGF-β1诱导的EMT对肿瘤SP细胞丰度的究竟产生何种影响尚有争论, 如在小鼠肝癌细胞系K-251中, TGF-β1诱导可上调SP细胞的表达, 而在小鼠肝癌细胞系dRLa74中SP的表达则无明显改变[31]; 在人乳腺癌细胞系MCF7[28]和人肝细胞癌系SMMC-7721[32]中, TGF-β1诱导的EMT则又可导致SP细胞的表达下调. 虽有研究者发现EGFR[31]、E-cadherin蛋白[28]可能参与了SP细胞丰度的调控过程, 但其具体的分子机制尚需进一步研究. EMT可被分为可逆性和不可逆性的EMT[33-35]. 为了证实TGF-β1诱导的EMT是否可逆, 即发生MET, 我们撤去了引起的GBC-SD发生EMT的TGF-β1. 结果显示TGF-β1诱导GBC-SD发生的EMT是可逆的, 并且SP细胞的丰度可随着TGF-β1撤去也逐渐恢复至GBC-SD细胞处理前的水平. 因我们的前期研究已经证实GBC-SD中SP细胞多处于静止期[17], 结合本次研究的结果我们不排除TGF-β1诱导的EMT选择性的抑制SP细胞的分化, 从而造成SP细胞的丰度随着TGF-β1的撤除而呈现波动性的变化.
总之, 本研究初步探讨了TGF-β1诱导的EMT与人胆囊癌细胞系GBC-SD中SP细胞丰度间的关系, 这将有助于进一步拓展肿瘤干细胞生物学特性的研究. 虽然目前EMT导致SP细胞丰度改变的具体分子机制尚不清楚, 但如果能够促使EMT的GBC-SD细胞恢复上皮细胞特性, 逆转EMT达到下调SP细胞丰度的效果, 这将为从细胞源头上控制胆囊癌的发生和发展提供新的思路和依据.
肿瘤干细胞理论认为肿瘤起始于一类具有干细胞性质的细胞亚群, 他驱动肿瘤发生的自我更新和分化, 对肿瘤的恶性生物学特征起决定性作用. 上皮间质转化是指上皮细胞失去其上皮特征, 获得间质特性的过程. 他可增强细胞的迁移和运动能力, 是导致肿瘤发生远处转移的重要机制之一.
张宗明, 教授, 清华大学第一附属医院消化医学中心
肿瘤干细胞和细胞上皮间质转化一直都是研究的热点, 而近年来两者在肿瘤发生、发展过程中的协同作用更是引起了广泛的关注. 肿瘤干细胞的上皮间质转化或者上皮间质转化促进了肿瘤干细胞发生等研究都是目前肿瘤干细胞研究领域内亟须解决的问题, 他可为深入了解肿瘤干细胞在肿瘤发生、发展中的角色提供新的理论支持.
自2008年Weinberg等研究者发现EMT可诱导人乳腺癌细胞高表达干细胞标志物后, 肿瘤干细胞与EMT间的关系逐渐引起了人们的关注.当前人们已经在多种肿瘤中发现了具有干细胞特性的SP细胞, 并且在乳腺癌细胞系MCF-7中也发现了TGF-β1诱导的EMT可对SP细胞的表达产生影响.
本文发现了TGF -β1诱导的EMT是影响人胆囊癌细胞系SP细胞丰度的因素之一, 这对全面了解SP细胞在肿瘤发生、发展过程中的关键角色有着重要的补充作用.
SP细胞: 一类细胞膜高表达ABCG2/BCRP1基因而具有外排DNA染料-Hoechst33342特性的细胞, 该细胞亚群在流式细胞术检测下呈弱荧光信号, 已被证实广泛存在于正常组织、肿瘤组织和肿瘤细胞系中, 而且来源于某些肿瘤细胞系的SP细胞具有类似CSC的强致瘤能力和耐药特性.
本文有较好的科学性和可读性, 有一定的学术意义.
编辑: 李军亮 电编:何基才
| 1. | Zhou S, Schuetz JD, Bunting KD, Colapietro AM, Sampath J, Morris JJ, Lagutina I, Grosveld GC, Osawa M, Nakauchi H. The ABC transporter Bcrp1/ABCG2 is expressed in a wide variety of stem cells and is a molecular determinant of the side-population phenotype. Nat Med. 2001;7:1028-1034. [PubMed] [DOI] |
| 2. | Majka SM, Beutz MA, Hagen M, Izzo AA, Voelkel N, Helm KM. Identification of novel resident pulmonary stem cells: form and function of the lung side population. Stem Cells. 2005;23:1073-1081. [PubMed] [DOI] |
| 3. | Haraguchi N, Utsunomiya T, Inoue H, Tanaka F, Mimori K, Barnard GF, Mori M. Characterization of a side population of cancer cells from human gastrointestinal system. Stem Cells. 2006;24:506-513. [PubMed] [DOI] |
| 4. | Szotek PP, Pieretti-Vanmarcke R, Masiakos PT, Dinulescu DM, Connolly D, Foster R, Dombkowski D, Preffer F, Maclaughlin DT, Donahoe PK. Ovarian cancer side population defines cells with stem cell-like characteristics and Mullerian Inhibiting Substance responsiveness. Proc Natl Acad Sci U S A. 2006;103:11154-11159. [PubMed] [DOI] |
| 5. | Qi S, Zheng J, Zhu H, Yang L, Xiao X. Identification of neuroblastoma stem cells by characterization of side population cells in the human neuroblastoma SK-N-SH cell line. J Pediatr Surg. 2010;45:2305-2311. [PubMed] [DOI] |
| 6. | Murase M, Kano M, Tsukahara T, Takahashi A, Torigoe T, Kawaguchi S, Kimura S, Wada T, Uchihashi Y, Kondo T. Side population cells have the characteristics of cancer stem-like cells/cancer-initiating cells in bone sarcomas. Br J Cancer. 2009;101:1425-1432. [PubMed] [DOI] |
| 7. | Kai K, D'Costa S, Yoon BI, Brody AR, Sills RC, Kim Y. Characterization of side population cells in human malignant mesothelioma cell lines. Lung Cancer. 2010;70:146-151. [PubMed] [DOI] |
| 8. | Kruger JA, Kaplan CD, Luo Y, Zhou H, Markowitz D, Xiang R, Reisfeld RA. Characterization of stem cell-like cancer cells in immune-competent mice. Blood. 2006;108:3906-3912. [PubMed] [DOI] |
| 9. | Komuro H, Saihara R, Shinya M, Takita J, Kaneko S, Kaneko M, Hayashi Y. Identification of side population cells (stem-like cell population) in pediatric solid tumor cell lines. J Pediatr Surg. 2007;42:2040-2045. [PubMed] [DOI] |
| 10. | Grichnik JM, Burch JA, Schulteis RD, Shan S, Liu J, Darrow TL, Vervaert CE, Seigler HF. Melanoma, a tumor based on a mutant stem cell. J Invest Dermatol. 2006;126:142-153. [PubMed] [DOI] |
| 11. | Thiery JP. Epithelial-mesenchymal transitions in tumour progression. Nat Rev Cancer. 2002;2:442-454. [PubMed] [DOI] |
| 12. | Lee JM, Dedhar S, Kalluri R, Thompson EW. The epithelial-mesenchymal transition: new insights in signaling, development, and disease. J Cell Biol. 2006;172:973-981. [PubMed] [DOI] |
| 13. | Shook D, Keller R. Mechanisms, mechanics and function of epithelial-mesenchymal transitions in early development. Mech Dev. 2003;120:1351-1383. [PubMed] [DOI] |
| 14. | Mani SA, Guo W, Liao MJ, Eaton EN, Ayyanan A, Zhou AY, Brooks M, Reinhard F, Zhang CC, Shipitsin M. The epithelial-mesenchymal transition generates cells with properties of stem cells. Cell. 2008;133:704-715. [PubMed] [DOI] |
| 15. | Kurrey NK, Jalgaonkar SP, Joglekar AV, Ghanate AD, Chaskar PD, Doiphode RY, Bapat SA. Snail and slug mediate radioresistance and chemoresistance by antagonizing p53-mediated apoptosis and acquiring a stem-like phenotype in ovarian cancer cells. Stem Cells. 2009;27:2059-2068. [PubMed] [DOI] |
| 16. | Al-Hajj M, Wicha MS, Benito-Hernandez A, Morrison SJ, Clarke MF. Prospective identification of tumorigenic breast cancer cells. Proc Natl Acad Sci U S A. 2003;100:3983-3988. [PubMed] [DOI] |
| 17. | 胡 均, 李 健, 刘 文松, 杜 志勇, 王 敏, 陈 敏, 石 程剑, 沈 俊, 秦 仁义. 人胆囊癌GBC-SD细胞系中干细胞样SP细胞群的分离及其ABCG2的表达. 华中科技大学学报. 2008;37:200-203. |
| 18. | Massague J. The transforming growth factor-beta family. Annu Rev Cell Biol. 1990;6:597-641. [PubMed] [DOI] |
| 19. | Willis BC, Liebler JM, Luby-Phelps K, Nicholson AG, Crandall ED, du Bois RM, Borok Z. Induction of epithelial-mesenchymal transition in alveolar epithelial cells by transforming growth factor-beta1: potential role in idiopathic pulmonary fibrosis. Am J Pathol. 2005;166:1321-1332. [PubMed] [DOI] |
| 20. | Keshamouni VG, Michailidis G, Grasso CS, Anthwal S, Strahler JR, Walker A, Arenberg DA, Reddy RC, Akulapalli S, Thannickal VJ. Differential protein expression profiling by iTRAQ-2DLC-MS/MS of lung cancer cells undergoing epithelial-mesenchymal transition reveals a migratory/invasive phenotype. J Proteome Res. 2006;5:1143-1154. [PubMed] [DOI] |
| 21. | Kasai H, Allen JT, Mason RM, Kamimura T, Zhang Z. TGF-beta1 induces human alveolar epithelial to mesenchymal cell transition (EMT). Respir Res. 2005;6:56. [PubMed] [DOI] |
| 22. | Ranganathan P, Agrawal A, Bhushan R, Chavalmane AK, Kalathur RK, Takahashi T, Kondaiah P. Expression profiling of genes regulated by TGF-beta: differential regulation in normal and tumour cells. BMC Genomics. 2007;8:98. [PubMed] [DOI] |
| 23. | Nakaya Y, Sukowati EW, Wu Y, Sheng G. RhoA and microtubule dynamics control cell-basement membrane interaction in EMT during gastrulation. Nat Cell Biol. 2008;10:765-775. [PubMed] [DOI] |
| 24. | Klymkowsky MW, Savagner P. Epithelial-mesenchymal transition: a cancer researcher's conceptual friend and foe. Am J Pathol. 2009;174:1588-1593. [PubMed] [DOI] |
| 25. | Kalluri R, Weinberg RA. The basics of epithelial-mesenchymal transition. J Clin Invest. 2009;119:1420-1428. [PubMed] [DOI] |
| 26. | Zeisberg M, Neilson EG. Biomarkers for epithelial-mesenchymal transitions. J Clin Invest. 2009;119:1429-1437. [PubMed] [DOI] |
| 27. | Kalluri R. EMT: when epithelial cells decide to become mesenchymal-like cells. J Clin Invest. 2009;119:1417-1419. [PubMed] [DOI] |
| 28. | Yin L, Castagnino P, Assoian RK. ABCG2 expression and side population abundance regulated by a transforming growth factor beta-directed epithelial-mesenchymal transition. Cancer Res. 2008;68:800-807. [PubMed] [DOI] |
| 29. | Zhang Q, Helfand BT, Jang TL, Zhu LJ, Chen L, Yang XJ, Kozlowski J, Smith N, Kundu SD, Yang G. Nuclear factor-kappaB-mediated transforming growth factor-beta-induced expression of vimentin is an independent predictor of biochemical recurrence after radical prostatectomy. Clin Cancer Res. 2009;15:3557-3567. [PubMed] [DOI] |
| 30. | Doerner AM, Zuraw BL. TGF-beta1 induced epithelial to mesenchymal transition (EMT) in human bronchial epithelial cells is enhanced by IL-1beta but not abrogated by corticosteroids. Respir Res. 2009;10:100. [PubMed] [DOI] |
| 31. | Nishimura T, Azuma T, Yokoyama A, Ochiai H, Saito H, Hibi T. New mechanism of transforming growth factor-beta signaling in hepatoma: Dramatic up-regulation of tumor initiating cells and epidermal growth factor receptor expression. Hepatol Res. 2009;39:501-509. [PubMed] [DOI] |
| 32. | 王 波, 夏 羽佳, 晏 维, 夏 丽敏, 刘 梅, 田 德安. TGF-β1诱导的上皮间质转化对肝癌细胞系中边缘群细胞的调控. 世界华人消化杂志. 2010;18:2416-2421. [DOI] |
| 33. | Thiery JP. Epithelial-mesenchymal transitions in development and pathologies. Curr Opin Cell Biol. 2003;15:740-746. [PubMed] [DOI] |
| 34. | Stover DG, Bierie B, Moses HL. A delicate balance: TGF-beta and the tumor microenvironment. J Cell Biochem. 2007;101:851-861. [PubMed] [DOI] |