修回日期: 2011-04-20
接受日期: 2011-04-21
在线出版日期: 2011-06-08
目的: 探讨内皮祖细胞(EPCs)在大鼠肝癌模型形成中的作用.
方法: 分离培养大鼠EPCs, 体外用4', 6-二脒基-2-苯基吲哚(DAPI)标记后, 将EPCs-DAPI制成1×105/150 μL, 2×105/150 μL, 4×105/150 μL的低、中、高浓度悬液, 模型组和EPCs移植组的SD大鼠腹腔注射二乙基亚硝胺(DEN)制成肝癌模型, 空白组注射等量的生理盐水, EPCs移植组经尾静脉注射低、中、高浓度EPCs-DAPI悬液1 mL, 空白组和模型组经尾静脉注射生理盐水1 mL, 分别于第4、6、8周末处死, 留取血清和肝脏组织标本, 检测EPCs标志物CD34、CD133和KDR表达, 检测各组血清ALT、AST、AFP的表达, 观察EPCs-DAPI表达的量及分布的变化, 并用Imagepro plus图像分析软件对EPCs-DAPI表达的阳性区域面积(PA)作半定量分析.
结果: 培养的细胞7 d后检测细胞表面标志物CD34、CD133和KDR的表达均呈阳性, 低浓度EPCs移植4 wk组较ALT、AST、AFP模型对照4 wk组显著升高(P<0.01); 中浓度EPCs移植6 wk组较ALT、AST、AFP模型对照6 wk组显著升高(P<0.01); 高浓度EPCs移植8 wk组较ALT、AST、AFP模型对照8 wk组显著升高(P<0.01); EPCs移植组中DAPI均呈阳性, 且依注射EPCs悬液浓度高低和时间长短呈上升趋势, 表达逐渐增强, 在视野中密集分布, 染色渐深. EPCs低、中、高浓度移植4 wk组, EPCs低、中、高浓度移植6 wk组和EPCs低、中、高浓度移植8 wk组PA值比较, 差异具有显著性(P<0.05); 低浓度EPCs移植 4、6、8 wk组, 中浓度EPCs移植4、6、8 wk组和高浓度EPCs移植4、6、8 wk组PA值比较, 差异无显著性.
结论: EPCs在肝癌形成过程中对肝功能有影响, 且随着造模时间的延长而加重. EPCs在肝癌形成过程中有促进作用. EPCs体内示踪在肝组织的分布和表达水平表明其对肝癌有靶向作用.
引文著录: 郭宁刚, 邵泽勇, 吕锋. EPCs在肝癌模型中的分布及其对肝癌形成的影响. 世界华人消化杂志 2011; 19(16): 1666-1673
Revised: April 20, 2011
Accepted: April 21, 2011
Published online: June 8, 2011
AIM: To investigate the role of endothelial progenitor cells (EPCs) in the formation of liver cancer and to explore the possibility of using EPCs as a delivery vehicle for the treatment of liver cancer.
METHODS: Isolated and cultured EPCs were labeled with DAPI in vitro. Sprague-Dawley rats were divided into three groups: control group, model group, and EPC group. The model group and EPC group were intraperitoneally injected with diethylnitrosamine (DEN) to induce liver cancer, while the control group was injected with saline. Rats of the EPC group were further divided into three subgroups and intravenously injected with 1 mL of low (1 × 105/150 μL), medium (2 × 105/150 μL), and high (4 × 105/150 μL) concentrations of EPCs-DAPI suspension, respectively, while the control group and model group were injected with equal volume of saline. At weeks 4, 6 and 8, rats were killed to take liver tissue samples to detect the expression of EPCs markers CD34, CD133, and KDR, and serum samples to measure the levels of ALT, AST, and AFP. EPCs-DAPI-positive area (PA) was quantified using the Imagepro plus image analysis software.
RESULTS: Positive expression of cell surface markers CD34, CD133, and KDR could be detected on cultured cells after 7 days of culture. Serum ALT, AST, and AFP differed significantly between the low-concentration EPC group and model group at week 4, between the medium-concentration EPC group and model group at week 6, and between the high-concentration EPC group and model group at week 8 (all P < 0.01). Positive DAPI was detected in all the EPC groups, and the positive rate of DAPI was dependent on the concentration of injected EPCs and injection duration. PA was significantly different among rats injected with different concentrations of EPCs at all time points (all P < 0.05), but showed no significant differences among rats injected with the same concentration of EPCs at different time points (all P > 0.05).
CONCLUSION: EPCs affect liver function in the rat model of liver cancer in a concentration- and time-dependent manner. EPCs in the liver can promote the formation of liver cancer. EPCs have a tropism to liver cancer in vivo.
- Citation: Guo NG, Shao ZY, Lv F. Distribution of exogenous endothelial progenitor cells in a rat model of hepatoma and their impact on liver cancer formation. Shijie Huaren Xiaohua Zazhi 2011; 19(16): 1666-1673
- URL: https://www.wjgnet.com/1009-3079/full/v19/i16/1666.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i16.1666
据统计原发性肝癌在我国其死亡率占全部恶性肿瘤的18.8%, 占全球肝癌死亡率的53%, 位居之首, 严重危害人类的健康. 目前对于早期肝癌和小肝癌尽量手术切除, 不能手术的采取放疗、化疗、免疫疗法及中医药治疗, 但是这些理化因素及生物性的治疗措施在杀灭或抑制肝癌细胞的同时, 对正常的肝细胞也会产生不同程度的损伤或抑制作用. 骨髓抑制、心肝肾损害以及放化疗相关的第二原发肿瘤等严重的不良反应大大限制了上述治疗措施的临床应用[1-3]. 对于手术无法切除的肝癌, 靶向治疗一直是研究的热点[4,5]. 本实验拟通过探索内皮祖细胞(endothelial progenitor cells, EPCs)在二乙基亚硝胺(diethylnitrosamine, DEN)所致大鼠肝癌模型中的分布规律, 并进一步探讨其在肝癌形成过程中的作用, 为EPCs作为靶向治疗肝癌的载体提供可靠的实验依据, 从而为肝癌的治疗提供新的策略.
泸州医学院动物试验中心提供的标准清洁级SD♂大鼠160只, 体质量180 g±20 g. 四川省实验动物合格证编号: 医动字24101115号. 环境合格证编号: 21080713号. DEN购自美国BBI公司; 大鼠甲胎蛋白检测试剂盒购自美国ADL公司; 血清丙氨酸氨基转氨酶(alanine aminotransferase, ALT)、天冬氨酸氨基转氨酶(aspartate aminotransferase, AST)、白蛋白(albumin, ALB)的测定试剂盒购自上海荣盛生物制剂厂; 大鼠抗人CD133 Ab、大鼠抗人CD34 Ab, 抗KDR mAb购自Becton Dickinson; Dil-acLDL购自Molecular Probe公司; FITC-UEA-1购自Vector公司; DAPI荧光染料和羊抗大鼠lgG-FITC购自Sigma公司; 胎牛血清和大鼠淋巴细胞分离液购自天津市灏阳生物制品科技有限责任公司; 马血清和IMDM购自Hydone公司; 碱性成纤维细胞生长因子(basicity fibroblast growth factor, bFGF)和内皮细胞生长添加剂(endothelial cell growth supplement, ECGS)购自PEPROTECH INC. USA. Bio-Rad680型酶标仪(美国BIO-RAD公司); 倒置相差显微镜CKX41型(日本OLYMPUS公司); 荧光显微镜DM4000B型(德国Leica); 7020全自动生化分析仪(日立); 3DA-2002型图像分析检测仪(北京创新思成科技有限公司).
1.2.1 分组与造模: 将♂SD大鼠150只, 按体质量随机分3组: 空白对照组(18只)、模型对照组(33只)、EPCs实验组(99只), 其中又将EPCs实验组依据注射EPCs浓度不同, 分为低、中、高3个浓度组, 每组都分成4、6、8 wk组; 空白对照4、6、8 wk组均为6只/组; 模型对照与低、中、高浓度4 wk组为9只/组; 模型对照与低、中、高浓度6、8 wk组为12只/组. 取SD大鼠外周血, 用Ficoll密度梯度离心法获取单个核细胞, 同时用bFGF和ECGS诱导, Dil标记的乙酰化低密度脂蛋白(Dil-acLDL)和FITC标记的荆豆凝集素-1(FITC-UEA-1)荧光双染色法鉴定EPCs, 免疫组化组织化学染色法检测EPCs标志物CD34、CD133和KDR的表达, 体外经DAPI标记后, 并将EPCs-DAPI制成1×105/150 μL, 2×105/150 μL, 4×105/150 μL的低、中、高浓度悬液, 模型对照组和EPCs实验组腹腔注射DEN造模, 以0.9% NaCl溶液配置成浓度为40 g/L(4%)的DEN稀释液, 按每次1 mL/kg体质量的剂量腹腔注射, 2次/wk, 直至8 wk, 空白对照组则腹腔注射与DEN等体积的生理盐水. EPCs实验组自注射DEN的当日开始, 每日经尾静脉注射低、中、高浓度EPCs-DAPI悬液1 mL, 空白对照组和模型对照组经尾静脉注射生理盐水1 mL, 分别于第4、6、8周末处死, 留取标本.
1.2.2 检测指标: EPCs荧光染色情况; EPCs表面标志CD34、CD133和KDR的表达; EPCs-DAPI表达水平; 血清AFP、ALT、AST和ALB水平; 肝脏肉眼大体观及HE染色病理切片.
统计学处理 用SPSS14.0统计软件处理, 全部数据均用mean±SD表示. 计量资料采用单因素方差分析, 规定P<0.05为有统计学意义.
大鼠在给予DEN注射后, 均不同程度地出现体毛干枯无泽、活动及食量减少, 大便溏泻、小便黄而少等, EPCs实验组体质量均有所下降, 尤以高浓度8 wk组明显, 饮食减少, 活动迟缓, 体质量降低等.
实验过程中共死亡29只, 其中有24只为造模反应太重, 发生肝、肾、肺等器官出血, 逐渐衰竭死亡, 3只因腹腔注射时刺破腹腔动脉死亡, 2只因操作时抓取动物不当导致脊柱弯曲不能进食死亡(表1).
| 分组 | n | 存活 | 死亡 |
| 空白对照组 | |||
| 4 wk | 6 | 6 | 0 |
| 6 wk | 6 | 6 | 0 |
| 8 wk | 6 | 6 | 0 |
| 模型对照组 | |||
| 4 wk | 9 | 8 | 1 |
| 6 wk | 12 | 10 | 2 |
| 8 wk | 12 | 10 | 2 |
| 低浓度组 | |||
| 4 wk | 9 | 8 | 1 |
| 6 wk | 12 | 10 | 2 |
| 8 wk | 12 | 9 | 3 |
| 中浓度组 | |||
| 4 wk | 9 | 7 | 2 |
| 6 wk | 12 | 9 | 3 |
| 8 wk | 12 | 9 | 3 |
| 高浓度组 | |||
| 4 wk | 9 | 7 | 2 |
| 6 wk | 12 | 8 | 4 |
| 8 wk | 12 | 8 | 4 |
2.3.1 EPCs对肝功能指标的影响: 空白对照4 wk组与空白对照8 wk组比较, ALT、AST、ALB无显著差异(P>0.05); 其余各组, 同时间点或同浓度比较, ALT、AST、ALB具有差异性(P<0.05, 表2).
| 分组 | n | ALT(U/L) | AST(U/L) | ALB(g/L) | AFP(µg/L) |
| 空白对照组 | |||||
| 4 wk | 6 | 25.61±5.62 | 76.30±7.34 | 36.41±2.91 | 4.337±0.147 |
| 6 wk | 6 | 25.23±2.68 | 78.17±5.33 | 36.53±2.07 | 4.323±0.171 |
| 8 wk | 6 | 27.01±2.51 | 78.53±4.72 | 36.33±1.61 | 4.032±0.331 |
| 模型对照组 | |||||
| 4 wk | 8 | 128.26±8.13 | 217.13±22.37 | 31.17±2.33 | 6.287±0.425 |
| 6 wk | 10 | 183.17±13.52 | 283.37±37.16 | 27.63±2.73 | 6.933±0.363 |
| 8 wk | 10 | 235.46±27.33 | 335.28±21.63 | 24.36±1.83 | 7.391±0.172 |
| 低浓度组 | |||||
| 4 wk | 8 | 301.67±27.14 | 415.36±36.27 | 23.56±2.94 | 7.183±0.473 |
| 6 wk | 10 | 378.27±32.31 | 463.44±35.24 | 19.74±2.15 | 7.834±0.337 |
| 8 wk | 9 | 410.39±17.38 | 535.71±27.33 | 16.97±2.67 | 8.732±0.173 |
| 中浓度组 | |||||
| 4 wk | 7 | 419.38±28.16 | 553.83±24.29 | 16.61±2.11 | 9.316±0.383 |
| 6 wk | 9 | 482.52±37.26 | 631.74±24.35 | 13.85±1.96 | 10.627±0.131 |
| 8 wk | 9 | 537.41±37.27 | 717.36±33.76 | 10.98±2.73 | 11.336±0.293 |
| 高浓度组 | |||||
| 4 wk | 7 | 561.33±25.17 | 731.28±21,33 | 11.47±2.17 | 11.612±0.471 |
| 6 wk | 8 | 603.91±23.16 | 779.38±35.43 | 8.37±2.31 | 13.241±0.285 |
| 8 wk | 8 | 693.73±36.12 | 827.94±19.31 | 5.63±2.47 | 14.331±0.495 |
2.3.2 EPCs对AFP指标的影响: 空白对照4 wk组与空白对照8 wk组比较, AFP无显著差异(P>0.05); 其余各组, 同时间点或同浓度比较, AFP具有差异性(P<0.05).
2.4.1 肝脏肉眼大体观: 空白对照组大鼠肝脏外观呈红褐色, 质软而富有弹性, 表面光滑; 模型对照4 wk组大鼠肝脏与其他脏器粘连, 不易剥离, 体积增大, 色泽黯淡, 被膜紧张, 质地较硬, 边缘较锐利, 弹性较正常对照组明显减弱, 表面红黄相间, 色黄处有大小均匀的灰黄色细小颗粒分布, 切面有较多点状出血; 模型对照6 wk组大鼠肝脏呈褐黄色, 质地更硬, 满布大小均匀的灰黄色细小颗粒, 模型对照8 wk组和低浓度4 wk组病变与之相近. 低浓度6 wk组大鼠肝脏外观呈暗黄绿色, 表面见圆形结节大小不一, 有的见单个巨大孤立性癌肿, 低浓度8 wk组和中浓度4 wk组病变与之相近; 中浓度6 wk组大鼠肝脏外观呈灰黄色, 表面可有不规则的红褐色结节, 边缘不清, 中浓度8 wk组和高浓度4 wk组病变与之相近; 高浓度6 wk组大鼠肝脏外观呈黄褐色, 表面见形状不规则的结节, 高浓度8 wk组病变与之相近; EPCs实验组大鼠肝脏有的伴有多个巨大癌肿, 边缘清楚, 可有纤维包膜包绕.
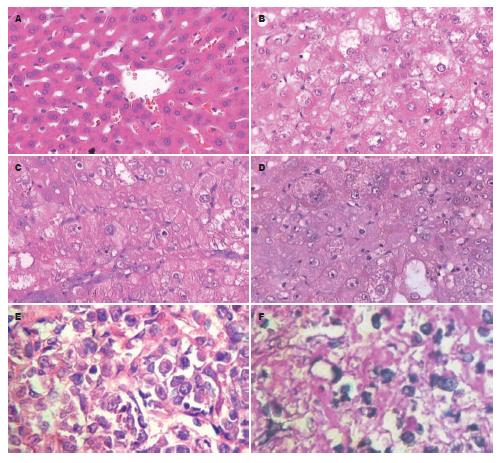
2.4.2 肝脏HE染色镜下观: 正常肝组织结构完整, 清晰, 肝小叶正常; 模型对照4 wk组癌细胞呈梁状或多板状排列; 模型对照6 wk组癌细胞呈索状, 其间有丰富的血窦; 模型对照8 wk组和低浓度4 wk组镜下病变与之相近; 低浓度6 wk组癌细胞呈梁状腺样结构, 或呈脂肪变, 弥漫性分布, 低浓度8 wk组和中浓度4 wk组镜下病变与之相近; 中浓度6 wk组癌细胞大小不一, 为多角形, 呈颗粒状, 中浓度8 wk组和高浓度4 wk组镜下病变与之相近; 高浓度6 wk组癌细胞呈梁状或腺样或硬癌样结构, 胞核深染, 高浓度8 wk组镜下病变与之相近(图1).
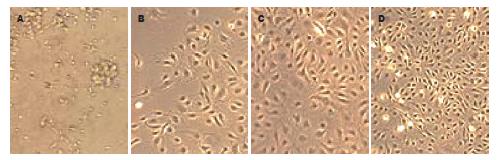
2.5.1 倒置显微镜观察细胞形态变化: 大鼠外周血单个核细胞刚接种时, 呈圆形, 仅少数细胞伸展. 第2天可见少数细胞贴壁, 呈梭形, 两端有突起伸出. 培养4-7 d后可见贴壁细胞数量明显增多, 呈集落样生长(图2).
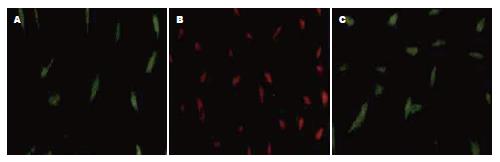
2.5.2 荧光双染色镜下观: 培养第7天, 贴壁细胞用Dil-acLDL和FITC-UEA-1行荧光化学染色, Dil-acLDL标记阳性细胞呈红色, FITC-UEA-1标记阳性细胞呈绿色, 荧光显微镜下双染色阳性细胞为橙黄色.
2.5.3 EPCs表面标记CD34、CD133和KDR免疫荧光检测结果: 培养第7天, 贴壁细胞表面标志物CD34, CD133和KDR免疫细胞化学染色均呈阳性(图3).
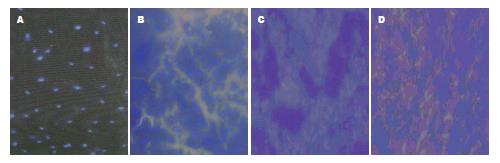
2.6.1 EPCs-DAPI表达在肝组织的分布: 在荧光显微镜下观察, 体外经DAPI标记的EPCs, 核发蓝色荧光, 移植细胞呈散在分布, 以肝脏坏死区周缘较多, 部分标记的EPCs分化为毛细血管内皮细胞, 表现为毛细血管内皮细胞为蓝染的细胞. 免疫荧光染色证实, 植入的DAPI阳性细胞归巢到肝癌组织, 经分化为血管内皮细胞, 参与了癌组织血管的生成, 促进了肝癌的形成, 且其表达与EPCs-DAPI浓度成正相关(图4).
癌组织; C: EPCs中浓度6 wk组肝癌组织; D: EPCs高浓度6 wk组肝癌组织.
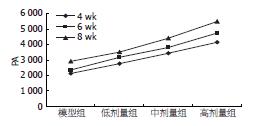
2.6.2 EPCs-DAPI表达的PA值在各组间的变化: 相同类别的组间两两比较, PA无显著差异性(P>0.05), 相同时间的组间两两比较, PA具有差异性(P<0.05, 图5).
EPCs是一群起源于骨髓, 具有与来源于胚胎血岛细胞相似特征的单核细胞群. 研究表明当受到血管生长因子的作用时, 外周血中的EPCs就会增殖并迁移到血管形成的位置, 分化为成熟的EPCs, 即在原位形成血管, 最终形成毛细血管网. 由EPCs参与的血管发生在器官形成过程中具有重要作用, 也是不同疾病引发的病理损伤时的组织和器官再生的重要起始阶段. 因此, 动员或移植自体来源的EPCs能够为缺血性疾病或肿瘤的治疗提供新的靶点[6]. 本实验根据EPCs的生物学特性, 制定从外周血中提取, 经体外用bFGF和ECGS诱导分化后, 从形态学和免疫学两个角度对EPCs进行鉴定, 为进一步探讨EPCs在大鼠肝癌模型中动员和靶向到达癌组织的机制提供可靠的基础.
肿瘤具有丰富的血管, 而且其生长、侵袭、转移都依赖于血管, EPCs对肿瘤血管的生成具有促进作用, Vajkoczy等[7]以鼠胚胎EPCs为模型研究了EPCs在肿瘤模型新血管形成中的机制, 指出EPCs保留其能力可促成成年鼠肿瘤血管发生. 肿瘤产生的高水平VEGF可能导致外周循环中骨髓源性干细胞动员, 提高他们向肿瘤脉管系统的聚集[8]. Raida等[9]报道EPCs的数量与肿瘤内的氧张力明显呈负相关. 这表明EPCs能够感应肿瘤微环境发出的信号, 具有追踪肿瘤的作用. 武钧等[10]研究发现肝脏缺血/再灌(ischemis/reperfusion, I/R)损伤后骨髓及循环中EPCs数量显著增加, 并伴有高水平的VEGF、TNF-α, I/R后肝脏血管内皮细胞凋亡明显增加, 说明EPCs具有肝癌靶向性的特点, 可以作为靶向治疗肝癌的载体.
本实验在前期研究的基础上, 证实了EPCs在肝癌发生过程中有趋化作用: EPCs的阳性表达, EPCs实验组较模型对照组有明显增高; 同一阶段的低、中、高浓度组也有显著升高; 相同浓度的4、6、8 wk组逐渐升高. 利用EPCs具有肿瘤趋化作用, 而且无毒性, 可以把EPCs用作靶向治疗肝癌的载体, 制备转染了自杀基因或抑癌基因的治疗细胞, 同时阻断EPCs的促血管生成作用, 然后回输至肿瘤动物模型体内, 实现对肿瘤细胞的精确打击[11,12]. 肝癌动物模型的建立是研究肝癌机制及其开展靶向性药物防治肝癌实验研究的重要手段, 理想的动物肝癌模型应具有人类肝癌的形态特征, 模型成功率高, 重现性好, 死亡率低等特点. 目前常用于建立肝癌模型的主要动物是大鼠、小鼠、狗、猫、鸡、兔, 其中以大鼠最多, 原因是SD大鼠模型制造方法简单, 成本适中, 采血量大, 可满足一次做多种指标检测. 常用的化学物质有DEN、4, 2-甲基氨基氮苯、2-乙酰氨基酸、亚氨基偶氮甲苯、黄曲霉素等. 给药方法有灌胃、掺入饲料或饮水中喂养、皮下注射、局部皮肤涂抹及腹腔注射. 另外还有肿瘤细胞接种和干细胞注射等方法.
DEN具有肝毒性、基因毒性和免疫毒性, 在机体内代谢生成乙醛等, 可引起肝细胞损害, 产生活性的甲基可使核酸、蛋白质等生命物质发生甲基化反应. DNA被甲基化后就封闭了基因的表达, 致使机体发生肿瘤. DEN腹腔注射染毒可致肝内炎细胞浸润, 出血性坏死及纤维化的发生, 且随着染毒次数的增加而加重, 同时一般情况、血清及肝脏生化指标亦呈相应变化. 采用DEN制作实验性肝癌模型, 其造模死亡率相对较低、周期短, 肝癌形成相对稳定, 所致病变类似人类肝病病理改变, 而且他存在于周围环境并可在人体内自然形成, 因此更具有实际意义.
本实验造模方法选择DEN腹腔注射诱导肝癌模型, 把DEN用生理盐水稀释成浓度为40 g/L的溶液, 按40 mg/kg体质量(1 mL/kg体质量)腹腔注射, 2次/wk, 共8 wk. 无论是动物的一般情况与血清学相关指标, 还是动物病理性变化, 都与医学慢性肝病的表现极为相似.
研究证实体外培养的EPCs, 经DAPI标记后, 移植到大鼠肝癌模型体内, 癌组织冰冻切片荧光显微镜下观察发现, 在肝脏坏死区周缘见到移植细胞, 表明EPCs-DAPI阳性细胞归巢到肝癌组织, 参与了癌组织的发生. 研究表明, EPCs在参与肝癌病理形成过程中, 肝细胞损坏程度与EPCs浓度有关, 同一阶段浓度越高, 肝细胞坏死程度越重; 肝细胞损坏程度与移植EPCs的时间有关, 相同浓度移植时间越长, 肝细胞损坏程度越深; EPCs对DEN所致的肝癌有促进作用, 同一阶段浓度越高, 癌细胞浸润程度越严重; 肝癌的程度与移植EPCs的作用时间有关, 相同浓度移植时间越长, 癌细胞浸润程度越严重. 目前研究发现, EPCs通过VEGF/VEGF-2/flk-1信号通路参与肝癌肿瘤血管新生, Yoshiji等[13]报道, 在肝癌中. VEGF主要通过VEGF-2/flk-l受体起作用, VEGF与VEGF-2/flk-1受体结合后, 激发了相应信号转导机制, 从而发挥其增加微血管通透性, 诱导不同来源内皮细胞分裂、增殖、迁移的作用. 同时改变内皮细胞的基因表达, 产生间质胶原蛋白酶、基质降解蛋白等蛋白酶来降解基质, 最终促进肝癌肿瘤血管生成.
总之, EPCs以其无毒性, 较高的增殖潜能, 没有免疫原性, 较好的肿瘤组织趋化性[14-17], 以及对肝癌微小病灶的敏感性等优点, 在载药靶向治疗肝癌中有着广阔的研究前景, 然而, 由于EPCs的表型尚未明确, 与肝癌的特异性机制, 与靶向性治疗肝癌药物结合的稳定性, 及其数量与载药量和药物释放之间的关系等尚待进一步研究, 所以, 目前关于EPCs载药靶向治疗肝癌的临床研究报道很少, 因此, 更加深入的研究EPCs与肝癌的依赖性, 以求实现最佳肝靶向效果, 将是靶向性治疗肝癌的新热点.
原发性肝癌在我国其死亡率占全部恶性肿瘤的18.8%, 占全球肝癌死亡率的53%, 位居之首, 严重危害人类的健康. 目前对于早期肝癌和小肝癌尽量手术切除, 不能手术的采取放疗、化疗、免疫疗法及中医药治疗, 但是这些理化因素及生物性的治疗措施在杀灭或抑制肝癌细胞的同时, 对正常的肝细胞也会产生不同程度的损伤或抑制作用.
唐南洪, 教授, 福建医科大学附属协和医院省肝胆外科研究所
对于手术无法切除的肝癌, 靶向治疗一直是研究的热点.
Vajkoczy等以鼠胚胎EPCs为模型研究了EPCs在肿瘤模型新血管形成中的机制, 指出EPCs保留其能力可促成成年鼠肿瘤血管发生.
本实验根据EPCs的生物学特性, 制定从外周血中提取, 经体外用bFGF和ECGS诱导分化后, 从形态学和免疫学两个角度对EPCs进行鉴定, 为进一步探讨EPCs在大鼠肝癌模型中动员和靶向到达癌组织的机制提供可靠的基础.
本文创新性较好, 有一定的应用价值.
编辑: 曹丽鸥 电编:何基才
| 1. | Bhattacharyya N, Chien W. Risk of second primary malignancy after radioactive iodine treatment for differentiated thyroid carcinoma. Ann Otol Rhinol Laryngol. 2006;115:607-610. [PubMed] |
| 2. | Spunt SL, Rodriguez-Galindo C, Fuller CE, Harper J, Krasin MJ, Billups CA, Khoury JD. Ewing sarcoma-family tumors that arise after treatment of primary childhood cancer. Cancer. 2006;107:201-206. [PubMed] [DOI] |
| 3. | Greten TF, Manns MP, Reinisch I, Kaatsch P. Hepatocellular carcinoma occurring after successful treatment of childhood cancer with high dose chemotherapy and radiation. Gut. 2005;54:732. [PubMed] [DOI] |
| 4. | May C, Doody JF, Abdullah R, Balderes P, Xu X, Chen CP, Zhu Z, Shapiro L, Kussie P, Hicklin DJ. Identification of a transiently exposed VE-cadherin epitope that allows for specific targeting of an antibody to the tumor neovasculature. Blood. 2005;105:4337-4344. [PubMed] [DOI] |
| 5. | Pinthus JH, Fridman E, Dekel B, Goldberg I, Kaufman-Francis K, Eshhar Z, Harmelin A, Rechavi G, Mor O, Ramon J. ErbB2 is a tumor associated antigen and a suitable therapeutic target in Wilms tumor. J Urol. 2004;172:1644-1648. [PubMed] [DOI] |
| 6. | Zammaretti P, Zisch AH. Adult 'endothelial progenitor cells'. Renewing vasculature. Int J Biochem Cell Biol. 2005;37:493-503. [PubMed] [DOI] |
| 7. | Vajkoczy P, Blum S, Lamparter M, Mailhammer R, Erber R, Engelhardt B, Vestweber D, Hatzopoulos AK. Multistep nature of microvascular recruitment of ex vivo-expanded embryonic endothelial progenitor cells during tumor angiogenesis. J Exp Med. 2003;197:1755-1765. [PubMed] [DOI] |
| 8. | Gill M, Dias S, Hattori K, Rivera ML, Hicklin D, Witte L, Girardi L, Yurt R, Himel H, Rafii S. Vascular trauma induces rapid but transient mobilization of VEGFR2(+)AC133(+) endothelial precursor cells. Circ Res. 2001;88:167-174. [PubMed] |
| 9. | Raida M, Weiss T, Leo C, Lenz D, Tarnok A, Ameri K, Harris AL, Höckel M, Niederwieser D. Circulating endothelial progenitor cells are inversely correlated with the median oxygen tension in the tumor tissue of patients with cervical cancer. Oncol Rep. 2006;16:597-601. [PubMed] |
| 11. | Asakage M, Tsuno NH, Kitayama J, Kawai K, Okaji Y, Yazawa K, Kaisaki S, Osada T, Watanabe T, Takahashi K. Early-outgrowth of endothelial progenitor cells can function as antigen-presenting cells. Cancer Immunol Immunother. 2006;55:708-716. [PubMed] [DOI] |
| 12. | Wei J, Blum S, Unger M, Jarmy G, Lamparter M, Geishauser A, Vlastos GA, Chan G, Fischer KD, Rattat D. Embryonic endothelial progenitor cells armed with a suicide gene target hypoxic lung metastases after intravenous delivery. Cancer Cell. 2004;5:477-488. [PubMed] [DOI] |
| 13. | Yoshiji H, Kuriyama S, Hicklin DJ, Huber J, Yoshii J, Miyamoto Y, Kawata M, Ikenaka Y, Nakatani T, Tsujinoue H. KDR/Flk-1 is a major regulator of vascular endothelial growth factor-induced tumor development and angiogenesis in murine hepatocellular carcinoma cells. Hepatology. 1999;30:1179-1186. [PubMed] [DOI] |
| 14. | Dome B, Timar J, Dobos J, Meszaros L, Raso E, Paku S, Kenessey I, Ostoros G, Magyar M, Ladanyi A. Identification and clinical significance of circulating endothelial progenitor cells in human non-small cell lung cancer. Cancer Res. 2006;66:7341-7347. [PubMed] [DOI] |
| 15. | Rabascio C, Muratori E, Mancuso P, Calleri A, Raia V, Foutz T, Cinieri S, Veronesi G, Pruneri G, Lampertico P. Assessing tumor angiogenesis: increased circulating VE-cadherin RNA in patients with cancer indicates viability of circulating endothelial cells. Cancer Res. 2004;64:4373-4377. [PubMed] [DOI] |
| 16. | Dome B, Timar J, Ostoros G, Paku S. Endothelial progenitor cells in non-small cell lung cancer. J Clin Pathol. 2005;58:447. [PubMed] |
| 17. | Kim HK, Song KS, Kim HO, Chung JH, Lee KR, Lee YJ, Lee DH, Lee ES, Kim HK, Ryu KW. Circulating numbers of endothelial progenitor cells in patients with gastric and breast cancer. Cancer Lett. 2003;198:83-88. [PubMed] [DOI] |