修回日期: 2011-04-12
接受日期: 2011-04-26
在线出版日期: 2011-06-08
胰腺移植是治疗终末期糖尿病的可行性选择. 40来, 外科手术技术及免疫抑制的进步, 显著促进了胰腺移植适应证的增加和移植物存活率的提高. 胰腺移植能替代患者每天的胰岛素注射, 提高生活质量, 同时也需要复杂的手术操作和终生的免疫抑制治疗. 因此发展创伤更小的内分泌替代治疗方法(胰岛移植)的研究一直在进行. 本文概括地介绍了胰腺移植的适应证、供体选择、手术技术、免疫抑制和排斥的现状.
引文著录: 张书浩, 吴云红, 朱亮. 胰腺移植的研究进展. 世界华人消化杂志 2011; 19(16): 1651-1658
Revised: April 12, 2011
Accepted: April 26, 2011
Published online: June 8, 2011
Pancreas transplantation has emerged as the treatment of choice for patients with end-stage diabetes mellitus. Over the last four decades, many improvements have been made in the surgical techniques and immunosuppressive regimens, which contributed to increased number of indications and improved allograft survival. Pancreas transplantation can be justified on the basis that patients replace daily injections of insulin with an improved quality of life but at the expense of a major surgical procedure with a relatively higher complication rate, and lifelong immunosuppression. Therefore, efforts to develop more minimally invasive techniques for endocrine replacement therapy such as islet transplantation have been in progress. This article summarizes the current understanding of pancreas transplantation-associated indications, donor selection, surgical techniques, immunosuppression, and rejection.
- Citation: Zhang SH, Wu HY, Zhu L. Current status of pancreas transplantation. Shijie Huaren Xiaohua Zazhi 2011; 19(16): 1651-1658
- URL: https://www.wjgnet.com/1009-3079/full/v19/i16/1651.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i16.1651
1966年明尼苏达大学附属医院的Kelly和Lillehei等[1]进行了世界首例胰腺移植手术, 此后虽然胰岛移植等其他治疗方法一直在发展, 但胰腺移植依然是治疗糖尿病及其并发症的最佳选择. 糖尿病的治疗关键在于使血糖平稳维持在正常水平. 1993年美国糖尿病控制和并发症实验(diabetes control and complications trial, DCCT)明确指出控制血糖能有效降低Ⅰ型糖尿病合并长期并发症的风险[2]. 随后1998年英国前瞻性糖尿病研究(UK prospective diabetes study, UKPDS)在Ⅱ型糖尿病治疗方面也得出了相似的结论[3]. 但单纯依赖加强胰岛素治疗会引发严重的低血糖, 同时注射胰岛素也无法完全模拟人体正常分泌胰岛素的全部生理调节过程. 而胰腺移植则是通过提供足够的胰岛B细胞来使血糖浓度恢复到正常水平, 这不仅使患者免于每天注射胰岛素, 提高生活质量, 而且实现了胰岛素和胰高血糖素的正常生理分泌, 其长期优势在于可以延缓或改善糖尿病晚期出现的并发症如糖尿病肾病、视网膜病变等[4].
据国际胰腺移植登记处(international pancreas transplantation registry, IPTR)最新统计资料显示, 到目前为止全世界范围内已有超过23 000例胰腺移植被登记在案, 其移植类型可分为3种: 胰肾联合移植(simultaneous pancreas and kidney transplant, SPK)占78%、肾移植后胰腺移植(pancreas after kidney transplant, PAK)占16%、单纯胰腺移植(pancreas transplant alone, PTA)占7%. 而美国器官分配联合网(united network for organ sharing, UNOS)的统计数据显示美国在1988-1998年, 胰腺移植例数呈逐年增加趋势, 在1998-2009年趋于稳定, 其中自1995后SPK与PAK例数保持稳定, 而PTA例数则有所增加.
我国胰腺移植起步较晚, 且由于供体的严重短缺, 及国内医疗水平偏低这两大障碍的存在, 胰腺移植的开展受到了严重的制约. 自1989 年武汉同济医院施行首例SPK以来, 全国共施行胰腺移植约200余例, 其中仅1例PAK, 其余均为SPK[5]. 但随着我国经济的不断发展, 人们对于健康要求的不断增强, 以及医疗技术水平的不断提高, 预计未来胰腺移植将会在我国得到更大范围的开展.
胰腺移植适应证包括: (1)Ⅰ型糖尿病具有以下情况: 存在明确的糖尿病并发症如糖尿病肾病、视网膜病变等; 糖尿病高度不稳定, 血糖难以控制或反复出现低血糖伴意识障碍、严重酮症酸中毒等; 无法脱敏的胰岛素过敏或出现抗皮下注射胰岛素状态; (2)Ⅱ型糖尿病出现严重并发症或血糖难以控制; (3)其他原因导致的全胰切除, 如慢性胰腺炎、胰腺肿瘤、胰腺损伤等[6]. 目前, 接受胰腺移植的患者中约有90%为Ⅰ型糖尿病, 7%-8%为Ⅱ型糖尿病, 极少数为全胰切除[7,8].
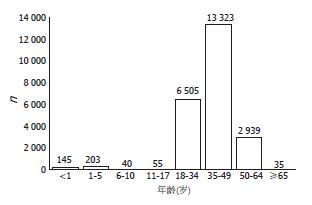
胰腺移植实际上没有年龄限制, 即只要患者足够健康, 能经受手术, 年龄不是胰腺移植的禁忌条件. 在UNOS统计的1988-2009年所有的胰腺移植中, 有13%的受体超过50岁(图1). 虽然年老受体的排斥反应发生率低于年轻受体, 但年龄高于50岁时出现术后并发症的风险更高, 所以在评估风险及益处时必须考虑年龄[7,9]. 若患者有高手术并发症风险如心血管疾病, 但符合其他标准, 可考虑选择胰岛移植.
胰腺移植类型的选择取决于受体的并发症情况(尤其是肾功能)和供体的可用性.
对于仅具有外源性胰岛素控制血糖疗效不佳和轻微蛋白尿但肾功能稳定(肾小球滤过率为80-100 mL/(min•1.73 m2)的患者, PTA是其恰当的选择. 但在移植前必须充分考虑免疫抑制剂的肾毒性. 据早期一项PTA后肾损伤的形态学研究显示, 由于免疫抑制剂的使用, PTA无法提高患者的肾功能[10]. 进一步研究也表明, 由于免疫抑制剂的使用, 接受PTA后患者的肾小球滤过率(glomerular filtration rate, GFR)在接受PTA后1年由(84±33) mL/(min•1.73 m2)降至(52±26) mL/(min•1.73 m2)(P<0.001)[11]. Scalea等[12]在一项包括131例PTA的回顾性研究中也发现, 移植前患者平均GFR为88.9 mL/(min•1.73 m2), 而在移植后平均3.68年时降至55.6 mL/(min•1.73 m2)(P<0.0001), 更有13例在平均4.36年后因终末性肾病而接受肾移植, 且此结果与供体、移植前肾功能、配型均无明显关系. 另一项研究也证实近30%的PTA受体会在10年后由于免疫抑制剂的累积损害而最终接受肾移植(kidney transplantation alone, KTA)[9]. 而且由于肾小球滤过率低于80 mL/(min•1.73 m2)的患者对药物更加敏感, 若接受PTA将在未来更有可能接受肾移植[13,14]. 所以虽然目前认为非尿毒症患者不必接受KTA, 但应将PTA列为引发肾衰竭的独立危险因素, 而排除肾功能不佳的患者. 且若要在PTA后接受KTA, 必须在开始接受透析之前, 而且在免疫抑制方案中还需要加入能维持肾功能的药物[15,16].
肾小球滤过率低于(50-60) mL/(min•1.73 m2)的患者可接受PAK. Kleinclauss等[17]在对比175例PAK与75例适合接受PAK却仅接受KTA的患者后发现, 两组1、5、10年植入肾存活率分别为98%、82%、67%; 100%、84%、62%(P = 0.9), 但4年后GRF分别为(52±20) mL/(min•1.73 m2); (43±16) mL/(min•1.73 m2)(P = 0.016), 这表说明虽然PAK与KTA相比无法提高移植肾脏的存活率, 但移植肾的长期功能优于KTA. 而PAK与SPK相比, 虽然急性排异率相近(4.3% vs 4.0%, P>0.05)[7], 但PAK具有等待时间更短, 肾源更为广泛(可以从已治愈尿毒症的活体捐献者上选择肾)等优点[18]. 在PAK中, 两者间隔可达20 mo, 而且由于PAK由于肾移植先行治愈尿毒症, 改善健康状况, 如考虑到在等待器官移植时的高死亡率, PAK比SPK能起到更好的效果[7,8]. Humar等[19]对比205例PAK与193例SPK后得出, 植入胰腺1、3年存活率分别为77.9%. 78%(P>0.05)与61.7%, 74.1%(P = 0.15), 植入肾3年存活率为94.6%, 83.6%(P = 0.001); 此外, 两组平均等待胰腺移植的时间为167 d, 244 d(P = 0.001), 此结果充分证明了上述观点.
SPK是大多数胰腺移植患者的最佳选择. SPK优势在于既结合了具有最高成功率的KTA, 又使患者同时获得胰腺; 其劣势在于移植耗时长, 取自死亡供体的胰腺必须紧接先行的取自尸体或活体的肾进行移植[8]. 但即使如此, SPK在各种胰腺移植类型中依然是最合理的选择[20]. 其中一个优点便是SPK较透析能使患者具有更长的存活时间, 且具有更好的效果, Pruijm等[21]研究了180例接受SPK的患者, 其中65例优先接受移植, 其余115例优先接受透析, 两组10、15年存活利率分别为71.3%、63.8%、64.8%、45.1%(P<0.05). 另一优点是在于可通过血清肌酐浓度检测两器官的急性排异反应程度, 提高胰腺移植的成功率. 同时, 由于SPK中胰腺取自尸体而肾可取自活体, 即供肾活体可以等至有合适的尸体供胰后再捐肾, 这也取得较好的效果.
大多数胰腺取自脑死亡供体, 部分取自无心跳供体[22], 仅有0.5%的胰腺取自活体[7].
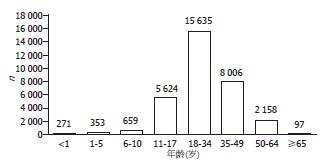
据UNOS最新统计资料显示, 1988-2009年美国供体多分布在11-50岁, 其余各年龄段均有分布(图2). 虽然年龄超过55岁不适于作为供体, 但最新统计结果显示, 在超过700例移植物取自45岁以上供体的SPK中, 移植胰腺5年存活率仍可达到71%[23]. 同时供体的高血糖虽然不是禁忌, 但却是影响移植物长期存活的因素, 最新研究显示, 移植物取自血糖浓度大于200 mg/dL供体的患者移植后相对风险为取自小于200 mg/dL供体患者的1.7倍(P = 0.02)[24]. 而高淀粉酶血症只要不伴其他严重疾病如胰腺炎、转移癌或胰腺损伤, 便不构成器官捐献的禁忌证[25].
体质量方面, 取自小体质量(25-50 kg)供体的胰腺由于较高的血栓形成率(18%), 移植物一年存活率仅为72%[26]. 但Illanes等[27]最近分析了2006-09/2009-10 68例SPK、3例PTA与3例PAK, 包括6例SPK和2例PTA使用小儿供体(9.6-27 kg, 平均体质量20.82 kg), 在平均281 d的观察期内, 两组患者均未接受胰岛素或透析治疗, 其糖化血红蛋白A1c与空腹血糖均正常, 说明小儿(<28 kg)也可作为胰腺移植供体, 此结果可使供体范围扩大10.81%. 相反, 肥胖是拒绝胰腺捐献的常见原因, 因为供体肥胖是胰腺移植的危险因素. 最近Sampaio等[28]在回顾UNOS上2000-2007年的5 725例SPK后发现, 肥胖组(BMI 30-40 kg/m2)与正常组(BMI 18.5-24.9 kg/m2)相比, 两者移植后并发症发病率分别为35.7%, 28.6%(P<0.05). 由此可见, 肥胖至少应列为器官捐献的相对禁忌证. 因此, 英美的分配制度是只要BMI超过35 kg/m2便不能作为供体, 超过30 kg/m2或年龄超过50岁只能作为胰岛移植的供体[29]. 另外, 若胰腺取自活体, 排除标准还应有直系亲属患糖尿病、妊娠糖尿病、BMI>27 kg/m2、HbA1c高于6%、年龄高于50岁等[30].
配型方面, 胰腺移植的配型要求较肝移植更低. ABO不相容移植已经在有高群体反应性抗体(panel reactive antibody, PRA)的受体上施行[31]. T淋巴细胞及B淋巴细胞交叉反应阳性的患者也可成功进行移植[32]. HLA配型方面, SPK及PAK的要求低于PTA[14]. Gruessner等[7]在分析1988-2004年UNOS上所有的胰腺移植记录后发现, 有超过半数的SPK与PAK有5种以上抗原错配, 与未错配的患者相比, 两者存活率并无明显区别, 只是前者会产生更强的免疫损伤.
胰腺的血供重建是利用取自供体髂动脉的Y形血管与供体肠系膜上动脉、脾动脉吻合, 位置位于盆腔与肾移植类似. 动脉常吻合至受体的髂总动脉, 以便静脉可引流至门静脉、髂总静脉或下腔静脉. 外分泌可引流至肠道或膀胱.
门静脉系统引流可使胰岛素首次经肝便有50%参与代谢, 因此在腔静脉引流中, 由于胰岛素不经过肝, 易造成高胰岛素血症. 而原发高胰岛素血症是加剧动脉粥样硬化的原因, 但早期研究无法证明胰腺移植会造成这种后果[33,34]. 最近Stadler等[35]在对比9例腔静脉引流胰肾移植(SPK&PAK)与9名健康体检者后发现, 虽然两组空腹胰岛素分别为20 U/L±6 U/L与9 U/L±3 U/L(P<0.0002), 但在口服葡糖糖耐量试验中两者胰岛素、C蛋白曲线基本一致; 肝胰岛素耐受指数分别为25.0 mg/(min•kg)±13.2 mg/(min•kg)、35.6 mg/(min•kg)±20 mg/(min•kg), 内源性葡糖糖量为1.6 mg/(min•kg)±0.2 mg/(min•kg)、1.7 mg/(min•kg)±0.2 mg/(min•kg); 两组肝细胞内脂含量分别为2.9%±2.5%、4.4%±6.6%, 肌细胞内脂含量分别为1.0%±0.4%、1.0%±0.5%, 说明腔静脉引流引发的高胰岛素血症也不会造成肝与肌肉的脂肪变性.
在治疗高胰岛素血症时, 保持血糖浓度长期稳定是最为重要的. 在使用免疫抑制剂的情况下, SPK与无糖尿病条件下PTA在糖类代谢方面无明显差异[36]. 而在脂类代谢方面, 门静脉引流会提高低密度脂蛋白及载脂蛋白B的浓度, 降低极低密度脂蛋白及游离胆固醇的浓度[37].
门静脉系统引流常伴随外分泌液的引流, 胰外分泌液的处理有许多方法, 包括胰管结扎、十二指肠造口术或直接引流至肠道或膀胱. 80年代Sollinger等[38]将胰管与膀胱相吻合, 后这项技术被Nghiem与Corry[39]改进为经移植十二指肠进行膀胱引流的全胰十二指肠联合移植, 并广泛沿用至今. 在PTA与PAK中使用膀胱引流的最大优势在于, 可在不可逆的高血糖症形成前, 通过检测尿淀粉酶浓度评估早期排斥反应[40]. 同时接受膀胱引流的患者的血栓形成率较接受肠道引流的低[7]. 可能的解释是肠道引流会造成更强的排斥反应, 使血栓形成更为明显[41]. 另一项肠道引流的难点在于吻合口瘘的处理, 若造成感染会使患者需多次手术, 而膀胱引流则可通过长期插管处理. 而且瘘口的形成与是否经手缝合无关[7].
而膀胱引流的劣势在于会造成酸中毒、排尿困难、上泌尿道感染、血尿、恶性增生等疾病. 同时约50%患者会因尿潴留而患反流性胰腺炎[42,43], 同时胰腺分泌的消化酶也会引发膀胱炎[44]. 但患有糖尿病或神经性膀胱病症的患者也可以采用膀胱引流, 即使尿动力学检查异常[45]. 由于以上原因, 有多达25%的接受膀胱引流的患者会在10年内改为肠道引流, 且移植物会在更换中受到损伤[46].
考虑到膀胱引流的潜在并发症和对生活质量的影响, 肠道引流的使用已逐渐增多. 在1995年前仅有不到10%的胰腺移植采用肠道引流, 但最新统计结果表明, 至2002-2003年已有82%的SPK, 72%的PAK, 57%的PTA采用肠道引流; 同时, 采用膀胱引流与肠道引流的1年存活率: SPK为87%, 85%, PAK为80%, 77%, 79%, 72%(P>0.05), 而在SPK中植入肾1年存活率方面为91%, 93%(P = 0.24)[7]. 而最近Jiménez-Romero等[47]在回顾采用膀胱引流(n = 66)与肠道引流(n = 52)的两组胰腺移植后发现, 其腹腔感染率分别为24.2%, 29.4%(P>0.05), 急性排斥率分别为15.2%, 9.8%(P>0.05), 患者及移植物的3年存活率分别为96.1%与65.3%, 89.0%与74.0%(P>0.05). 以上结果说明与膀胱引流相比, 采用肠道引流不会降低移植物与患者的生存率.
在预防胰腺血栓形成中多使用低分子量肝素, 但Schenker等[48]回顾58例使用低分子量肝素与129例普通肝素的SPK后发现, 两组各有7%与17%的植入物产生血栓(P = 0.047), 而需再开腹手术治疗的大出血发生率为6.9%, 7.8%(P>0.05), 两组患者1年存活率分别为98.9%, 97.8%(P>0.05), 移植物1年存活率为89.6%, 74.4%(P>0.05), 说明低分子量肝素较普通肝素虽可降低血栓发生率, 但两者在患者与移植物存活方面的作用并无不同.
胰腺移植伴随有同种异体免疫及自身免疫[4], 而慢性排斥是移植物长期存活的重要影响因素[49], 所以即使同卵双生的双胞胎之间移植也需使用免疫抑制剂以防止自身免疫发生[50]. 在使用环孢菌素(ciclosporin, CSA)的时代, 78%的胰腺移植会发生排斥反应, 并有近30%发生再排斥, 而霉酚酸酯(mycophenolate mofetil, MMF, 又称骁悉)与他克莫司(tacrolimus, FK506)或环孢菌素联用较过去环孢菌素与硫唑嘌呤(azathioprine, AZA, 又称依木兰)联用时排斥率则有明显降低(11% vs 77%, P<0.01)[51]. Gruessner等[7]在分析了2000-2004年美国胰腺移植后得出, 当前MMF与FK506已在65%的胰腺移植中使用, 伴随这些新药物的投入使用, 移植物的1年存活率已不低于80%.
与其他实质性器官移植不同, 使用抗T淋巴细胞抗体的诱导治疗在80%的胰腺移植中被广泛采用[7,52]. 最常用的为抗人T淋巴细胞免疫球蛋白, 根据不同手术类型其剂量在4-12 mg/kg(PTA剂量最高, SPK最低). 另有IL-2受体拮抗剂如巴利昔单抗(basiliximab, 又称舒莱)或达克珠单抗(daclizumab, 又称赛尼派), 抗CD52抗体如阿伦单抗(alemtuzumab)也可作为替代方案. Lo等[53]研究使用IL-2受体拮抗剂(n = 17)与不使用(n = 17)的两组SPK后发现, 患者6 mo存活率为88%, 100%(P>0.05), 胰腺、肾急性排斥率分别为32%, 24%与12%, 12%(P>0.05). 而此后Stratta等[54]的研究结果显示, 使用短期诱导治疗方案的排斥率为8%, 而不采用诱导治疗的排斥率为36%. 这说明使用诱导疗法可以降低排斥反应的发作次数与程度, 但不会改善患者与移植的存活率.
对于何种免疫抑制方案能将排斥反应降到最低, 目前仍在探索之中. 2003年欧洲SPK1期实验中, 在同时使用MMF、类固醇与抗人T细胞免疫球蛋白的条件下, 对比分别使用FK506(n = 103)与环孢菌素(n = 102)的患者, 结果显示两组1年排斥率为27.2%, 38.2%(P = 0.09), 而器官存活方面FK506优于环孢菌素, 其中胰腺存活率为91.3%, 74.5%(P<0.005), 而肾存活率相近, 且使用FK506可以减少MMF用量(平均用量1.36 g/d, 1.67 g/d, P = 0.007)[55]. 而3年后, 两组胰腺存活率分别为89.2%, 72.4%(P = 0.002), 肾脏存活率基本相同, 由以上结果可得胰腺移植中FK506较环孢菌素更为安全有效[56,57].
为把胰岛素耐受及愈合不良限制在最小范围内, MMF与FK506联用, 短期伴用糖皮质激素与诱导治疗是最常用的免疫抑制方案. 而大多数无糖皮质激素的免疫抑制方案中都会再加入抗人T淋巴细胞免疫球蛋白或阿伦单抗. Kaufman等[58]发现两者1年急性排斥率为2.6% vs 6.1%(P>0.05), 2年急性排斥率为5.3%, 8.2%(P>0.05), 说明这两种方案其免疫抑制程度相同. 但阿伦单抗更为廉价, 且病毒感染率更低. Thai等[59]在研究60例联用阿伦单抗与FK506联用的患者(30例SPK, 20例PAK, 10例PTA)后发现, 即使排斥率升至30%, 22 mo内仅有1例(1.7%)出现淋巴组织增生, 11例(11.7%)出现巨细胞病毒感染, 在SPK中平均血清肌酐水平为1.37 g/L±0.33 g/L, 而在PAK中则基本不变, 1年与22 mo后患者、胰腺、肾脏存活率分别为95%, 93%, 90%, 94%, 89%, 87%. 而同类的巴利普单抗与阿伦单抗效果相近, Kaufman等[60]在对比使用巴利昔单抗(n = 155)与阿伦单抗(n = 123)的KTA后得出两组1年急性排斥率为13.5%, 14.9%(P>0.05). 但阿伦单抗是否较其他诱导剂更为有效, 由于缺乏大量随机试验, 目前尚无定论[61].
在制定免疫抑制方案时, 不应仅考虑药物的种类与剂量, 药物的剂型也应在考虑范围之内. 如MMF能引发移植后非感染性腹泻, 而肠溶剂型的霉酚酸酯钠能有效减少腹泻的发生, Rangel等[62]回顾165例SPK, 其中63%使用MMF、36.4%使用肠溶衣霉酚酸酯钠、0.6%使用AZA, 多元变量分析结果得出糖尿病病程(P = 0.049, 95%CI: 1.00-1.13)与MMF的使用(P = 0.013, 95%CI: 0.20-0.82)为移植后急性腹泻的主要影响因素, 而MMF与肠溶衣霉酚酸酯钠两组因腹泻所致直立性低血压发病率为42.4%, 15.1%(P = 0.001), 而降低相同剂量后两组急性肾排斥率无明显不同(30.8% vs 26.7%, P = 0.53), 这说明肠溶衣霉酚酸酯钠需减小剂量的可能性更小且能取得较好效果.
到目前为止胰腺移植已问世40余载, 随着手术指证的明确, 手术技术的持续改进, 与免疫排斥方案的日趋进步, 胰腺移植尤其是SPK, 已经成为治疗终末期Ⅰ型糖尿病的可行方案之一. 但供体来源的缺乏严重制约着胰腺移植的发展, 活体节段性胰腺移植、异种胰腺移植、胎胰移植以及生物组织工程都应成为未来的发展趋势[63,64]. 同时, 各种手术类型的比较, 更为安全有效的免疫抑制方案也都是需要继续研究的问题. 相信随着科学技术的不断发展, 胰腺移植一定能够在将来取得更大的突破.
胰腺移植是治疗终末期糖尿病的理想方法. 40年来, 外科手术技术及免疫抑制的进步, 显著促进了胰腺移植适应证的增加和移植物存活率的提高. 胰腺移植尤其是胰肾联合移植, 已经成为治疗终末期Ⅰ型糖尿病的可行方案之一.
宋振顺, 教授, 中国人民解放军第四军医大学西京医院肝胆外科
供受体年龄对胰腺移植的影响, 肾功能和胰腺移植手术方法的选择, 胰腺移植中的同种异体免疫及自身免疫和免疫排斥的关系, 都是胰腺移植领域亟待解决的问题.
最近Jiménez-Romero等在回顾采用膀胱引流(n = 66)与肠道引流(n = 52)的两组胰腺移植后发现, 其腹腔感染率分别为24.2%, 29.4%(P>0.05), 急性排斥率分别为15.2%, 9.8%(P>0.05), 患者及移植物的3年存活率分别为96.1%与65.3%, 89.0%与74.0%(P>0.05).
本文总结了最近20年胰腺移植的发展, 概括了胰腺移植领域的最新进展, 尤其在胰腺移植的适应证、供体选择、手术技术、免疫抑制和排斥的现状方面做了大量的论述.
本文论述了胰腺移植的最新进展, 对胰腺移植的基础和临床研究有很好的指导意义.
本文科学性较好, 内容详实, 为胰腺移植医师提供了参考依据.
编辑: 李薇 电编:何基才
| 1. | Kelly WD, Lillehei RC, Merkel FK, Idezuki Y, Goetz FC. Allotransplantation of the pancreas and duodenum along with the kidney in diabetic nephropathy. Surgery. 1967;61:827-837. [PubMed] |
| 2. | The Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med. 1993;329:977-986. [PubMed] [DOI] |
| 3. | UK Prospective Diabetes Study (UKPDS) Group. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet. 1998;352:837-853. [PubMed] [DOI] |
| 4. | Tydén G, Reinholt FP, Sundkvist G, Bolinder J. Recurrence of autoimmune diabetes mellitus in recipients of cadaveric pancreatic grafts. N Engl J Med. 1996;335:860-863. [PubMed] [DOI] |
| 7. | Gruessner AC, Sutherland DE. Pancreas transplant outcomes for United States (US) and non-US cases as reported to the United Network for Organ Sharing (UNOS) and the International Pancreas Transplant Registry (IPTR) as of June 2004. Clin Transplant. 2005;19:433-455. [PubMed] [DOI] |
| 8. | Gruessner RW, Sutherland DE, Gruessner AC. Mortality assessment for pancreas transplants. Am J Transplant. 2004;4:2018-2026. [PubMed] [DOI] |
| 9. | Sutherland DE, Gruessner RW, Dunn DL, Matas AJ, Humar A, Kandaswamy R, Mauer SM, Kennedy WR, Goetz FC, Robertson RP. Lessons learned from more than 1,000 pancreas transplants at a single institution. Ann Surg. 2001;233:463-501. [PubMed] [DOI] |
| 10. | Fioretto P, Steffes MW, Sutherland DE, Goetz FC, Mauer M. Reversal of lesions of diabetic nephropathy after pancreas transplantation. N Engl J Med. 1998;339:69-75. [PubMed] [DOI] |
| 11. | Mazur MJ, Rea DJ, Griffin MD, Larson TS, Prieto M, Gloor JM, Schwab TR, Textor SC, Nyberg SL, Stegall MD. Decline in native renal function early after bladder-drained pancreas transplantation alone. Transplantation. 2004;77:844-849. [PubMed] [DOI] |
| 12. | Scalea JR, Butler CC, Munivenkatappa RB, Nogueira JM, Campos L, Haririan A, Barth RN, Philosophe B, Bartlett ST, Cooper M. Pancreas transplant alone as an independent risk factor for the development of renal failure: a retrospective study. Transplantation. 2008;86:1789-1794. [PubMed] [DOI] |
| 13. | Gruessner RW, Sutherland DE, Najarian JS, Dunn DL, Gruessner AC. Solitary pancreas transplantation for nonuremic patients with labile insulin-dependent diabetes mellitus. Transplantation. 1997;64:1572-1577. [PubMed] [DOI] |
| 14. | Odorico JS, Voss B, Munoz Del Rio A, Leverson G, Becker YT, Pirsch JD, Hoffman RM, Sollinger HW. Kidney function after solitary pancreas transplantation. Transplant Proc. 2008;40:513-515. [PubMed] [DOI] |
| 15. | Gruessner RW, Kandaswamy R, Humar A, Gruessner AC, Sutherland DE. Calcineurin inhibitor- and steroid-free immunosuppression in pancreas-kidney and solitary pancreas transplantation. Transplantation. 2005;79:1184-1189. [PubMed] [DOI] |
| 16. | Knight RJ, Kerman RH, McKissick E, Lawless A, Podder H, Katz S, Van Buren CT, Kahan BD. Selective corticosteroid and calcineurin-inhibitor withdrawal after pancreas-kidney transplantation utilizing thymoglobulin induction and sirolimus maintenance therapy. Clin Transplant. 2008;22:645-650. [PubMed] [DOI] |
| 17. | Kleinclauss F, Fauda M, Sutherland DE, Kleinclauss C, Gruessner RW, Matas AJ, Kasiske BL, Humar A, Kandaswamy R, Kaul S. Pancreas after living donor kidney transplants in diabetic patients: impact on long-term kidney graft function. Clin Transplant. 2009;23:437-446. [PubMed] [DOI] |
| 18. | Gruessner AC, Sutherland DE, Dunn DL, Najarian JS, Humar A, Kandaswamy R, Gruessner RW. Pancreas after kidney transplants in posturemic patients with type I diabetes mellitus. J Am Soc Nephrol. 2001;12:2490-2499. [PubMed] |
| 19. | Humar A, Ramcharan T, Kandaswamy R, Matas A, Gruessner RW, Gruessner AC, Sutherland DE. Pancreas after kidney transplants. Am J Surg. 2001;182:155-161. [PubMed] [DOI] |
| 20. | Douzdjian V, Escobar F, Kupin WL, Venkat KK, Abouljoud MS. Cost-utility analysis of living-donor kidney transplantation followed by pancreas transplantation versus simultaneous pancreas-kidney transplantation. Clin Transplant. 1999;13:51-58. [PubMed] [DOI] |
| 21. | Pruijm MT, de Fijter HJ, Doxiadis II, Vandenbroucke JP. Preemptive versus Non-preemptive simultaneous pancreas-kidney transplantation: a single-center, long-term, follow-up study. Transplantation. 2006;81:1119-1124. [PubMed] [DOI] |
| 22. | Fernandez LA, Di Carlo A, Odorico JS, Leverson GE, Shames BD, Becker YT, Chin LT, Pirsch JD, Knechtle SJ, Foley DP. Simultaneous pancreas-kidney transplantation from donation after cardiac death: successful long-term outcomes. Ann Surg. 2005;242:716-723. [PubMed] [DOI] |
| 23. | Salvalaggio PR, Schnitzler MA, Abbott KC, Brennan DC, Irish W, Takemoto SK, Axelrod D, Santos LS, Kocak B, Willoughby L. Patient and graft survival implications of simultaneous pancreas kidney transplantation from old donors. Am J Transplant. 2007;7:1561-1571. [PubMed] [DOI] |
| 24. | Gores PF, Gillingham KJ, Dunn DL, Moudry-Munns KC, Najarian JS, Sutherland DE. Donor hyperglycemia as a minor risk factor and immunologic variables as major risk factors for pancreas allograft loss in a multivariate analysis of a single institution's experience. Ann Surg. 1992;215:217-230. [PubMed] [DOI] |
| 25. | Hesse UJ, Sutherland DE. Influence of serum amylase and plasma glucose levels in pancreas cadaver donors on graft function in recipients. Diabetes. 1989;38 Suppl 1:1-3. [PubMed] |
| 26. | Schulz T, Schenker P, Flecken M, Kapischke M. Donors with a maximum body weight of 50 kg for simultaneous pancreas-kidney transplantation. Transplant Proc. 2005;37:1268-1270. [PubMed] [DOI] |
| 27. | Illanes HG, Quarin CM, Maurette R, Sánchez NG, Reniero L, Casadei DH. Use of small donors (& lt; 28 kg) for pancreas transplantation. Transplant Proc. 2009;41:2199-2201. [PubMed] [DOI] |
| 28. | Sampaio MS, Reddy PN, Kuo HT, Poommipanit N, Cho YW, Shah T, Bunnapradist S. Obesity was associated with inferior outcomes in simultaneous pancreas kidney transplant. Transplantation. 2010;89:1117-1125. [PubMed] [DOI] |
| 29. | Stegall MD, Dean PG, Sung R, Guidinger MK, McBride MA, Sommers C, Basadonna G, Stock PG, Leichtman AB. The rationale for the new deceased donor pancreas allocation schema. Transplantation. 2007;83:1156-1161. [PubMed] [DOI] |
| 30. | White SA, Shaw JA, Sutherland DE. Pancreas transplantation. Lancet. 2009;373:1808-1817. [PubMed] [DOI] |
| 31. | Stratta RJ, Bennett L. Pancreas underutilization in the United States: analysis of United Network for Organ Sharing data. Transplant Proc. 1997;29:3309-3310. [PubMed] [DOI] |
| 32. | Khwaja K, Wijkstrom M, Gruessner A, Noreen H, Sutherland DE, Humar A, Kandaswamy R, Gruessner RW. Pancreas transplantation in crossmatch-positive recipients. Clin Transplant. 2003;17:242-248. [PubMed] [DOI] |
| 33. | Fontbonne A, Charles MA, Thibult N, Richard JL, Claude JR, Warnet JM, Rosselin GE, Eschwège E. Hyperinsulinaemia as a predictor of coronary heart disease mortality in a healthy population: the Paris Prospective Study, 15-year follow-up. Diabetologia. 1991;34:356-361. [PubMed] [DOI] |
| 34. | Stout RW. Insulin and atheroma. 20-yr perspective. Diabetes Care. 1990;13:631-654. [PubMed] [DOI] |
| 35. | Stadler M, Anderwald C, Pacini G, Zbýn S, Promintzer-Schifferl M, Mandl M, Bischof M, Gruber S, Nowotny P, Luger A. Chronic peripheral hyperinsulinemia in type 1 diabetic patients after successful combined pancreas-kidney transplantation does not affect ectopic lipid accumulation in skeletal muscle and liver. Diabetes. 2010;59:215-218. [PubMed] [DOI] |
| 36. | Katz H, Homan M, Velosa J, Robertson P, Rizza R. Effects of pancreas transplantation on postprandial glucose metabolism. N Engl J Med. 1991;325:1278-1283. [PubMed] [DOI] |
| 37. | Hughes TA, Gaber AO, Amiri HS, Wang X, Elmer DS, Winsett RP, Hathaway DK, Hughes SM. Kidney-pancreas transplantation. The effect of portal versus systemic venous drainage of the pancreas on the lipoprotein composition. Transplantation. 1995;60:1406-1412. [PubMed] [DOI] |
| 38. | Sollinger HW, Cook K, Kamps D, Glass NR, Belzer FO. Clinical and experimental experience with pancreaticocystostomy for exocrine pancreatic drainage in pancreas transplantation. Transplant Proc. 1984;16:749-751. [PubMed] |
| 39. | Nghiem DD, Corry RJ. Technique of simultaneous renal pancreatoduodenal transplantation with urinary drainage of pancreatic secretion. Am J Surg. 1987;153:405-406. [PubMed] [DOI] |
| 40. | Prieto M, Sutherland DE, Fernandez-Cruz L, Heil J, Najarian JS. Urinary amylase monitoring for early diagnosis of pancreas allograft rejection in dogs. J Surg Res. 1986;40:597-604. [PubMed] [DOI] |
| 41. | Drachenberg CB, Papadimitriou JC, Farney A, Wiland A, Blahut S, Fink JC, Philosophe B, Schweitzer E, Lal T, Anderson L. Pancreas transplantation: the histologic morphology of graft loss and clinical correlations. Transplantation. 2001;71:1784-1791. [PubMed] [DOI] |
| 42. | Hickey DP, Bakthavatsalam R, Bannon CA, O'Malley K, Corr J, Little DM. Urological complications of pancreatic transplantation. J Urol. 1997;157:2042-2048. [PubMed] [DOI] |
| 43. | Sollinger HW, Odorico JS, Knechtle SJ, D'Alessandro AM, Kalayoglu M, Pirsch JD. Experience with 500 simultaneous pancreas-kidney transplants. Ann Surg. 1998;228:284-296. [PubMed] [DOI] |
| 44. | See WA, Smith JL. Urinary levels of activated trypsin in whole-organ pancreas transplant patients with duodenocystostomies. Transplantation. 1991;52:630-633. [PubMed] [DOI] |
| 45. | Taylor RJ, Mays SD, Grothe TJ, Strtta RJ. Correlation of preoperative urodynamic findings to postoperative complications following pancreas transplantation. J Urol. 1993;150:1185-1188. [PubMed] |
| 46. | Sollinger HW, Sasaki TM, D'Alessandro AM, Knechtle SJ, Pirsch JD, Kalayoglu M, Belzer FO. Indications for enteric conversion after pancreas transplantation with bladder drainage. Surgery. 1992;112:842-845; discussion 842-845. [PubMed] |
| 47. | Jiménez-Romero C, Manrique A, Meneu JC, Cambra F, Andrés A, Morales JM, González E, Hernández E, Morales E, Praga M. Compative study of bladder versus enteric drainage in pancreas transplantation. Transplant Proc. 2009;41:2466-2468. [PubMed] [DOI] |
| 48. | Schenker P, Vonend O, Ertas N, Wunsch A, Schaeffer M, Rump LC, Viebahn R. Incidence of pancreas graft thrombosis using low-molecular-weight heparin. Clin Transplant. 2009;23:407-414. [PubMed] [DOI] |
| 49. | Humar A, Khwaja K, Ramcharan T, Asolati M, Kandaswamy R, Gruessner RW, Sutherland DE, Gruessner AC. Chronic rejection: the next major challenge for pancreas transplant recipients. Transplantation. 2003;76:918-923. [PubMed] [DOI] |
| 50. | Sutherland DE, Sibley R, Xu XZ, Michael A, Srikanta AM, Taub F, Najarian J, Goetz FC. Twin-to-twin pancreas transplantation: reversal and reenactment of the pathogenesis of type I diabetes. Trans Assoc Am Physicians. 1984;97:80-87. [PubMed] |
| 51. | Stegall MD, Simon M, Wachs ME, Chan L, Nolan C, Kam I. Mycophenolate mofetil decreases rejection in simultaneous pancreas-kidney transplantation when combined with tacrolimus or cyclosporine. Transplantation. 1997;64:1695-1700. [PubMed] [DOI] |
| 52. | Cantarovich D, Vistoli F. Minimization protocols in pancreas transplantation. Transpl Int. 2009;22:61-68. [PubMed] [DOI] |
| 53. | Lo A, Stratta RJ, Alloway RR, Egidi MF, Shokouh-Amiri MH, Grewal HP, Gaber LW, Gaber AO. Initial clinical experience with interleukin-2 receptor antagonist induction in combination with tacrolimus, mycophenolate mofetil and steroids in simultaneous kidney-pancreas transplantation. Transpl Int. 2001;14:396-404. [PubMed] [DOI] |
| 54. | Stratta RJ, Alloway RR, Lo A, Hodge E. Two-dose daclizumab regimen in simultaneous kidney-pancreas transplant recipients: primary endpoint analysis of a multicenter, randomized study. Transplantation. 2003;75:1260-1266. [PubMed] [DOI] |
| 55. | Bechstein WO, Malaise J, Saudek F, Land W, Fernandez-Cruz L, Margreiter R, Nakache R, Secchi A, Vanrenterghem Y, Tydén G. Efficacy and safety of tacrolimus compared with cyclosporine microemulsion in primary simultaneous pancreas-kidney transplantation: 1-year results of a large multicenter trial. Transplantation. 2004;77:1221-1228. [PubMed] [DOI] |
| 56. | Saudek F, Malaise J, Boucek P, Adamec M. Efficacy and safety of tacrolimus compared with cyclosporin microemulsion in primary SPK transplantation: 3-year results of the Euro-SPK 001 trial. Nephrol Dial Transplant. 2005;20 Suppl 2:ii3-ii10, ii62. [PubMed] |
| 57. | Malaise J, Saudek F, Boucek P, Adamec M, Van Ophem D, Squifflet JP. Tacrolimus compared with cyclosporine microemulsion in primary simultaneous pancreas-kidney transplantation: the EURO-SPK 3-year results. Transplant Proc. 2005;37:2843-2845. [PubMed] [DOI] |
| 58. | Kaufman DB, Leventhal JR, Gallon LG, Parker MA. Alemtuzumab induction and prednisone-free maintenance immunotherapy in simultaneous pancreas-kidney transplantation comparison with rabbit antithymocyte globulin induction - long-term results. Am J Transplant. 2006;6:331-339. [PubMed] [DOI] |
| 59. | Thai NL, Khan A, Tom K, Blisard D, Basu A, Tan HP, Marcos A, Fung JJ, Starzl TE, Shapiro R. Alemtuzumab induction and tacrolimus monotherapy in pancreas transplantation: One- and two-year outcomes. Transplantation. 2006;82:1621-1624. [PubMed] [DOI] |
| 60. | Kaufman DB, Leventhal JR, Axelrod D, Gallon LG, Parker MA, Stuart FP. Alemtuzumab induction and prednisone-free maintenance immunotherapy in kidney transplantation: comparison with basiliximab induction--long-term results. Am J Transplant. 2005;5:2539-2548. [PubMed] [DOI] |
| 61. | Watson CJ, Bradley JA, Friend PJ, Firth J, Taylor CJ, Bradley JR, Smith KG, Thiru S, Jamieson NV, Hale G. Alemtuzumab (CAMPATH 1H) induction therapy in cadaveric kidney transplantation--efficacy and safety at five years. Am J Transplant. 2005;5:1347-1353. [PubMed] [DOI] |
| 62. | Rangel EB, Melaragno CS, Sá JR, Gonzalez AM, Linhares MM, Salzedas A, Medina-Pestana JO. Mycophenolate mofetil versus enteric-coated mycophenolate sodium after simultaneous pancreas-kidney transplantation. Transplant Proc. 2009;41:4265-4269. [PubMed] [DOI] |