修回日期: 2011-05-17
接受日期: 2011-05-20
在线出版日期: 2011-05-28
目的: 检测人大肠腺癌标本中hARD1的表达及其与肿瘤分化的相关性.
方法: 收集昆明医学院第一附属医院手术切除的大肠癌患者大肠腺癌组织、癌旁组织及大肠正常切缘组织标本100例, 排除术前化疗的2例, 共98例, 其中高分化腺癌30例, 中分化腺癌27例, 低分化腺癌31例, 黏液腺癌10例. 细胞免疫化学法检测hARD1在大肠腺癌组织、大肠腺瘤和正常大肠组织中的表达. 应用图像分析技术检测hARD1在不同大肠癌组织中的表达差异.
结果: hARD1在人大肠腺癌组织中高表达(78.57%), 大肠腺瘤组织中低表达(33.33%), 正常大肠组织几乎不表达(0%). hARD1在人高分化腺癌中的表达明显高于中、低分化腺癌(P<0.05), 中分化腺癌中的表达又高于低分化腺癌(P<0.05), 且在黏液腺癌中表达更低(P<0.05).
结论: hARD1在大肠癌组织、大肠腺瘤和正常大肠组织表达有差异. hARD1在不同分化的大肠癌组织中表达也有差异. 其中在高分化腺癌中表达最高.
引文著录: 白松, 邵佳发, 王维琦, 钟孝斌, 赵翔宇. hARD1在人大肠腺癌中的表达及与肿瘤分化的相关性. 世界华人消化杂志 2011; 19(15): 1585-1590
Revised: May 17, 2011
Accepted: May 20, 2011
Published online: May 28, 2011
AIM: To examine the expression of human arrest defective 1 (hARD1) in human colorectal carcinoma and to analyze its relationship with tumor differentiation.
METHODS: A total of 98 colorectal carcinoma samples (including 30 cases of well-differentiated adenocarcinoma, 27 cases of moderately differentiated adenocarcinoma, 31 cases of lowly differentiated adenocarcinoma, and 10 cases of mucous adenoma) were collected from the First Affiliated Hospital of Kunming medical College and used in this study. Immunohistochemistry was used to detect hARD1 expression in the above tissue samples.
RESULTS: hARD1 was highly expressed in colorectal carcinoma (78.57%), moderately or lowly in adenoma (33.33%), and hardly found in normal colorectal tissue (0%). hARD1 expression was significantly higher in well differentiated adenocarcinoma than in moderately and lowly differentiated adenocarcinoma (P < 0.05), in moderately differentiated adenocarcinoma than in lowly differentiated adenocarcinoma (P < 0.05), and in adenocarcinoma than in mucous adenoma (P< 0.05).
CONCLUSION: hARD1 expression was high in colorectal carcinoma, and differential expression of hARD1 was detected among colorectal carcinoma, adenoma and normal colorectal tissue. hARD1 expression was related to tumor differentiation in colorectal adenocarcinoma.
- Citation: Bai S, Shao JF, Wang WQ, Zhong XB, Zhao XY. Correlation between hARD1 expression and tumor differentiation in human colorectal carcinoma. Shijie Huaren Xiaohua Zazhi 2011; 19(15): 1585-1590
- URL: https://www.wjgnet.com/1009-3079/full/v19/i15/1585.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i15.1585
近年来, 大肠腺癌的发病率不断升高, 而对于其早期诊断依然缺少有效方法. 目前普遍认为大肠腺癌是多因素作用、多基因参与、多阶段发展的疾病. 近年来分子生物学的长足进展, 使得大肠腺癌治疗的研究方向朝着更新更微观发展, 对其各种分子机制、细胞周期调控、凋亡分化诱导的研究越来越深入. hARD1基因定位于染色体Xq28区域, 全长5019 bp, 含有7个外显子, 编码235个氨基酸的蛋白质, 其相对分子量约26 500 Da[1]. hARD1广泛表达于人体多种组织, hARD1基因表达的蛋白与N乙酰化转移酶NATH结合形成具有乙酰转移酶活性的复合物, 发挥蛋白质N-α-氨基乙酰化功能, 目前研究发现hARD1能在细胞生长的过程包括细胞凋亡、增殖、分化、代谢等方面发挥作用, 故与肿瘤的发生, 发展密切相关.
收集2009-04/2010-04昆明医学院第一附属医院手术切除的100例大肠腺癌患者癌组织、癌旁组织及大肠正常切缘组织标本, 排除术前化疗的2例, 共98例, 平均年龄63.5岁, 其中男61例, 女37例, 高分化腺癌30例, 中分化腺癌27例, 低分化腺癌31例, 黏液腺癌10例. 癌旁组织为距癌组织1 cm的组织, 正常切缘组织为距癌组织10 cm以上组织. 同时收取肠镜切除大肠腺瘤21例及正常大肠组织15例(经痔疮手术, 切除的多余的废弃的大肠组织, 经医院伦理委员会同意使用). 所有标本均符合2000年WHO大肠癌诊断分类标准. 所有新鲜组织取材后迅速分装于冻存管中放于液氮罐低温保存备用.
免疫组织化学法检测hARD1在98例大肠腺癌、21例大肠腺瘤、15例正常大肠组织中的表达. 石蜡包埋组织标本, 以3-4 μm的厚度作连续切片, 利用辣根酶标记的链霉亲合素(SP)染色法进行免疫组化染色, PBS代替一抗作阴性对照, 用CEA代替一抗做标准阳性对照. 实验过程中以鼠抗人ARD1单克隆抗体作为一抗, 结果判定: 采用半定量积分法, 应用计算机图像分析技术对免疫组织化学结果进行定量.
统计学处理 应用SPSS17.0统计软件包进行数据统计. 其中计数资料采用秩和检验, 计量资料采用单因素方差分析, hARD1与临床病理因素采用多因素回归分析, 并做参照单位分析图.
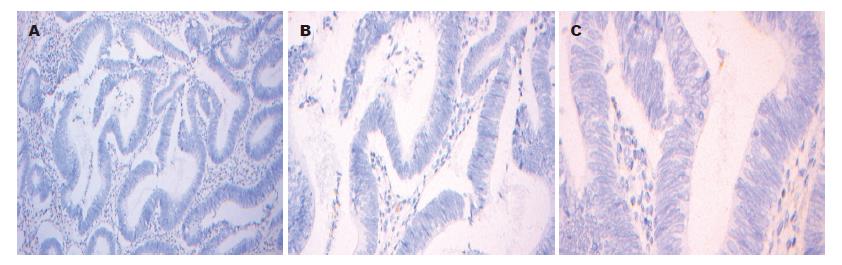
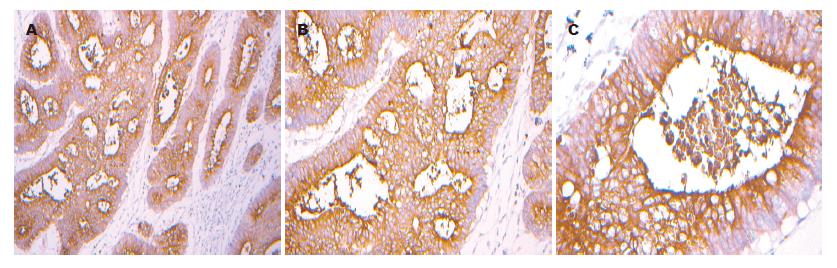
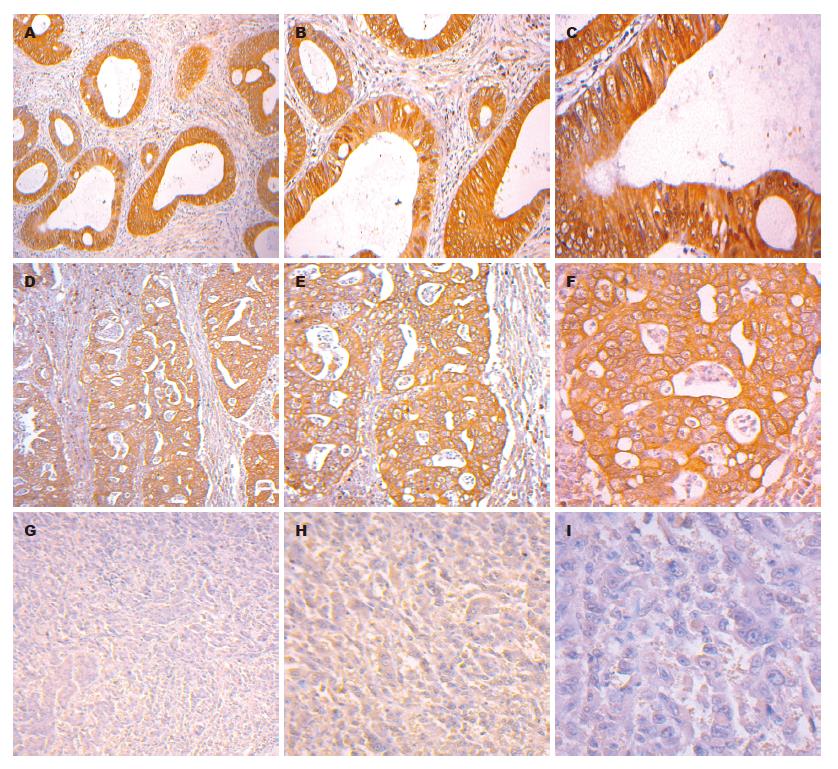
用PBS代替一抗做阴性对照, 未见阳性染色(图1); 用CEA代替一抗做阳性对照, 见癌组织实质细胞质呈棕黄色颗粒染色(图2); hARD1主要表达于癌组织区实质细胞质(亦可见胞核), 呈现棕黄色颗粒染色, 与CEA阳性染色相近(图3).
hARD1蛋白在大肠腺癌组织中阳性77例, 阳性率为78.57%, 而大肠腺瘤阳性率为33.33%, 正常大肠组织阳性率为0%(图4). 大肠腺癌组织中hARD1表达与腺瘤组织相比, 存在显著性差异(P<0.01), 大肠腺癌组织中hARD1表达与正常组织相比, 存在显著性差异(P<0.01). 应用计算机图像分析软件对各组中hARD1表达强度的分析, 大肠腺癌组织中的hARD1表达强度为42.74±20.62, 大肠腺瘤为26.91±14.72, 正常大肠组织为9.72±4.9(表1). 大肠腺癌组织与大肠腺瘤的表达强度相比, 有显著性差异(P<0.01), 与正常大肠组织的表达强度相比有显著性差异(P<0.01).
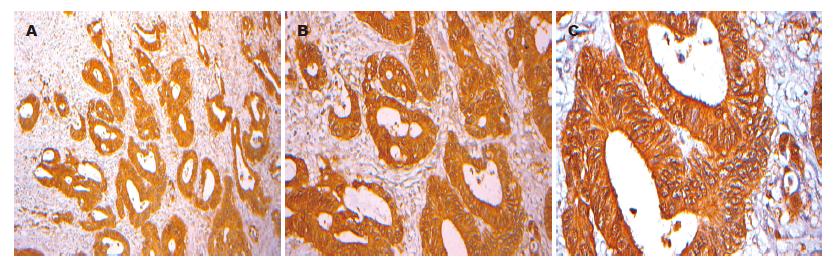
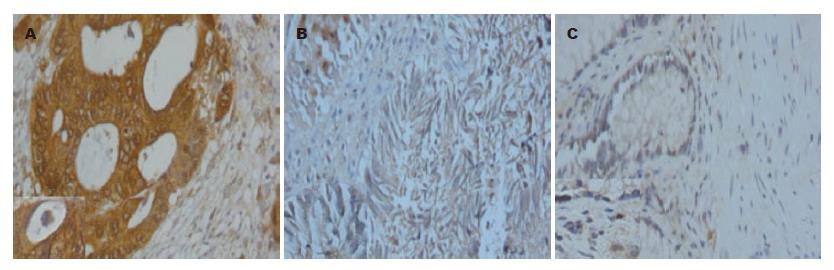
在高分化大肠腺癌组织中hARD1阳性表达率为96.66%, 中分化大肠腺癌组织中hARD1阳性表达率为81.48%, 低分化腺癌中hARD1阳性表达率为74.19%, 黏液腺癌中hARD1阳性表达率为30%(图5, 6), 经秩和检验两两比较差异均具显著性, 各组组间比较存在显著性差异(P<0.01). 在大肠腺癌组织中hARD1的表达率依次为, 高分化腺癌>中分化腺癌>低分化腺癌>黏液腺癌(表2, 图5, 6).
在大肠腺癌组织中, 高分化腺癌阳性表达强度(PU)为63.25±12.36, 中分化腺癌阳性表达强度为47.4±7.48, 低分化腺癌阳性表达强度为30.94±9.82, 黏液腺癌阳性表达强度为5.18±9.63. 经过统计分析, 各组之间存在显著性差异(P<0.05). 大肠腺癌组织阳性表达强度依次为, 高分化腺癌>中分化腺癌>低分化腺癌>黏液腺癌(表2, 图5, 6).
以hARD1为自变量, 性别、年龄、浸润程度、转移与否为因变量, 进行多因素方差分析, 肿瘤部位与hARD1相关(P = 0.000), 与其余的临床指标无相关性. 但对肿瘤部位(升结肠、横结肠、乙状结肠、直肠)进行LSD多重比较未发现统计学差异.
蛋白的乙酰化和去乙酰化是调节细胞凋亡、细胞循环和肿瘤生成翻译后重要的修饰. 乙酰化普遍发生于真核生物的各种蛋白质, 是一种重要的蛋白质翻译后修饰, 或伴随着蛋白质的翻译过程发生, 在各种不同的真核生物蛋白质中大约85%存在乙酰化修饰, 对蛋白质的稳定性和活性产生重大影响[2]. 蛋白质乙酰化由一套范围很广的乙酰基转移酶催化, 将乙酰基从乙酰CoA转移至N-末端的α-氨基酸或赖氨酸残基的ε-氨基的不同位置.
本研究首次发现hARD1表达水平在由低到高的表达顺序为正常大肠组织-腺瘤-腺癌. 这说明hARD1的表达水平, 与临床上肿瘤发生发展有一定的相关性. 腺瘤作为正常组织向癌发展过程中的一个环节, 其hARD1表达水平介于正常组织和癌组织之间. 可能提示hARD1随着细胞的变异而表达增强, 进一步说明hARD1与大肠腺癌的发展存在密切的关系.
本实验还首次证实了hARD1与大肠腺癌分化有关, 并且进一步证实了hARD1与大肠腺癌分化的具体关系: 在大肠腺癌中, hARD1表达水平在高、中、低分化、黏液腺癌中表达存在差异, 在高分化中表达最高, 由低到高顺序为黏液腺癌-低分化腺癌-中分化腺癌-高分化腺癌. 癌组织的分化程度是表示肿瘤细胞异型性程度的一个指标, 也是一个判定肿瘤恶性程度的标准. 在大肠腺癌的类型中, 黏液腺癌为一个特殊类型, 临床上恶性程度较高. 免疫组化的结果显示黏液腺癌的hARD1表达最低. 在癌组织中, 由高分化-中分化到低分化, 肿瘤的恶性程度不断增加, hARD1的表达也越来越少, 提示hARD1可能随着肿瘤恶性程度的增加而表达降低.
在正常大肠组织-腺瘤-癌组织中hARD1表达渐增, 对比分化上恶性度越高hARD1表达渐减少, 我们发现在腺瘤中hARD1表达的水平较低, 而进入癌发生阶段后, 随着分化程度的不同, hARD1表达存在明显的上升, 其具体机制尚待今后进一步研究, 我们猜测, 在大肠腺癌发生过程中, hARD1可能是一条新的细胞蛋白修饰途径的关键因子, 不同于正常细胞中的蛋白修饰, 可能是一种较为独立的途径. 目前发现和大肠腺癌分化相关的因子有PKCa(protein kinase a)、cyclinD1、CDK4[3-6]、上皮型钙黏蛋白(E cadherin)[7]、层粘连蛋白(LN)[8,9], 前三者与低分化有密切关系, 组织分化减低伴随E cadherin表达下调和LN的缺失. 目前蛋白组学研究证实大肠腺癌的低分化和高分化组织间, 蛋白质表达存在差异[10,11], 与本实验相联系, 提示可以通过蛋白组学的方法, 进一步研究hARD1与大肠腺癌分化更深层次的关系.
本研究对98例大肠腺癌hARD1表达与临床及病理多个因素进行了多因素统计学分析, 结果显示hARD1的表达与性别、年龄、肿瘤部位、肿瘤浸润深度、转移无统计学意义, 提示hARD1的表达可能与性别、年龄、肿瘤部位、浸润深度、转移无关.
总之, 在大肠腺癌中hARD1的表达水平, 不仅与组织的类型有关, 还与组织分化类型有关. 由此可见, hARD1与癌发展过程中的组织变化, 范围变化和分化改变有着密切的关系. 从这三方面可以说明, hARD1在大肠腺癌发展的过程中, 与癌组织的发生发展有着极为密切的联系. 具体渐变过程见上. 本实验证实了hARD1与大肠腺癌几个临床因素之间的关系, Arnesen提出了hARD1可能作为肿瘤治疗的新靶点的设想[11]. 在大肠腺癌的研究中, 我们发现, hARD1与大肠腺癌密切的关系, 并且有一定的规律. 这为了进一步研究大肠腺癌中hARD1的作用, 打下了坚实的基础. hARD1与大肠腺癌分化程度存在联系, 而其是否在癌组织发展过程中促使组织分化成熟过程依然未知.
大肠癌近年来发病率上升, 其发病机制被认为是多因素、多因子和多阶段共同参与. 目前研究发现hARD1能在细胞生长的过程包括细胞凋亡、增殖、分化、代谢等方面发挥作用, 故与肿瘤的发生, 发展密切相关. hARD1与乳腺癌、肝癌、肺癌和甲状腺癌有密切的关系, 其与大肠癌关系的研究较少. 所以研究hARD1与大肠癌的多种因素的关系显得更加重要.
刘丽江, 教授, 江汉大学医学院病理学与病理生理学教研室
2008年, 任婷婷等研究发现, ARD1在大肠腺癌组织和肠炎组织表达有差异. 而且越来越多的研究证实hARD1与beta-catinen、cyclin D1等多种因子有密切关系. 但是与大肠癌临床因素的研究一直还未开展.
目前对hARD1的研究显示其与细胞凋亡和增殖有关, Arnesen等提出了hARD1可能是治疗癌症的新靶点. 但是临床研究较少, 对于肺癌、乳腺癌和甲状腺癌的研究发现, hARD1在不同肿瘤中发挥不同的作用, 而其对于大肠腺癌的研究也只有任婷婷等报道的大肠腺癌组织与肠炎组织的表达差异.
本研究首次发现hARD1表达水平由大肠组织-腺瘤到腺癌依次升高, 这说明hARD1的表达水平, 与临床上肿瘤发生发展有一定的相关性, 提示hARD1随着细胞的变异而表达增强.
本文应用免疫组织化学法检测hARD1在大肠癌组织、大肠腺瘤和正常大肠组织中的表达, 发现: hARD1在人大肠腺癌组织中高表达, 在大肠腺瘤中低表达, 在正常大肠组织不表达; hARD1在不同分化的大肠腺癌组织中均表达并有差异. 提示: hARD1与大肠腺癌的发展存在密切的关系, 为大肠腺癌基因研究提供了新的方向, 为进一步研究hARD1与大肠腺癌的关系奠定了基础.
本研究选题尚可, 对临床医师有一定的参考价值.
编辑: 李军亮 电编:李薇
| 1. | Arnesen T, Anderson D, Baldersheim C, Lanotte M, Varhaug JE, Lillehaug JR. Identification and characterization of the human ARD1-NATH protein acetyltransferase complex. Biochem J. 2005;386:433-443. [PubMed] [DOI] |
| 2. | Meinnel T, Peynot P, Giglione C. Processed N-termini of mature proteins in higher eukaryotes and their major contribution to dynamic proteomics. Biochimie. 2005;87:701-712. [PubMed] [DOI] |
| 3. | Whittaker SR, Walton MI, Garrett MD, Workman P. The Cyclin-dependent kinase inhibitor CYC202 (R-roscovitine) inhibits retinoblastoma protein phosphorylation, causes loss of Cyclin D1, and activates the mitogen-activated protein kinase pathway. Cancer Res. 2004;64:262-272. [PubMed] [DOI] |
| 4. | Lahn M, Paterson BM, Sundell K, Ma D. The role of protein kinase C-alpha (PKC-alpha) in malignancies of the gastrointestinal tract. Eur J Cancer. 2004;40:10-20. [PubMed] [DOI] |
| 5. | Yan KX, Liu BC, Shi XL, You BR, Xu M. Role of cyclinD1 and CDK4 in the carcinogenesis induced by silica. Biomed Environ Sci. 2005;18:286-296. [PubMed] |
| 6. | Reddy HK, Mettus RV, Rane SG, Graña X, Litvin J, Reddy EP. Cyclin-dependent kinase 4 expression is essential for neu-induced breast tumorigenesis. Cancer Res. 2005;65:10174-10178. [PubMed] [DOI] |
| 7. | Herbst TJ, McCarthy JB, Tsilibary EC, Furcht LT. Differential effects of laminin, intact type IV collagen, and specific domains of type IV collagen on endothelial cell adhesion and migration. J Cell Biol. 1988;106:1365-1373. [PubMed] [DOI] |
| 8. | Offerhaus GJ, Giardiello FM, Bruijn JA, Stijnen T, Molyvas EN, Fleuren GJ. The value of immunohistochemistry for collagen IV expression in colorectal carcinomas. Cancer. 1991;67:99-105. [PubMed] [DOI] |
| 9. | Stierum R, Gaspari M, Dommels Y, Ouatas T, Pluk H, Jespersen S, Vogels J, Verhoeckx K, Groten J, van Ommen B. Proteome analysis reveals novel proteins associated with proliferation and differentiation of the colorectal cancer cell line Caco-2. Biochim Biophys Acta. 2003;1650:73-91. [PubMed] |
| 10. | Stulík J, Osterreicher J, Koupilová K, Knízek A, Bures J, Jandík P, Langr F, Dedic K, Jungblut PR. The analysis of S100A9 and S100A8 expression in matched sets of macroscopically normal colon mucosa and colorectal carcinoma: the S100A9 and S100A8 positive cells underlie and invade tumor mass. Electrophoresis. 1999;20:1047-1054. [PubMed] [DOI] |
| 11. | Arnesen T, Thompson PR, Varhaug JE, Lillehaug JR. The protein acetyltransferase ARD1: a novel cancer drug target? Curr Cancer Drug Targets. 2008;8:545-553. [PubMed] [DOI] |