修回日期: 2011-04-18
接受日期: 2011-04-26
在线出版日期: 2011-05-28
目的: 研究中药丹参有效活性成分丹参酮ⅡA(TanⅡA)对人结肠癌HCT-116细胞的生长抑制作用及其调控COX-2对HCT-116细胞VEGF表达的影响.
方法: 利用MTT法检测不同浓度的TanⅡA对人结肠癌HCT-116细胞的生长抑制作用, 将pGL3-Basic-COX-2-promoter重组质粒和pRL-TK内参质粒共转染HCT-116细胞, 分为空白组、对照组和TanⅡA组. 药物作用48 h后, 双荧光素酶测定法检测COX-2启动子转录活性. 将含COX-2 CDS序列的pIRESI-COX-2重组质粒转染HCT-116细胞, 分为空白组、对照组和TanⅡA组, ELISA法检测细胞培养液中VEGF的表达.
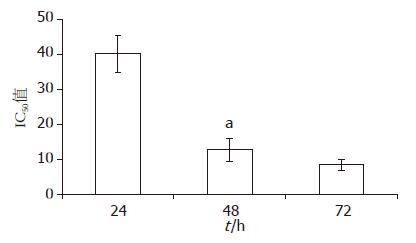
结果: TanⅡA对人结肠癌HCT-116细胞有明显的增殖抑制作用, 24、48、72 h的IC50值分别为40.3 μmol/L±5.22 μmol/L, 12.9 μmol/L ±3.24 μmol/L, 8.5 μmol/L±1.47 μmol/L, 24 h的最大无毒剂量为10 μmol/L. 转染pGL3-Basic-COX-2-promoter重组质粒48 h后, COX-2启动子活性明显上调(对照组 vs 空白组, P<0.01), 而不同浓度的TanⅡA可明显抑制COX-2启动子活性. 转染pIRESI-COX-2重组质粒后, 细胞培养液VEGF浓度升高(对照组 vs 空白组, P<0.05), 而10 μmol/L TanⅡA处理后, VEGF的表达显著下调(TanⅡA vs 对照组, P<0.05).
结论: TanⅡA能明显抑制人结直肠癌细胞增殖, 并通过调控人结肠癌细胞COX-2表达抑制结直肠癌细胞VEGF的表达.
引文著录: 周利红, 王炎, 范忠泽, 吴琼, 刘宣, 慈书俊, 李琦. 丹参酮ⅡA调节COX-2对人结肠癌HCT-116细胞VEGF表达的影响. 世界华人消化杂志 2011; 19(15): 1561-1567
Revised: April 18, 2011
Accepted: April 26, 2011
Published online: May 28, 2011
AIM: To investigate the effect of tanshinone IIA (Tan IIA), an active component of salvia miltiorrhiza, on cell proliferation and cyclooxygenase-2 (COX-2)-regulated vascular endothelial growth factor (VEGF) expression in human colon cancer HCT-116 cells.
METHODS: MTT assay was used to evaluate the effect of Tan IIA on the proliferation of HCT-116 cells. HCT-116 cells were co-transfected transiently with the recombinant plasmid pGL3-Basic-COX-2-promoter and control vector pRL-TK and randomly divided into blank group, control group, and Tan IIA group. Dual luciferase reporter assay was used to observe the activity of COX-2 promoter 48 h after treatment with Tan IIA. HCT-116 cells were transfected with the pIRESI-COX-2 plasmid and divided into three groups as above. The expression of COX-2 mRNA in transfected cells was detected by real-time PCR, and the level of VEGF in culture medium was assayed by ELISA.
RESULTS: Tan IIA had obvious inhibition on the proliferation of HCT-116 cells. The half maximal inhibitory concentrations (IC50) at 24, 48, and 72 h were 40.3 μmol/L ± 5.22 μmol/L, 12.9 μmol/L ± 3.24 μmol/L, and 8.5 μmol/L ± 1.47 μmol/L, respectively, and the maximal no-effect dose at 24 h was 10 μmol/L. At 48 h after transfection with plasmids carrying the COX-2-promoter and COX-2 cDNA, the activity of COX-2 promoter and expression of COX-2 mRNA were obviously up-regulated (both P < 0.01), and the concentration of VEGF was three times higher than that in control cells (P < 0.05). Treatment with 10 μmol/L Tan IIA significantly down-regulated the expression of COX-2 and VEGF in transfected cells (P < 0.05).
CONCLUSION: Tan IIA down-regulates VEGF expression and inhibits cell proliferation possibly by regulating COX-2 promoter activity and mRNA expression in HCT-116 cells.
- Citation: Zhou LH, Wang Y, Fan ZZ, Wu Q, Liu X, Ci SJ, Li Q. Tan IIA inhibits COX-2-regulated VEGF expression in human colon cancer HCT-116 cells. Shijie Huaren Xiaohua Zazhi 2011; 19(15): 1561-1567
- URL: https://www.wjgnet.com/1009-3079/full/v19/i15/1561.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i15.1561
COX-2在肿瘤发生、发展和转移的整个过程中起着重要的作用, 参与了肿瘤形成的多个环节. 因此, 对肿瘤组织或肿瘤细胞中COX-2活性检测可以作为监测肿瘤的发生发展的一个重要手段, COX-2在细胞中的基因表达水平也可以作为抗肿瘤药物筛选的一个重要指标. 丹参酮ⅡA(tanshinoneⅡA, TanⅡA)是从中药丹参中提取的脂溶性有效成分, 具有抗氧化、抗心脑血管疾病、抗菌消炎等药理作用, 近年研究发现TanⅡA对肝癌、胃癌、肠癌等肿瘤细胞具有杀伤作用. 本课题组前期研究显示[1], TanⅡA对结直肠癌小鼠肿瘤组织微血管生成具有较好的抑制作用, 但其抑制肿瘤血管新生的作用机制是否与其下调COX-2表达有关尚待进一步研究. 本实验采用前期构建的含COX-2启动子和萤火虫荧光素酶报告基因(luc)的重组质粒pGL3-Basic-COX-2-promoter, 及含海肾荧光素酶报告基因(Rluc)的内参质粒pRL-TK共转染低表达COX-2基因的人结肠癌HCT-116细胞, 研究TanⅡA对人结肠癌HCT-116细胞COX-2启动子的影响; 以含COX-2 CDS序列的重组质粒pIRESI-COX-2上调HCT-116细胞mRNA表达, 并检测TanⅡA对细胞培养液中VEGF表达的影响, 以期通过调控COX-2及VEGF表达情况, 研究TanⅡA介导COX-2对人肠癌血管新生的作用机制.
TanⅡA, 纯度98%, 西安冠宇生物技术有限公司); 四甲基偶氮唑盐(MTT, 美国Sigma公司); 二甲基亚砜(DMSO, 上海凌峰化学试剂公司); Lipofectamine 2000转染脂质体(美国Invitrogen公司); 人VEGF试剂盒(美国Bio Sources公司); Dual-Luciferase Assay System试剂盒(美国Promega公司)Rnaiso试剂(日本TaKaRa公司); RNA的反转录试剂盒(日本TaKaRa公司); Real Time PCR试剂盒(日本TaKaRa公司). 人结肠癌HCT-116细胞, 购买自中国科学院上海细胞研究所. 细胞置50 mL/L CO2培养箱, 37 ℃培养, 培养基为RPMI 1640, 添加100 mL/L的小牛血清. 重组质粒pGL3-Basic-COX-2-promoter、pIRESI-COX-2、内参质粒pRL-TK(由上海中医药大学附属普陀医院肿瘤实验室保藏). 人COX-2基因、探针及上下游引物由上海闪晶生物科技有限公司合成, 其中5'端标记上报告荧光基团FAM(6-carboxy-fluo-rescein-phosphoramidite), 3'端标记上淬灭荧光基团TAMRA(carboxy-tetramethyl-rhodamine), 序列如表1.
| 基因 | 引物序列(5'-3') |
| GAPDH | 上游引物 5'TGTGTCCGTCGTGGATCTGA3' |
| 下游引物 5'CCTGCTTCACCACCTTCTTGA3' | |
| 探针 5'CCGCCTGGAGAAACCTGCCAAGTATG3' | |
| COX-2 | 上游引物 5'AATGAGTACCGCAAACGCTTCT3' |
| 下游引物 5'TTCTGCAGCCATTTCCTTCTC3' | |
| 探针 5'CCTGAAGCCGTACACATCATTTG3' |
1.2.1 细胞培养: 人结肠癌HCT-116细胞株购中国科学院上海细胞研究所, 用含100 mL/L小牛血清的RPMI 1640培养基于置于50 mL/L CO2、饱和湿度、37 ℃孵箱中常规培养, 每1-2 d传代1次, 取对数生长期的细胞用于实验.
1.2.2 MTT法测定细胞的药物敏感性: 取常规培养的对数生长期人结肠癌HCT-116细胞, 配制成5×107个/L的单细胞悬液, 以每孔100 μL的量接种于3个96孔板中, 置于50 mL/L CO2、饱和湿度、37 ℃培养箱中培养. 24 h后吸弃培养液, 分别加入含TanⅡA的含药培养液200 μL, 药物初治浓度为64 μmol/L, 设置倍比稀释的7个浓度, 每个浓度设置10个复孔. 继续培养24、48、72 h后吸弃培养液, 每孔加入无血培养液180 μL及浓度5 g/L的MTT溶液20 μL, 置于50 mL/L CO2、饱和湿度、37 ℃培养箱中继续培养. 4 h后小心吸弃孔内液体, 每孔加入150 μL DMSO, 置于酶标仪上检测各孔细胞在570 nm处的吸光度值. 根据检测结果计算TanⅡA对HCT-116细胞的生长抑制率(growth inhibitor rate, GIR), 计算公式如下: GIR = [1-(An-A0)/(Ac-A0)]×100%, A0为空白组吸光值, Ac为正常对照组吸光组, An为各不同剂量给药组吸光值, 使用IC50专用软件计算TanⅡA的IC50值及24 h细胞生长抑制率为10%最大剂量.
1.2.3 脂质体法质粒转染细胞: 取常规培养的对数生长期人结肠癌HCT-116细胞, 配制成1×108个/L的单细胞悬液, 以每孔500 μL的量接种于24孔板中, 置于50 mL/L CO2、饱和湿度、37 ℃培养箱中培养. 待24孔板中的HCT-116细胞达80%汇片后, 分别吸去培养板中的培养液, 并添加500 μL无血清无抗生素的新鲜RPMI 1640培养基(RPMI 1640-FS)进行润洗细胞2-3次, 取2个无菌处理过的1.5 mL管心管, 向1号离心管中按50 μL/孔加入RPMI 1640-FS, 然后按要求加入pGL3-Basic-COX-2-promoter和pRL-TK质粒DNA共0.8 μg/孔, 轻柔混匀后静置5 min; 向2号离心管中按50 μL/孔加入RPMI 1640-FS, 按2 μL/孔加入Lipofectamine 2000转染试剂, 轻柔混匀后静置5 min; 将两个离心管中的液体混合, 轻柔混匀后室温静置20 min; 20 min后, 吸除24孔板中的培养液, 将上述离心管中的混合液缓慢均匀地滴加到各组细胞上. 将细胞置于37 ℃、恒湿的含50 mL/L CO2的培养箱中培养3-5 h(一般约为4 h), 3-5 h后, 吸去质粒/脂质体/RPMI 1640复合物, 向上述24孔板中的各组细胞中各加入500 μL的完全培养基或含药培养基, 并置于上述同样的培养条件下继续培养24-48 h.
1.2.4 化学发光法检测双荧光素酶活性: 将上述转染pGL3-Basic-COX-2-promoter和pRL-TK质粒的HCT-116细胞于转染3-5h后吸除质粒/脂质体/RPMI 1640复合物, 以未转染组为空白组, 转染后加完全培养基为对照组, 分别加入4、8、12、16、20 μmol/L的TanⅡA培养液, 每个浓度3个复孔, 于50 mL/L CO2、37 ℃的培养箱中培养48 h后进行双荧光素酶活性. 双荧光素酶活性检测采用美国Promega公司提供的Dual Luciferase Assay System试剂盒, 方法如下: (1)裂解细胞: 吸除24孔培养板中的旧培养液, 加入1 mL PBS, 轻轻洗涤细胞, 完全倾去洗涤液, 每孔加100 μL 1×PLB(Passive Lysis Buffer), 混匀. 将24孔培养板放在摇床上摇15-20 min, 使细胞充分裂解; (2)发光测定: 在发光测定仪(美国Promega公司, GloMix 20/20)选择双荧光素酶检测程序, 设定测读时间为10 s. 取萤火虫荧光素酶检测液(LAR Ⅱ)100 μL加入1.5 mL离心管底部, 然后将20 μL细胞裂解液加入离心管, 用加样枪抽吸3-5次混匀, 放入仪器中立即测定, 记录发光值1(即萤火虫荧光素酶发光值, 单位RLU); 检测结束后取Stop & Glo Reagent 100 μL加入管底部, 用加样枪抽吸3-5次混匀, 放入仪器中立即测定, 记录发光值2(即海肾荧光素酶发光值, 单位RLU); (3)数据处理: 将上述得到的两个荧光素酶的值进行归一化处理, 分别用萤火虫荧光素酶的值除以海肾荧光素酶的值, 所得到的比值(RLU1/RLU2)即可反映COX-2基因启动子的转录活性.
1.2.5 RT-PCR检测COX-2的表达: 取常规培养对数生长期HCT-116细胞, 配制成以5×108个/L单细胞悬液, 接种于6个60 mm的培养皿中, 每皿2 mL. 分为3组, 每组5个复孔: (1)空白组: 加入空白培养液; (2)COX-2基因转染组: pIRESI-COX-2质粒转染后加入空白培养液; (3)TanⅡA处理组: pIRESI-COX-2质粒转染加入10 μmol/L的TanⅡA; 分别按要求对细胞处理48 h.
按总RNA提取试剂盒(日本TaKaRa公司)的说明书提取细胞总RNA, 并用DEPC处理过的三蒸水稀释, 用紫外分光光度计测定260/280 nm处A值, 计算RNA纯度和浓度. 按比例分别加入5×PrimeScript Buffer 4 µL、PrimeScript RT Enzyme Mix I 1 µL、Oligo dT Primer(50 µmol/L)1 µL、Random 6 mers(100 µmol/L)1 µL、Total RNA 4 µL, 加Rnase Free Water至20 µL, 37 ℃ 15 min, 85 ℃ 5 s, 反应结束所得cDNA保存于-20 ℃. 用荧光定量PCR试剂盒: 将合成的GAPDH和COX-2基因上下游引物和探针及cDNA分别按以下剂量加入到8联管中, 每个基因做12个复孔: Forward Primer 0.4 µL、Reverse Primer 0.4 µL、Probe 0.8 µL、cDNA 2 µL、Rox Reference Dye 0.4 µL、Premix EX Taq 10 µL, 加diH2O至20 µL, 94 ℃预变性10 s; 95 ℃变性5 s; 60 ℃退火、延伸31 s, 40个循环, 所得到的数据采用ABI 7300 SDS软件分析. 相对mRNA表达 = 2-ΔCt, (ΔCt = 靶基因Ct值-GAPDH Ct值), 以GAPDH作为内参, 同时以正常HCT-116细胞为基准, 各组细胞COX-2 mRNA的表达量表示成正常HCT-116细胞的N倍(N = 2-样品ΔCt/2-基准ΔCt).
1.2.6 ELISA法检测VEGF的表达: 取常规培养对数生长期的人结肠癌HCT-116细胞, 配制成1×108个/L单细胞悬液, 每孔500 μL的量接种于24孔细胞培养板中, 置于50 mL/L CO2、饱和湿度、37 ℃培养箱中培养. 按方法1.2.5将24孔板中的HCT-116细胞共分为3组, 每组4个复孔, 将细胞进行pGL3-Basic-COX-2-promoter质粒转染或加药处理48 h. 处理后, 每孔各取100 μL培养液上清, 按人VEGF试剂盒说明书进行ELISA法检测细胞培养液中VEGF的表达情况.
统计学处理 采用PEMS3.1专用统计软件包对数据进行统计分析, 所得到的数据以mean±SD表示, 多样本均数比较用单因素方差分析; 各组两两比较采用SNK检验, 统计结果以P<0.05为差异有显著性.
MTT检测结果表明, TanⅡA对人结肠癌HCT-116细胞具有明显的抑制作用(表2), 24、48、72 h的IC50分别为(40.3±5.22) μmol/L、(12.9±3.24) μmol/L、(8.5±1.47) μmol/L, 48 h细胞的生长抑制作用与24 h相比具有显著性差异(P<0.05), 但与72 h的相比不具统计学意义, 因此说明TanⅡA作用细胞48 h是抑制效果最佳(图1). 同时, 根据结果计算24 h细胞最大无毒剂量(即细胞生长抑制率为10%最大剂量)约为10 μmol/L, 因此选择10 μmol/L TanⅡA作为最佳剂量用于后续实验.
| 分组 | 抑制率(%) | ||
| 24 h | 48 h | 72 h | |
| 1 µmol/L | 2.3±1.6 | 7.4±1.7 | 8.9±1.4 |
| 2 µmol/L | 3.5±1.5 | 12.4±2.9 | 18.0±3.1 |
| 4 µmol/L | 7.0±1.9 | 20.1±1.6 | 26.6±2.0 |
| 8 µmol/L | 9.2±1.1 | 24.8±2.3 | 33.9±4.0 |
| 16 µmol/L | 34.0±3.5 | 67.3±1.1 | 78.9±2.7 |
| 32 µmol/L | 49.6±1.1 | 77.3±2.4 | 85.9±2.1 |
| 64 µmol/L | 57.5±2.0 | 85.1±1.5 | 93.6±2.1 |
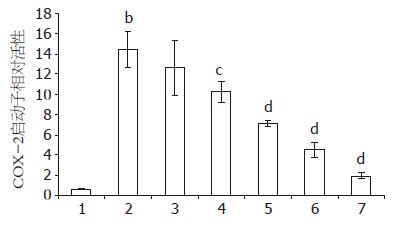
将COX-2启动子重组质粒pGL3-Basic-COX-2-promoter和内参质粒pRL-TK共转染肠癌HCT-116细胞4 h后, 分为空白组、对照组、4、8、12、16、20 μmol/L 7个组, 分别加入含不同浓度TanⅡA的RPMI 1640培养液, 处理细胞48 h后化学发光法检测双荧光素酶的活性. 结果显示, pGL3-Basic-COX-2-promoter重组质粒转染HCT-116细胞后, COX-2启动子活性上调明显(P<0.01). 而TanⅡA能够明显抑制细胞COX-2启动子的转录表达, 并呈现剂量依赖关系, 平均相对活性由对照组的14.5下降到最高剂量组的2.0, 相对活性下降了7.25倍, 其中浓度高于4 μmol/L的各组与对照组相比具有显著差异(P<0.05, P<0.01, 图2, 表3).
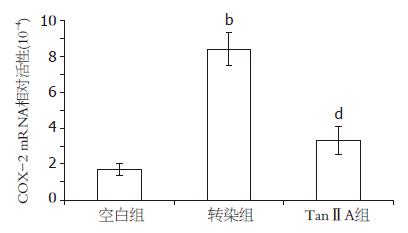
空白组HCT-116细胞COX-2 mRNA相对活性为(1.72±0.36)×10-4, 表达水平较低, 转染COX-2 CDS序列重组质粒后, COX-2 mRNA表达水平明显上调, 表达量(8.39±0.93)×10-4约为空白组的5倍, 两者具有显著差异(P<0.01); 而加入10 μmol/L TanⅡA处理后, COX-2 mRNA水平明显下调(P<0.01, 图3).
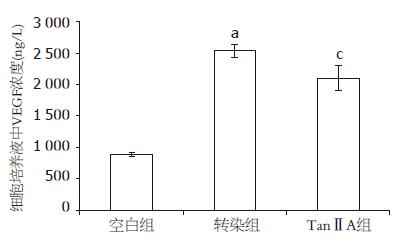
ELISA结果显示, 48 h空白组细胞培养液中VEGF的浓度是(887.13±33.90) ng/L, 转染COX-2 CDS序列重组质粒48 h后, 培养液中的VEGF的浓度为(2 530.77±99.87) ng/L, 约为空白对照组的3倍, 两者具有显著差异(P<0.05), 而转染后加入10 μmol/L的TanⅡA作用48 h后, VEGF的表达被抑制, 培养液中VEGF的浓度降为(2 101.66±201.02) ng/L, 具有统计学意义(P<0.05, 图4).
COX是催化花生四烯酸(arachidonic acid)产生前列腺素(prostaglandins, PGs)的关键限速酶, 有COX-1和COX-2两种类型. COX-1表达于所有组织与细胞, 具有调节机体生理平衡, 维持内环境稳定, 维持胃肠黏膜完整, 保持肾脏功能及血小板活化、巨噬细胞分化等"管家酶"功能[2]. COX-2在生理状态下不表达, 但在多种刺激因素(如IL-1、TNF等)作用下可诱导性的表达[3]. COX-2已成为肿瘤发生、发展重要分子靶标之一, 在多种肿瘤组织中呈现高表达, 如胃癌[4]、大肠癌[5]、肺癌[6]等. COX-2对肿瘤的发生、发展、浸润和转移有明显的促进作用[7,8], 其作用机制可能是多方面的, 包括促进肿瘤细胞增殖、抑制肿瘤细胞凋亡、促进肿瘤新生血管形成[9,10]等. 近几年对于COX-2的研究表明, 在上皮癌组织中普遍存在COX-2过度表达现象, 且除了肿瘤细胞有COX-2表达外, 肿瘤新血管周围存在肿瘤血管生长因子和COX-2共表达的现象[11]. 这些现象提示了COX-2在肿瘤的发生和发展、转移中有重要的生理功能, 其水平的增加可能是肿瘤发生的一个早期事件.
VEGF是1983年由Senger等[12]发现, 是促血管生成因子的典型代表. VEGF是一种糖基化分泌性多肽因子, 具有很强的促血管生长作用, 能特异性刺激血管内皮细胞增殖与血管生成[13], 可直接刺激血管内皮细胞有丝分裂的发生, 或通过增加血管通透性, 使包括许多基质形成重要因子的血浆蛋白外渗, 为血管内皮细胞的迁移及肿瘤细胞的转移提供基质[14], 促进多种恶性肿瘤生长、血管新生[15]. 现已证实[16], COX-2过表达导致VEGF的大量生成与结直肠癌发生发展关系密切, 特别是对肠癌肿瘤组织血管新生具有明显的促进作用. Tsujii等[16]研究发现转染COX-2基因的CaCo-2结肠癌细胞株, 在体外培养时产生VEGF等血管生成因子的量比未转染的细胞株增加4-8倍, 而COX-2抑制剂可使其恢复基础水平, 表明COX-2通过诱导以VEGF为代表的生长因子的表达, 促进肿瘤新生血管形成. VEGF 与大肠癌的发生发展、浸润程度及淋巴结转移关系密切, 干预VEGF的生成及其产生的作用途径或破坏其受体可抑制大肠癌肿瘤血管生成, 从而抑制大肠癌的生长、转移, 为临床治疗本病提供了新思路.
报告基因是一种编码容易被检测蛋白质或酶的基因, 他可以和目的基因表达调节序列相融合形成嵌合基因, 在调控序列控制下进行表达, 达到标定基因表达的目的[17]. 重组质粒即是同时稳定表达目的基因和报告基因的载体, 能通过脂质体转染法将目的基因转染进不表达或低表达该基因活细胞内, 使目的基因和报告基因通过活细胞的转录功能转变成可直接检测的荧光蛋白, 从而靶向、高效、快速的表达目的基因. 荧光素酶报告基因[18,19](Luciferase reporter gene)是最经典的报告基因, 他能催化荧光素或脂肪醛氧化发光, 主要有细菌荧光素酶(Bacterial Luciferase)、萤火虫荧光素酶(Firefly Luciferase)以及以海星、发光鱼等为来源的荧光素酶. 本实验采用成功构建的萤火虫荧光素酶基因的重组质粒pGL3-Basic-COX-2-promoter, 与含海肾荧光素酶基因的内参质粒pRL-TK组成双报告基因的检测系统, 不但克服了Western blot、ELISA、FMC等方法的可信度低和操作复杂的缺点, 而且还能够通过特异性的序列来靶向筛选抗肿瘤药物.
TanⅡA是从中药丹参中提取的有效活性成分, 其对多种消化系肿瘤(如肝癌、胃癌、结直肠癌)具有较好的抗肿瘤活性[20,21], 其作用机制可能与抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡分化、影响端粒酶活性、促进肿瘤血管新生、增强旁观者效应等相关, 但具体的机制尚不明确. 本研究前期动物实验表明[1], TanⅡA对小鼠肠癌组织肿瘤微血管新生具有明显的抑制作用, 其抗肠癌血管新生的作用可能与其抑制肠癌VEGF、MVD有关. 为进一步明确TanⅡA抗肠癌血管新生的作用机制, 探讨其是否与调节肿瘤细胞内COX-2基因表达相关, 本研究采用双荧光素酶报告基因检测系统, 研究TanⅡA的细胞内作用靶点. 检测结果发现, TanⅡA能明显抑制HCT-116细胞COX-2启动子及mRNA的表达, 呈现剂量依赖关系, 说明TanⅡA抗肠癌血管新生可能与其介导COX-2下调细胞内VEGF表达有关.
COX-2在肿瘤发生、发展和转移的整个过程中起着重要的作用, 参与了肿瘤形成的多个环节. 对肿瘤组织或肿瘤细胞中COX-2活性检测可以作为监测肿瘤的发生发展的一个重要手段, COX-2在细胞中的基因表达水平也可以作为抗肿瘤药物筛选的一个重要指标.
曹鹏, 副研究员, 江苏省中医药研究院细胞与分子生物学实验室
TanⅡA是从中药丹参中提取的脂溶性有效成分, 具有抗氧化、抗心脑血管疾病、抗菌消炎等药理作用, 近年研究发现TanⅡA具有较好的抗肿瘤作用, 对肝癌、胃癌、肠癌等消化系肿瘤细胞具有较强的抑制作用.
日本研究人员Tsujii等研究发现转染COX-2基因的CaCo-2结肠癌细胞株, 在体外培养时产生VEGF等血管生成因子的量比未转染的细胞株增加4-8倍, 而COX-2抑制剂可使其恢复基础水平, 表明COX-2通过诱导以VEGF为代表的生长因子的表达, 促进肿瘤新生血管形成.
荧光素酶报告基因(Luciferase reporter gene)是最经典的报告基因, 他能催化荧光素或脂肪醛氧化发光, 主要有细菌荧光素酶(Bacterial Luciferase)、萤火虫荧光素酶(Firefly Luciferase)以及以海星、发光鱼等为来源的荧光素酶.
本实验采用成功构建的萤火虫荧光素酶基因的重组质粒pGL3-Basic-COX-2 -promoter, 与含海肾荧光素酶基因的内参质粒pRL-TK组成双报告基因的检测系统, 不但克服了Western blot、ELISA、FMC等方法的可信度低和操作复杂的缺点, 而且还能够通过特异性的序列来靶向筛选抗肿瘤药物.
本研究思路清晰, 论证严谨, 具有较好的学术价值.
编辑: 李薇 电编:何基才
| 2. | Beasley NJ, Prevo R, Banerji S, Leek RD, Moore J, van Trappen P, Cox G, Harris AL, Jackson DG. Intratumoral lymphangiogenesis and lymph node metastasis in head and neck cancer. Cancer Res. 2002;62:1315-1320. [PubMed] |
| 3. | He Y, Rajantie I, Ilmonen M, Makinen T, Karkkainen MJ, Haiko P, Salven P, Alitalo K. Preexisting lymphatic endothelium but not endothelial progenitor cells are essential for tumor lymphangiogenesis and lymphatic metastasis. Cancer Res. 2004;64:3737-3740. [PubMed] [DOI] |
| 4. | Fujimura T, Ohta T, Oyama K, Miyashita T, Miwa K. Cyclooxygenase-2 (COX-2) in carcinogenesis and selective COX-2 inhibitors for chemoprevention in gastrointestinal cancers. J Gastrointest Cancer. 2007;38:78-82. [PubMed] [DOI] |
| 5. | Adegboyega PA, Ololade O, Saada J, Mifflin R, Di Mari JF, Powell DW. Subepithelial myofibroblasts express cyclooxygenase-2 in colorectal tubular adenomas. Clin Cancer Res. 2004;10:5870-5879. [PubMed] [DOI] |
| 6. | Koki AT, Khan NK, Woerner BM, Seibert K, Harmon JL, Dannenberg AJ, Soslow RA, Masferrer JL. Characterization of cyclooxygenase-2 (COX-2) during tumorigenesis in human epithelial cancers: evidence for potential clinical utility of COX-2 inhibitors in epithelial cancers. Prostaglandins Leukot Essent Fatty Acids. 2002;66:13-18. [PubMed] [DOI] |
| 7. | Itatsu K, Sasaki M, Yamaguchi J, Ohira S, Ishikawa A, Ikeda H, Sato Y, Harada K, Zen Y, Sato H. Cyclooxygenase-2 is involved in the up-regulation of matrix metalloproteinase-9 in cholangiocarcinoma induced by tumor necrosis factor-alpha. Am J Pathol. 2009;174:829-841. [PubMed] [DOI] |
| 8. | Karahan N, Güney M, Baspinar S, Oral B, Kapucuoglu N, Mungan T. Expression of gelatinase (MMP-2 and MMP-9) and cyclooxygenase-2 (COX-2) in endometrial carcinoma. Eur J Gynaecol Oncol. 2007;28:184-188. [PubMed] |
| 9. | Dohadwala M, Yang SC, Luo J, Sharma S, Batra RK, Huang M, Lin Y, Goodglick L, Krysan K, Fishbein MC. Cyclooxygenase-2-dependent regulation of E-cadherin: prostaglandin E(2) induces transcriptional repressors ZEB1 and snail in non-small cell lung cancer. Cancer Res. 2006;66:5338-5345. [PubMed] [DOI] |
| 10. | Franchi A, Gallo O, Massi D, Baroni G, Santucci M. Tumor lymphangiogenesis in head and neck squamous cell carcinoma: a morphometric study with clinical correlations. Cancer. 2004;101:973-978. [PubMed] [DOI] |
| 11. | Lazăr D, Tăban S, Ardeleanu C, Simionescu C, Sporea I, Cornianu M, Vernic C. Immunohistochemical expression of the cyclooxygenase-2 (COX-2) in gastric cancer. The correlations with the tumor angiogenesis and patients' survival. Rom J Morphol Embryol. 2008;49:371-379. [PubMed] |
| 12. | Senger DR, Galli SJ, Dvorak AM, Perruzzi CA, Harvey VS, Dvorak HF. Tumor cells secrete a vascular permeability factor that promotes accumulation of ascites fluid. Science. 1983;219:983-985. [PubMed] [DOI] |
| 13. | Hotz HG, Hines OJ, Hotz B, Foitzik T, Buhr HJ, Reber HA. Evaluation of vascular endothelial growth factor blockade and matrix metalloproteinase inhibition as a combination therapy for experimental human pancreatic cancer. J Gastrointest Surg. 2003;7:220-227; discussion 220-227. [PubMed] [DOI] |
| 14. | 姜 萌, 王 彬尧, 王 长谦, 何 奔, 范 华骅, 邵 琴, 黄 定九. 低氧诱导因子-1α小干扰质粒(siHIF-1α)抑制体内血管新生. 标记免疫分析与临床. 2008;15:150-155. |
| 16. | Tsujii M, Kawano S, Tsuji S, Sawaoka H, Hori M, DuBois RN. Cyclooxygenase regulates angiogenesis induced by colon cancer cells. Cell. 1998;93:705-716. [PubMed] [DOI] |
| 17. | Hu MC, Hsu HJ, Guo IC, Chung BC. Function of Cyp11a1 in animal models. Mol Cell Endocrinol. 2004;215:95-100. [PubMed] [DOI] |
| 19. | Marques SM, Esteves da Silva JC. Firefly bioluminescence: a mechanistic approach of luciferase catalyzed reactions. IUBMB Life. 2009;61:6-17. [PubMed] [DOI] |