修回日期: 2011-05-04
接受日期: 2011-05-11
在线出版日期: 2011-05-18
目的: 探讨WEE1在肝细胞癌(HCC)发生、发展中的异常表达及与肿瘤病理分期的关系.
方法: 收集2010-03/2010-05河南省人民医院肝胆外科手术标本正常肝组织23例, 肝硬化20例, HCC 42例. 采用RT-PCR检测mRNA水平的表达, Western blot及免疫组织化学检测蛋白的表达, 并分析其与肝癌临床病理学分期的关系.
结果: WEE1 mRNA阳性表达率分别为21.7%、55.0%和90.5%, 三组间差异有统计学意义(P<0.01). Western blot和免疫组织化学方法分别检测蛋白阳性表达率分别为13.04%/17.4%、40%/60%和78.6%/83.3%, 三组间相比差异有统计学意义(P<0.01). 肝癌组织中WEE1强度与肿瘤的分化程度及病理分级相关(χ2 = 17.454, P<0.01; χ2 = 14.559, P<0.01).
结论: WEE1基因在肝癌中呈上调表达, 其参与的DNA的修复异常与肝癌的发生密切相关, 且与肿瘤的分化程度和病理分级相关.
引文著录: 吕慧, 杨玉秀, 张立达, 白阳秋. WEE1与肝癌的关系. 世界华人消化杂志 2011; 19(14): 1515-1519
Revised: May 4, 2011
Accepted: May 11, 2011
Published online: May 18, 2011
AIM: To investigate the expression of WEE 1 in hepatocellular carcinoma (HCC) and to analyze its relationship with clinicopathological characteristics of HCC.
METHODS: Twenty-three normal human liver tissue specimens, 20 cirrhosis specimens, and 42 HCC specimens were used in this study. Reverse transcriptional-polymerase chain reaction (RT-PCR) was used to measure the expression of WEE 1 mRNA in the above tissue specimens, while Western blot and immunohistochemistry were used to detect the expression of WEE 1 protein. The relationship between WEE 1 expression and clinicopathological characteristics of HCC was analyzed.
RESULTS: The positive rates of Wee 1 mRNA expression in normal liver tissue, cirrhosis and HCC were 21.7%, 55% and 90.5%, respectively, with a significant difference among the three groups (P < 0.01). The positive rates of Wee 1 protein expression as revealed by Western blot and immunohistochemistry in the above three groups were 13.04%/17.4%, 40%/60% and 78.6%/83.3%, respectively, with significant differences among the three groups (both P < 0.01). Up-regulated expression of WEE 1 was significantly correlated with tumor differentiation and pathological grade in HCC (χ2 = 17.454, P < 0.01; χ2 = 14.559, P < 0.01).
CONCLUSION: WEE 1 expression was significantly up-regulated in HCC. High expression of WEE 1 may be closely related with tumor differentiation and pathological grade in HCC.
- Citation: Lv H, Yang YX, Zhang LD, Bai YQ. Relationship between WEE 1 and hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2011; 19(14): 1515-1519
- URL: https://www.wjgnet.com/1009-3079/full/v19/i14/1515.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i14.1515
肝细胞癌(hepatocellular carcinoma, HCC)是常见的消化系统高度恶性肿瘤, 因其发病隐匿、恶性程度高、进展快、预后差、死亡率高而严重威胁人类健康. 本研究通过RT-PCR、Western blot、免疫组织化学的方法检测人正常肝脏、肝硬化和肝癌组织中WEE1基因转录和蛋白表达的差异, 探讨WEE1在肝癌发生过程中的作用; 并分析其表达强度与肝癌分化程度及核分期的关系.
正常肝组织23例, 肝硬化20例, HCC 42例, 均取自河南省人民医院肝胆外科2010-03/2010-05肝脏手术切除标本. 正常肝组织HBsAg阴性, 肝硬化和肝癌组织HBsAg均阳性. 所取组织疾病诊断均经病理证实. 正常肝组织取自肝血管瘤手术切除病变部位的周围组织; 肝硬化组织取自门静脉高压行贲门周围血管离断术要求行病理检查的肝脏组织; HCC组织取自HCC手术切除组织, 标本新鲜, 通过伦理委员会审核, 患者知情签字同意. 标本取出后切成小块状迅速置于液氮冷冻待用.
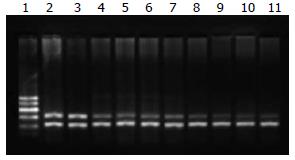
1.2.1 RT-PCR检测WEE1基因的表达: WEE1引物序列, 上游引物序列5'-GATGAGCAGAACGCTTTGAGAG-3', 下游引物序列5'- CAGAGGCAGCATTTGGGATT- 3', 扩增长度: 319 bp; GAPDH引物序列: 上游引物序列: 5'-CTTAGATTTGGTCGTATTGG-3', 下游引物序列5'-GAAGATGGTGATGGGATT-3', 扩增长度: 207 bp; 按照RNA提取试剂盒(杭州博日公司)说明书提取总RNA. 按RT-PCR试剂盒(杭州博日公司)步骤进行逆转录聚合酶链式反应; 目的基因与内参同管扩增, 扩增产物进行2%琼脂糖凝胶电泳. 结果用BIO-RAD Gel Doc XR全自动凝胶成像系统进行拍照、以WEE1产物与GAPDH产物的比值为WEE1 mRNA在各肝脏组织中表达的相对量.
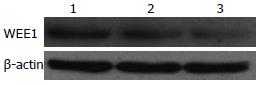
1.2.2 Western blot检测WEE1蛋白的表达: WEE1一抗为兔抗人多克隆抗体(美国Bioassay Technology公司); 二抗为辣根过氧化物酶标羊抗兔IgG聚合物(北京中杉金桥生物公司). 按照常规方法进行肝脏组织蛋白提取, 取50-100 mg肝脏组织加入200-300 μL裂解液(含PMSF)快速匀浆, 提取总蛋白. 所有蛋白样品调至等浓度后取15 μL上样, 10% SDS聚丙烯酰胺凝胶电泳, 半干转20 V 30 min将蛋白转移到PVDF膜上, 5%奶粉的封闭缓冲液室温封闭1 h, 一抗稀释液(1:500)封闭, 4 ℃孵育过夜, TBST洗膜3次, 二抗稀释液(1:900)室温孵育1-1.5 h, TBST洗膜3次, 行ECL化学发光X片曝光显影、以WEE1蛋白与内参β-actin的比值作为WEE1蛋白在各肝脏组织中表达的相对量.
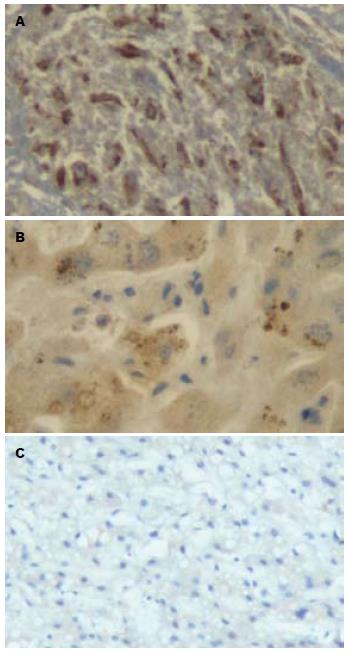
1.2.3 免疫组织化学检测WEE1蛋白的表达: 将肝脏组织标本经多聚甲醛固定、石蜡包埋, 制成4 μm厚的石蜡切片, HE染色. 采用免疫组织化学S-P法, 切片经脱蜡水化、抗原修复、一抗孵育、二抗孵育、DAB显色、苏木素复染、脱水透明、中性树胶封片后于显微镜下观察. WEE1抗体稀释为1:600, 以0.01 mol/L、pH值为7.5的磷酸盐缓冲液代替一抗作为阴性对照. 以细胞中出现棕黄色颗粒为WEE1表达阳性细胞, 以阳性细胞数≥10%作为阳性判断标准. 根据阳性细胞百分率分为阴性(-): 阳性细胞不可见或阳性细胞不足5%; 弱阳性(+): 阳性细胞散在或为组织细胞的1/3以下; 中度阳性(++): 阳性细胞呈局灶分布, 占全组织细胞1/3-2/3; 强阳性(+++): 阳性细胞呈弥漫分布, 占全组织细胞2/3以上.
统计学处理 应用SPSS17.0统计软件, 相对表达量用mean±SD表示, 定性资料进行χ2检验和Fisher's精确检验, 独立多组定量资料应用单因素方差分析后行LSD-t检验两两比较, 等级定性资料进行Kruskal-Wallis非参数秩和检验, 以α = 0.05为检验水准.
各肝脏组织总RNA提取结果良好, 总RNA的吸光度A260/A280 = 1.8-2.0, 电泳结果证实RNA未降解. WEE1扩增产物电泳图谱显示319 bp处有DNA片段, GAPDH扩增产物显示207 bp处有DNA片段(图1). 在正常肝脏、肝硬化和肝癌组织中WEE1 mRNA阳性表达率逐渐增高, 肝癌组与正常组、硬化组比较有统计学意义(χ2 = 30.762, P<0.01, 表1). 三组相对表达量分别为0.6835±0.1275、0.9164±0.0664和0.9986±0.0643; 3组间差异具有统计学意义. 肝癌组与正常组、硬化组比较有统计学意义(F = 38.372, P<0.01).
正常肝脏、肝硬化和肝癌组织中WEE1蛋白表达阳性率分别为13.04%、40%和78.6%, 3组间差异有统计学意义(χ2 = 26.69, P<0.01, 图2). 3组相对表达量分别为0.2430±0.0365, 0.5089±0.0866, 0.7503±0.1238, 3组间差异有统计学意义, 肝癌组与正常组、硬化组比较有统计学意义(F = 36.347, P<0.01).
WEE1蛋白阳性表达为棕黄色颗粒, 在肝癌组织中细胞核、细胞质均有表达(图3). 正常肝脏、肝硬化和HCC组织中WEE1蛋白的阳性表达率分别为17.4%, 60%, 83.3%, 3组间WEE1表达强度有统计学意义(χ2 = 33.143, P<0.01).
高分化组与中、低分化组差异有统计学意义(P<0.05), Edmondson Ⅳ级、Ⅲ级、Ⅱ即与Ⅰ级差异有统计学意义(P<0.05). 不同分化程度和不同病理分级的HCC组织中WEE1表达强度差异有统计学意义(χ2 = 17.454, P<0.01; χ2 = 14.559, P<0.01), HCC组织中WEE1表达越强, 分化程度就越低, 病理分级也越高(表1).
人类的WEE1(WEE1A; WEE1hu)是从人类细胞中克隆出来的WEE1同源基因, 编码一种为核蛋白的酪氨酸激酶, 属于蛋白激酶中丝氨酸/苏氨酸家族的一员[1]. WEE1基因表达的wee1激酶是一种双特异性激酶, 可磷酸化cyclin B-P34 CDC2复合物中的CDC2的Tyr15而抑制CDC2的活化.从而延迟有丝分裂, 是调控细胞周期G2期阻滞的关键元件, 在保证细胞进入有丝分裂前完成DNA复制以及在DNA损伤的修复, 从而避免异常的DNA进入有丝分裂而发生细胞凋亡[2-4].很多研究表明细胞周期的进程特别是DNA的复制需要精确的调控, 轻度的偏差将会使细胞经历死亡[5]. Wang等[6]发现在肿瘤细胞中WEE1的高表达可以对抗DNA损伤后引起的凋亡.
本研究对正常肝脏、肝硬化和HCC组织中WEE1表达进行分析, 证明WEE1在HCC的发生过程中呈上调表达, 且在肝癌组织中的表达与前两者相比差异有统计学意义. Masaki等[7]研究小鼠肝癌形成模型发现wee1激酶在肝炎到肝硬化、肝癌的发生过程中表达水平是逐渐升高的. Mir等[8]发现在恶性胶质瘤细胞中WEE1高表达, 通过抑制WEE1的表达可以使肿瘤细胞分裂时直接跳过G2期DNA修复, 提早结束有丝分裂, 致细胞死亡. 并认为通过抑制WEE1的表达可能会作为一种潜在的治疗恶性胶质瘤的方法. Iorns等通过RNA干扰筛选技术发现乳腺癌细胞株大量表达WEE1, 通过抑制WEE1的表达会明显降低乳腺癌细胞的增殖[9,10].
由于疾病的发生往往与特异蛋白质的变化更加密切相关, 因而检测肝组织中的中的WEE1蛋白可能更具临床意义. 本组资料提示, 在肝癌组织中WEE1蛋白阳性表达率和相对表达量均明显增高, 3组间差异具有统计学意义, 并与HCC的分化程度、病理分级有密切的关系. 这在蛋白水平印证了WEE1的表达在肝癌的发生发展过程中起着重要作用. 同样Yoshida等[11]应用免疫组织化学的方法在非小细胞性肺癌组织中检测到WEE1蛋白的大量表达, 而且WEE1表达与肺癌的复发密切相关, 是一个判断预后的指标. Butz等[12]应用免疫组织化学的方法检测垂体腺瘤和正常脑垂体中WEE1蛋白的表达, 发现WEE1蛋白在腺瘤中的表达更高, 通过RNA干扰WEE1表达在mRNA水平无明显变化, 而在蛋白水平的表达明显下降, 提示WEE1表达与肿瘤的发生相关.
由于目前国内外文献中关于WEE1在人肝癌中的表达情况的研究极少, WEE1在肝癌发生发展过程中确切的作用机制目前尚未完全明了, 还需要进一步研究其作用机制. 相关研究显示肿瘤细胞的共同改变主要是涉及正常细胞周期调控及DNA损伤修复的细胞传导通路的改变[13]. 正长细胞癌变后, 由于基因的改变, 肿瘤细胞多数有细胞周期调控点G1的缺陷, 而且对DNA损伤更敏感, 因此在细胞DNA复制及损伤修复过程中更依赖于G2调控点. 而WEE1是调控细胞G2/S期的关键因子, 推测肿瘤细胞增殖迅速, DNA大量复制, WEE1表达增加, 当有DNA损伤时细胞感应器ATM和ATR将被激活, 通过ATM-CHK2/ATR-CHK1传导通路的级联放大信号传导激活细胞周期调控点的效应器Chk1、Chk2激活并进一步活化wee1激酶. 促进WEE1表达增加[14,15]. 本实验结果证明WEE1在mRNA和蛋白水平均是高表达, 且与肿瘤分化程度及病理分期相关. 他有可能作为分子靶点在肝癌的基因诊断及治疗中发挥作用.
人类的WEE1( WEE1A; WEE1hu)是从人类细胞中克隆出来的WEE1同源基因, 可磷酸化cyclinB-P34 CDC2复合物中的CDC2的Tyr15而抑制CDC2的活化, 从而延迟有丝分裂, 是调控细胞周期G2期阻滞的关键元件, 保证细胞在进入有丝分裂前完成DNA复制以及在DNA损伤时进行修复. 目前国内外尚无WEE1与肝癌发生、发展关系的研究, 通过研究其在肝癌中的表达及其与病理分级的关系, 有可能为肝癌的早期诊断提供新的标志物, 为其靶向治疗提供新的方法.
单云峰, 副主任医师, 温州医学院附属第一医院肝胆外科
关于WEE1研究主要与细胞周期调控有关, 最近研究的热点是WEE1在恶性肿瘤中的表达情况以及通过抑制其表达来降低肿瘤细胞的增殖或诱导凋亡等可能的靶向治疗手段.
Masaki通过凝胶测定wee1激酶的活性发现在小鼠肝炎到肝硬化、肝癌的发生过程中其表达水平是逐渐升高的.
本研究首次应用RT-PCR、Western blot和免疫组织化学3种方法探讨WEE1在肝癌发生过程中的作用, 发现其不仅与肝癌发生发展有关, 而且与肝癌的分化程度及病理分级密切相关.
WEE1在肝癌形成过程中起了重要的作用, 有可能对诊断、治疗早期肝癌具有重要的临床指导作用.
RNA干扰(RNAi): 有21-25个碱基对组成的小干扰性双链RNA能够诱发细胞内基因沉默, 与双链RNA有同源序列的mRNA被降解, 从而抑制该基因的表达, 这种现象称为RNA干扰.
本文选题新颖, 方法科学, 结果可靠, 论据充分, 对临床肝细胞癌患者预后判断和治疗具有重要的参考作用.
编辑: 李薇 电编:李薇
| 1. | Masuda H, Fong CS, Ohtsuki C, Haraguchi T, Hiraoka Y. Spatiotemporal regulations of Wee1 at the G2/M transition. Mol Biol Cell. 2011;22:555-569. [PubMed] [DOI] |
| 2. | Watanabe N, Broome M, Hunter T. Regulation of the human WEE1Hu CDK tyrosine 15-kinase during the cell cycle. EMBO J. 1995;14:1878-1891. [PubMed] |
| 3. | Wang Y, Decker SJ, Sebolt-Leopold J. Knockdown of Chk1, Wee1 and Myt1 by RNA interference abrogates G2 checkpoint and induces apoptosis. Cancer Biol Ther. 2004;3:305-313. [PubMed] [DOI] |
| 4. | Harrison JC, Bardes ES, Ohya Y, Lew DJ. A role for the Pkc1p/Mpk1p kinase cascade in the morphogenesis checkpoint. Nat Cell Biol. 2001;3:417-420. [PubMed] |
| 5. | O'Farrell PH. Triggering the all-or-nothing switch into mitosis. Trends Cell Biol. 2001;11:512-519. [PubMed] [DOI] |
| 6. | Wang F, Zhu Y, Huang Y, McAvoy S, Johnson WB, Cheung TH, Chung TK, Lo KW, Yim SF, Yu MM. Transcriptional repression of WEE1 by Kruppel-like factor 2 is involved in DNA damage-induced apoptosis. Oncogene. 2005;24:3875-3885. [PubMed] [DOI] |
| 7. | Masaki T, Shiratori Y, Rengifo W, Igarashi K, Matsumoto K, Nishioka M, Hatanaka Y, Omata M. Hepatocellular carcinoma cell cycle: study of Long-Evans cinnamon rats. Hepatology. 2000;32:711-720. [PubMed] [DOI] |
| 8. | Mir SE, De Witt Hamer PC, Krawczyk PM, Balaj L, Claes A, Niers JM, Van Tilborg AA, Zwinderman AH, Geerts D, Kaspers GJ. In silico analysis of kinase expression identifies WEE1 as a gatekeeper against mitotic catastrophe in glioblastoma. Cancer Cell. 2010;18:244-257. [PubMed] [DOI] |
| 9. | Iorns E, Lord CJ, Grigoriadis A, McDonald S, Fenwick K, Mackay A, Mein CA, Natrajan R, Savage K, Tamber N. Integrated functional, gene expression and genomic analysis for the identification of cancer targets. PLoS One. 2009;4:e5120. [PubMed] [DOI] |
| 10. | Murrow LM, Garimella SV, Jones TL, Caplen NJ, Lipkowitz S. Identification of WEE1 as a potential molecular target in cancer cells by RNAi screening of the human tyrosine kinome. Breast Cancer Res Treat. 2010;122:347-357. [PubMed] [DOI] |
| 11. | Yoshida T, Tanaka S, Mogi A, Shitara Y, Kuwano H. The clinical significance of Cyclin B1 and Wee1 expression in non-small-cell lung cancer. Ann Oncol. 2004;15:252-256. [PubMed] [DOI] |
| 12. | Butz H, Likó I, Czirják S, Igaz P, Khan MM, Zivkovic V, Bálint K, Korbonits M, Rácz K, Patócs A. Down-regulation of Wee1 kinase by a specific subset of microRNA in human sporadic pituitary adenomas. J Clin Endocrinol Metab. 2010;95:E181-E191. [PubMed] [DOI] |
| 13. | Stathis A, Oza A. Targeting Wee1-like protein kinase to treat cancer. Drug News Perspect. 2010;23:425-429. [PubMed] |
| 14. | Leijen S, Beijnen JH, Schellens JH. Abrogation of the G2 checkpoint by inhibition of Wee-1 kinase results in sensitization of p53-deficient tumor cells to DNA-damaging agents. Curr Clin Pharmacol. 2010;5:186-191. [PubMed] [DOI] |
| 15. | Kawabe T. G2 checkpoint abrogators as anticancer drugs. Mol Cancer Ther. 2004;3:513-519. [PubMed] |