修回日期: 2011-04-25
接受日期: 2011-05-05
在线出版日期: 2011-05-18
目的: 构建针对人宫颈癌基因2(HCCR2)有效靶点的RNA干扰真核表达载体, 鉴定获得干扰质粒稳定转染的人胰腺癌PANC1细胞株.
方法: 设计并合成多个针对HCCR2基因的RNA干扰序列, 并将其插入真核表达慢病毒载体pGCsi-H1/Hygro/NEGative, 通过测序和与HCCR过表达载体共转染293T细胞后行Western blot检测, 筛选出有效干扰质粒; 通过脂质体转染法将该有效干扰质粒pGCsi-HCCR2稳定转染至人胰腺癌细胞株PANC1. 抗生素G418筛选获得稳转细胞株; Western blot检测稳转细胞株中HCCR2蛋白表达水平.
结果: HCCR2干扰载体和过表达载体共转染293T细胞后Western blot检测结果表明干扰质粒3具有最佳干扰效果, 选其作为最终干扰质粒. 将该质粒稳定转染至胰腺癌PANC1细胞后, Western blot检测显示, 干扰组的PANC1细胞株与空载体组比较, HCCR2蛋白表达水平下调, 表明获得HCCR2的RNA干扰质粒稳定转染的PANC1细胞株.
结论: 成功构建了HCCR2的RNA干扰真核表达载体及其稳定转染的人胰腺癌PANC1细胞株.
引文著录: 张盛, 朱亚青, 张国新, 蒋佳凯. 人宫颈癌基因RNA干扰真核表达载体的构建及其稳定转染胰腺癌细胞株的建立. 世界华人消化杂志 2011; 19(14): 1463-1468
Revised: April 25, 2011
Accepted: May 5, 2011
Published online: May 18, 2011
AIM: To construct eukaryotic expression vectors expressing small interfering RNAs (siRNAs) targeting the human cervical cancer oncogene 2 (HCCR2) gene and transfect them into human pancreatic cancer cell line PANC1 to obtain a cell line stably transfected with the HCCR2 siRNA plasmid.
METHODS: Multiple siRNAs targeting the HCCR2 gene were designed, chemically synthesized, and cloned into the eukaryotic expression vector pGCsi-H1/Hygro/NEGative. The resulting recombinant vectors were identified by direct sequencing. After the recombinant pGCsi-HCCR plasmids were co-transfected with an HCCR eukaryotic expression vector into 293T cells, the protein expression of HCCR-2 was analyzed by Western blotting to identify the pGCsi-HCCR vector that had the highest gene knockdown efficiency. This recombinant vector was then transfected into PANC1 cells with LipofectamineTM 2000. G418-resistant clones were selected to obtain a stably transfected cell line. The expression of HCCR2 protein in stably transfected cell line was detected by Western blot.
RESULTS: The pGCsi-HCCR-3 plasmid had the highest gene knockdown efficiency and was used to transfect PANC1 cells. Western blotting analysis demonstrated that HCCR2 expression was significantly inhibited in PANC-1 cells stably transfected with the pGCsi-HCCR-3 plasmid compared to cells transfected with the empty vector.
CONCLUSION: Eukaryotic expression vectors expressing siRNAs targeting the HCCR2 gene were successfully constructed and a PANC-1 cell line stably transfected with the pGCsi-HCCR-3 plasmid was successfully established.
- Citation: Zhang S, Zhu YQ, Zhang GX, Jiang JK. Construction of eukaryotic expression vectors expressing siRNAs targeting the HCCR2 gene and their transfection into PANC1 cells. Shijie Huaren Xiaohua Zazhi 2011; 19(14): 1463-1468
- URL: https://www.wjgnet.com/1009-3079/full/v19/i14/1463.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i14.1463
人宫颈癌基因(human cervical cancer oncogene, HCCR)因最先在人宫颈癌组织中发现而得名. 研究发现, HCCR在多种肿瘤如宫颈癌、乳腺癌、肝癌、肾癌、胃癌、结肠癌[1]等中均有过度表达. 由于其前体mRNA选择性拼接加工结果不同, HCCR可分为HCCR1和HCCR2两种亚型. 细胞克隆形成及裸鼠成瘤实验结果提示HCCR2比HCCR1有更强的致癌性[1]. 我们之前曾构建组织芯片研究了HCCR和胰腺癌的关系, 结果发现胰腺癌组织和细胞中HCCR均有明显过度表达[2]. 因此, 本研究采用RNA干扰(RNA interference, RNAi)技术, 设计了针对HCCR2 mRNA的干扰序列, 并与真核表达载体pGCsi-H1/Hygro/NEGative重组构建质粒, 经过鉴定后将该真核表达质粒转染人胰腺癌PANC1细胞, 筛选获得了稳定转染细胞株, 以进一步研究HCCR和胰腺癌之间的关系.
HCCR siRNA引物由上海生工生物工程公司合成; 人胰腺癌细胞系PANC1购自中国科学院上海细胞所; 293T细胞由上海吉凯公司提供; HCCR过表达载体和siRNA干扰慢病毒载体由上海吉凯公司构建, 测序及进行有效靶点筛选. 脂质体细胞转染试剂LipofectamineTM 2000购自Invitrogen公司; 鼠抗人HCCR单抗由本实验室制备; HRP标记的羊抗鼠二抗、HRP标记的羊抗兔二抗购自晶美公司; G418购自美国Sigma公司; BCA蛋白定量试剂盒、ECL化学发光试剂盒购自Pierce公司; 蛋白预染Marker、DNA Marker购自Fermentas公司; 其余试剂均为分析纯.
1.2.1 分组: 293T细胞干扰质粒筛靶实验分组: (1)293T细胞+OV组: 仅有293T细胞, 转染时不加入慢病毒质粒, 仅有HCCR过表达质粒; (2)NC+OV组1, 2: 转染时加入不含干扰靶点的空质粒和HCCR过表达质粒; (3)RNAi+OV组1, 2, 3: 转染时加入构建好的干扰质粒和HCCR过表达质粒. 用最佳效果的干扰质粒稳定转染PANC1细胞后, 所得细胞株的进行Western blot鉴定实验分组: (1)RNAi Clone1, 2: 干扰质粒稳转PANC1细胞株; (2)Vector Clone1, 2: 空载体质粒稳转PANC1细胞株.
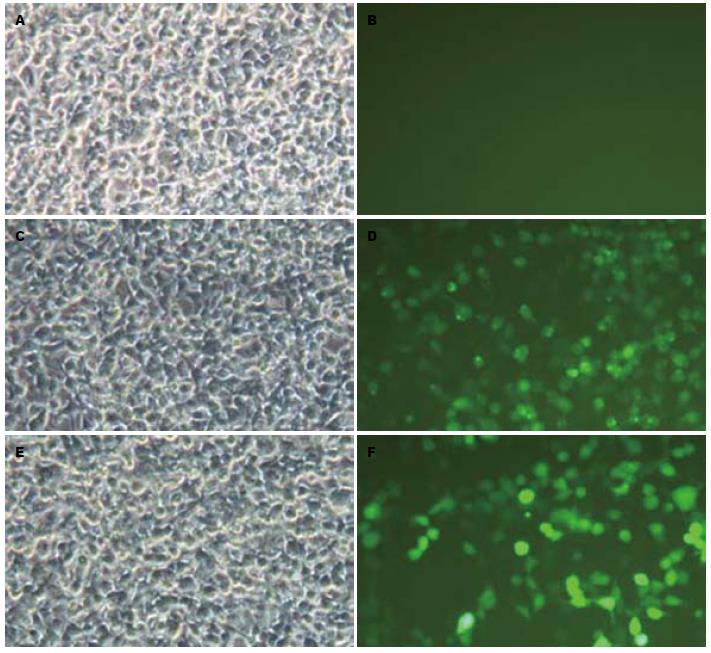
1.2.2 HCCR siRNA真核表达质粒构建及有效靶点筛选: 利用GenBank中HCCR cDNA序列和siRNA设计软件设计出干扰序列, 靶向cDNA前后序列分别为: SR54-3F: TGCTGAATCACATCGGAATGCTCATTGTTTTGGCCACTGACTGACAATGAGCACCGATGTGATT; SR54-3R: CCTGAATCACATCGGTGCTCATTGTCAGTCAGTGGCCAAAACAATGAGCATTCCGATGTGATTC. 将干扰序列与双酶切后的真核表达慢病毒载体pGCsi-H1/Hygro/NEGative在连接酶作用下进行连接, 连接产物转化细菌感受态细胞, 对长出的克隆提取质粒, 进行测序和分析比对, 比对正确的即为构建成功的HCCR2 siRNA表达质粒载体. 将针对靶基因不同干扰靶点的siRNA表达质粒载体和HCCR2的过表达质粒pEGFP-HCCR2(前期已构建成功), 分别共转染培养好的工具细胞(即293T细胞), 转染24 h荧光显微镜下观测转染效果, 转染36-48 h收集细胞抽提蛋白, 采用Western blot检测目的蛋白的表达情况, 进而判断不同靶点的干扰效果, 获得有效靶点.
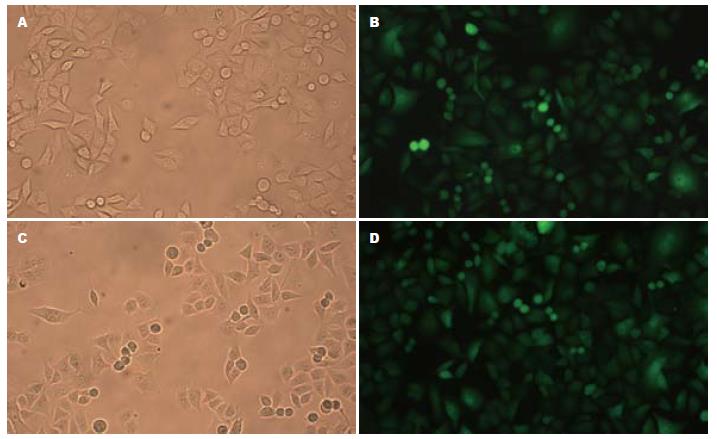
1.2.3 细胞培养与稳定转染: 转染前24 h取对数生长期PANC1细胞2.5×105个接种于35 mm培养皿中, 置于不含有抗生素的含有100 mL/L新生牛血清的DMEM培养液中培养, 次日观察细胞生长至80%融合时开始转染. 取转染质粒2 μg稀释于无抗生素的DMEM 125 μL, 10 μL脂质体LipofectamineTM 2000稀释于DMEM 125 μL, 室温孵育20 min后两者混匀加入培养皿, 置于37 ℃培养箱, 6 h后更换新鲜的含100 mL/L新生牛血清、100 kU/L青霉素和100 mg/L链霉素的DMEM培养液, 其后每2 d换液. 细胞转染后24 h按1:9的比例传代, 48 h后开始用含500 mg/L G418的选择性培养液进行筛选, 2-3 wk以后克隆形成. 以克隆环挑取细胞克隆转移至6孔板扩大培养、传代, 最后转入60 mL培养瓶, 阳性克隆在荧光显微镜下可见绿色荧光表达.
1.2.4 Western blot检测HCCR蛋白及其相关基因的表达: 收集各组细胞, 冰PBS洗2次, 加入细胞裂解液适量裂解细胞, 用细胞刮尽可能收集全部细胞裂解液放置于1.5 mL离心管, 超声细胞破碎仪破碎细胞并离心, BCA标准蛋白制备标准曲线, 根据标准曲线求得各待测样品的蛋白浓度, 从而计算上样体积. 检测不同蛋白选择适当的总蛋白上样量(20-60 μg), 行稳流(电流40 mA)SDS-PAGE电泳, 稳压(电压100 mV)冰浴电转至PVDF膜, 5%脱脂奶粉室温封闭1 h后TBST漂洗5 min, 加入一抗(工作浓度: HCCR 1:400)4 ℃孵育过夜. 次日TBST漂洗3×5 min后再加HRP标记的二抗(工作浓度分别为羊抗鼠1:4 000; 羊抗鼠1:2 000)室温孵育1 h, TBST漂洗3×5 min. ECL化学发光法曝光、显影, 同法处理内参照. 实验均重复3次.
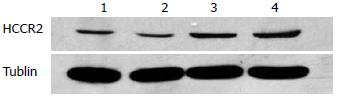
经上海生工生物工程公司测序鉴定, 重组获得的3个干扰真核表达质粒与预期完全相同. 将这3个干扰载体分别与HCCR2真核表达载体共转染293T细胞, 24 h后荧光显微镜下观察其转染情况(图1). 干扰载体具有的GFP表达元件能够表达绿色荧光. 绿色荧光显示, 转染效率达到70%以上. 转染后36-48 h收集细胞, 抽提总蛋白进行Western blot检测HCCR蛋白表达(图2). 干扰质粒3具有最好的敲减效果, 后续试验选取该质粒作为干扰质粒.
将获取的有效干扰靶点质粒和空载体质粒分别转染胰腺癌PANC1细胞, 抗生素筛选并挑取后的阳性克隆在荧光显微镜下可见绿色荧光表达(图3). RNAi Clone组和Vector Clone组阳性克隆细胞经Western blot多次检测, 获得HCCR2蛋白表达明显低于对照组的RNA干扰稳定转染细胞(图4).
胰腺癌是恶性程度较高的肿瘤之一, 其发病率在国内外均呈上升趋势. 胰腺癌预后极差, 5年生存率不足5%[3-5]. 由于胰腺癌早期症状隐匿, 加上胰腺位于腹腔深部, 影像检测准确率不高, 使得胰腺癌的早期诊断存在一定的困难. 目前CA19-9是诊断胰腺癌较常用的血清标志物, 其敏感性和特异性不高, 仅为68%和76%, 对早期胰腺癌敏感性更低[6,7]. 寻找胰腺癌新的早期诊断标志物和有效治疗靶点对于指导临床治疗, 提高胰腺癌患者的生存具有重要意义. 目前对胰腺癌的治疗的研究则倾向于分子靶向治疗和相关信号转导通路的深入研究[8].
近年来, HCCR与多种肿瘤的关系日益引起人们的关注. HCCR是2003年Ko等用差异显示RT-PCR的方法从宫颈癌组织及宫颈癌细胞株中筛选出的差异表达癌基因[1,9], 定位于人染色体12q, 由于其前体mRNA选择性拼接加工结果不同, 其分为HCCR-1和HCCR-2两种亚型. HCCR在白血病、肝癌、乳腺癌、宫颈癌等多种肿瘤中均可见过量表达, 这提示HCCR在人的恶性肿瘤发生发展中具有重要作用[9,10]. Kim等用间接ELISA法来检测血清HCCR的水平, 发现血清HCCR浓度在肝癌患者显著高于肝硬化、非酒精性脂肪肝、慢性活动性肝炎等患者. 检测570例血清样本中HCCR蛋白水平, 发现对肝癌的特异性为95.7%, 敏感性为78.2%, 而AFP的敏感性仅为64.6%. 说明HCCR作为肝癌诊断标志物优于AFP, 尤其是在诊断早期肝癌及小肝癌方面, HCCR阳性率较高[11]. 作为检测指标, HCCR对乳腺癌的敏感性为86.8%, 比糖类抗原CA15-3高21%. 因而认为在早期检测诊断乳腺癌时, HCCR远较CA15-3优越[12]. 研究表明, NIH/3T3细胞转染HCCR基因后, 细胞发生恶性转型, 并在软琼脂上形成了更多的克隆, 并分化成上皮细胞癌[1,13]; HCCR转基因鼠可自发形成乳腺癌, 并伴有转移灶形成; 表明HCCR与肿瘤的发生相关[14]. p53是重要的肿瘤抑制基因[15-17], 转染HCCR基因的细胞内P53的稳定性增加, 但与P53相关的基因p21、bax等基因的表达下调; 表明HCCR可能通过失活P53来促进肿瘤发生、发展[1]. PI3K/Akt信号通路是人类肿瘤发生过程中一条重要调控通路, 参与调节细胞周期和调控细胞凋亡等, 同样研究发现HCCR的表达可能受其调控[18]. HCCR通过减少乳腺癌细胞中载脂蛋白E(apoE)的分泌来抑制apoE的抗增殖功能[19].
本研究小组成员曾构建了HCCR蛋白表达载体, 制备出HCCR单克隆抗体, 并研究了其在肝癌及胃癌中的表达及意义[20-22]. 目前尚未有HCCR与胰腺癌之间的相关性研究, 因此, 为了探明HCCR与胰腺癌之间是否相关, 前期我们构建了组织芯片, 高通量检测了胰腺癌组织及癌旁正常胰腺组织的HCCR表达. 结果显示, 胰腺癌组织中HCCR蛋白阳性表达率高达77.5%(138/178), 明显高于其在癌旁组织及良性肿瘤组织中的表达48.9%(23/47), 且与病理组织学分级相关, Western blot结果发现三株胰腺癌细胞PANC1、SW1990、CFPAC1中HCCR蛋白均呈过量表达. 由此说明HCCR编码蛋白与胰腺癌关系密切[2].
RNAi现象, 即真核细胞中存在的非编码siRNA片段通过与mRNA按照碱基配对原则结合来调控目的基因的表达. 两位美国科学家安德鲁•菲尔和克雷格•梅洛因该发现而获得2006年诺贝尔医学奖. RNAi目前是研究基因功能和治疗疾病的强有力工具[23], 在肿瘤的基因功能研究中已得到广泛应用[24,25]. 有文献报道, 瞬时转染HCCR siRNA质粒到肝癌细胞株HepG2中, 发现细胞增殖受到抑制, 细胞凋亡增加[26]. 本实验中RNA干扰真核表达载体pGCsi-H1/Hygro/NEGative为慢病毒载体, 具有高效的质粒重组性能和转染效率[27]. 293T细胞是转染腺病毒E1A基因的人肾上皮细胞系, 具有较高的转染效率, 蛋白表达水平高, 是重要的用于转染的工具细胞[27,28]. 获得的3个重组干扰质粒与HCCR真核过表达载体共转染293T细胞, 通过绿色荧光观察到具有较高的转染效率, Western blot检测HCCR蛋白在293T细胞中的表达, 从而保证获得最佳筛选靶点.
与瞬时转染不同, 稳定转染获得的干扰细胞株生物学特性相对稳定, 实验结果更真实可信, 且能够为进一步实验打下更好的基础. 本实验通过稳定转染来获得RNA干扰的PANC1细胞株, 无论干扰组还是空载体组, 经抗生素G418筛选并挑取后的阳性干扰细胞克隆在荧光显微镜下可见绿色荧光表达, 表明慢病毒载体已成功转染进细胞株. 但最终干扰效果, 还是取决于HCCR蛋白水平的表达情况. 经过Western blot反复鉴定挑选出的数十株稳定转染单克隆细胞株, 检测HCCR蛋白表达情况, 确定其敲减效果, 最终获得持续效果较佳的稳定表达RNA干扰效果的胰腺癌细胞株两株, 为进一步探讨HCCR与胰腺癌的关系, 进行相关生物学实验和信号通路研究打下实验基础, 观察其能否作为胰腺癌诊治的靶点.
人宫颈癌基因(HCCR)因最先在人宫颈癌中发现而得名, 国外研究发现HCCR在乳腺癌、肝癌和子宫癌等多种肿瘤中均有过度表达, 在早期肿瘤的表达更明显, 提示HCCR与人类多种恶性肿瘤的早期发生有关.
郭晓钟, 教授, 中国人民解放军沈阳军区总医院消化内科
郭晓钟, 教授, 中国人民解放军沈阳军区总医院消化内科
Kim等用间接ELISA法来检测血清HCCR的水平, 发现血清HCCR浓度在肝癌患者显著高于肝硬化、非酒精性脂肪肝、慢性活动性肝炎等患者.
目前尚未有HCCR与胰腺癌的深入研究, 本研究首次运用RNA干扰技术来研究HCCR和胰腺癌的关系, 探求其作为胰腺癌诊断标记物和基因治疗靶点的可行性, 为研究、开发RNA干扰药物提供理论依据.
本文设计科学、合理, 方法先进, 结果可信, 为今后进一步研究HCCR与胰腺癌的关系奠定了实验基础.
编辑: 李薇 电编:何基才
| 1. | Ko J, Lee YH, Hwang SY, Lee YS, Shin SM, Hwang JH, Kim J, Kim YW, Jang SW, Ryoo ZY. Identification and differential expression of novel human cervical cancer oncogene HCCR-2 in human cancers and its involvement in p53 stabilization. Oncogene. 2003;22:4679-4689. [PubMed] [DOI] |
| 3. | Cleary SP, Gryfe R, Guindi M, Greig P, Smith L, Mackenzie R, Strasberg S, Hanna S, Taylor B, Langer B. Prognostic factors in resected pancreatic adenocarcinoma: analysis of actual 5-year survivors. J Am Coll Surg. 2004;198:722-731. [PubMed] [DOI] |
| 4. | Pliarchopoulou K, Pectasides D. Pancreatic cancer: current and future treatment strategies. Cancer Treat Rev. 2009;35:431-436. [PubMed] [DOI] |
| 5. | Hines OJ, Reber HA. Pancreatic neoplasms. Curr Opin Gastroenterol. 2004;20:452-458. [PubMed] [DOI] |
| 6. | Harsha HC, Kandasamy K, Ranganathan P, Rani S, Ramabadran S, Gollapudi S, Balakrishnan L, Dwivedi SB, Telikicherla D, Selvan LD. A compendium of potential biomarkers of pancreatic cancer. PLoS Med. 2009;6:e1000046. [PubMed] [DOI] |
| 7. | Fry LC, Mönkemüller K, Malfertheiner P. Molecular markers of pancreatic cancer: development and clinical relevance. Langenbecks Arch Surg. 2008;393:883-890. [PubMed] [DOI] |
| 8. | Furukawa T. Molecular targeting therapy for pancreatic cancer: current knowledge and perspectives from bench to bedside. J Gastroenterol. 2008;43:905-911. [PubMed] [DOI] |
| 9. | Chung YJ, Kim JW. Novel oncogene HCCR: its diagnostic and therapeutic implications for cancer. Histol Histopathol. 2005;20:999-1003. [PubMed] |
| 10. | Shin SM, Chung YJ, Oh ST, Jeon HM, Hwang LJ, Namkoong H, Kim HK, Cho GW, Hur SY, Kim TE. HCCR-1-interacting molecule & quot; deleted in polyposis 1& quot; plays a tumor-suppressor role in colon carcinogenesis. Gastroenterology. 2006;130:2074-2086. [PubMed] [DOI] |
| 11. | Yoon SK, Lim NK, Ha SA, Park YG, Choi JY, Chung KW, Sun HS, Choi MJ, Chung J, Wands JR. The human cervical cancer oncogene protein is a biomarker for human hepatocellular carcinoma. Cancer Res. 2004;64:5434-5441. [PubMed] [DOI] |
| 12. | Jung SS, Park HS, Lee IJ, Namkoong H, Shin SM, Cho GW, Ha SA, Park YG, Lee YS, Ko J. The HCCR oncoprotein as a biomarker for human breast cancer. Clin Cancer Res. 2005;11:7700-7708. [PubMed] [DOI] |
| 13. | Ha SA, Shin SM, Lee YJ, Kim S, Kim HK, Namkoong H, Lee H, Lee YS, Cho YS, Park YG. HCCRBP-1 directly interacting with HCCR-1 induces tumorigenesis through P53 stabilization. Int J Cancer. 2008;122:501-508. [PubMed] [DOI] |
| 14. | Ko J, Shin SM, Oh YM, Lee YS, Ryoo ZY, Lee YH, Na DS, Kim JW. Transgenic mouse model for breast cancer: induction of breast cancer in novel oncogene HCCR-2 transgenic mice. Oncogene. 2004;23:1950-1953. [PubMed] [DOI] |
| 15. | Vogelstein B, Lane D, Levine AJ. Surfing the p53 network. Nature. 2000;408:307-310. [PubMed] [DOI] |
| 16. | Petitjean A, Achatz MI, Borresen-Dale AL, Hainaut P, Olivier M. TP53 mutations in human cancers: functional selection and impact on cancer prognosis and outcomes. Oncogene. 2007;26:2157-2165. [PubMed] [DOI] |
| 17. | Olivier M, Petitjean A, Marcel V, Pétré A, Mounawar M, Plymoth A, de Fromentel CC, Hainaut P. Recent advances in p53 research: an interdisciplinary perspective. Cancer Gene Ther. 2009;16:1-12. [PubMed] [DOI] |
| 18. | Cho GW, Shin SM, Namkoong H, Kim HK, Ha SA, Hur SY, Kim TE, Chai YG, Kim JW. The phosphatidylinositol 3-kinase/Akt pathway regulates the HCCR-1 oncogene expression. Gene. 2006;384:18-26. [PubMed] [DOI] |
| 19. | Ha SA, Shin SM, Kim HK, Kim S, Namkoong H, Lee YS, Kim HJ, Jung SM, Lee YS, Chung YJ. Dual action of apolipoprotein E-interacting HCCR-1 oncoprotein and its implication for breast cancer and obesity. J Cell Mol Med. 2009;13:3868-3875. [PubMed] [DOI] |
| 21. | 杨 杨, 张 国新, 施 瑞华, 林 艳, 郝 波, 王 晓勇, 王 宏娣, 黄 祖瑚. 人宫颈癌基因蛋白在人肝细胞癌中的表达及其临床意义. 中华肝脏病杂志. 2007;15:223-224. |
| 22. | 王 晓勇, 张 国新, 施 瑞华, 林 艳, 郝 波, 杨 杨, 王 宏娣, 黄 祖瑚. 人宫颈癌基因蛋白多抗的制备及其在胃癌中的表达和意义. 中华消化杂志. 2007;27:568-569. |
| 23. | Siomi H, Siomi MC. On the road to reading the RNA-interference code. Nature. 2009;457:396-404. [PubMed] [DOI] |