修回日期: 2011-05-06
接受日期: 2011-05-11
在线出版日期: 2011-05-18
目的: 探讨外源性人重组白介素10(IL-10)在急性坏死性胰腺炎(ANP)大鼠胰腺及肝组织中对信号转导和转录激活因子3(STAT3)表达的影响.
方法: 92只健康SD♂大鼠随机分为正常对照组(C组, n = 24)、ANP组(A组, n = 36)和IL-10后干预组(I组, n = 32). 采用腹腔注射左旋精氨酸(L-arginine)的方法诱导大鼠ANP模型, 注射L-arginine后2、5、8 h, 腹腔注射重组IL-10 10 000 U干预后, 分别于4、12、24、36 h分批处死各组大鼠, 苏木精-伊红染色(HE)观察大鼠胰腺及肝组织病理学变化, 快捷免疫组织化学MaxVisionTM法检测在胰腺和肝组织中STAT3的表达变化.
结果: A组、I组各时点胰腺病理学评分显著高于C组(均P<0.01), 12、24、36 h的I组胰腺评分较A组低(均P<0.05). 肝组织A组各时点病理学评分均显著高于C组(均P<0.05或0.01); I组肝脏病理评分高于C组(均P<0.05或0.01), 除24 h较A组下降以外, 其余各时点与A组无差异. 胰腺组织和肝组织的A组、I组各时点STAT3灰度值均显著低于C组(P<0.01); I组胰腺12、24、36 h的STAT3灰度值显著高于A组(12 h: 174.61±6.25 vs 146.10±10.51; 24 h: 178.55±10.36 vs 150.63±9.11; 36 h: 193.37±21.54 vs 155.55±11.70, 均P<0.05或0.01). I组肝组织24、36 h的STAT3灰度值显著高于A组(24 h: 89.88±18.89 vs 38.85±10.27; 36 h: 48.79±15.38 vs 23.51±5.67, 均P<0.01).
结论: 外源性IL-10后干预对ANP胰腺及肝组织损伤有一定保护作用, STAT3可能早期即参与ANP胰腺和肝脏组织的炎症反应, IL-10可能通过抑制STAT3途径对胰腺、肝组织起保护作用.
引文著录: 梁志海, 王珺平, 唐国都. 外源性IL-10对急性坏死性胰腺炎大鼠胰腺及肝组织STAT3表达的影响. 世界华人消化杂志 2011; 19(14): 1457-1462
Revised: May 6, 2011
Accepted: May 11, 2011
Published online: May 18, 2011
AIM: To investigate the effect of treatment with exogenous interleukin-10 (IL-10) on the expression of signal transducer and activator of transcription3 (STAT3) in pancreatic and hepatic tissue of rats with acute necrotizing pancreatitis (ANP).
METHODS: Ninety-two male Sprague-Dawley rats were divided randomly into three groups: control group (n = 24), ANP group (n = 36), and IL-10 group (n = 32). ANP was induced in rats by intraperitoneal injection (ip) of L-arginine. The IL-10 group was treated with 10 000 units of recombinant human IL-10 (rhIL-10) by ip at 2, 5, and 8 h after the last L-arginine injection. Rats were killed at 4, 12, 24, and 36 h after the last L-arginine injection. Pancreatic and hepatic histopathological changes were scored, and the expression of STAT3 was detected by immunohistochemical (IHC) staining.
RESULTS: Pancreatic and hepatic histopathological scores at all time points were significantly higher in the ANP group and IL-10 group than in the control group (all P < 0.01 or 0.05). Compared to the ANP group, pancreatic histopathological scores at 12, 24, and 36 h and hepatic histopathological score at 24 h were significantly lower in the IL-10 group (all P < 0.05 or 0.01). The expression levels of STAT3 in pancreatic and hepatic tissue at all time points were significantly lower in the ANP group and IL-10 group than in the control group (all P < 0.01). The expression levels of STAT3 in pancreatic (12 h: 174.61 ± 6.25 vs 146.10 ± 10.51; 24 h: 178.55 ± 10.36 vs 150.63 ± 9.11; 36 h: 193.37 ± 21.54 vs 155.55 ± 11.70, all P < 0.01 or 0.05) and hepatic tissue (24 h: 89.88 ± 18.89 vs 38.85 ± 10.27; 36 h: 48.79 ± 15.38 vs 23.51 ± 5.67, all P < 0.01) were significantly higher in the IL-10 group than in the ANP group.
CONCLUSION: STAT3 may be involved in the early inflammatory response to ANP. Exogenous IL-10 could improve pancreatic and hepatic tissue injury in ANP rats possibly by down-regulating STAT3 expression.
- Citation: Liang ZH, Wang JP, Tang GD. Exogenous IL-10 down-regulates STAT3 expression in pancreatic and hepatic tissue of rats with acute necrotizing pancreatitis. Shijie Huaren Xiaohua Zazhi 2011; 19(14): 1457-1462
- URL: https://www.wjgnet.com/1009-3079/full/v19/i14/1457.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i14.1457
急性胰腺炎(acute pancreatitis, AP)是临床常见的急症, 其中15%-20%发展为重症急性胰腺炎(severe acute pancreatitis, SAP), SAP常并发多器官损伤, 病死率较高, 其死亡原因多为多器官功能不全综合征(multiple organ dysfunction syndrome, MODS), 其中AP肝功能衰竭的发生率虽然只有5%, 但一旦肝功能衰竭发生, 多会导致死亡. 国外一项对178例SAP相关MODS患者的回顾性研究中, 具有最高死亡率的是肝衰竭患者占83%, 而多器官衰竭患者中, 又以肝肾衰竭死亡率最高91%[1]. 国内文献报道, AP肝损伤发生率40.1%-73.0%, 肝功能衰竭发生率约5%; SAP肝损伤发生率88.9%-100.0%[2].
AP发病机制至今尚未完全阐明, 细胞因子级联瀑布效应是AP不断恶化的重要机制. 酪氨酸蛋白激酶(janus kinas 1, JAK1)/信号转导和转录激活因子(signal transducers and activators of transcription, STAT)通路是细胞因子信息传递最重要的通道之一, 目前已发现多种细胞因子, 如IL-18、TNF-α、IL-6、IL-1β等, 均可通过激活JAK/STAT信号转导通路, 在炎症反应的发生、发展过程中发挥重要作用[3]. STAT3是单核吞噬细胞系统(mononuclear phagocyte system, MPS)中抗炎症信号的最重要中间体, 在细胞因子诱导的细胞特异性应答反应中起关键作用. 目前STAT3介导的IL-10抗炎症反应机制逐渐被了解, 有学者认为IL-10的产生与STAT3途径被激活有关[4], 并有望成为调节炎症的新途径. 本实验通过建立ANP大鼠模型, 给予外源性IL-10对ANP大鼠进行后干预, 应用免疫组织化学法观察STAT3在胰腺和肝组织表达随时点变化的情况, 探讨IL-10在ANP大鼠胰腺及肝组织中对STAT3表达的影响.
健康SD♂大鼠92只, 清洁级, 鼠龄2-3 mo, 体质量250-350 g, 由广西医科大学实验动物中心提供. L-arginine(美国Sigma)、rhIL-10(美国R&D)、兔抗大鼠多克隆抗体(美国Lab Vision)、MaxVisionTM试剂盒(福州迈新).
1.2.1 诱导ANP模型及干预方法: 同本课题组文献所述[5], 92只健康SD♂大鼠随机分为正常对照组(C组, n = 24)、ANP组(A组, n = 36)和IL-10后干预组(I组, n = 32). A组大鼠分3次给予6% L-arginine(3×1.0 mg/g体质量)ip, 注射间隔1 h, 诱导ANP模型; I组于末次L-arginine注射后2、5、8 h分别ip外源性rhIL-10各10 000 U, 共30 000 U; C组大鼠予0.9%生理盐水ip对照. 各组大鼠均于末次注射L-arginine后4、12、24、36 h分批处死并取材.
1.2.2 胰腺及肝组织病理检查: 胰腺组织病理学评分采用Kusske法[6], 肝组织病理学评分法参考Suzuki法[7].
1.2.3 免疫组织化学检测: 采用MaxVisionTM法检测胰腺及肝组织STAT3的表达变化. 按说明书操作, 设阳性及阴性对照. 结果判断标准: 在400倍镜下观察组织切片, 每张切片选取四周及中央共5个区域, 以细胞胞质或胞核出现棕黄色颗粒, 且着色强度明显高于背景非特异性染色者判断为阳性. 使用Leica QWin分析软件检测视野灰度值进行定量分析, 取值范围为0-255, 白色为255, 黑色为0. 灰度值越高, 染色越浅, STAT3表达产物越少; 灰度值越低, 染色越深, STAT3表达产物越高.
统计学处理 应用SPSS13.0分析, 对实验数据进行方差分析(方差齐时用One-way ANOVA, 以LSD进行多重比较; 方差不齐时用非参数检验, 以Mann-Whitney U进行多重比较. 所有实验数据均以mean±SD表示, P<0.05认为差异有统计学意义.
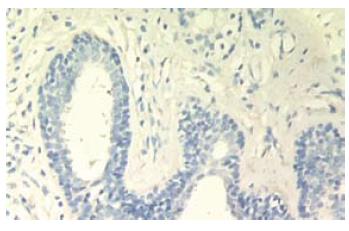
C组各时点胰腺腺泡结构完整、腺小叶清晰; A组胰腺可见胰腺腺泡水肿、组织坏死, 在胰腺实质、间质内有中性粒细胞、淋巴细胞浸润以及出血病灶形成. 随时间延长病变加重, 24 h以后可见大片胰腺组织凝固性坏死. A组各时点病理学评分显著高于C组(P<0.01), I组病理损伤较A组轻(P<0.05, 表1).
ANP大鼠肝脏大体标本没有明显变化. 光镜观察: C组各时点标本肝血管, 肝细胞, 间质均正常, 可见正常肝组织存在淋巴细胞及巨噬细胞, 无细胞坏死, 评分为0分; A组肝脏标本在镜下可见充血、少量中性粒细胞浸润普遍存在, 可见血栓形成、肝细胞浊肿明显, 个别有门脉周围炎, 随时间延长病变加重, 出现灶状肝细胞凝固性坏死、大量炎症细胞浸润; I组大鼠肝脏血栓、坏死、炎症细胞浸润较A组轻, 但明显重于C组, 可见少量中性粒细胞浸润, 偶有肝细胞浊肿, 血栓少见, 未见肝细胞凝固性坏死. A组4、12、24 h病理学评分显著高于C组(P<0.01), 36 h病理学评分显著高于C组(P<0.05), A组各时点评分呈上升趋势; I组4、12、24 h病理学评分显著高于C组(P<0.01), 36 h病理学评分显著高于C组(P<0.05); 除24 h病理学评分低于A组(P<0.05)外, 其余各时点病理评分与A组无差异(表1).
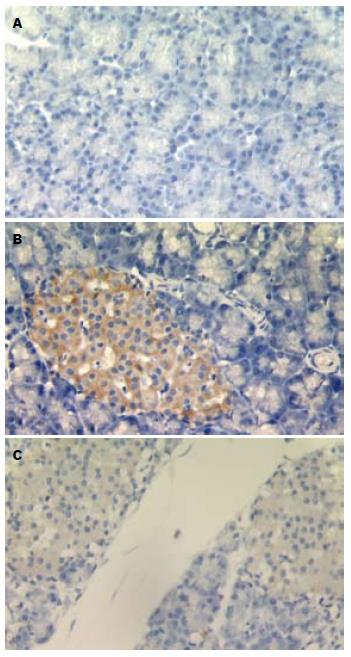
C组呈阴性表达, 细胞胞质淡蓝色, 胞核深蓝色; A组各时点均见阳性产物表达, 主要在胰岛细胞的胞质表达, 呈棕黄色颗粒, 部分呈棕褐色, 其他部位胞质、胞膜和腺泡腔表达较少, 呈浅黄色, 组织边缘处阳性表达强于内部; I组表达部位似A组, 为棕黄和浅黄色颗粒. A组各时点STAT3灰度值显著低于C组(P<0.01); 提示A组STAT3的表达4 h已显著高于C组, 随后表达减少. I组各时点STAT3灰度值显著低于C组(P<0.01), STAT3灰度值随时间延长从4 h开始逐渐增高, 12、24、36 h灰度值显著高于A组(P<0.01或<0.05)(表2, 图1, 2); 提示I组STAT3表达高于C组, 表达随时间延长而减少, 表达高峰位于4 h, rhIL-10后干预的I组12、24、36 h时点STAT3表达比A组减少.
| 分组 | n | 4 h | 12 h | 24 h | 36 h |
| 胰腺 | |||||
| C组 | 6 | 207.05±14.72 | 202.92±3.35 | 202.23±7.43 | 204.20±10.16 |
| A组 | 9 | 168.52±11.72b | 146.10±10.51b | 150.63±9.11b | 155.55±11.70b |
| I组 | 8 | 170.19±5.01b | 174.61±6.25bd | 178.55±10.36bd | 193.37±21.54bc |
| 肝脏 | |||||
| C组 | 6 | 200.70±30.70 | 212.09±51.97 | 191.77±49.01 | 191.46±65.49 |
| A组 | 9 | 50.85±6.40b | 47.36±7.45b | 38.85±10.27b | 23.51±5.67b |
| I组 | 8 | 51.46±23.04b | 62.58±22.22b | 89.88±18.89bd | 48.79±15.38bd |
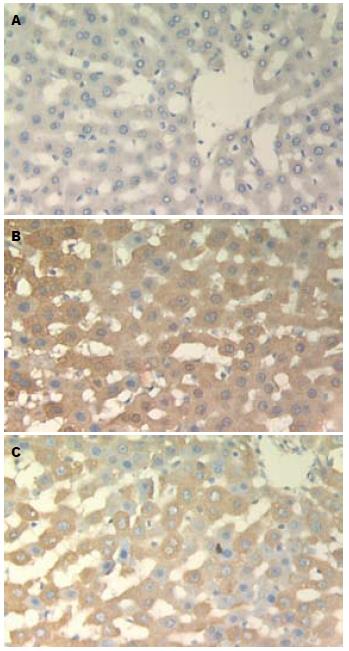
C组呈阴性表达. A组各时点均见阳性产物表达, 主要在肝细胞胞质中表达, 部分胞核有表达, 呈深棕褐色颗粒, 部分呈深棕黄色, 组织边缘处阳性表达强于内部; I组表达部位似A组, 着色介于前两组之间. A组各时点STAT3灰度值显著低于C组(P<0.01), 并随时间延长灰度值逐渐减少; 说明A组肝组织STAT3表达高于比C组, 从4 h开始高表达, 随时间延长逐渐上升. I组各时点STAT3灰度值显著低于C组(P<0.01), 24、36 h的STAT3灰度值显著高于A组(P<0.01); 提示I组肝组织STAT3从4 h开始表达, 24、36 h表达低于A组(表2, 图3).
IL-10主要由Th2细胞分泌, 具有很强的免疫抑制及免疫调控作用, 是目前研究较多的抗炎症因子. IL-10可广泛抑制活化巨噬/单核细胞的功能, 抑制产生IL-1、TNF等细胞因子, 减少这两种细胞因子通过诱导次级介质来扩大炎症反应. 也可抑制活化的单核细胞产生趋化因子, 并增强促炎细胞因子天然拮抗物的表达[8]. IL-10抗炎作用的信号转导系统与JAK/STAT系统、核因子-κB(nuclear factor-κB, NF-κB)有关, 其作用机制与激活JAK-STAT3-SOCS3途径、增强靶分子mRNA不稳定性而促进其降解有关[9]. 已经有动物实验和临床前期研究表明IL-10在诊断和治疗AP中具有重要的临床价值[10], 内源性IL-10和外源性IL-10均被认为对AP有保护作用[11,12]. 本课题组既往研究结果提示, 外源性IL-10后干预可减轻ANP胰腺组织的病理损伤, 其机制可能与减少NF-κB的活化、减少促炎细胞因子释放有关[13]. Feng等[14]在进行药物性肝损伤的研究中发现, 敲除IL-10基因的小鼠肝损伤更为严重, 而且促炎细胞因子IL-8水平上升, 其机制可能与NF-κB、p38促分裂素原活化蛋白激酶(mitogen-activated protein kinases, MAPK)途径激活有关, 同时发现STAT1、STAT3表达增高, 因此认为外源性IL-10对肝损伤有保护作用, 其作用机制可能与减少NF-κB、p38 MAPK、STAT相关途径的激活有关. 本实验提取大鼠胰腺、肝脏进行病理评分发现, A组胰腺、肝脏病理评分较C组高, 说明L-arginine大剂量腹腔注射诱导的大鼠ANP可同时发生肝脏病理损伤. rhIL-10后干预的I组胰腺病理评分较A组下降, 说明IL-10可减轻ANP胰腺损伤. 另外, 虽然rhIL-10干预后肝脏病理学评分各时点病理评分数据均较A组有所减少, 但统计学分析仅有24 h大鼠肝脏病理评分较A组低(P<0.05), 因此本研究尚不足以说明rhIL-10后干预可使ANP大鼠的肝损伤减轻, 有待于通过增大样本量或延长观察时点观察rhIL-10干预是否对ANP肝脏病理损伤有保护作用.
STAT3是STAT家族的重要成员, 他可被JAK激酶通过酪氨酸磷酸化激活, STAT3是MPS中JAK1/STAT3抗炎症信号转导途径的最重要中间体, 在细胞因子诱导的细胞特异性应答反应中起关键作用, 参与细胞生长、恶性转化、凋亡等生理功能的调控[15]. 由于STAT3的活化过程与IL-10受体(IL-10R)有关, 因此STAT3被认为是IL-10反应中的一个关键调节物. STAT3的活化过程是: 在MPS中IL-10结合于IL-10R1的细胞外结构域, 形成同源或异源二聚体, 激活受体连接的JAK1, JAK1使位于IL-10R1链细胞内结构域特异的酪氨酸残基发生磷酸化. 一旦磷酸化, 这些酪氨酸残基为潜在的转录因子STAT3提供一个暂时锚靠位点. STAT3通过其SH2结构域结合于这些位点, STAT3分子上的酪氨酸依次被连接于受体的JAK1磷酸化. 活化的STAT3离开受体, 在胞质内形成同源或异源二聚体, 迅速转位入核, 与其特异的DNA序列结合, 启动胞核内DNA转录, 开始抗炎症的级联反应[10,16]. Benkhart等[17]发现在人IL-10启动子区-120 bp处的序列特定地与STAT3连接, 而不与其他的STAT蛋白连接, 认为STAT3通过连接IL-10启动子上-120 bp处的motif而控制着人IL-10基因的表达. 因此, JAK1/STAT3通路可能与IL-10的抗炎作用密切相关. 这些基础研究的结论也得到相关研究结果支持. 如人类单核细胞受到酒精的刺激后, 可引起IL-10的释放增多和IL-10 mRNA表达上调, 作者认为其机制与STAT3活化有关[18]; Murray[19,20]研究表明, IL-10在应激的MPS中, 需要活化的STAT3参与, 最终抑制炎症介质产生; 肝损伤动物实验发现, 敲除IL-10基因可使STAT3表达增高[14]; 在心肌梗死后的左室重构研究中, Krishnamurthy等[21]发现IL-10可通过激活STAT3而抑制炎症反应. 本实验中胰腺组织A组STAT3表达4 h已显著高于C组, 高峰位于12 h, 随后24、36 h表达减少, 故推测STAT3可能早期即参与ANP胰腺组织的炎症反应; A组与I组STAT3表达在4 h无显著差异, 12、24、36 h可见I组的STAT3表达较A组降低, 提示rhIL-10可以下调STAT3在胰腺的表达, 推测rhIL-10可能是通过下调STAT3表达从而减轻在AP的胰腺损伤.
STAT3与肝损伤关系密切, 如在酒精肝动物实验中, 敲除STAT3基因的小鼠肝窦内皮细胞凋亡减少、炎症减轻[22]; CCl4致肝损伤的实验中, 也发现敲除STAT3基因后实验动物肝脏损伤的炎症反应减轻[23]; Horiguchi等[24]用肝细胞特异性敲除STAT3基因的小鼠(H-STAT3 KO mice)制备酒精性肝损伤模型, 发现H-STAT3 KO小鼠几乎无炎症反应, 同时促炎症因子低表达. 国内学者在动物实验中也发现抑制JAK2/STAT3信号转导通路可显著减轻大鼠肝移植缺血再灌注损伤, 同时减少细胞凋亡[25]. 国内体外实验结果表明, 抑制JAK/STAT通路的活化可下调elastase诱导Kupffer细胞分泌促炎症因子IL-18的表达, 可能有助于减轻AP的炎症反应和肝损伤[26]. 这些都说明抑制STAT3后, 肝细胞中的炎症反应可以得到改善. 本实验中肝组织A组STAT3表达4 h已显著高于C组, 且随时间延长表达逐渐增多, 推测STAT3可能早期即参与ANP肝组织的炎症反应. rhIL-10后干预的I组大鼠肝组织STAT3表达水平于24、36 h比A组明显降低, 说明rhIL-10干预可以抑制STAT3表达, 可能rhIL-10通过下调STAT3发挥对ANP大鼠肝组织的保护作用.
总之, STAT3可能早期即参与ANP胰腺和肝脏组织的炎症反应, IL-10可能通过下调STAT3介导的炎症反应对胰腺、肝脏组织起保护作用, 通过调控JAK/STAT信号转导途径可能是减轻AP发病后炎症反应的新手段.
IL-10可以减轻急性胰腺炎的病理损伤、炎症反应, 但其作用机制尚未完全阐明; JAK1/ STAT3信号转导途径与IL-10密切相关, 但目前关于STAT3与急性胰腺炎的关系报道不多, 关于急性胰腺炎肝损伤的STAT3表达相关研究更少.
周国雄, 主任医师, 南通大学附属医院消化内科
IL-10的抗炎作用已经得到公认, 目前研究的热点主要是IL-10对炎症性疾病的保护作用及机制, 目前所知可能与此有关的信号转导途径包括NF-κB、JAK/STAT、MAPK等; IL-10受体、IL-10家族的其他成员在炎症反应中发挥的作用也引人关注.
Keceli等研究提示外源性IL-10可以减轻雨蛙肽诱导的急性胰腺炎大鼠胰腺损伤; 李敏利等进行的体外实验结果提示特异性的JAK2抑制剂AG490可以通过抑制促炎细胞因子IL-18诱导JAK/STAT信号通路的活化, 达到减少炎症反应和肝损伤.
本研究是国内外首次研究外源性IL-10干预对急性胰腺炎的胰腺和肝脏病理损伤和STAT3表达的影响, 丰富了外源性IL-10应用于治疗急性胰腺炎的理论体系.
本研究结果表明JAK/STAT信号转导途径与急性胰腺炎发病后的炎症反应有关, 抑制STAT3的表达可能为急性胰腺炎的治疗提供新途径.
本文选题较好, 方法可靠, 有一定的指导价值.
编辑: 李薇 电编:何基才
| 1. | Halonen KI, Pettilä V, Leppäniemi AK, Kemppainen EA, Puolakkainen PA, Haapiainen RK. Multiple organ dysfunction associated with severe acute pancreatitis. Crit Care Med. 2002;30:1274-1279. [PubMed] [DOI] |
| 3. | Lee C, Lim HK, Sakong J, Lee YS, Kim JR, Baek SH. Janus kinase-signal transducer and activator of transcription mediates phosphatidic acid-induced interleukin (IL)-1beta and IL-6 production. Mol Pharmacol. 2006;69:1041-1047. [PubMed] |
| 4. | Wang H, Brown J, Garcia CA, Tang Y, Benakanakere MR, Greenway T, Alard P, Kinane DF, Martin M. The role of glycogen synthase kinase 3 in regulating IFN-β-mediated IL-10 production. J Immunol. 2011;186:675-684. [PubMed] [DOI] |
| 6. | Kusske AM, Rongione AJ, Ashley SW, McFadden DW, Reber HA. Interleukin-10 prevents death in lethal necrotizing pancreatitis in mice. Surgery. 1996;120:284-228; discussion 289. [PubMed] |
| 7. | Suzuki S, Toledo-Pereyra LH, Rodriguez FJ, Cejalvo D. Neutrophil infiltration as an important factor in liver ischemia and reperfusion injury. Modulating effects of FK506 and cyclosporine. Transplantation. 1993;55:1265-1272. [PubMed] [DOI] |
| 8. | Couper KN, Blount DG, Riley EM. IL-10: the master regulator of immunity to infection. J Immunol. 2008;180:5771-5777. [PubMed] |
| 9. | 任 大宾, 孙 仁宇. 白介素-10的抗炎功能及其分子机制. 国外医学•呼吸系统分册. 2005;25:175-178. |
| 11. | Van Laethem JL, Eskinazi R, Louis H, Rickaert F, Robberecht P, Devière J. Multisystemic production of interleukin 10 limits the severity of acute pancreatitis in mice. Gut. 1998;43:408-413. [PubMed] [DOI] |
| 12. | Keceli M, Kucuk C, Sozuer E, Kerek M, Ince O, Arar M. The effect of interleukin-10 on acute pancreatitis induced by cerulein in a rat experimental model. J Invest Surg. 2005;18:7-12. [PubMed] [DOI] |
| 14. | Feng D, Wang Y, Xu Y, Luo Q, Lan B, Xu L. Interleukin 10 deficiency exacerbates halothane induced liver injury by increasing interleukin 8 expression and neutrophil infiltration. Biochem Pharmacol. 2009;77:277-284. [PubMed] [DOI] |
| 15. | Hoey T, Grusby MJ. STATs as mediators of cytokine-induced responses. Adv Immunol. 1999;71:145-162. [PubMed] [DOI] |
| 16. | Murray PJ. Understanding and exploiting the endogenous interleukin-10/STAT3-mediated anti-inflammatory response. Curr Opin Pharmacol. 2006;6:379-386. [PubMed] [DOI] |
| 17. | Benkhart EM, Siedlar M, Wedel A, Werner T, Ziegler-Heitbrock HW. Role of Stat3 in lipopolysaccharide-induced IL-10 gene expression. J Immunol. 2000;165:1612-1617. [PubMed] |
| 18. | Norkina O, Dolganiuc A, Shapiro T, Kodys K, Mandrekar P, Szabo G. Acute alcohol activates STAT3, AP-1, and Sp-1 transcription factors via the family of Src kinases to promote IL-10 production in human monocytes. J Leukoc Biol. 2007;82:752-762. [PubMed] [DOI] |
| 19. | Murray PJ. The primary mechanism of the IL-10-regulated antiinflammatory response is to selectively inhibit transcription. Proc Natl Acad Sci U S A. 2005;102:8686-8691. [PubMed] [DOI] |
| 20. | Murray PJ. STAT3-mediated anti-inflammatory signalling. Biochem Soc Trans. 2006;34:1028-1031. [PubMed] [DOI] |
| 21. | Krishnamurthy P, Rajasingh J, Lambers E, Qin G, Losordo DW, Kishore R. IL-10 inhibits inflammation and attenuates left ventricular remodeling after myocardial infarction via activation of STAT3 and suppression of HuR. Circ Res. 2009;104:e9-e18. [PubMed] [DOI] |
| 22. | Miller AM, Wang H, Park O, Horiguchi N, Lafdil F, Mukhopadhyay P, Moh A, Fu XY, Kunos G, Pacher P. Anti-inflammatory and anti-apoptotic roles of endothelial cell STAT3 in alcoholic liver injury. Alcohol Clin Exp Res. 2010;34:719-725. [PubMed] [DOI] |
| 23. | Horiguchi N, Lafdil F, Miller AM, Park O, Wang H, Rajesh M, Mukhopadhyay P, Fu XY, Pacher P, Gao B. Dissociation between liver inflammation and hepatocellular damage induced by carbon tetrachloride in myeloid cell-specific signal transducer and activator of transcription 3 gene knockout mice. Hepatology. 2010;51:1724-1734. [PubMed] [DOI] |
| 24. | Horiguchi N, Wang L, Mukhopadhyay P, Park O, Jeong WI, Lafdil F, Osei-Hyiaman D, Moh A, Fu XY, Pacher P. Cell type-dependent pro- and anti-inflammatory role of signal transducer and activator of transcription 3 in alcoholic liver injury. Gastroenterology. 2008;134:1148-1158. [PubMed] [DOI] |