修回日期: 2011-04-22
接受日期: 2011-04-26
在线出版日期: 2011-05-08
目的: 探讨Ras蛋白激活物类似物-1(RASAL1)基因在胃癌组织中的表达情况及临床意义.
方法: 应用免疫组织化学SP法分别检测50例正常组织、50例低级别上皮内瘤变组织、50例高级别上皮内瘤变组织+早期胃癌组织及50例进展期胃癌组织中RASAL1基因的表达, 并结合其临床病理资料进行综合分析.
结果: RASAL1基因在正常组、低级别上皮内瘤变组、高级别上皮内瘤变+早期胃癌组及进展期胃癌组的阳性率分别为94.0%(47/50)、70.0%(35/50)、42.0%(21/50)及18.0%(9/50), 各组之间的差异有统计学意义(均P<0.05); 各组RASAL1基因的表达与性别、年龄、生长部位等均无相关性; 高级别上皮内瘤变组织+早期胃癌组和进展期胃癌组中RASAL1基因的表达与肿瘤大小、分化程度、浸润深度及淋巴结转移有相关性(均P<0.05).
结论: RASAL1基因的低表达与胃癌的发生及进展有密切关系, 检测胃癌组织中RASAL1的表达可反映肿瘤大小、分化程度、浸润深度及有无淋巴结转移.
引文著录: 夏挺松, 陈洪, 钱建忠, 徐洪明, 陆枫林. RASAL1基因在胃癌组织中的表达及其临床意义. 世界华人消化杂志 2011; 19(13): 1403-1407
Revised: April 22, 2011
Accepted: April 26, 2011
Published online: May 8, 2011
AIM: To detect the expression of Ras protein activator like 1 (RASAL1) in gastric cancer and to analyze its clinicopathological significance.
METHODS: Immunohistochemistry was used to detect RASAL1 expression in 50 cases of normal gastric tissue, 50 cases of low intraepithelial neoplasia, 50 cases of high intraepithelial neoplasia and early gastric carcinoma, and 50 cases of advanced gastric carcinoma. The correlation between RASAL1 expression and clinicopathological features of gastric cancer was then analyzed.
RESULTS: The positive rate of RASAL1 expression had significant differences among each group. The positive rate of RASAL1 expression was 94.0% (47/50) in normal gastric tissue, 70.0% (35/50) in low intraepithelial neoplasia, 42.0% (21/50) in intraepithelial neoplasia and early gastric carcinoma, and 18.0% (9/50) in advanced gastric carcinoma. The positive rate of RASAL1 expression was not correlated with sex, age, or tumor site, but was correlated with tumor size, differentiation, invasive depth and lymph node metastasis in high intraepithelial neoplasia and early gastric carcinoma and advanced gastric carcinoma (all P < 0.05).
CONCLUSION: Decreased expression of RASAL1 correlates with the development of gastric cancer. The lower expression of RASAL1 underlies bigger tumor size, lower degree of differentiation, deeper invasion, and more metastatic lymph nodes in patients with gastric cancer.
- Citation: Xia TS, Chen H, Qian JZ, Xu HM, Lu FL. Clinical significance of expression of RASAL1 in gastric cancer. Shijie Huaren Xiaohua Zazhi 2011; 19(13): 1403-1407
- URL: https://www.wjgnet.com/1009-3079/full/v19/i13/1403.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i13.1403
胃癌是最常见的恶性肿瘤之一, 占全球癌症死亡原因的第2位, 而我国属胃癌高发病区, 每年死于胃癌的患者居恶性肿瘤死亡原因的首位[1]. 目前, 对胃癌的发生发展机制研究虽取得了一定的进展, 但具体分子机制仍不清楚. Ras蛋白激活物类似物-1(Ras protein activator like 1, RASAL1, 也称Ras GTP酶激活蛋白1, Ras GTPase-activating-like protein 1, Ras GAPs)基因是近年新发现的一种钙离子依赖性Ras活性调节基因, 位于第12号染色体(12q24.13)[2], 其编码蛋白激活Ras GTP酶, 继而使与Ras P21蛋白结合的GTP转变为GDP, 使Ras P21蛋白失活, 从而参与细胞的增殖、分化、凋亡. 迄今为止, RASAL1基因与胃癌的关系研究甚少. 本文以胃镜活检组织及胃癌手术标本为研究对象, 检测组织中RASAL1基因的表达, 探讨RASAL1基因在正常胃组织、低级别上皮内瘤变组织、高级别上皮内瘤变+早期胃癌组织和进展期胃癌组织中的表达改变及其临床意义.
2008-01/2010-09行胃镜检查、治疗或外科手术治疗的患者, 所有病例均有完整的病理资料和临床资料(性别、年龄、生长部位、肿瘤大小、淋巴转移、浸润深度及分化程度, 术前未进行任何放化疗及生物治疗. 正常组胃组织标本取自距胃癌组织边缘5 cm以上(n = 50); 低级别上皮内瘤变组均为胃镜下活检组织(n = 50); 高级别上皮内瘤变+早期胃癌组标本来源于胃镜下活检组织、内镜下黏膜切除术(endoscopic mucosal resection, EMR)、内镜下黏膜剥离术(endoscopic submucosal dissection, ESD)及外科手术标本(n = 50); 进展期胃癌组标本均为外科手术标本(n = 50).
1.2.1 免疫组织化学染色: 利用免疫组织化学法检测RASAL1在4组标本中的表达. 病理组织蜡块经4 μm连续切片、常规脱蜡、微波低火抗原修复, 分别作抗RASAL1免疫组织化学染色. 染色方法按免疫组织化学染色试剂盒(武汉博士德生物有限公司)说明书步骤进行; 一抗RASAL1羊抗人多克隆抗体购自英国Abcam公司, 工作浓度为1:200; 二抗为兔抗羊IgG-HRP. 以正常山羊血清代替一抗作阴性对照.
1.2.2 结果判断: RASAL1阳性染色者在细胞胞质或(和)细胞膜有棕黄色颗粒沉着; 根据染色程度和染色细胞百分率进行评定和分析[3]: 基本不着色者为0分, 着色淡者为1分, 着色适中者为2分, 着色深者为3分; 着色细胞占计数细胞的百分率阳性率≤5%记0分, 6%-25%记1分, 26%-50%记2分, ≥51%记3分. 将每张切片的染色程度与染色细胞百分率得分各自相乘, 为其最后得分. 0-1分为阴性(-), 2-3分为弱阳性(+), 4-6分为中等阳性(++), >6分为强阳性(+++); 由两位高级职称病理医师无序2次重复阅片.
统计学处理 用SPSS13.5统计软件进行处理, 计数资料采用两个(或多个)样本率比较的χ2检验, P<0.05为差异有统计学意义.
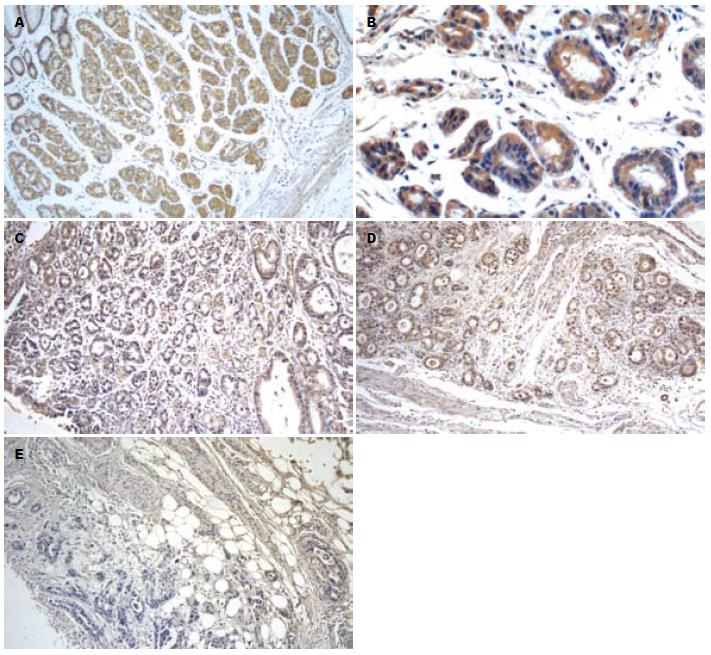
免疫组织化学染色结果显示, RASAL1蛋白在正常组、低级别上皮内瘤变组、高级别上皮内瘤变+早期胃癌组及进展期胃癌组的阳性率分别为94.0%(47/50)、70.0%(35/50)、42.0%(21/50)及18.0%(9/50)(图1), 4组RASAL1蛋白的阳性率呈递减趋势, 经两两比较及统计分析, 显示各组之间差异均有统计学意义(均P<0.05, 表1). 4组中强阳性的例数同样呈递减趋势, 差异有统计学意义(均P<0.05); 中度阳性的例数也呈递减趋势, 但差异无统计学意义(均P>0.05); 弱阳性的例数各组间的差异无统计学意义(均P>0.05). 分析提示, 各组RASAL1蛋白的表达与性别、年龄、生长部位等均无相关性(均P>0.05, 表2). 高级别上皮内瘤变+早期胃癌组及进展期胃癌组中RASAL1蛋白的表达与肿瘤大小、分化程度、浸润深度、淋巴结转移均有明显相关性(均P<0.05, 表3).
| 临床资料 | 正常组 | 低级别上皮内瘤变组 | 高级别上皮内瘤变+早期胃癌组 | 进展期胃癌组 | ||||||||
| n | 阳性n(%) | P值 | n | 阳性n(%) | P值 | n | 阳性n(%) | P值 | n | 阳性n(%) | P值 | |
| 性别 | ||||||||||||
| 男 | 35 | 33(94.3) | >0.05 | 27 | 19(70.4) | >0.05 | 31 | 13(41.9) | >0.05 | 33 | 6(18.2) | >0.05 |
| 女 | 15 | 14(93.3) | 23 | 16(69.6) | 19 | 8(42.1) | 17 | 3(17.6) | ||||
| 年龄(岁) | ||||||||||||
| >40 | 32 | 30(93.8) | >0.05 | 39 | 27(69.8) | >0.05 | 36 | 15(41.7) | >0.05 | 40 | 7(17.5) | >0.05 |
| ≤40 | 18 | 17(94.4) | 11 | 8(72.7) | 14 | 6(42.9) | 10 | 2(20.0) | ||||
| 标本部位 | ||||||||||||
| 胃底 | 9 | 8(88.9) | >0.05 | 7 | 5(71.4) | >0.05 | 10 | 4(40.0) | >0.05 | 12 | 2(16.7) | >0.05 |
| 胃体 | 26 | 25(96.2) | 18 | 13(72.2) | 13 | 6(46.2) | 15 | 3(20.0) | ||||
| 胃窦 | 15 | 14(93.3) | 25 | 17(68.0) | 27 | 11(40.7) | 23 | 4(17.4) | ||||
| 病理特征 | 高级别上皮内瘤变+早期胃癌组 | 进展期胃癌组 | ||||
| n | 阳性n(%) | P值 | n | 阳性n(%) | P值 | |
| 肿瘤直径(cm) | ||||||
| <4 | 40 | 20(50.0) | <0.05 | 8 | 5(62.5) | <0.05 |
| ≥4 | 10 | 1(10.0) | 42 | 4(9.5) | ||
| 分化程度 | ||||||
| 高、中分化 | 28 | 19(67.9) | <0.05 | 16 | 7(43.8) | <0.05 |
| 低分化、印戒细胞 | 22 | 2(9.1) | 34 | 2(5.9) | ||
| 浸润深度 | ||||||
| 黏膜 | 32 | 18(56.3) | <0.05 | 0 | 0(0.0) | <0.05 |
| 黏膜下 | 18 | 3(16.7) | 0 | 0(0.0) | ||
| 肌层 | 0 | 0(0.0) | 22 | 7(31.8) | ||
| 浆膜及浆膜外 | 0 | 0(0.0) | 28 | 2(7.1) | ||
| 淋巴结转移 | ||||||
| 无 | 39 | 20(51.3) | <0.05 | 5 | 3(60.0) | <0.05 |
| 有 | 11 | 1(9.1) | 45 | 6(13.3) | ||
癌基因不可逆的积累突变和失调是恶性肿瘤发生的重要分子机制, 其中ras基因突变、过量表达与肿瘤发生发展的关系密切, 一直受到人们的关注. ras是最早发现的人类原癌基因, 编码相对分子量为21 000 Da的蛋白, 即Ras蛋白, 是一类重要的功能蛋白, 对细胞的增殖、分化、凋亡等多种生理过程发挥重要调节作用. 当Ras蛋白保持持续活化状态, 则能激活下游的信号分子, 造成细胞生长失控、无限制增殖, 进而引起肿瘤的发生. 近年研究表明, 除了ras基因突变及过量表达, 还存在着一些Ras蛋白活性调节因子, 如Ras GAPs, 这些Ras蛋白活性调节因子的功能缺失也会使得Ras蛋白活性异常增高, 继而促进肿瘤发生发展的可能性提高[4,5].
Ras GAPs具有GTP酶活性, 能将与Ras蛋白结合的GTP水解成GDP而使Ras蛋白失活. 因Ras GAPs缺失导致Ras活化进而引起恶性肿瘤的假说, 已经在前列腺癌、乳癌、肺癌、肝癌、结肠癌等多种肿瘤中得到证实[6-8]. RASAL1作为Ras GAPs具有GTP酶活性, 可使Ras蛋白失活, 进而抑制肿瘤的发生发展, 起到抑癌基因的作用[9]. 正常情况下RASAL1基因在内分泌组织高表达, 如肾上腺、唾液腺以及垂体; 而在髓样细胞、肌肉、神经和基质组织中RASAL1呈低表达[10]. Jin等[2]的研究结果提示, RASAL1基因在多种正常组织可正常表达, 而在鼻咽癌、乳腺癌、肺癌、肝癌、食管癌、淋巴瘤等6种肿瘤细胞株以及鼻咽癌、口腔鳞癌肿瘤组织中的表达均有下调. 进一步研究提示, 肿瘤细胞株中RASAL1基因表达降低的机制与RASAL1基因启动子甲基化有关, 基因启动子甲基化后该基因的功能被沉默, 从而使Ras GTPs酶活性减弱, 继而Ras活性上调[2,11]. 因此, RASAL1基因及其编码蛋白具有肿瘤抑制功能. 胃癌的发生同其他肿瘤一样, 有癌基因的过度表达和/或抑癌基因的失活[12]. 最近Seto等[13]通过免疫印迹法发现10个胃癌细胞系中有6个细胞系的RASAL1表达降低; 通过基因转染使胃癌细胞RASAL1表达上调后, 胃癌细胞的增殖减慢; 同时还检测到所有RASAL1表达下调的细胞株均有RASAL1基因启动子的甲基化. 研究结果说明了Ras信号通路在胃癌发生中的重要性.
WHO确定的胃黏膜上皮内瘤变分为低级别和高级别, 低级别上皮内瘤变即传统的轻度及中度异型增生, 除非内镜活检偏离靶点造成漏诊, 经随访研究低级别上皮内瘤变转变成胃癌的几率较低[14], 而高级别上皮内瘤变在病理学上包括重度异型增生及原位癌, 与胃癌关系极为密切, 其细胞肿瘤性与高分化癌无本质区别, 故本研究中将其与早期胃癌列为同组. 本研究提示, RASAL1基因在正常组、低级别上皮内瘤变组、高级别上皮内瘤变+早期胃癌组及进展期胃癌组的阳性率分别为94.0%、70.0%、42.0%及18.0%, 4组中RASAL1基因的阳性率呈递减趋势, 经两两比较及统计分析, 各组之间的差异均有统计学意义(P<0.05). 据此我们推测RASAL1基因的低表达与胃癌的发生及进展有密切关系. 另外本研究还提示RASAL1蛋白表达与临床病理特征也有一定关系, 各组中RASAL1蛋白的表达情况与性别、年龄无相关性(P>0.05); 来源于胃体部的标本其阳性表达率高于来源于胃底及胃窦部的标本, 可能与胃体富含分泌功能的壁细胞有关, 但差异并无统计学意义(P>0.05). 在高级别上皮内瘤变+早期胃癌组和进展期胃癌组中, RASAL1基因的表达与肿瘤大小、分化程度、浸润深度、淋巴结转移均有明显相关性(P<0.05), 据此我们可推测肿瘤体积的增大、分化程度的降低、浸润深度的加深及淋巴转移的出现均可通过胃癌组织中RASAL1的表达下降表现出来.
本研究提示, RASAL1基因的表达下降在胃癌发生发展中起着重要的作用, 进一步深入研究RASAL1基因的分子功能可以为胃癌的早期诊断以及分子靶向治疗提供实验依据.
胃癌是我国发病率较高的恶性肿瘤之一, 居消化系恶性肿瘤的首位, 明确其病因与发病机制、寻找早期诊断及有效药物靶点是医学研究领域的一个重要课题. 目前已明确Ras基因家族活性异常增高是人类恶性肿瘤形成的关键因素之一, 因而围绕Ras基因及其信号转导通路的研究一直是分子肿瘤学的研究热点.
王健生, 教授, 西安交通大学医学院第一附属医院肿瘤外科
RASAL1是近年新发现的基因, 研究发现其功能失活可能与部分恶性肿瘤的发生发展有关, 被认为是候选的抑癌基因. 但迄今为止, 有关RASAL1基因表达改变与胃癌关系的研究报告极少.
Seto等报道, 在10种胃癌细胞株中, 有6种细胞株RASAL1的表达降低.
本文应用免疫组织化学法检测RASAL1基因在正常组、低级别上皮内瘤变、高级别上皮内瘤变+早期胃癌组及进展期胃癌组的表达改变, 并探讨其临床意义, 目前在国内外尚无相关报道.
本文检测了RASAL1基因在正常组、低级别上皮内瘤变、高级别上皮内瘤变+早期胃癌组及进展期胃癌组的表达情况, 并分析其与胃癌临床病理特征的关系, 为胃癌的早期诊断及治疗提供了新的思路.
本文设计合理, 可读性较好, 有助于了解RASAL1在胃癌进展中的表达变化及可能的临床意义.
编辑: 李军亮 电编:何基才
| 2. | Jin H, Wang X, Ying J, Wong AH, Cui Y, Srivastava G, Shen ZY, Li EM, Zhang Q, Jin J. Epigenetic silencing of a Ca(2+)-regulated Ras GTPase-activating protein RASAL defines a new mechanism of Ras activation in human cancers. Proc Natl Acad Sci U S A. 2007;104:12353-12358. [PubMed] [DOI] |
| 4. | Bernards A, Settleman J. GAPs in growth factor signalling. Growth Factors. 2005;23:143-149. [PubMed] [DOI] |
| 5. | Kupzig S, Deaconescu D, Bouyoucef D, Walker SA, Liu Q, Polte CL, Daumke O, Ishizaki T, Lockyer PJ, Wittinghofer A. GAP1 family members constitute bifunctional Ras and Rap GTPase-activating proteins. J Biol Chem. 2006;281:9891-9900. [PubMed] [DOI] |
| 6. | Dote H, Toyooka S, Tsukuda K, Yano M, Ouchida M, Doihara H, Suzuki M, Chen H, Hsieh JT, Gazdar AF. Aberrant promoter methylation in human DAB2 interactive protein (hDAB2IP) gene in breast cancer. Clin Cancer Res. 2004;10:2082-2089. [PubMed] [DOI] |
| 7. | Yano M, Toyooka S, Tsukuda K, Dote H, Ouchida M, Hanabata T, Aoe M, Date H, Gazdar AF, Shimizu N. Aberrant promoter methylation of human DAB2 interactive protein (hDAB2IP) gene in lung cancers. Int J Cancer. 2005;113:59-66. [PubMed] [DOI] |
| 8. | Dote H, Toyooka S, Tsukuda K, Yano M, Ota T, Murakami M, Naito M, Toyota M, Gazdar AF, Shimizu N. Aberrant promoter methylation in human DAB2 interactive protein (hDAB2IP) gene in gastrointestinal tumour. Br J Cancer. 2005;92:1117-1125. [PubMed] [DOI] |
| 9. | Bernards A, Settleman J. Loss of the Ras regulator RASAL1: another route to Ras activation in colorectal cancer. Gastroenterology. 2009;136:46-48. [PubMed] [DOI] |
| 11. | Ohta M, Seto M, Ijichi H, Miyabayashi K, Kudo Y, Mohri D, Asaoka Y, Tada M, Tanaka Y, Ikenoue T. Decreased expression of the RAS-GTPase activating protein RASAL1 is associated with colorectal tumor progression. Gastroenterology. 2009;136:206-216. [PubMed] [DOI] |
| 13. | Seto M, Ohta M, Ikenoue T, Sugimoto T, Asaoka Y, Tada M, Mohri D, Kudo Y, Ijichi H, Tateishi K. Reduced expression of RAS protein activator like-1 in gastric cancer. Int J Cancer. 2011;128:1293-1302. [PubMed] [DOI] |
| 14. | 吴 云林. 提高早期胃癌诊断水平的几项关键点. 胃肠病学和肝病学杂志. 2008;17:175-176. |