修回日期: 2011-02-28
接受日期: 2011-03-08
在线出版日期: 2011-05-08
目的: 评价中国结直肠癌患者中k-ras基因突变状态及其与临床病理参数的关系.
方法: 收集2008-01/2009-12在中国人民解放军南京军区福州总医院手术切除的临床资料完整的结直肠癌石蜡包埋组织280例, 分别应用实时荧光定量PCR和直接测序法检测结直肠癌中k-ras基因外显子2中第12、13编码子上最常见的7种突变类型, 即第12编码子的35G>A、35G>T、35G>C、34G>A、34G>T、34G>C及第13编码子的38G>A, 同时将两种检测结果进行比对分析.
结果: (1)经直接基因测序, 确认在280例结直肠癌中, k-ras基因测序阳性(基因突变型)94例, 阳性率33.57%(94/280), 其中第12编码子的35G>A、35G>T、35G>C、34G>A、34G>T及34G>C的突变率分别为14.64%(41/280)、4.29%(12/280)、0.36%(1/280)、2.86% (8/280)、3.57%(10/280)、0.36%(1/280), 第13编码子的38G>A的突变率为7.5%(21/280); (2)94例k-ras基因测序阳性(基因突变型)病例中, 实时荧光定量PCR阳性91例[灵敏度96.8%(91/94)], 阴性3例; 186例基因测序阴性(野生型)中, 实时荧光定量PCR阴性184例[特异性98.9%(184/186)], 阳性2例; 实时荧光定量PCR法与直接基因测序法符合率为98.2%[(91+184)/280]; (3)k-ras基因突变与患者性别、年龄相关(均P<0.05), 而与肿瘤部位、分化程度、浸润深度、TNM分期、淋巴结转移及远处转移无相关性(均P>0.05).
结论: (1)中国结直肠癌患者中存在较大比例的k-ras基因突变(33.57%), 在临床选取表皮生长因子受体(EGFR)酪氨酸激酶抑制剂和抗EGFR单抗靶向药物治疗结直肠癌患者之前均应常规检测k-ras基因突变状态, 从而为靶向治疗提供可靠的参考依据; (2)实时荧光定量PCR检测结果与基因测序检测结果高度一致, 实时荧光定量PCR能够准确、快速、简便的检测出结直肠癌k-ras基因突变位点, 可用于结直肠癌k-ras基因突变的检测; (3)k-ras基因突变与结直肠癌的生物学行为无明显相关性, 但在≥60岁的女性人群中k-ras基因突变率较高.
引文著录: 刘伟, 王丽, 余英豪, 王旭洲, 武一曼, 吴在增, 欧阳学农, 王烈. k-ras基因在中国结直肠癌患者中的突变状态. 世界华人消化杂志 2011; 19(13): 1367-1374
Revised: February 28, 2011
Accepted: March 8, 2011
Published online: May 8, 2011
AIM: To investigate k-ras gene mutations and to analyze their clinical significance in Chinese patients with colorectal cancer.
METHODS: A total of 280 surgical specimens taken from patients with colorectal cancer who were treated at Fuzhou General Hospital of Nanjing Military Command between January 2008 and December 2009 and had complete clinical data were used in the study. Six k-ras gene mutations at codon 12 (35G>A, 35G>T, 35G>C, 34G>A, 34G>T, 34G>C) and one at codon 13 (38G>A) were detected by real-time fluorescence quantitative PCR (qPCR) and direct sequencing. A comparison of results obtained by the two methods was then performed.
RESULTS: The overall positive rate of k-ras gene mutations obtained by direct sequencing was 33.57% (94/280), and the positive rate of mutations at codon 12 [4.29% (12/280) for 35G>A, 0.36% (1/280) for 35G>T, 0.36% (1/280) for 35G>C, 2.86% (8/280) for 34G>A, 3.57% (10/280) for 34G>T, and 0.36% (1/280) for 34G>C] was 14.64% (41/280) and 7.5% (21/280) at codon 13. Of 94 patients who were demonstrated to have k-ras gene mutations by direct sequencing, 91 were confirmed by qPCR [sensitivity, 96.8% (91/94)]. Meanwhile, of 186 patients who were demonstrated to have no k-ras gene mutation by direct sequencing, 184 were confirmed by qPCR [specificity, 98.9% (184/186)]. The matching rate between the two methods was 98.2%. K-ras gene mutations were significantly associated with sex and age (both P < 0.05), but not with tumor site, differentiation, depth of invasion, TNM stage, lymph node metastasis, or distant metastasis (all P > 0.05).
CONCLUSION: A high proportion of k-ras gene mutations (33.57%) were detected in Chinese patients with colorectal cancer. qPCR may be an accurate, rapid and simple method for detection of k-ras gene mutations in patients with colorectal cancer. There was no significant correlation between k-ras gene mutations and biological behavior of colorectal cancer, though a higher rate of gene mutations were detected in female patients older than 60 years.
- Citation: Liu W, Wang L, Yu YH, Wang XZ, Wu YM, Wu ZZ, Ouyang XN, Wang L. Detection of k-ras gene mutations in Chinese patients with colorectal cancer. Shijie Huaren Xiaohua Zazhi 2011; 19(13): 1367-1374
- URL: https://www.wjgnet.com/1009-3079/full/v19/i13/1367.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i13.1367
结直肠癌(colorectal cancer, CRC)是严重危害人类生命健康的临床最常见的恶性肿瘤之一, 其发病率在全球约排第3位, 在中国居第4位. 目前, 其治疗仍以手术为主, 放化疗为辅, 但大部分患者在诊断时已属晚期, 化疗效果不明显, 寻找有效的化疗药物以提高疗效一直是肿瘤学界的研究方向. 近年来出现的靶向治疗, 促进了个体化治疗的发展, 明显提高了肿瘤治疗的疗效. 在结直肠癌靶向治疗中, 表皮生长因子受体(epidermal growth factor receptor, EGFR)酪氨酸激酶抑制剂和抗EGFR单抗[西妥昔单抗(cetuximab, C225, 商品名Erbitux)、帕尼单抗(panitumumab, 商品名Vectibix)]能特异性地抑制具有野生型k-ras基因的CRC细胞的生长, 使患者的预后得到改善, 而具有k-ras基因突变型的CRC患者并未能获益, 因而, CRC中k-ras基因的突变状态是决定靶向治疗是否有效的关键性指标[1-14]. 本研究采用大宗病例研究, 应用实时荧光定量PCR(real-time fluorescence quantitative PCR, FQ-PCR)和直接基因测序法(direct sequencing)检测k-ras基因外显子2中第12、13编码子上最常见的7种突变类型, 并将两种检测结果进行对比分析, 评价k-ras基因突变与CRC患者的临床病理参数的关系, 以期了解中国CRC人群中k-ras基因突变状态, 同时为CRC的靶向治疗及预后判断提供可靠的参考依据.
收集2008-01/2009-12在中国人民解放军南京军区福州总医院手术切除的临床资料完整的CRC组织标本280例, 手术标本经40 g/L中性甲醛固定, 石蜡包埋, 3 μm厚切片, 进行HE染色确认均为结直肠腺癌; 所有病例术前均未行放化疗. 患者中男170例, 女110例, 年龄21-92(平均56.5)岁. 采用2000年WHO结直肠肿瘤TNM分期标准进行分类. k-ras基因突变检测试剂盒(FQ-PCR法), 购自北京金菩嘉医疗科技有限公司; FQ-PCR仪(ABI Step One Real-time PCR System), ABI 3730测序仪(Applied Biosystems), 石蜡切片机(LEICA RM2245), 电热恒温干燥箱(上海-恒科技有限公司).
1.2.1 FQ-PCR法检测k-ras基因突变: (1)石蜡样本DNA提取[使用TaKaRa公司的石蜡样本处理试剂(DEXPAT)]: 选取全部为CRC组织的石蜡包埋标本, 连续切3张10 μm厚切片, 用灭菌小镊子将组织薄片放入1.5 mL EP管中, 包埋组织至少需要6 mm×6 mm大小; 颠倒混合DEXPATTM试剂, 向装有实验材料的EP管中加入0.5 mL; 盖上EP管盖, 100 ℃加热处理10 min; 加热后立即进行12 000 r/min, 4 ℃离心10 min; 用移液枪吸取水层, 避免吸取石蜡膜、树脂以及组织残渣; 吸取的水层直接作为PCR反应的模板, 进行PCR反应; (2)PCR扩增: 从试剂盒中取出各反应成分, 在冰上融化并颠倒混匀后短暂离心. 设定所需的PCR反应数量为n(n = 样本数+NTC+对照品), 每个PCR反应体系均为27 μL. 将27 μL/反应分装至0.2 mL PCR反应管中, 将PCR反应管转移至样本处理区. 在各设定的PCR反应管中分别加入3 μL相应DNA模板, 盖紧管盖, 充分混匀后转移到检测区. 将反应管放入荧光PCR检测仪内, 记录样本摆放顺序. 循环条件设置: 50 ℃ 2 min(保温)→95 ℃ 10 min(变性)→ (95 ℃ 15 s→69 ℃ 10 s→62 ℃ 1 min), 40次循环; (3)仪器检测通道选择: 本试剂盒中所提供探针均为K-ras突变探针与内参基因探针两种荧光探针的混合物, 每个反应中检测通道设置按说明书进行. 参比荧光选择ROX, 荧光信号采集设为62 ℃, 反应体系为30 μL.
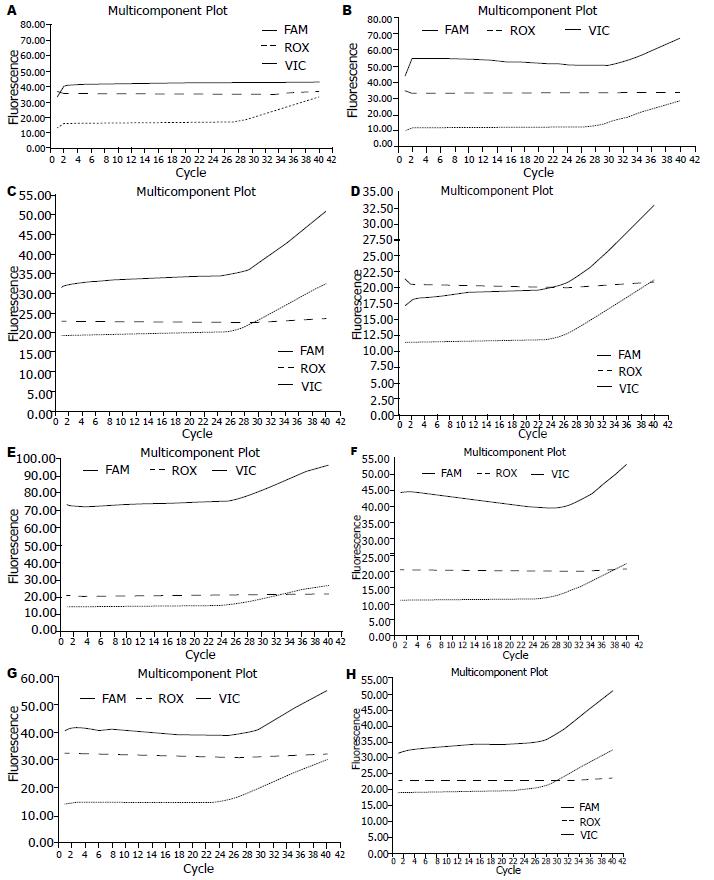
1.2.2 FQ-PCR检测k-ras基因突变状态的结果判断标准: Ct值≤34.0判断为突变阳性; 34.0<Ct值≤38.0判断为突变可疑; Ct值>38.0或为"Undet"判断为突变阴性或者低于试剂盒的检测下限.
1.2.3 直接测序法检测K-ras突变: 将PCR产物在ABI 3730测序仪(Applied Biosystems)上完成测序, 采用DNAStar(Lasergene) 软件进行序列分析.
统计学处理 采用SPSS16.0软件进行χ2检验分析.
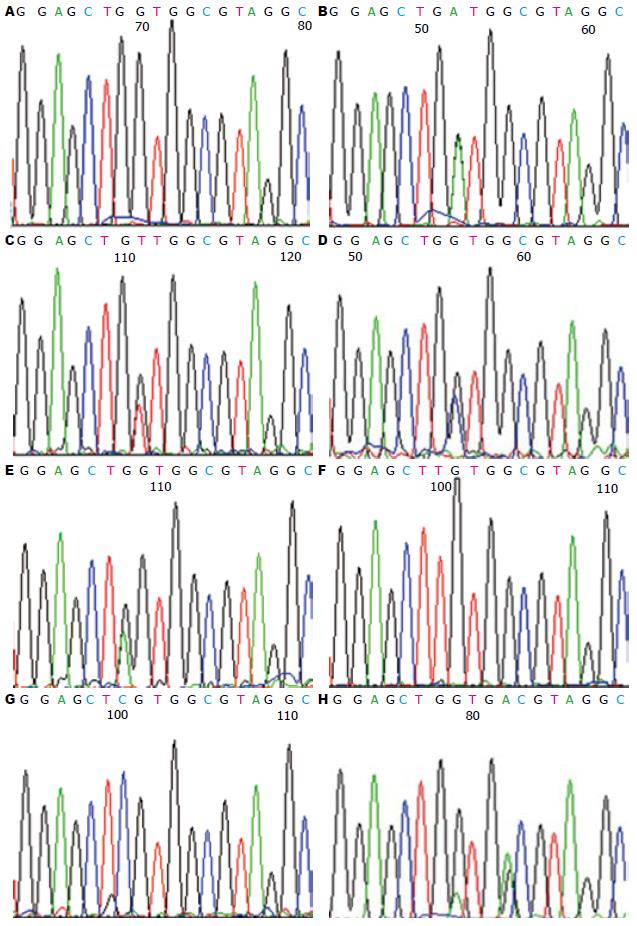
经直接基因测序, 确认在280例CRC中, k-ras基因测序阳性(基因突变型)94例, 阳性率33.57%(94/280), 其中第12编码子的35G>A、35G>T、35G>C、34G>A、34G>T及34G>C的突变率分别为14.64%(41/280)、4.29%(12/280)、0.36%(1/280)、2.86%(8/280)、3.57%(10/280)、0.36%(1/280), 第13编码子的38G>A的突变率为7.5%(21/280)(图1).
在280例CRC中, FQ-PCR阳性93例(基因突变型), 阳性率33.21%(93/280);其中第12编码子的35G>A、35G>T、35G>C、34G>A、34G>T及34G>C的突变率分别为13.93%(39/280)、4.29%(12/280)、0.36%(1/280)、2.86%(8/280)、3.93%(11/280)、0.36%(1/280), 第13编码子的38G>A的突变率为7.5%(21/280)(图2).
基因测序阳性(突变型)94例, 其中FQ-PCR阳性91例[灵敏度96.8%(91/94)], 阴性3例; 基因测序阴性(野生型)186例, 其中FQ-PCR阴性184例[特异性98.9%(184/186)], 阳性2例; FQ-PCR法与基因测序法符合率为(91+184)/280 = 98.2%(表1). 在两种检测方法中, 各突变位点的阳性一致率和阴性一致率符合性均在90%以上, 其中四个位点的符合率达到100%(表2), 两种方法的检测结果高度一致.
| FQ-PCR | 基因测序 | 合计 | |
| 阳性 | 阴性 | ||
| 阳性 | 91 | 2 | 93 |
| 阴性 | 3 | 184 | 187 |
| 合计 | 94 | 186 | 280 |
| FQ-PCR | 基因测序检测 | 合计 | 一致率(%) | |
| 34G>A阳性 | 34G>A阴性 | |||
| 34G>A阳性 | 8 | 0 | 8 | 100.0 |
| 34G>A阴性 | 0 | 272 | 272 | 100.0 |
| 合计 | 8 | 272 | 280 | 100.0 |
| 34G>C阳性 | 34G>C阴性 | |||
| 34G>C阳性 | 1 | 0 | 1 | 100.0 |
| 34G>C阴性 | 0 | 279 | 279 | 100.0 |
| 合计 | 1 | 279 | 280 | 100.0 |
| 34G>T阳性 | 34G>T阴性 | |||
| 34G>T阳性 | 10 | 1 | 11 | 100.0 |
| 34G>T阴性 | 0 | 269 | 269 | 99.6 |
| 合计 | 10 | 270 | 280 | 99.6 |
| 35G>A阳性 | 35G>A阴性 | |||
| 35G>A阳性 | 39 | 0 | 39 | 95.1 |
| 35G>A阴性 | 2 | 239 | 241 | 100.0 |
| 合计 | 41 | 239 | 280 | 99.3 |
| 35G>C阳性 | 35G>C阴性 | |||
| 35G>C阳性 | 1 | 0 | 1 | 100.0 |
| 35G>C阴性 | 0 | 279 | 279 | 100.0 |
| 合计 | 1 | 279 | 280 | 100.0 |
| 35G>T阳性 | 35G>T阴性 | |||
| 35G>T阳性 | 11 | 1 | 12 | 91.7 |
| 35G>T阴性 | 1 | 267 | 268 | 99.6 |
| 合计 | 12 | 268 | 280 | 99.3 |
| 38G>A阳性 | 38G>A阴性 | |||
| 38G>A阳性 | 21 | 0 | 21 | 100.0 |
| 38G>A阴性 | 0 | 259 | 259 | 100.0 |
| 合计 | 21 | 259 | 280 | 100.0 |
在280例CRC中, k-ras基因测序阳性(基因突变型)94例, 阳性率33.57%; k-ras基因突变率在≥60岁的人群中较高(42.4% vs 25.7%, P<0.05), 而且女性高于男性(41.8% vs 28.2%, P<0.05). 而与肿瘤部位、分化程度、浸润深度、TNM分期、淋巴结转移及远处转移无相关性(均P>0.05).
k-ras基因定位于人类染色体12p12.1, 编码一种具有GTP酶活性的鸟嘌呤核苷酸结合蛋白, 定位于细胞膜内侧, 是EGFR功能信号的下游分子, 在膜受体到腺苷环化酶信号传导中起重要作用[15-20], 相关研究证实, k-ras基因状态与EGFR酪氨酸激酶抑制剂和抗EGFR单抗治疗CRC的疗效密切相关. CRYSTAL研究[21]显示, 在K-ras野生型患者中, C225+FOLFIRI联合组有效率显著优于FOLFIRI治疗组(59.3% vs 43.2%, P = 0.0025), 而野生型患者中联合化疗组较单用FOLFIRI治疗组未见明显获益; Christos研究发现[1], K-ras野生型患者一线西妥昔单抗联合化疗较单纯化疗能获得显著延长患者的生存期, 而K-ras突变型患者未见疗效获益. 在帕尼单抗运用于CRC三线治疗的Ⅲ期随机对照试验研究中[2], K-ras野生型患者的无进展生存期(progression-free survival, PFS)风险比突变型者低, 且中位PFS和有效率明显较突变型患者高. 以上临床试验证实, 在CRC治疗过程中, K-ras野生型患者靶向治疗的获益显著优于突变型患者, k-ras基因突变状态是靶向治疗疗效的独立预测指标[22,23].
目前, 检测CRC中k-ras基因突变状态的方法主要有: 限制性片段长度多态性分析、DNA 单链构象多态性分析、直接基因测序法等. 限制性片段长度多态性分析和DNA单链构象多态性分析具有简便、价廉、设备条件要求低, 以及一次处理样品数量多等优点, 但以上两种方法检出率均较低、对被检片段要求苛刻, 故应用范围受到局限. 直接基因测序技术是目前临床上k-ras基因突变检测的常用方法, 因该技术检测结果虽具有客观性和特异性好的优点, 从而使直接测序法成为基因突变检测的金标准.
本研究中, 经直接基因测序, 确认在280例CRC中, k-ras基因测序阳性(基因突变型)94例, 阳性率33.57%(94/280), 其中第12编码子的35G>A、35G>T、35G>C、34G>A、34G>T及34G>C的突变率分别为14.64%(41/280、4.29%(12/280)、0.36%(1/280)、2.86%(8/280)、3.57%(10/280)、0.36%(1/280), 第13编码子的38G>A的突变率为7.5%(21/280), 其中突变率最高的位点为35G>A, 这与相关报道基本一致[24-31]. 表明中国CRC患者中亦存在较大比例的k-ras基因突变, 发生k-ras基因突变的患者将不能从针对EGFR的靶向治疗中获益, 因此中国CRC患者在应用靶向药物治疗之前亦应常规检测k-ras基因突变, 从而为靶向治疗提供可靠的参考依据.
虽然直接测序法能够准确、客观、特异地检测出k-ras基因突变状态, 但其对技术要求高、操作过程复杂、易造成污染以及结果判读耗时费力等缺点也非常明显, 并且各级医院中往往无测序设备, 需将标本送往相应的公司进行检测, 导致其既耗费时间长而且成本较高, 故有很大局限性, 因此, 寻求准确、快速、简便的检测CRC中k-ras基因的突变状态的方法, 以供临床应用西妥昔单抗等靶向药物是临床的迫切需求.
FQ-PCR技术能够从基因水平进行检测, 其操作简单、检测周期短、灵敏性高、特异性强、重复性好, 显示出很多临床应用的优点. 本研究中, 在基因测序阳性(突变型)的94例患者中, FQ-PCR阳性91例, 灵敏度96.8%(91/94), 阴性3例; 在基因测序阴性(野生型)的186例患者中, FQ-PCR阴性184例, 特异性98.9%(184/186), 阳性2例. 在两种检测方法中, 各突变位点的阳性一致率和阴性一致率符合性均在90%以上, 其中4个位点的符合率达到100%, 两种方法的检测结果高度一致, 总符合率达98.2%. 这表明FQ-PCR能够准确、快速、简便的检测CRC中k-ras基因的突变状态, 可以作为临床CRC中k-ras基因的突变状态的方法, 从而为临床靶向治疗提供参考依据.
在280例CRC标本中, 有5例实时荧光定量PCR检测结果与基因测序检测结果不相符, 包括两种情形: 一种为测序检测结果为野生型, FQ-PCR检测结果为突变型, 这可能是由于石蜡包埋样本制备过程中核酸DNA损伤严重, 断裂为短小的核酸片断或者是由于样本保存不当, 核酸DNA降解为短小片断, 这两种情况均可导致可扩增的核酸片断减少, 降低了测序的灵敏性, 由此可产生阴性测序结果, 导致与本试剂盒检测结果的不一致性; 其次为测序检测结果为突变型, 而FQ-PCR检测结果为野生型, 这可由于石蜡包埋样本制备过程中, 核酸碱基受到固定剂的影响发生转换或颠换, 导致产生新的突变位点或者核酸DNA提取质量不高, 存在影响检测探针杂交的因素, 这两种情况都可导致荧光探针杂交不稳定, 从而使引物延伸过程中探针被替换而非被剪切, 最终无荧光信号发出导致假阴性的产生.
在280例CRC中, k-ras基因测序阳性(基因突变型)94例, 阳性率33.57%(94/280); k-ras基因突变与患者性别、年龄相关(均P<0.05), 在≥60岁的女性人群中k-ras基因具有更高的突变率, 而与肿瘤部位、分化程度、浸润深度、TNM分期、淋巴结转移及远处转移无相关性(均P>0.05). Yuan等[32]应用限制性片段长度多态性方法对153例CRC标本k-ras基因外显子2中第12、13编码子的突变情况, k-ras基因突变率为37.9%(58/153), 其中35G>A的突变率最高, 为16.33%(25/153), k-ras基因突变与性别、分化程度、浸润深度、TNM分期、淋巴结转移及远处转移无相关性, 而与年龄和肿瘤部位相关, 且在年轻人和直肠癌中突变率较高. Yunxia等[33]研究认为k-ras基因突变与肿瘤的分化程度有一定的相关性, 而与患者的总生存期无关, 不是患者预后的指标; 而在Chang等[34]的研究中发现, k-ras基因突变率为36%(83/228), 且k-ras基因突变与肿瘤大小、分化程度、淋巴结转移相关, 且与患者的预后密切相关, 是患者预后的参考指标. Poehlmann等[35]研究中, k-ras基因突变率为27.7%(18/65), 其中35G>A的突变率最高, 为18.5%(12/65), 且在具有k-ras基因突变型患者预后较野生型差. 关于k-ras基因突变与临床病理参数及预后的关系的报道不一, 这可能与检测方法不同、样本量大小等原因造成的, k-ras基因突变与患者的预后的关系仍需多中心的临床随访研究来进一步证实.
在应用抗EGFR单抗治疗结直肠癌的靶向治疗中, 部分患者的预后能够改善, 而部分患者并未能从中获益, 寻求能够有效预测靶向治疗疗效的指标是临床的迫切需要.
李淑德, 主任医师, 中国人民解放军第二军医大学长海医院消化内科
结直肠癌的治疗仍以手术为主, 放化疗为辅, 但大部分患者在诊断时已属晚期, 化疗效果不明显, 寻找有效的化疗药物以提高疗效一直是肿瘤学界的研究方向.
Yunxia等研究认为k-ras基因突变与肿瘤的分化程度有一定的相关性, 而与患者的总生存期无关, 不是患者预后的指标.
本文采用FQ-PCR和直接测序法联合检测k-ras基因突变, 综合分析了中国结直肠癌患者中k-ras基因突变状态.
k-ras基因突变状态检测可为临床选取在应用针对EGFR的结直肠癌靶向治疗中治疗结直肠癌患者提供参考依据.
本文设计合理, 研究手段较先进, 对于结直肠癌的分子靶向治疗有重要的指导意义.
编辑: 李军亮 电编:李薇
| 1. | Karapetis CS, Khambata-Ford S, Jonker DJ, O'Callaghan CJ, Tu D, Tebbutt NC, Simes RJ, Chalchal H, Shapiro JD, Robitaille S. K-ras mutations and benefit from cetuximab in advanced colorectal cancer. N Engl J Med. 2008;359:1757-1765. [PubMed] [DOI] |
| 2. | Amado RG, Wolf M, Peeters M, Van Cutsem E, Siena S, Freeman DJ, Juan T, Sikorski R, Suggs S, Radinsky R. Wild-type KRAS is required for panitumumab efficacy in patients with metastatic colorectal cancer. J Clin Oncol. 2008;26:1626-1634. [PubMed] [DOI] |
| 3. | Wierzbicki R, Jonker DJ, Moore MJ, Berry SR, Loehrer PJ, Youssoufian H, Rowinsky EK. A phase II, multicenter study of cetuximab monotherapy in patients with refractory, metastatic colorectal carcinoma with absent epidermal growth factor receptor immunostaining. Invest New Drugs. 2011;29:167-174. [PubMed] [DOI] |
| 4. | Schimanski CC, Zimmermann T, Schmidtmann I, Gockel I, Lang H, Galle PR, Moehler M, Berger MR. K-ras mutation status correlates with the expression of VEGFR1, VEGFR2, and PDGFRalpha in colorectal cancer. Int J Colorectal Dis. 2010;25:181-186. [PubMed] [DOI] |
| 5. | Crous-Bou M, De Vivo I, Porta M, Pumarega JA, López T, Alguacil J, Morales E, Malats N, Rifà J, Hunter DJ. CYP1B1 polymorphisms and k-ras mutations in patients with pancreatic ductal adenocarcinoma. Dig Dis Sci. 2008;53:1417-1421. [PubMed] [DOI] |
| 6. | Krens LL, Baas JM, Gelderblom H, Guchelaar HJ. Therapeutic modulation of k-ras signaling in colorectal cancer. Drug Discov Today. 2010;15:502-516. [PubMed] [DOI] |
| 7. | Codacci-Pisanelli G, Spinelli G, Tomao S. K-ras mutations and cetuximab in colorectal cancer. N Engl J Med. 2009;360:835; author reply 835-836. [PubMed] |
| 8. | Gattenlohner S, Germer C, Muller-Hermelink HK. K-ras mutations and cetuximab in colorectal cancer. N Engl J Med. 2009;360:835; author reply 835-836. [PubMed] |
| 9. | Meads C, Round J, Tubeuf S, Moore D, Pennant M, Bayliss S. Cetuximab for the first-line treatment of metastatic colorectal cancer. Health Technol Assess. 2010;14 Suppl 1:1-8. [PubMed] |
| 10. | van Houdt WJ, de Bruijn MT, Emmink BL, Raats D, Hoogwater FJ, Borel Rinkes IH, Kranenburg O. Oncogenic K-ras activates p38 to maintain colorectal cancer cell proliferation during MEK inhibition. Cell Oncol. 2010;32:245-257. [PubMed] |
| 11. | Licar A, Cerkovnik P, Ocvirk J, Novakovic S. KRAS mutations in Slovene patients with colorectal cancer: frequency, distribution and correlation with the response to treatment. Int J Oncol. 2010;36:1137-1144. [PubMed] |
| 12. | Waldner MJ, Neurath MF. The molecular therapy of colorectal cancer. Mol Aspects Med. 2010;31:171-178. [PubMed] [DOI] |
| 13. | Smith G, Bounds R, Wolf H, Steele RJ, Carey FA, Wolf CR. Activating K-Ras mutations outwith 'hotspot' codons in sporadic colorectal tumours - implications for personalised cancer medicine. Br J Cancer. 2010;102:693-703. [PubMed] [DOI] |
| 14. | Turaga K, Shibata D. K-Ras and MSI: potential markers of both patient prognosis and treatment efficacy. Ann Surg Oncol. 2010;17:354-355. [PubMed] [DOI] |
| 15. | Frattini M, Saletti P, Romagnani E, Martin V, Molinari F, Ghisletta M, Camponovo A, Etienne LL, Cavalli F, Mazzucchelli L. PTEN loss of expression predicts cetuximab efficacy in metastatic colorectal cancer patients. Br J Cancer. 2007;97:1139-1145. [PubMed] [DOI] |
| 16. | Eng C. K-Ras and sensitivity to EGFR inhibitors in metastatic colorectal cancer. Clin Adv Hematol Oncol. 2008;6:174-175. [PubMed] |
| 17. | Markman B, Javier Ramos F, Capdevila J, Tabernero J. EGFR and KRAS in colorectal cancer. Adv Clin Chem. 2010;51:71-119. [PubMed] [DOI] |
| 18. | Bennani B, Gilles S, Fina F, Nanni I, Ibrahimi SA, Riffi AA, Nejjari C, Benajeh DA, El Abkari M, Martin PM. Mutation analysis of BRAF exon 15 and KRAS codons 12 and 13 in Moroccan patients with colorectal cancer. Int J Biol Markers. 2010;25:179-184. [PubMed] |
| 19. | Dunn EF, Iida M, Myers RA, Campbell DA, Hintz KA, Armstrong EA, Li C, Wheeler DL. Dasatinib sensitizes KRAS mutant colorectal tumors to cetuximab. Oncogene. 2011;30:561-574. [PubMed] [DOI] |
| 20. | Winder T, Lenz HJ. Beyond KRAS: a new approach in metastatic colorectal cancer. Lancet Oncol. 2010;11:706-707. [PubMed] [DOI] |
| 21. | Van Cutsem E, Köhne CH, Hitre E, Zaluski J, Chang Chien CR, Makhson A, D'Haens G, Pintér T, Lim R, Bodoky G. Cetuximab and chemotherapy as initial treatment for metastatic colorectal cancer. N Engl J Med. 2009;360:1408-1417. [PubMed] [DOI] |
| 22. | Ramos FJ, Tabernero J. K-Ras mutation status as a predictive biomarker in metastatic colorectal cancer. Biomark Med. 2008;2:97-99. [PubMed] [DOI] |
| 23. | Folprecht G. [Current medicinal treatment of metastasized colorectal carcinoma]. Chirurg. 2010;81:507-515. [PubMed] [DOI] |
| 24. | Cunningham D, Humblet Y, Siena S, Khayat D, Bleiberg H, Santoro A, Bets D, Mueser M, Harstrick A, Verslype C. Cetuximab monotherapy and cetuximab plus irinotecan in irinotecan-refractory metastatic colorectal cancer. N Engl J Med. 2004;351:337-345. [PubMed] [DOI] |
| 25. | Cartwright T, Kuefler P, Cohn A, Hyman W, Berger M, Richards D, Vukelja S, Nugent JE, Ruxer RL Jr, Boehm KA, Asmar L. Results of a phase II trial of cetuximab plus capecitabine/irinotecan as first-line therapy for patients with advanced and/or metastatic colorectal cancer. Clin Colorectal Cancer. 2008;7:390-397. [PubMed] [DOI] |
| 26. | Cavallini A, Valentini AM, Lippolis C, Campanella D, Guerra V, Caruso ML. KRAS genotyping as biomarker in colorectal cancer: a comparison of three commercial kits on histologic material. Anticancer Res. 2010;30:5251-5256. [PubMed] |
| 27. | Su N, Xu XY, Chen H, Gao WC, Ruan CP, Wang Q, Sun YP. Increased expression of annexin A1 is correlated with K-ras mutation in colorectal cancer. Tohoku J Exp Med. 2010;222:243-250. [PubMed] [DOI] |
| 28. | Dempke WC, Heinemann V. Ras mutational status is a biomarker for resistance to EGFR inhibitors in colorectal carcinoma. Anticancer Res. 2010;30:4673-4677. [PubMed] |
| 29. | Onozato W, Yamashita K, Yamashita K, Kuba T, Katoh H, Nakamura T, Sato T, Ihara A, Okayasu I, Watanabe M. Genetic alterations of K-ras may reflect prognosis in stage III colon cancer patients below 60 years of age. J Surg Oncol. 2011;103:25-33. [PubMed] [DOI] |
| 30. | Tímár J, Hegedüs B, Rásó E. KRAS mutation testing of colorectal cancer for anti-EGFR therapy: dogmas versus evidence. Curr Cancer Drug Targets. 2010;10:813-823. [PubMed] [DOI] |
| 31. | Yuan Y, Hu HG, Ye XX, Shen H, Zheng S. [K-ras gene mutation in colorectal cancer and its clinicopathologic significance]. Zhonghua Waike Zazhi. 2010;48:1247-1251. [PubMed] |
| 32. | Yunxia Z, Jun C, Guanshan Z, Yachao L, Xueke Z, Jin L. Mutations in epidermal growth factor receptor and K-ras in Chinese patients with colorectal cancer. BMC Med Genet. 2010;11:34. [PubMed] [DOI] |
| 33. | Chang YS, Yeh KT, Chang TJ, Chai C, Lu HC, Hsu NC, Chang JG. Fast simultaneous detection of K-RAS mutations in colorectal cancer. BMC Cancer. 2009;9:179. [PubMed] [DOI] |
| 34. | Poehlmann A, Kuester D, Meyer F, Lippert H, Roessner A, Schneider-Stock R. K-ras mutation detection in colorectal cancer using the Pyrosequencing technique. Pathol Res Pract. 2007;203:489-497. [PubMed] [DOI] |