修回日期: 2011-04-20
接受日期: 2011-04-26
在线出版日期: 2011-05-08
目的: 探讨LL-37在溃疡性结肠炎(UC)患者结肠黏膜组织中的表达及其与结肠炎症之间的关系.
方法: 选择2007-09/2008-12在北京大学第一医院消化内科确诊的UC患者32例, 并按UC疾病活动指数(UCDAI)分为轻、中、重度活动组; 选择同时期行结肠镜发现有结肠息肉的患者为对照组; 用荧光定量PCR方法测定不同疾病活动度UC患者的炎症结肠黏膜中LL-37和炎症因子(TNF-α、IL-1β、IL-4)的表达及其相互关系; 用免疫组织化学方法观察LL-37在正常结肠黏膜和炎症黏膜中的表达部位; 用炎症因子体外刺激结肠上皮细胞, 观察其对LL-37表达的影响.
结果: 活动期UC患者炎症结肠黏膜中LL-37和炎症因子的表达较正常黏膜增高(LL-37: 4.97±6.95, 31.46±10.74, 75.50±13.19 vs 0.27±0.45; TNF-α: 97.04±23.74, 201.07±33.46, 290.81±30.45 vs 72.82±18.85; IL-1β: 72.98±38.03, 153.46±22.68, 211.34±25.12 vs 38.56±10.38; IL-4: 26.04±12.47, 46.38±15.12, 46.94±16.53 vs 19.34±11.61, 均P<0.05), 且随疾病活动度的增加而增高, 二者的表达呈正相关(γ = 0.965, 0.940, 0.628, 均P<0.01); LL-37表达于人正常结肠黏膜和UC患者炎症结肠黏膜的表层上皮, 另外在UC患者炎症黏膜中浸润的大量炎症细胞内存在高表达; 体外炎症因子刺激并不能上调结肠上皮细胞中LL-37的表达.
结论: 抗菌肽LL-37在活动期UC患者炎症结肠黏膜中的高表达及其与炎症因子呈正相关, 提示其参与了UC的免疫炎症过程, 但其机制可能与结肠上皮细胞无关.
引文著录: 李懿璇, 王化虹, 迟雁. 人抗菌肽LL-37在溃疡性结肠炎组织中的表达及其与结肠炎症的关系. 世界华人消化杂志 2011; 19(13): 1359-1366
Revised: April 20, 2011
Accepted: April 26, 2011
Published online: May 8, 2011
AIM: To investigate the expression of human cathelicidin LL-37 in the colon mucosa of patients suffering from ulcerative colitis and to assess its relationship with colon inflammation.
METHODS: Thirty-two patients with ulcerative colitis were included in the study. The severity of ulcerative colitis was assessed using the Ulcerative Colitis Disease Activity Index (UCDAI). The expression of LL-37 and cytokines (TNF-α, IL-1β and IL-4) in the colon mucosa was detected by real-time RT-PCR. Immunohistochemistry was used to investigate the location of the LL-37 peptide in the normal and inflamed colon mucosa. Colon epithelial cells were stimulated in vitro with cytokines to evaluate mechanisms that influence cathelicidin production.
RESULTS: The mRNA expression of LL-37 and cytokines in the colon mucosa was significantly elevated with the severity of disease activity in UC patients compared to controls (LL-37: 4.97 ± 6.95, 31.46 ± 10.74, 75.50 ± 13.19 vs 0.27 ± 0.45; TNF-α: 97.04 ± 23.74, 201.07 ± 33.46, 290.81 ± 30.45 vs 72.82 ± 18.85; IL-1β: 72.98 ± 38.03, 153.46 ± 22.68, 211.34 ± 25.12 vs 38.56 ± 10.38; IL-4: 26.04 ± 12.47, 46.38 ± 15.12, 46.94 ± 16.53 vs 19.34 ± 11.61, all P < 0.05). Significant correlations were found between the mRNA expression of LL-37 and cytokines (r = 0.965, 0.940, 0.628, all P < 0.01). Immunohistochemistry analysis showed that the LL-37 peptide was located in the colon epithelial surface in both normal controls and UC patients. In addition, the LL-37 peptide was detected easily in inflammatory cells infiltrating into the inflamed colon mucosa in UC patients. In vitro stimulation with cytokines did not up-regulate LL-37 expression in colon epithelial cells.
CONCLUSION: The up-regulation of LL-37 expression in inflamed colon mucosa of UC patients and high correlation between the expression of LL-37 and cytokines indicate a close relationship between LL-37 and immune inflammatory response in UC patients with ulcerative colitis; however, this process does not involve colonic epithelial cells.
- Citation: Li YX, Wang HH, Chi Y. Correlation between expression of human cathelicidin peptide LL-37 and colon inflammation in patients with ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2011; 19(13): 1359-1366
- URL: https://www.wjgnet.com/1009-3079/full/v19/i13/1359.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i13.1359
近几十年来有关炎症性肠病(inflammatory bowel disease, IBD)的两大类疾病溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn's disease, CD)发病机制的研究越来越多, 目前公认为细菌感染和异常的免疫应答相互作用使黏膜炎症迁延不愈是IBD的机制核心[1-3]. 其中各种炎症因子表达的失衡与肠道炎症的发生和迁延密切相关[4-7]. 人的肠道黏膜内有内源性免疫系统来维持肠道内环境平衡[8,9], 其中一大类非常重要的内源性免疫系统的效应器被称作cathelicidins, 目前发现唯一的人cathelicidin源抗菌肽为hCAP18/LL-37[10]. LL-37表达广泛[11-17], 其功能和作用复杂[18-22]. 已证实LL-37表达于人的胃和结肠黏膜上皮, 在胃肠道黏膜起着重要防御功能[12,13]. 很多研究提示抗菌肽的表达在IBD患者的结肠黏膜中存在异常[23-28]. 其机制及作用尚不清楚, 综合目前研究结果认为可能CD患者中抗菌肽是低表达并导致肠黏膜屏障的缺陷, 从而诱发细菌感染和慢性炎症[23,24,26], 但UC患者中抗菌肽的表达及意义尚不清楚. 本研究主要揭示LL-37在UC患者结肠黏膜的表达情况及其与结肠炎症之间的关系.
本研究通过了北京大学第一医院伦理委员会的伦理审批, 所有参加入组的患者都是自愿参加并签署知情同意书. UC组的选择标准: 选择2007-09/2008-12在北京大学第一医院消化内科确诊的UC患者. 诊断标准依据2007年中华医学会消化病学分会炎症性肠病协作组制定的炎症性肠病诊治规范; 病情的活动度采用Sutherland或Mayo疾病活动指数(disease activity index, DAI)评分分为3级, 3-5分为轻度活动, 6-10分为中度活动, 11-12分为重度活动. 总共32例患者(平均年龄49.56岁)入选, 其中轻度活动组(UCDAI平均分4.1)10例, 中度活动组(UCDAI平均分8.3)12例, 重度活动组(UCDAI平均分11.2)10例. 对照组的选择标准: 同时期行结肠镜发现有结肠息肉的患者. 总共12例患者(平均年龄60.75岁)入选. UC组及对照组的排除标准: 伴发有其他可能会影响试验结果的疾病者, 包括: 全身或局部的感染性疾病、炎症性皮肤病、恶性肿瘤等; 近期服用维生素D者; 患有严重心、肝、肺、肾疾病, 不能耐受结肠镜检查者; 拒绝取活检者; 另外UC组的排除标准还包括诊断不明确的各种肠炎. UC组: 在内镜下观察炎症部位结肠黏膜取活检组织1-2块. 对照组: 在内镜下观察息肉以外的正常结肠黏膜取活检组织1-2块. 将活检的结肠黏膜标本立即放入液氮中冷冻保存.
1.2.1 RNA的制备、逆转录和普通PCR及实时荧光定量PCR: 活检的结肠黏膜标本放在液氮中保存. 组织和细胞的RNA参照TRIzol(美国Invitrogen公司)的说明书用TRIzol方法提取, 用紫外分光光度计定量RNA的浓度. 取2 μg总RNA, 用0.5 μg的Oligo-dT(美国Promega公司)、10 mmol/L的dNTP(美国Promega公司)各1.25 μL和200 U M-MLV(美国Promega公司)配成25 μL反应体系, 逆转录合成cDNA, 具体参照M-MLV逆转录酶的说明书进行, 放入-20 ℃保存.
引物序列及TaqMan探针(上海生工生物工程技术服务有限公司合成)见表1. 对cDNA分别进行目的基因和管家基因的普通PCR扩增, 将扩增产物进行2%的琼脂糖凝胶电泳, 在紫外灯下观察条带. 实时荧光定量PCR的反应体系为25 μL, 包含模板cDNA 2 μL, 上下游引物各0.75 pmol, 10 mmol/L的dNTP各0.5 μL, 10×反应缓冲液2.5 μL, TaqMan探针5 pmol, Taq DNA聚合酶0.25 μL. 采用荧光定量PCR扩增仪(美国ABI公司Prism 7300操作系统)进行DNA的扩增, 反应条件为: 95 ℃预变性10 min; 95 ℃ 15 s, 60 ℃ 30 s, 72 ℃ 1 min, 共40个循环. 通过系统自带的软件得出样品的Ct值(荧光信号达到阈值的循环数), 将每个标本目的基因的Ct值与管家基因GAPDH的Ct值相比较, 换算成目的基因的表达量: 2(Ct管家基因-Ct目的基因), 经过同一个阳性对照纠正后得出目的基因表达的相对水平. 由于目的基因在某些标本中的表达非常少, 故最终表达水平以原始结果×100倍表示.
| 引物名称 | 序列 | 产物大小(bp) | |
| LL-37 | 上游引物 | 5'-ACCCAGCAGGGCAAATCTC-3' | 109 |
| 下游引物 | 5'-GAAGGACGGGCTGGTGAAG-3' | ||
| TaqMan探针 | 5'-TGTTATCCTTATCACAACTGAT-3' | ||
| TNF-α | 上游引物 | 5'-GGCCCCCAGAGGGAAGA-3' | 118 |
| 下游引物 | 5'-GGTTTGCTACAACATGGGCTACA-3' | ||
| TaqMan探针 | 5'-TTCCCCAGGGACCTCTCTCTAATCAGCC-3' | ||
| IL-1β | 上游引物 | 5'-GTTCCCTGCCCACAGACCTT-3' | 97 |
| 下游引物 | 5'-CGTTATCCCATGTGTCGAAGAA-3' | ||
| TaqMan探针 | 5'-TGACCTGAGCACCTTCTTTCCCTTCATCTT-3' | ||
| IL-4 | 上游引物 | 5'-CCACGGACACAAGTGCGATA-3' | 102 |
| 下游引物 | 5'-GCCCTGCAGAAGGTTTCCTT-3' | ||
| TaqMan探针 | 5'-TGAACAGCCTCACAGAGCAGAAGAACACA-3' | ||
| GAPDH | 上游引物 | 5'-CAGTCAGCCGCATCTTCTTTT-3' | 110 |
| 下游引物 | 5'-GTGACCAGGCGCCCAATAC-3' | ||
| TaqMan探针 | 5'-CGTCGCCAGCCGAGCCACA-3' |
1.2.2 免疫组织化学: 活检的结肠黏膜标本放入40 g/L的甲醛中固定, 石蜡包埋, 切片4 μm. 脱蜡、水化后用3%过氧化氢甲醇室温放置20 min以消除内源性过氧化物酶活性. 用0.01 mol/L枸橼酸盐缓冲液(pH6.0)微波法进行抗原修复. 用正常的山羊血清封闭液进行封闭后, 滴加1:200兔抗人LL-37一抗(美国Santa Cruz公司)4 ℃过夜, 滴加通用型二抗(北京中杉金桥生物技术有限公司二步法免疫组织化学检测试剂盒)室温放置1 h, 用DAB溶液(北京中杉金桥生物技术有限公司浓缩型DAB试剂盒)显色3 min, 流水终止反应后苏木素复染核, 并脱水、透明后封片. 染色阳性标准: 细胞胞质内见到棕黄色颗粒.
1.2.3 细胞培养: 人结肠癌细胞系HT-29在含50 mL/L CO2, 37 ℃恒温的培养箱中培养, 细胞培养基为含2 mmol/L的L-谷氨酰胺和100 mL/L胎牛血清(美国Hyclone公司)的RPMI 1640培养基(美国Hyclone公司). 在培养基内分别加入终浓度为0.1、1 、10、100 μg/L的TNF-α, IL-1β(美国Millipore公司)或IL-4(美国Peprotech Asia公司), 阳性对照组中加入终浓度2 mmol/L的丁酸钠, 继续培养细胞24及48 h. 收集细胞后用RT-PCR的方法测定LL-37的表达.
统计学处理 所有计量资料以mean±SD表示, 用SPSS13.0软件对资料进行分析. 由于部分数据方差不齐, 用独立样本近似t检验比较两组间的差异; 用单因素方差分析近似F检验比较两组以上的组间差异; 用Pearson相关性检验分析LL-37和细胞因子间的相关性, P<0.05认为差异有统计学意义.
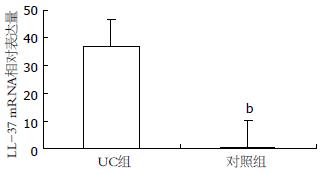
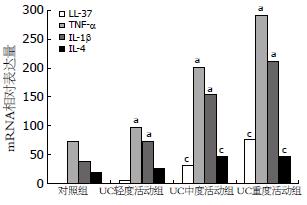
29/32例UC组患者和4/12例对照组患者的结肠黏膜组织在本实验条件下有LL-37 mRNA的扩增. 对于在本实验条件下未检测到目的基因扩增的标本, 即认为无目的基因的表达, 表达水平设定为0. UC组患者炎症部位结肠黏膜LL-37 mRNA的表达水平为36.94±30.44, 对照组患者正常结肠黏膜LL-37 mRNA的表达水平为0.27±0.45, 较UC组明显降低, 两者相比具有显著性差异(P<0.001, 图1). LL-37在不同疾病活动程度的UC患者结肠黏膜的表达有差异, 随着UCDAI的评分增加, LL-37的表达进行性升高, 即重度活动组>中度活动组>轻度活动组(P<0.05), 但轻度活动组和对照组LL-37的表达无显著性差异(表2, 图2).
| 分组 | n | LL-37 | TNF-α | IL-1β | IL-4 |
| 对照组 | 12 | 0.27±0.45 | 72.82±18.85 | 38.56±10.38 | 19.34±11.61 |
| UC轻度活动组 | 10 | 4.97±6.95 | 97.04±23.74 | 72.98±38.03 | 26.04±12.47 |
| UC中度活动组 | 12 | 31.46±10.74 | 201.07±33.46 | 153.46±22.68 | 46.38±15.12 |
| UC重度活动组 | 10 | 75.50±13.19 | 290.81±30.45 | 211.34±25.12 | 46.94±16.53 |
各种炎症因子的表达在UC组较对照组明显增高, 且随着UCDAI的评分增加而升高, 其中TNF-α和IL-1β的表达在UC重度活动组>UC中度活动组>UC轻度活动组>对照组(P<0.05), IL-4在UC中、重度活动组的表达也较轻度活动组明显增加(表2, 图2). LL-37的表达和炎症因子TNF-α、IL-1β及IL-4的表达呈明显的正相关关系(γ = 0.965, 0.940, 0.628, 均P<0.01).
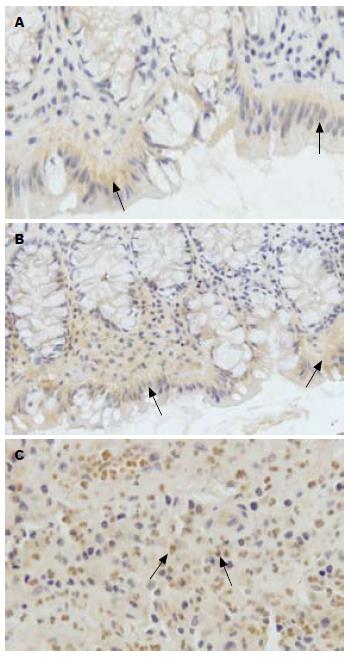
LL-37表达于人正常结肠黏膜的表层上皮和临近隐窝的上部, 而深部隐窝和固有层腺体上皮几乎无表达. LL-37在UC患者炎症部位结肠黏膜的表达与正常结肠黏膜相似, 也是仅位于结肠表层上皮, 且与正常结肠黏膜相比表达无特别的差异. 免疫组织化学灰度值结果显示LL-37在对照组结肠黏膜表层上皮的表达为0.1877±0.0015, 在UC炎症部位结肠黏膜表层上皮的表达为0.1893±0.0014, 两者之间无显著性差异(P>0.05). 此外, LL-37在UC患者炎症部位结肠黏膜的隐窝脓肿和固有层内浸润的大量炎症细胞中高表达, 提示LL-37可能在UC患者的结肠黏膜炎症中发挥重要作用(图3).
在本实验条件下(荧光定量PCR), 结肠上皮细胞HT-29的LL-37 mRNA的表达是低于检测下限的, 用不同浓度(0.1、1、10、100 μg/L)的炎症因子TNF-α, IL-1β或IL-4体外刺激结肠上皮细胞HT-29 24或48 h后, 仍然不能检测到LL-37的表达, 而作为阳性对照组, 用丁酸(2 mmol/L)刺激HT-29细胞24 h后即有LL-37的表达(图4). 故认为细胞因子并不能上调结肠上皮细胞LL-37的表达.
IBD的两大类主要疾病UC和CD是一组由多因素引起的以慢性病程、反复发作为特点的慢性非特异性肠道炎症性疾病. 虽然其结肠炎症的具体病因和机制尚未完全清楚, 但目前研究的进展表明: 在易感人群中, 环境因素、肠道内微生物和机体的免疫系统三者相互作用导致异常的免疫应答[3,29]. 这种异常的免疫应答通过内源性免疫系统以及后天获得性免疫系统介导并最终引起肠道炎症[30], 其中内源性免疫系统的主要效应器-抗菌肽以其强大的杀灭病原微生物和免疫调节功能在IBD的发病机制中受到越来越多的关注[31].
实际上抗菌肽cathelicidins最初是在皮肤病中的研究广泛且成熟, 其在炎症性皮肤病中表达异常且参与疾病的发病机制, 如: cathelicidins在特应性皮炎的患者中表达是降低的, 并可以导致二重感染的几率大大增加; 在红斑痤疮的患者中cathelicidins过度表达并形成异常结构, 可导致局部的皮肤炎症和血管反应; 而在银屑病患者中cathelicidins与自身DNA结合并诱发自身免疫反应[32,33]. 随着研究的深入, 发现cathelicidins在结肠黏膜存在表达, 且与IBD的发病机制有密切联系, LL-37在UC患者的结肠黏膜表达显著升高, 而在CD患者中表达无类似升高, 但这种异常表达在IBD发病机制中的意义尚不明确[28].
本研究结果显示: LL-37在UC患者炎症部位结肠黏膜的表达较对照组正常结肠黏膜显著升高; 同时我们初步探讨了不同UC疾病活动度患者中LL-37表达的差异: 随着UC疾病活动度的增加, LL-37的表达进行性升高. 这提示LL-37的表达和UC患者的疾病严重程度或疾病活动度有密切关系, 其表达水平有助于反应UC目前疾病的炎症状态及程度. 既往的研究曾表明UC患者LL-37的表达较健康体检者正常结肠黏膜升高, 无论是在炎症部位还是非炎症部位的结肠黏膜, 但在炎症部位结肠黏膜中这种升高更为显著[28], 这也支持我们的研究结果LL-37的表达与UC患者的结肠炎症程度有关; 近期Wehkamp的研究表明另一大类抗菌肽-防御素HBD-2和HBD-3的表达在UC患者的结肠黏膜也是显著增高的, 而且主要是炎症部位结肠黏膜的表达增高[23]; 有研究者认为HBD2的高表达在炎症黏膜显著高于非炎症黏膜提示HBD2与结肠炎症反应持久放大有关[34].
为了进一步评价LL-37在UC患者中的高表达和结肠炎症之间的关系, 我们研究了LL-37的表达和炎症因子的关系. 炎症因子是在IBD发病机制中起关键作用的一类免疫炎症分子[35]; 他是由免疫细胞产生的一类短肽, 在细胞之间起信号传递的作用, 通过自分泌、旁分泌和内分泌途径能够介导局部和全身性炎症反应[6]. IBD中大量致炎因子和调节性炎症因子的表达失衡导致了肠道黏膜的破坏程度并决定了疾病的表型[36]. TNF-α和IL-1β是两个在UC发病机制中非常重要的致炎因子, 许多研究都表明其在UC患者中的表达显著升高[34,37,38]; Olsen和Guimbaud的研究提示TNF-α、IL-1β的表达随着活动期UC疾病活动度的增加而相应的升高, 和结肠炎症呈很好的相关性[7,39]. 但是很多调节性炎症因子如IL-4等在IBD的表达及作用尚研究的不透彻, 不同的研究观察到IL-4在UC中的表达也不一致[7,40-42]; IL-4对T、B淋巴细胞具有调节作用, 在肠道被认为是一个免疫抑制性分子, 产生IL-4的Th2型CD4 T淋巴细胞在IBD的免疫病理机制中也起非常重要的作用[43]. 我们的研究表明细胞因子TNF-α、IL-1β和IL-4在UC患者炎症部位结肠黏膜的表达较对照组正常结肠黏膜显著升高, 并和UC疾病活动度有关; 其中TNF-α和IL-1β的表达随着疾病活动度的增加而显著升高, IL-4表达也随着疾病活动度的增加有升高的趋势, 特别是在中、重度患者中, 但没有前两者明显.
进一步相关性研究的结果显示LL-37的表达与炎症因子TNF-α、IL-1β和IL-4呈明显的正相关, 提示LL-37可能和UC异常免疫炎症反应有密切关系. 一方面, LL-37的表达在某些细胞或组织中受炎症因子的调控: 如炎症因子IL-6和IFN-γ可以刺激外周血单核细胞使LL-37蛋白的分泌量明显增加[44]; 特应性皮炎被认为与UC类似, 是一种Th2应答为主的皮肤炎症性疾病, Howell等[45]的研究发现Th2细胞因子IL-4和IL-13可以抑制抗菌肽的LL-37在角质细胞的表达而使特应性皮炎患者皮肤感染的机会增加; 另外发现, LL-37基因中有可以和IL-6结合的增强子, IL-6在某些上皮中可以调节LL-37的表达[11,46]. 另一方面, LL-37反过来也具有趋化炎症细胞、调节机体免疫功能的作用: 他具有对单核细胞、肥大细胞、中性粒细胞和T淋巴细胞的趋化作用[47-49], 可以促进肥大细胞脱颗粒释放组胺[50]; 并能够调控20多种趋化因子及其受体的表达, 已证明LL-37可以上调趋化因子MCP-1和IL-8的表达[51]; 还促进DC细胞的成熟从而增强Th1细胞的应答[52]. 因此, LL-37与机体免疫功能有密切关系, 本研究的结果-LL-37和炎症因子表达的高度正相关性-说明其在UC异常免疫炎症反应中发挥重要作用.
LL-37在胃肠道的表达主要位于胃和结肠黏膜, 并可以分泌至胃肠道黏膜表面, 但在小肠黏膜中几乎无表达[12,13]. 本研究发现LL-37在人正常结肠黏膜和IBD患者炎症部位结肠黏膜的表达部位类似, 主要位于表层上皮细胞及临近的隐窝上部, 而在深部隐窝上皮未发现其表达, Hase等和Schauber等的研究与我们的研究结果相符合[12,28]. 另外我们首次发现LL-37蛋白表达于UC炎症部位结肠黏膜的隐窝脓肿和固有层内浸润的大量炎症细胞中, 因此我们推测LL-37参与UC免疫炎症过程的机制可能为: LL-37的表达在结肠上皮细胞水平或是炎症细胞水平或是二者兼有受炎症因子的调控.
进一步比较LL-37蛋白在正常结肠黏膜表层上皮和UC炎症部位结肠黏膜表层上皮的表达, 结果显示LL-37的表达在两者之间无显著性差异; 另外, 体外炎症因子刺激结肠上皮细胞系HT-29后, 不能诱导LL-37的表达. 据此实验结果, 可以认为LL-37的表达在结肠上皮细胞水平不受炎症因子的调控. 在正常生理情况下结肠表层上皮细胞中即表达LL-37, 有活性的LL-37被分泌至肠腔后在肠道表面形成一层薄膜屏障可以抑制细菌的黏附和生长, 这在维持宿主和肠道菌群之间的内环境稳定中具有重要意义[53]; 当细菌入侵时, 肠道的感受器被激活, 结肠上皮细胞在细菌的刺激下LL-37表达升高, 形成控制细菌入侵的第一道防线[12,54]; Islam等发现志贺菌却可以引起肠道上皮抗菌肽LL-37表达下降, 这被认为是细菌逃逸机体对其防御的一种机制[55]. 因此, 结肠上皮细胞表达的LL-37可能是肠道黏膜屏障抗感染的效应器, 而与UC的异常免疫炎症反应无关.
最初LL-37的表达即是在骨髓中发现的, 随后证实LL-37广泛存在于不同类型的免疫炎症细胞中, 包括单核、NK、T、B淋巴细胞, 肥大细胞及中性粒细胞[44,56-58]. 另外, 当感染急性志贺菌痢的时候, 结肠黏膜的固有层内有大量炎症免疫细胞浸润并表达cathelicidins抗菌肽; 研究表明, cathelicidins的转录活性和结肠炎症程度是匹配的, 炎症感染最重的部位其转录活性也最高, 随着感染控制后, 固有层内的免疫炎症细胞消失, 同时也伴随着固有层cathelicidins的表达下降[59]. 据此, 我们推测LL-37在UC患者中的高表达很可能是由UC患者炎症黏膜内大量炎症细胞浸润并产生的, 其和UC患者结肠炎症的密切关系也很可能是通过炎症细胞介导的.
Schauber等[28]认为LL-37在不同组织的表达可能受不同因素的调控, LL-37表达的受调节因素可能具有组织特异性. 本研究证实LL-37表达于UC患者炎症结肠黏膜的表层上皮, 但更重要的是, 表达于局部隐窝脓肿和固有层内浸润的大量炎症细胞中; 因此虽然我们的研究提示LL-37在结肠上皮细胞水平不受炎症因子的调控, 尚需要进一步研究证明LL-37在UC炎症细胞的表达是否受炎症因子的调控, 即: LL-37在炎症细胞中的表达是否和UC异常免疫炎症反应有关, 这需要进一步的研究去证实.
总之, 本研究初步观察探讨了抗菌肽LL-37在UC患者中的表达情况, 其在活动期UC患者炎症结肠黏膜中的高表达及其与炎症因子的正相关关系提示其参与了UC的免疫炎症过程; LL-37蛋白表达于UC患者炎症结肠黏膜的表层上皮及浸润的炎症细胞中, 但其参与UC免疫炎症过程的机制可能与结肠上皮细胞无关.
目前炎症性肠病(IBD)的发病机制仍不明, 细菌感染与免疫炎症为其核心机制. 抗菌肽在控制感染维持内环境稳定中有重要意义. 已证实LL-37表达于人的胃和结肠黏膜上皮, 在胃肠道黏膜起着重要防御功能. 很多研究提示抗菌肽的表达在IBD患者的结肠黏膜中存在异常, 这种异常在IBD的发病机制中的作用尚不清.
夏冰, 教授, 武汉大学中南医院消化内科; 许玲, 副教授, 中国人民解放军第二军医大学长征医院中医科
抗菌肽的作用广泛、复杂, 除了具有广谱的直接杀灭病原微生物的作用, 还具有强大的免疫调节功能. 初步的研究已表明其在结肠黏膜中存在表达且在炎症性肠病中的表达存在异常, 很多学者都关注于此, 其在炎症性肠病的发病机制中发挥的作用已成为研究热点.
有学者认为抗菌肽的高表达在炎症黏膜显著高于非炎症黏膜, 提示其与结肠炎症反应持久放大有关. 这些都提示, 抗菌肽可能在炎症性肠病的发病机制中起一定作用.
本文首次从不同层面证实了抗菌肽LL-37在结肠的表达及其与结肠炎症的密切关系.
本文为进一步探讨UC患者发病机制开拓了新思路, 为进一步寻找阻断UC患者疾病过程提供理论依据.
本文设计合理, 方法可靠, 对溃疡性结肠炎发生机制的深入认识有参考价值.
编辑: 李薇 电编:何基才
| 1. | Schmidt C, Stallmach A. Etiology and pathogenesis of inflammatory bowel disease. Minerva Gastroenterol Dietol. 2005;51:127-145. [PubMed] |
| 2. | Macfarlane S, Steed H, Macfarlane GT. Intestinal bacteria and inflammatory bowel disease. Crit Rev Clin Lab Sci. 2009;46:25-54. [PubMed] [DOI] |
| 3. | Stefanelli T, Malesci A, Repici A, Vetrano S, Danese S. New insights into inflammatory bowel disease pathophysiology: paving the way for novel therapeutic targets. Curr Drug Targets. 2008;9:413-418. [PubMed] [DOI] |
| 4. | Dianda L, Hanby AM, Wright NA, Sebesteny A, Hayday AC, Owen MJ. T cell receptor-alpha beta-deficient mice fail to develop colitis in the absence of a microbial environment. Am J Pathol. 1997;150:91-97. [PubMed] |
| 5. | Duchmann R, May E, Heike M, Knolle P, Neurath M, Meyer zum Büschenfelde KH. T cell specificity and cross reactivity towards enterobacteria, bacteroides, bifidobacterium, and antigens from resident intestinal flora in humans. Gut. 1999;44:812-818. [PubMed] [DOI] |
| 6. | Sanchez-Munoz F, Dominguez-Lopez A, Yamamoto-Furusho JK. Role of cytokines in inflammatory bowel disease. World J Gastroenterol. 2008;14:4280-4288. [PubMed] [DOI] |
| 7. | Olsen T, Goll R, Cui G, Husebekk A, Vonen B, Birketvedt GS, Florholmen J. Tissue levels of tumor necrosis factor-alpha correlates with grade of inflammation in untreated ulcerative colitis. Scand J Gastroenterol. 2007;42:1312-1320. [PubMed] [DOI] |
| 8. | Eckmann L. Defence molecules in intestinal innate immunity against bacterial infections. Curr Opin Gastroenterol. 2005;21:147-151. [PubMed] [DOI] |
| 9. | Eckmann L. Innate immunity and mucosal bacterial interactions in the intestine. Curr Opin Gastroenterol. 2004;20:82-88. [PubMed] [DOI] |
| 10. | Dürr UH, Sudheendra US, Ramamoorthy A. LL-37, the only human member of the cathelicidin family of antimicrobial peptides. Biochim Biophys Acta. 2006;1758:1408-1425. [PubMed] |
| 11. | Frohm Nilsson M, Sandstedt B, Sørensen O, Weber G, Borregaard N, Ståhle-Bäckdahl M. The human cationic antimicrobial protein (hCAP18), a peptide antibiotic, is widely expressed in human squamous epithelia and colocalizes with interleukin-6. Infect Immun. 1999;67:2561-2566. [PubMed] |
| 12. | Hase K, Eckmann L, Leopard JD, Varki N, Kagnoff MF. Cell differentiation is a key determinant of cathelicidin LL-37/human cationic antimicrobial protein 18 expression by human colon epithelium. Infect Immun. 2002;70:953-963. [PubMed] [DOI] |
| 13. | Hase K, Murakami M, Iimura M, Cole SP, Horibe Y, Ohtake T, Obonyo M, Gallo RL, Eckmann L, Kagnoff MF. Expression of LL-37 by human gastric epithelial cells as a potential host defense mechanism against Helicobacter pylori. Gastroenterology. 2003;125:1613-1625. [PubMed] [DOI] |
| 14. | Bals R, Wang X, Zasloff M, Wilson JM. The peptide antibiotic LL-37/hCAP-18 is expressed in epithelia of the human lung where it has broad antimicrobial activity at the airway surface. Proc Natl Acad Sci U S A. 1998;95:9541-9546. [PubMed] [DOI] |
| 15. | Chromek M, Slamová Z, Bergman P, Kovács L, Podracká L, Ehrén I, Hökfelt T, Gudmundsson GH, Gallo RL, Agerberth B. The antimicrobial peptide cathelicidin protects the urinary tract against invasive bacterial infection. Nat Med. 2006;12:636-641. [PubMed] [DOI] |
| 16. | Malm J, Sørensen O, Persson T, Frohm-Nilsson M, Johansson B, Bjartell A, Lilja H, Ståhle-Bäckdahl M, Borregaard N, Egesten A. The human cationic antimicrobial protein (hCAP-18) is expressed in the epithelium of human epididymis, is present in seminal plasma at high concentrations, and is attached to spermatozoa. Infect Immun. 2000;68:4297-4302. [PubMed] [DOI] |
| 17. | Murakami M, Ohtake T, Dorschner RA, Schittek B, Garbe C, Gallo RL. Cathelicidin anti-microbial peptide expression in sweat, an innate defense system for the skin. J Invest Dermatol. 2002;119:1090-1095. [PubMed] [DOI] |
| 18. | Turner J, Cho Y, Dinh NN, Waring AJ, Lehrer RI. Activities of LL-37, a cathelin-associated antimicrobial peptide of human neutrophils. Antimicrob Agents Chemother. 1998;42:2206-2214. [PubMed] |
| 19. | Oppenheim JJ, Tewary P, de la Rosa G, Yang D. Alarmins initiate host defense. Adv Exp Med Biol. 2007;601:185-194. [PubMed] [DOI] |
| 20. | Heilborn JD, Nilsson MF, Kratz G, Weber G, Sørensen O, Borregaard N, Ståhle-Bäckdahl M. The cathelicidin anti-microbial peptide LL-37 is involved in re-epithelialization of human skin wounds and is lacking in chronic ulcer epithelium. J Invest Dermatol. 2003;120:379-389. [PubMed] [DOI] |
| 21. | Koczulla R, von Degenfeld G, Kupatt C, Krötz F, Zahler S, Gloe T, Issbrücker K, Unterberger P, Zaiou M, Lebherz C. An angiogenic role for the human peptide antibiotic LL-37/hCAP-18. J Clin Invest. 2003;111:1665-1672. [PubMed] |
| 22. | Heilborn JD, Nilsson MF, Jimenez CI, Sandstedt B, Borregaard N, Tham E, Sørensen OE, Weber G, Ståhle M. Antimicrobial protein hCAP18/LL-37 is highly expressed in breast cancer and is a putative growth factor for epithelial cells. Int J Cancer. 2005;114:713-719. [PubMed] [DOI] |
| 23. | Wehkamp J, Harder J, Weichenthal M, Mueller O, Herrlinger KR, Fellermann K, Schroeder JM, Stange EF. Inducible and constitutive beta-defensins are differentially expressed in Crohn's disease and ulcerative colitis. Inflamm Bowel Dis. 2003;9:215-223. [PubMed] [DOI] |
| 24. | Wehkamp J, Salzman NH, Porter E, Nuding S, Weichenthal M, Petras RE, Shen B, Schaeffeler E, Schwab M, Linzmeier R. Reduced Paneth cell alpha-defensins in ileal Crohn's disease. Proc Natl Acad Sci U S A. 2005;102:18129-18134. [PubMed] [DOI] |
| 25. | Simms LA, Doecke JD, Walsh MD, Huang N, Fowler EV, Radford-Smith GL. Reduced alpha-defensin expression is associated with inflammation and not NOD2 mutation status in ileal Crohn's disease. Gut. 2008;57:903-910. [PubMed] [DOI] |
| 26. | Wehkamp J, Harder J, Weichenthal M, Schwab M, Schäffeler E, Schlee M, Herrlinger KR, Stallmach A, Noack F, Fritz P. NOD2 (CARD15) mutations in Crohn's disease are associated with diminished mucosal alpha-defensin expression. Gut. 2004;53:1658-1664. [PubMed] [DOI] |
| 27. | Wehkamp J, Wang G, Kübler I, Nuding S, Gregorieff A, Schnabel A, Kays RJ, Fellermann K, Burk O, Schwab M. The Paneth cell alpha-defensin deficiency of ileal Crohn's disease is linked to Wnt/Tcf-4. J Immunol. 2007;179:3109-3118. [PubMed] |
| 28. | Schauber J, Rieger D, Weiler F, Wehkamp J, Eck M, Fellermann K, Scheppach W, Gallo RL, Stange EF. Heterogeneous expression of human cathelicidin hCAP18/LL-37 in inflammatory bowel diseases. Eur J Gastroenterol Hepatol. 2006;18:615-621. [PubMed] [DOI] |
| 29. | Brown SJ, Mayer L. The immune response in inflammatory bowel disease. Am J Gastroenterol. 2007;102:2058-2069. [PubMed] [DOI] |
| 30. | Danese S, Fiocchi C. Etiopathogenesis of inflammatory bowel diseases. World J Gastroenterol. 2006;12:4807-4812. [PubMed] |
| 31. | Wehkamp J, Schmid M, Stange EF. Defensins and other antimicrobial peptides in inflammatory bowel disease. Curr Opin Gastroenterol. 2007;23:370-378. [PubMed] [DOI] |
| 32. | Schauber J, Ruzicka T, Rupec RA. [Cathelicidin LL-37. A central factor in the pathogenesis of inflammatory dermatoses?]. Hautarzt. 2008;59:72-74. [PubMed] [DOI] |
| 33. | Schauber J, Gallo RL. The vitamin D pathway: a new target for control of the skin's immune response? Exp Dermatol. 2008;17:633-639. [PubMed] [DOI] |
| 34. | Chang YY, Ouyang Q. [Expression and significance of mucosal beta-defensin-2, TNFalpha and IL-1beta in ulcerative colitis]. Zhonghua Neike Zazhi. 2008;47:11-14. [PubMed] |
| 35. | Neuman MG. Immune dysfunction in inflammatory bowel disease. Transl Res. 2007;149:173-186. [PubMed] [DOI] |
| 36. | José León A, Garrote JA, Arranz E. [Cytokines in the pathogenesis of inflammatory bowel diseases]. Med Clin (Barc). 2006;127:145-152. [PubMed] [DOI] |
| 37. | Raddatz D, Bockemühl M, Ramadori G. Quantitative measurement of cytokine mRNA in inflammatory bowel disease: relation to clinical and endoscopic activity and outcome. Eur J Gastroenterol Hepatol. 2005;17:547-557. [PubMed] [DOI] |
| 38. | Sawa Y, Oshitani N, Adachi K, Higuchi K, Matsumoto T, Arakawa T. Comprehensive analysis of intestinal cytokine messenger RNA profile by real-time quantitative polymerase chain reaction in patients with inflammatory bowel disease. Int J Mol Med. 2003;11:175-179. [PubMed] |
| 39. | Guimbaud R, Bertrand V, Chauvelot-Moachon L, Quartier G, Vidon N, Giroud JP, Couturier D, Chaussade S. Network of inflammatory cytokines and correlation with disease activity in ulcerative colitis. Am J Gastroenterol. 1998;93:2397-2404. [PubMed] [DOI] |
| 40. | Inoue S, Matsumoto T, Iida M, Mizuno M, Kuroki F, Hoshika K, Shimizu M. Characterization of cytokine expression in the rectal mucosa of ulcerative colitis: correlation with disease activity. Am J Gastroenterol. 1999;94:2441-2446. [PubMed] [DOI] |
| 41. | Nielsen OH, Køppen T, Rüdiger N, Horn T, Eriksen J, Kirman I. Involvement of interleukin-4 and -10 in inflammatory bowel disease. Dig Dis Sci. 1996;41:1786-1793. [PubMed] [DOI] |
| 42. | Kmieć Z. Cytokines in inflammatory bowel disease. Arch Immunol Ther Exp (Warsz). 1998;46:143-155. [PubMed] |
| 43. | Iijima H, Takahashi I, Kishi D, Kim JK, Kawano S, Hori M, Kiyono H. Alteration of interleukin 4 production results in the inhibition of T helper type 2 cell-dominated inflammatory bowel disease in T cell receptor alpha chain-deficient mice. J Exp Med. 1999;190:607-615. [PubMed] [DOI] |
| 44. | Agerberth B, Charo J, Werr J, Olsson B, Idali F, Lindbom L, Kiessling R, Jörnvall H, Wigzell H, Gudmundsson GH. The human antimicrobial and chemotactic peptides LL-37 and alpha-defensins are expressed by specific lymphocyte and monocyte populations. Blood. 2000;96:3086-3093. [PubMed] |
| 45. | Howell MD, Gallo RL, Boguniewicz M, Jones JF, Wong C, Streib JE, Leung DY. Cytokine milieu of atopic dermatitis skin subverts the innate immune response to vaccinia virus. Immunity. 2006;24:341-348. [PubMed] [DOI] |
| 46. | Dommett R, Zilbauer M, George JT, Bajaj-Elliott M. Innate immune defence in the human gastrointestinal tract. Mol Immunol. 2005;42:903-912. [PubMed] [DOI] |
| 47. | Chertov O, Michiel DF, Xu L, Wang JM, Tani K, Murphy WJ, Longo DL, Taub DD, Oppenheim JJ. Identification of defensin-1, defensin-2, and CAP37/azurocidin as T-cell chemoattractant proteins released from interleukin-8-stimulated neutrophils. J Biol Chem. 1996;271:2935-2940. [PubMed] [DOI] |
| 48. | Chertov O, Ueda H, Xu LL, Tani K, Murphy WJ, Wang JM, Howard OM, Sayers TJ, Oppenheim JJ. Identification of human neutrophil-derived cathepsin G and azurocidin/CAP37 as chemoattractants for mononuclear cells and neutrophils. J Exp Med. 1997;186:739-747. [PubMed] [DOI] |
| 49. | Niyonsaba F, Iwabuchi K, Someya A, Hirata M, Matsuda H, Ogawa H, Nagaoka I. A cathelicidin family of human antibacterial peptide LL-37 induces mast cell chemotaxis. Immunology. 2002;106:20-26. [PubMed] [DOI] |
| 50. | Niyonsaba F, Someya A, Hirata M, Ogawa H, Nagaoka I. Evaluation of the effects of peptide antibiotics human beta-defensins-1/-2 and LL-37 on histamine release and prostaglandin D(2) production from mast cells. Eur J Immunol. 2001;31:1066-1075. [PubMed] [DOI] |
| 51. | Scott MG, Davidson DJ, Gold MR, Bowdish D, Hancock RE. The human antimicrobial peptide LL-37 is a multifunctional modulator of innate immune responses. J Immunol. 2002;169:3883-3891. [PubMed] |
| 52. | Bowdish DM, Davidson DJ, Lau YE, Lee K, Scott MG, Hancock RE. Impact of LL-37 on anti-infective immunity. J Leukoc Biol. 2005;77:451-459. [PubMed] [DOI] |
| 53. | Zasloff M. Inducing endogenous antimicrobial peptides to battle infections. Proc Natl Acad Sci U S A. 2006;103:8913-8914. [PubMed] [DOI] |
| 54. | Akbari MR, Haghighi HR, Chambers JR, Brisbin J, Read LR, Sharif S. Expression of antimicrobial peptides in cecal tonsils of chickens treated with probiotics and infected with Salmonella enterica serovar typhimurium. Clin Vaccine Immunol. 2008;15:1689-1693. [PubMed] [DOI] |
| 55. | Islam D, Bandholtz L, Nilsson J, Wigzell H, Christensson B, Agerberth B, Gudmundsson G. Downregulation of bactericidal peptides in enteric infections: a novel immune escape mechanism with bacterial DNA as a potential regulator. Nat Med. 2001;7:180-185. [PubMed] [DOI] |
| 56. | Agerberth B, Gunne H, Odeberg J, Kogner P, Boman HG, Gudmundsson GH. FALL-39, a putative human peptide antibiotic, is cysteine-free and expressed in bone marrow and testis. Proc Natl Acad Sci U S A. 1995;92:195-199. [PubMed] [DOI] |
| 57. | Sørensen O, Arnljots K, Cowland JB, Bainton DF, Borregaard N. The human antibacterial cathelicidin, hCAP-18, is synthesized in myelocytes and metamyelocytes and localized to specific granules in neutrophils. Blood. 1997;90:2796-2803. [PubMed] |
| 58. | Di Nardo A, Vitiello A, Gallo RL. Cutting edge: mast cell antimicrobial activity is mediated by expression of cathelicidin antimicrobial peptide. J Immunol. 2003;170:2274-2278. [PubMed] |
| 59. | Raqib R, Sarker P, Bergman P, Ara G, Lindh M, Sack DA, Nasirul Islam KM, Gudmundsson GH, Andersson J, Agerberth B. Improved outcome in shigellosis associated with butyrate induction of an endogenous peptide antibiotic. Proc Natl Acad Sci U S A. 2006;103:9178-9183. [PubMed] [DOI] |