修回日期: 2011-03-28
接受日期: 2011-04-11
在线出版日期: 2011-05-08
目的: 探讨胃癌中IFN-γ通过非依赖STAT1途径对P53表达调控的作用及机制.
方法: SGC7901经IFN-γ及STAT1反义寡核苷酸处理, RT-PCR及灰度分析法检测STAT1和p53 mRNA水平变化, 应用Hoechest33258观察细胞凋亡. 人胃癌组织经免疫组织化学染色检测STAT1和P53蛋白. 各组平均吸光度值通过t检验分析.
结果: SGC7901细胞经IFN-γ处理后, STAT1和p53 mRNA表达上升(P<0.05). 经不同浓度STAT1反义寡核苷酸处理后, STAT1 mRNA表达下降, 有浓度依赖性(P<0.05). p53 mRNA表达量始终低于未处理组(P<0.05). 经IFN-γ和不同浓度STAT1反义寡核苷酸联合处理后, STAT1 mRNA和蛋白表达较IFN-γ单独处理逐渐下降, 有浓度依赖性(P<0.05), p53 mRNA表达量始终高于IFN-γ单独处理组(P<0.05). 所有处理组中, STAT1 mRNA与p53 mRNA表达无关. 人胃癌组织经免疫组织化学染色检测, STAT1和P53蛋白表达无关. 经IFN-γ和STAT1反义寡核苷酸处理后细胞无明显凋亡.
结论: IFN-γ可通过非依赖STAT1途径促进胃癌组织中P53的表达.
引文著录: 邓昊, 镇鸿燕, 陈莹, 付政祺, 刘丽江. IFN-γ通过非依赖STAT1途径对人胃癌组织中P53表达的调控机制. 世界华人消化杂志 2011; 19(13): 1353-1358
Revised: March 28, 2011
Accepted: April 11, 2011
Published online: May 8, 2011
AIM: To explore the relationship between STAT1 and p53 mRNA expression in human gastric cancer cell line SGC7901 and to characterize the regulatory effect of interferon-γ (IFN-γ) on p53 expression in gastric cancer.
METHODS: After SGC7901 cells were treated with IFN-γ and antisense oligonucleotides (ASON) targeting the STAT1 gene, alone or in combination, the mRNA expression of p53 and STAT1 was tested by RT-PCR, and cell apoptosis was examined by Hoechst 33258 staining. The protein expression of p53 and STAT1 in human gastric cancer tissue was examined by immunohistochemistry. Average optical density was compared between different groups using Student's t test analysis. The relationship between the expression of STAT1 and P53 protein in human gastric cancer was evaluated using Spearman rank correlation analysis.
RESULTS: Treatment with IFN-γ up-regulated the mRNA expression of STAT1 and p53 in SGC7901 cells (both P < 0.05). Treatment with STAT1-specific ASON induced down-regulation of STAT1 mRNA expression (P < 0.05) in a concentration-dependent manner. The expression of p53 mRNA was lower in all ASON groups than in the control group (all P > 0.05). Simultaneous treatment with IFN-γ and STAT1-specific ASON induced lower STAT1 mRNA expression than treatment with IFN-γ alone (P < 0.05). The mRNA expression of p53 was higher in all cells treated simultaneously with IFN-γ and STAT1-specific ASON than in those treated with IFN-γ alone (all P > 0.05). There was no correlation between STAT1 and p53 mRNA and protein expression in human gastric cancer tissue and cell lines. Treatment with either IFN-γ or STAT1-specific ASON had no significant impact on cell apoptosis.
CONCLUSION: IFN-γ could regulate p53 expression in gastric cancer through a STAT1-independent pathway.
- Citation: Deng H, Zhen HY, Chen Y, Fu ZQ, Liu LJ. IFN-γ regulates P53 expression in gastric cancer through a STAT1-independent pathway. Shijie Huaren Xiaohua Zazhi 2011; 19(13): 1353-1358
- URL: https://www.wjgnet.com/1009-3079/full/v19/i13/1353.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i13.1353
胃癌是我国最常见的恶性肿瘤之一, 死亡率居恶性肿瘤的第2位[1-3]. 有研究表明胃癌中细胞凋亡明显受阻[4-6], 但有关胃癌凋亡调控的机制尚未取得突破性的进展. 我们前期的研究发现, 人胃癌组织中转录信号转导子和转录活化子1(signal transducer and activator of transcription 1, STAT1)蛋白表达与胃癌淋巴结转移密切相关, 并有着重要的临床意义. 在胃癌细胞中, 干扰素γ(interferon-γ, IFN-γ)可通过STAT1促进p21waf在mRNA及蛋白水平的表达上调[7-9]. p21waf是细胞凋亡调控过程中的重要分子, 其基因定位于人染色体6p21.2, 编码的蛋白由164个氨基酸组成, 相对分子质量为21 000 Da, 是目前已知的具有最广泛激酶抑制活性的细胞周期抑制蛋白. p21waf是经典的p53下游分子, 其基因上游2.4 kb和8 kb处各有一个P53蛋白特殊序列结合位点[10]. 作为抑癌基因的p53自发现就备受关注, p53介导的信号转导途径在细胞的生长、分化、衰老、应激等生命过程中起着重要的调控作用, 而且与细胞内的其他信号转导通路间存在着错综复杂的相互关系[11-14]. 研究表明, STAT1可通过下调P53抑制蛋白MdM2的表达促进P53的表达进而完成对p21waf表达的调控[15]. 胃癌中, IFN-γ-STAT1途径对p21waf表达调控是否依赖P53途径完成, 当前尚无明确的意见. 本研究拟通过细胞生物学的研究方法, 在给予IFN-γ和STAT1反义寡核苷酸(antisense oligonucleotides, ASON)单独处理以及联合处理胃癌细胞系SGC7901时, 观察STAT1和p53 mRNA表达的变化以及相互关系, 并通过临床病理学的研究方法, 观察人胃癌组织中STAT1和P53蛋白的相关性, 以探讨胃癌中IFN-γ-STAT1途径能否对P53进行调控.
胃癌细胞株SGC7901由本实验室保存. 使用含100 mL/L小牛血清(Gibcol)的RMPI 1640培养基(Gibcol), 置于37 ℃, 50 mL/L CO2(体积分数)的培养箱中培养. 每2-3 d换1次液. 100例胃癌根治性手术切除标本来自江汉大学附属医院(1989-2003), 男68例, 女32例, 年龄26-77(中位年龄59)岁. 全部病例均有详细的病理学检查结果, 均为腺癌. 所有病例术前未进行放疗和化疗.
1.2.1 ASON的转染以及药物处理: 使用1 000 kIU/L IFN-γ[16](102CY27, PEPROTECHEC)分别处理细胞0.5、3和24 h.
ASON及引物序列由赛百胜生物技术有限公司合成. 用阳离子脂质体Transfectin(TianGENE)进行转染. ASON的序列设计以及浓度的使用根据已发表的文献. STAT1ASON: 5'-CCACTGAGACATCCTGCCACC-3', 按照200、400和600 nmol/L的浓度转染[17]. 将STAT1 ASON单独以及与1 000 kIU/L IFN-γ联合处理细胞24 h; 细胞的转染严格按照说明书操作, ASON:脂质体 = 1:2-3.
1.2.2 RT-PCR检测及灰度分析: 用TRIzol(Invitrogen)提取总RNA, 样品纯度和浓度经核酸测定仪测定, A260/280 = 1.8-2.0. 严格按照RT-PCR试剂盒(TaKaRa)说明书操作进行RT-PCR. 使用Primer 5.0引物设计软件分别设计STAT1、p53和β-actin的上游和下游引物(表1). 目的引物与β-actin用一管法进行PCR. PCR产物经1.5 g/L的琼脂糖凝胶电泳检测, 使用Biostep Photoimpact软件分析各组目的基因与β-actin条带的平均吸光度值, 计算两者的比值, 进行相对定量.
| 基因 | 反义 | 正义 | 长度(bp) |
| STAT1 | 5'-CATGCGGTTGAACCCTACA-3' | 5'-TTCTACAGAGCCCACTATCC-3' | 342 |
| p53 | 5'-CTGCTCAGATAGCGATGG-3' | 5'-TATGGCGGGAGGTAGACT-3' | 599 |
| β-actin | 5'-TGCTGTCCCTCTACGCCTCT-3' | 5'-GCTTCTCCTTGATGTCGC-3' | 234 |
1.2.3 Hoechest3325染色检测细胞凋亡: 无菌条件下取出细胞爬片并固定后, Hoechest33258孵育15 min, 0.01 MPBS洗5 min×1次. 水溶性封片剂封片, 荧光显微镜紫外光下观察, Hoechest33258染料呈现蓝色荧光. 高倍镜下观察, 凋亡细胞为蓝色亮点, 亮度明显强于未凋亡细胞, 形态学上出现核膜消失、核固缩、核碎裂等特征. 随机数取1 000个细胞进行凋亡细胞记数.
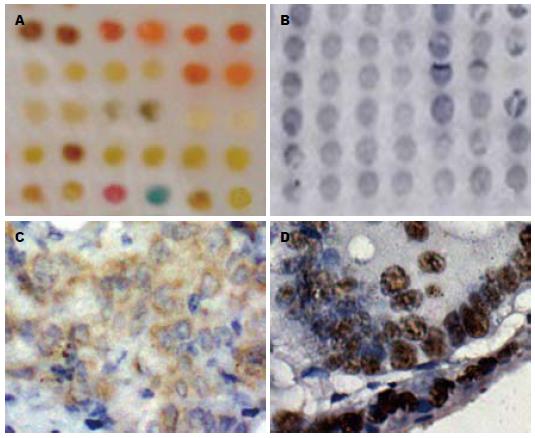
1.2.4 免疫组织化学及免疫细胞化学染色: 免疫组织化学及免疫细胞化学染色使用抗体为, 抗STAT1单克隆抗体(P84/P91, C-136, Santa Cruz公司产品), 即用型鼠抗人P53单克隆抗体(DO-7, NeoMarkers公司产品), SP法即用型检测试剂盒均购自福州迈新生物公司. 所有染色均经DAB显色. STAT1以癌细胞质内呈棕黄色表达为阳性, P53以癌细胞核内呈棕黄色表达为阳性. 操作过程严格按照说明书要求进行.
统计学处理 全部数据经SPSS12.0统计学软件处理, 相关因素分析采用Spearman等级相关分析, 各组平均光密度值通过t检验分析. P<0.05有统计学意义.
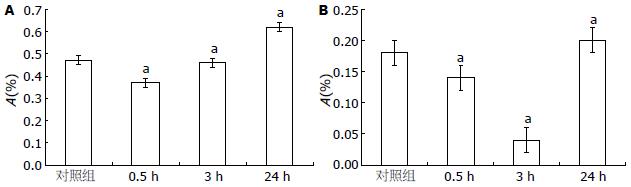
IFN-γ 1 000 kIU/L处理SGC7901细胞0.5、3、24 h, STAT1和p53在mRNA水平均有先下降后上升的表现, 24 h时, mRNA水平均高于对照组(P<0.05, 图1).
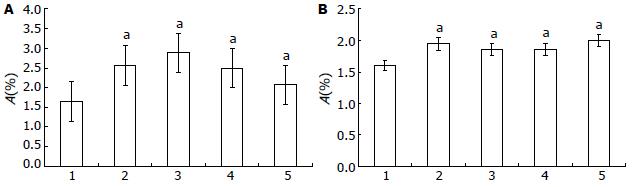
使用IFN-γ 1 000 kIU/L联合200、400和600 nmol/L STAT1 ASON处理SGC7901细胞24 h后, STAT1 mRNA表达均高于对照组, 但呈现逐渐下降的趋势(P<0.05), 在IFN-γ+600 nmol/L STAT1 ASON处理组其表达水平与对照组接近; p53 mRNA表达均高于对照组, 且有逐渐上升的表现(P<0.05, 图2).
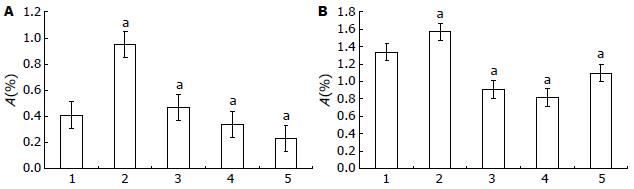
使用200、400和600 nmol/L STAT1 ASON处理SGC7901细胞24 h后, STAT1 mRNA表达逐渐下降, 在400 nmol/L STAT1 ASON处理时开始低于对照组(P<0.05); p53 mRNA表达量均低于对照组, 其变化与STAT1 mRNA表达变化无关(P>0.05, 图3).
SGC7901胃癌细胞在各处理组和对照组凋亡情况无明显变化(P>0.05).
STAT1阳性率为42%(42/100), P53阳性率为28% (28/100). 经Spearman等级相关分析显示: STAT1与P53蛋白表达无关(r = 0.10, P = 0.317, 图4).
STAT家族至少包括STAT1(α和β)、2、3、3β、4、5、6和果蝇STAT蛋白[即D-STAT(mrl)]等8个成员. STAT1作为STAT家族的重要成员, 是一个抑癌基因, 可促肿瘤细胞凋亡[6]. IFN-γ等信号因子作用于JAK蛋白酪氨酸激酶(janus protein tyrosine kinase, JAK)1、2等, 使胞质中STAT1激活并形成二聚体, 进入细胞核促进相应靶基因转录, 从而促进细胞凋亡[18-21]. 胃癌中, STAT1具有重要临床意义[7,8,22].
p21waf是STAT1促进细胞凋亡的重要调控点[17-19], 我们的前期研究也表明胃癌中IFN-γ-STAT1途径存在对p21waf表达的调控作用[7-9]. 研究表明, STAT1可通过非依赖P53[22-25]以及依赖P53两条途径来实现对p21waf的调控. 非依赖P53途径机制主要为STAT1可与p21waf上游转录调控位点(SIE1, SIE2以及SIE3)结合, 从而引起细胞的生长抑制. 对IFN-γ促进细胞凋亡及p21waf表达上调这一现象的研究发现, 此过程也正是通过活化的STAT1结合p21waf上游相应的3个结合位点而行使功效的[24]. 依赖P53途径机制主要为, STAT1与P53相互作用, 通过调控p21waf表达增强细胞的生长抑制和促凋亡作用, 但是对于STAT1和P53之间的相互关系以及调控机制, 当前尚存在争议. 有研究显示STAT1可通过抑制MDM2蛋白的表达来上调P53的表达[15]; 但是也有研究显示PIASI(STAT1抑制蛋白)是重要的促进P53表达的因子[26]. 胃癌中, IFN-γ-STAT1途径与P53的关系, 当前尚无定论.
本研究以人体胃癌组织系SGC7901作为研究模型. SGC7901是1981年建立的一株胃癌淋巴结转移癌细胞系, 该细胞系具有凋亡率低的特点[16]. 通过IFN-γ处理SGC7901细胞24 h时, STAT1以及p53 mRNA表达上升. 该现象提示胃癌中, IFN-γ可同时促进STAT1以及P53表达. 而当同时使用IFN-γ和STAT1 ASON处理SGC7901细胞时, 我们发现STAT1 mRNA表达出现抑制现象, 但p53 mRNA表达无明显变化. 该现象提示胃癌中, IFN-γ对P53的上调并不完全依赖上调STAT1完成. 当进一步单独使用STAT1 ASON处理SGC7901细胞时, 发现STAT1 mRNA表达与p53 mRNA表达也无关, 提示胃癌细胞中IFN-γ对P53的调控与IFN-γ-STAT1途径之间可能并不存在相互关系. 同时, 在人胃癌组织的研究中, 我们也发现STAT1蛋白表达率与P53蛋白表达率无关. 由此我们认为IFN-γ上调胃癌细胞中P53的表达, 并不是通过IFN-γ-STAT1途径完成的.
在本研究中, IFN-γ以及STAT1 ASON作用于胃癌SGC7901细胞, 其细胞凋亡水平无明显变化, 该结果与Beppu等[27]研究结果一致. 提示胃癌SGC7901细胞中可能存在多条凋亡抑制的途径.
胃癌中, IFN-γ可通过STAT1调控促凋亡分子p21waf的表达. P53作为p21waf的经典调节分子与细胞内的其他信号转导通路间存在着错综复杂的相互关系. 胃癌中, IFN-γ-STAT1途径对p21waf表达调控是否依赖P53途径完成, 当前尚无明确的结论.
季菊玲, 副教授, 南通大学医学院病理教研室
IFN-γ可促进SGC7901细胞STAT1以及p53 mRNA表达上升, 同时使用IFN-γ和STAT1 ASON以及单独使用STAT1 ASON处理SGC7901细胞时, p53 mRNA表达无明显变化, 提示胃癌中IFN-γ上调p53的表达, 并不是通过IFN-γ-STAT1途径完成的.
本研究首先明确了人胃癌中IFN-γ可上调p53的表达, 继而通过IFN-γ以及STAT1 ASON对胃癌细胞系SGC7901中STAT1和p53 mRNA影响以及人胃癌组织中STAT1和P53蛋白的相关性的观察, 探讨了胃癌中IFN-γ对P53分子的调控作用.
本研究证实IFN-γ对P53存在调控作用并对其机制进行了初步探讨. 该结论可望进一步完善当前凋亡调控理论, 并为临床治疗提供新的角度和思考.
本文设计合理, 内容全面, 有一定的临床实用意义.
编辑: 李薇 电编:何基才
| 1. | NCCN. NCCN Clinical Practice Guidelines in Oncology. NCCN online, 2006, cited 2011. Available from: www.nccn.org. |
| 2. | Corley DA, Buffler PA. Oesophageal and gastric cardia adenocarcinomas: analysis of regional variation using the Cancer Incidence in Five Continents database. Int J Epidemiol. 2001;30:1415-1425. [PubMed] [DOI] |
| 4. | Lauwers GY, Scott GV, Karpeh MS. Immunohistochemical evaluation of bcl-2 protein expression in gastric adenocarcinomas. Cancer. 1995;75:2209-2213. [PubMed] [DOI] |
| 5. | Ishida M, Gomyo Y, Tatebe S, Ohfuji S, Ito H. Apoptosis in human gastric mucosa, chronic gastritis, dysplasia and carcinoma: analysis by terminal deoxynucleotidyl transferase-mediated dUTP-biotin nick end labelling. Virchows Arch. 1996;428:229-235. [PubMed] [DOI] |
| 6. | Hoshi T, Sasano H, Kato K, Yabuki N, Ohara S, Konno R, Asaki S, Toyota T, Tateno H, Nagura H. Immunohistochemistry of Caspase3/CPP32 in human stomach and its correlation with cell proliferation and apoptosis. Anticancer Res. 1998;18:4347-4353. [PubMed] |
| 7. | 向 春香, 邓 昊, 罗 海莲, 刘 丽江. 胃癌细胞SGC7901中STAT1, NF-κB p65和caspase 8的关系. 世界华人消化杂志. 2007;15:2194-2200. [DOI] |
| 10. | Harper JW, Adami GR, Wei N, Keyomarsi K, Elledge SJ. The p21 Cdk-interacting protein Cip1 is a potent inhibitor of G1 cyclin-dependent kinases. Cell. 1993;75:805-816. [PubMed] [DOI] |
| 11. | Gan H, Ouyang Q, Wang Y. [Expression of p53 protein in colorectal cancer and its relationship to cell proliferative activity and prognosis]. Zhonghua Zhongliu Zazhi. 1996;18:244-246. [PubMed] |
| 12. | Bouzourene H, Gervaz P, Cerottini JP, Benhattar J, Chaubert P, Saraga E, Pampallona S, Bosman FT, Givel JC. p53 and Ki-ras as prognostic factors for Dukes' stage B colorectal cancer. Eur J Cancer. 2000;36:1008-1015. [PubMed] [DOI] |
| 13. | Kim YW, Lee S, Park JH, Yoon TY, Park YK, Yang MH. An immunohistochemical study of the expression of p53 protein in colon cancer. J Korean Med Sci. 1995;10:176-182. [PubMed] |
| 14. | Diez M, Medrano M, Mugüerza JM, Ramos P, Hernandez P, Villeta R, Martín A, Noguerales F, Ruiz A, Granell J. Influence of tumor localization on the prognostic value of P53 protein in colorectal adenocarcinomas. Anticancer Res. 2000;20:3907-3912. [PubMed] |
| 15. | Townsend PA, Scarabelli TM, Davidson SM, Knight RA, Latchman DS, Stephanou A. STAT-1 interacts with p53 to enhance DNA damage-induced apoptosis. J Biol Chem. 2004;279:5811-5820. [PubMed] [DOI] |
| 17. | Huang YQ, Li JJ, Karpatkin S. Thrombin inhibits tumor cell growth in association with up-regulation of p21(waf/cip1) and caspases via a p53-independent, STAT-1-dependent pathway. J Biol Chem. 2000;275:6462-6468. [PubMed] [DOI] |
| 19. | Leonard WJ, O'Shea JJ. Jaks and STATs: biological implications. Annu Rev Immunol. 1998;16:293-322. [PubMed] [DOI] |
| 20. | Li F, Ambrosini G, Chu EY, Plescia J, Tognin S, Marchisio PC, Altieri DC. Control of apoptosis and mitotic spindle checkpoint by survivin. Nature. 1998;396:580-584. [PubMed] [DOI] |
| 21. | Reed JC, Bischoff JR. BIRinging chromosomes through cell division--and survivin' the experience. Cell. 2000;102:545-548. |
| 22. | Deng H, Wu RL, Chen Y, Liu LJ. STAT1 and survivin expression in full lymph node examined gastric cancer by using tissue microarray technique. Chin-Ger J Clin Oncol. 2006;5:249-252. [DOI] |
| 23. | Chen B, He L, Savell VH, Jenkins JJ, Parham DM. Inhibition of the interferon-gamma/signal transducers and activators of transcription (STAT) pathway by hypermethylation at a STAT-binding site in the p21WAF1 promoter region. Cancer Res. 2000;60:3290-3298. [PubMed] |
| 24. | Xiao L, Naganawa T, Obugunde E, Gronowicz G, Ornitz DM, Coffin JD, Hurley MM. Stat1 controls postnatal bone formation by regulating fibroblast growth factor signaling in osteoblasts. J Biol Chem. 2004;279:27743-27752. [PubMed] [DOI] |
| 25. | Ihle JN. STATs and MAPKs: obligate or opportunistic partners in signaling. Bioessays. 1996;18:95-98. [PubMed] [DOI] |
| 26. | Megidish T, Xu JH, Xu CW. Activation of p53 by protein inhibitor of activated Stat1 (PIAS1). J Biol Chem. 2002;277:8255-8259. [PubMed] [DOI] |
| 27. | Beppu K, Morisaki T, Matsunaga H, Uchiyama A, Ihara E, Hirano K, Kanaide H, Tanaka M, Katano M. Inhibition of interferon-gamma-activated nuclear factor-kappa B by cyclosporin A: A possible mechanism for synergistic induction of apoptosis by interferon-gamma and cyclosporin A in gastric carcinoma cells. Biochem Biophys Res Commun. 2003;305:797-805. [PubMed] [DOI] |