修回日期: 2011-04-19
接受日期: 2011-04-26
在线出版日期: 2011-05-08
目的: 探讨食管鳞癌组织中hMLH1和RASSF1A基因表达及其对预后的影响.
方法: 采用原位杂交技术检测hMLH1基因、免疫组织化学法检测RASSF1A基因在60例食管鳞癌患者中的表达, 应用Cox回归模型和Kaplan-Meier生存曲线分析其与患者预后的关系.
结果: 在食管鳞癌组织中hMLH1 mRNA表达显著低于正常黏膜组织(41.67% vs 90.00%, P<0.01), RASSF1A蛋白表达低于食管正常黏膜组织(80% vs 100%, P<0.05). hMLH1和RASSF1A的表达与TNM分期、食管癌浸润深度、淋巴结转移和肿瘤大小相关(均P<0.05), 但与民族无关; RASSF1A与hMLH1表达呈正相关(r = 0.338, P<0.01); 本组病例5年总生存率为35%(21/60), 单因素生存分析表明, 食管癌hMLH1高表达组5年生存率高于低表达组, 差异有统计学意义(P<0.05); RASSF1A高表达组较低表达组有生存优势, 但差异无统计学意义; Cox模型多因素分析表明, hMLH1和RASSF1A不是影响生存期的独立因素, 而肿瘤浸润深度和TNM分期均是影响生存期的独立因素(P<0.05).
结论: hMLH1和RASSF1A在食管癌组织中表达均较低, 其表达水平与食管肿瘤的发生发展有一定的关系, 结合临床病理可作为判断预后的指标.
引文著录: 蒲红伟, 陈晓, 李晓梅, 卜晓红, 龚晓瑾, 张丽萍. hMLH1和RASSF1A在食管癌组织中的表达及其与患者预后的关系. 世界华人消化杂志 2011; 19(13): 1347-1352
Revised: April 19, 2011
Accepted: April 26, 2011
Published online: May 8, 2011
AIM: To investigate the expression of human mutL homologue 1 (hMLH1) and Ras association domain family 1A (RASSF1A) in esophageal squamous cell carcinoma (ESCC) and to analyze their prognostic value.
METHODS: The expression of hMLH1 mRNA and RASSF1A protein in 60 specimens of esophageal cancer was detected by in situ hybridization (ISH) and immunohistochemistry, respectively. The relationship of hMLH1 and RASSF1A expression with ESCC prognosis was evaluated using Cox regression model and Kaplan-Meier survival curve analysis.
RESULTS: The positive rates of hMLH1 and RASSF1A expression in esophageal carcinoma were significantly lower than those in normal esophageal tissue (41.67% vs 90.00%, 80.00% vs 100.00%; both P < 0.05). The expression of hMLH1 and RASSF1A was correlated with tumor TNM stage, invasion depth, lymph node metastasis, and tumor size (all P < 0.05), but not with patient's nationality (P > 0.05). The expression of RASSF1A was positively correlated with that of hMLH1 (r = 0.338, P < 0.01). The five-year overall survival rate for all the patients was 35% (21/60). Univariate survival analysis suggested that the five-year survival rate for patients with positive expression of RASSF1A was higher than that for patients with negative expression of RASSF1A though the difference was not significant (P > 0.05). Patients with positive expression of hMLH1 had a significantly higher survival rate compared to those with negative expression of hMLH1 (P < 0.05). Cox multivariate analysis indicated that tumor invasion depth and TNM stage were independent prognostic factors affecting survival of ESCC patients (both P < 0.05).
CONCLUSION: Both hMLH1 and RASSF1A were weakly expressed in ESCC. The expression of hMLH1 and RASSF1A was positively correlated with ESCC progression. Expression of hMLH1 and RASSF1A might be used as a prognostic parameter in ESCC patients.
- Citation: Pu HW, Chen X, Li XM, Bu XH, Gong XJ, Zhang LP. Correlation between hMLH1 and RASSF1A expression and prognosis of esophageal carcinoma. Shijie Huaren Xiaohua Zazhi 2011; 19(13): 1347-1352
- URL: https://www.wjgnet.com/1009-3079/full/v19/i13/1347.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i13.1347
食管癌是人类最常见的恶性肿瘤之一[1], 我国每年因食管癌死亡的人数约占全部恶性肿瘤死亡人数的1/4[2]. 食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)的发生是一个多步骤、多因素、进行性发展的过程, 涉及到多种肿瘤抑制基因失活、癌基因的激活和凋亡相关基因的变化. hMLH1是DNA错配修复(DNA mismatch repair, MMR)系统中重要组成部分, 定位于3p21.3-23, 主要与错配点结合并与其他修复蛋白结合复合体来进行DNA修复. 目前在结肠癌、子宫内膜癌等肿瘤中关于hMLH1的研究较多, 但是在ESCC中相关研究较少[3,4]. RASSF1A基因是Dammann等[5]于2000年从3p21.3上首先克隆出来并证实其转录本在肺癌细胞系中为肺癌的候选抑癌基因, 他所表达的产物广泛存在于肺、乳腺、肾、消化系等多种器官和组织中, 在多种癌组织中存在不同程度的表达缺失[6,7]. 本实验联合检测hMLH1和RASSF1A在60例ESCC中的表达水平, 分析两者与肿瘤临床病理特征和患者预后的关系.
选择2001-01/2004-12新疆医科大学第一及第二附属医院手术切除并经病理证实的ESCC标本60例, 其中汉族30例, 哈萨克族30例, 男40例, 女20例, 年龄38.0-76.0(平均54.6)岁. 所有病例术前未经任何放疗和化疗. 按照WHO分类标准进行病理分级: 高分化20例, 中低分化40例. Ⅰ期8例, Ⅱ期32例, Ⅲ期19例, Ⅳ期1例. 无淋巴结转移34例, 有淋巴结转移26例. 同时选取20例正常食管组织(距ESCC原发灶5 cm)作对照. 标本均经40 g/L甲醛固定, 常规石蜡包埋, 连续4 µm厚度切片. hMLH1原位杂交试剂盒, 兔抗人RASSF1A均购自武汉博士德生物工程有限公司, DAB显色试剂盒由北京中杉生物公司提供.
采用免疫组织化学PV-9000二步法检测各组织中RASSF1A蛋白的表达. 步骤如下: 石蜡切片逐级脱蜡、水化至水, 用30 mL/L H2O2室温下孵育20 min(封闭内源性过氧化物酶), PBS漂洗. 将切片置于pH6.0的枸橼酸盐缓冲液中, 微波炉加热修复抗原20 min(温度控制在95 ℃-100 ℃). 取出自然冷却至室温后, 用PBS漂洗. 滴加一抗, 置于湿盒内, 4 ℃冰箱过夜. 同法冲洗切片, 滴加生物素化通用性二抗工作液, DAB显色生物素化二抗工作液, 置于湿盒中, 自来水终止显色反应, 切片苏木素复染, 盐酸酒精分化返蓝, 脱水封片. hMLH1原位杂交步骤按试剂盒说明进行. RASSF1A以胞质内出现黄褐色或棕褐色颗粒为阳性染色细胞. hMLH1 mRNA探针以在胞质表达棕黄色颗粒为主, 也可见部分细胞核表达. 以正常食管黏膜细胞表达的强度及方式为阳性对照, 在400倍视野下每张切片随机观察5个视野, 阳性细胞<5%为阴性; >5%, 为阳性.
统计学处理 统计学分析采用SPSS15.0软件分别进行χ2检验、Kaplan-Meier生存分析和Cox模型多因素生存分析, 以P<0.05为差异有统计学意义.
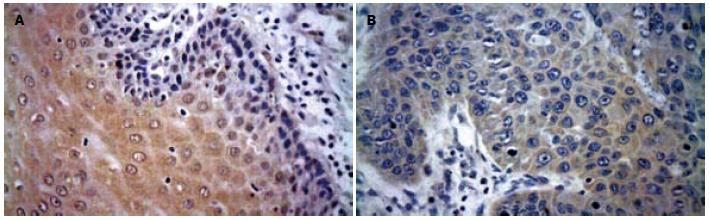
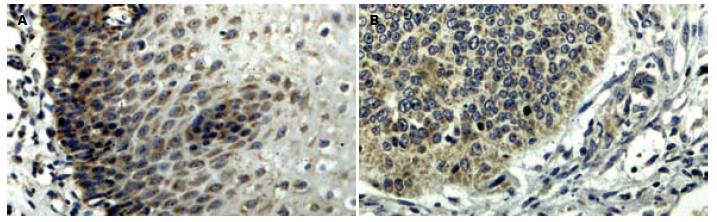
hMLH1 mRNA表达以在胞质出现棕黄色颗粒为主, 也可见部分细胞核表达, 在正常食管黏膜鳞状细胞和基底细胞中阳性表达, 在食管癌组织中表达部分或全部缺失, 差异有统计学意义(P<0.01, 图1); RASSF1A蛋白以细胞质出现棕褐、黄褐色颗粒为阳性染色细胞(图2), 正常食管黏膜鳞状细胞和基底细胞中RASSF1A几乎100%强阳性表达, 与食管癌组织中的表达差异有统计学意义(P<0.05).
hMLH1的表达则与肿瘤浸润深度、病理分期、肿瘤大小(最长径线)相关, 差异有统计学意义(P<0.05); hMLH1的表达在有淋巴结转移组低于无淋巴结转移组, 差异有统计学意义(P<0.01); 但其表达在不同分化程度组之间的差异无统计学意义(P>0.05); RASSF1A蛋白表达阳性率随病理分期增高依次降低, 差异有统计学意义(P<0.01); 有淋巴结转移组低于无淋巴结转移组, 差异有统计学意义(P<0.01); 随着浸润深度的增加阳性率也逐渐降低, 进行肌层和浆膜层两组之间的差异比较, 结果有统计学意义(P<0.05), 其表达阳性率随肿瘤分化程度降低依次降低但差异有统计学意义(P<0.05); 在不同的肿瘤大小组中的表达差异也有统计学意义(P<0.05). RASSF1A和hMLH1的表达在汉族和哈萨克族之间的差异无统计学意义(P>0.05, 表1).
| 病理特征 | n | hMLH1 mRNA表达 | RASSF1A蛋白表达 | ||||||||
| - | + | 阳性率(%) | χ2值 | P值 | - | + | 阳性率(%) | χ2值 | P值 | ||
| 癌组织 | 60 | 35 | 25 | 41.67 | 12 | 48 | 80.00 | ||||
| 正常组织 | 20 | 2 | 18 | 90.00 | 14.096 | 0.000 | 0 | 20 | 100.00 | 4.619 | 0.032 |
| 临床分期 | |||||||||||
| Ⅰ和Ⅱ | 40 | 17 | 23 | 57.50 | 3 | 37 | 92.50 | ||||
| Ⅲ和Ⅳ | 20 | 18 | 2 | 10.00 | 12.377 | 0.001 | 9 | 11 | 55.00 | 11.719 | 0.001 |
| 分化程度 | |||||||||||
| 高分化 | 20 | 9 | 11 | 55.00 | 1 | 19 | 95.00 | ||||
| 中低分化 | 40 | 26 | 14 | 35.00 | 2.194 | 0.171 | 11 | 29 | 72.50 | 4.219 | 0.047 |
| 浸润深度 | |||||||||||
| ≤肌层 | 29 | 12 | 17 | 58.62 | 2 | 27 | 93.11 | ||||
| ≥浆膜层 | 31 | 23 | 8 | 25.81 | 6.638 | 0.018 | 10 | 21 | 67.74 | 6.023 | 0.022 |
| 淋巴转移 | |||||||||||
| 有N1 | 26 | 23 | 3 | 11.54 | 10 | 16 | 61.54 | ||||
| 无N0 | 34 | 12 | 22 | 64.71 | 17.135 | 0.000 | 2 | 32 | 94.11 | 9.774 | 0.003 |
| 肿瘤大小(cm) | |||||||||||
| ≤5 | 35 | 16 | 19 | 54.28 | 3 | 32 | 91.43 | ||||
| >5 | 25 | 19 | 6 | 24.00 | 5.503 | 0.033 | 9 | 16 | 64.00 | 6.857 | 0.019 |
| 民族 | |||||||||||
| 汉族 | 30 | 16 | 14 | 46.67 | 5 | 25 | 83.34 | ||||
| 哈萨克族 | 30 | 19 | 11 | 36.67 | 0.617 | 0.601 | 7 | 23 | 76.67 | 0.924 | 0.391 |
hMLH1和RASSF1A的表达呈正相关(r = 0.338, P<0.01, 表2).
| hMLH1 | RASSF1A | 合计 | |
| - | + | ||
| - | 11 | 24 | 35 |
| + | 1 | 24 | 25 |
| 合计 | 12 | 48 | 60 |
本研究对60例ESCC患者进行随访, 其中21例存活, 中位生存期为51.0(38.8-63.2) mo, 5年生存率为35%(21/60).
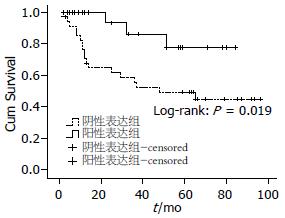
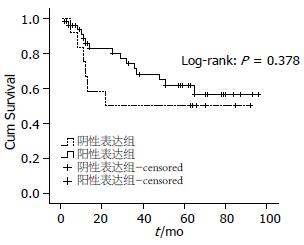
2.4.1 单因素Kaplan-Meier生存曲线: hMLH1阳性表达组与阴性表达组相比, 前者5年生存率较高, 且差异有统计学意义(P<0.05); RASSF1A阳性表达组平均生存时间和中位生存时间都高于阴性表达组, 但差异无统计学意义(P>0.05, 图3, 4).
2.4.2 多因素分析: 以患者肿瘤浸润深度、淋巴结转移、TNM分期、分化程度、病变长度以及食管癌中hMLH1和RASSF1A的表达为变量, 进行Cox多因素回归分析. 结果显示, 独立的预后因素为肿瘤浸润深度和TNM分期(P<0.05, 表3).
| 选入变量 | B | SE | Wald | df | Sig. | Exp(B) |
| TNM分期 | 0.908 | 0.367 | 6.130 | 1 | 0.013 | 2.478 |
| 肿瘤浸润深度 | 0.913 | 0.380 | 5.775 | 1 | 0.016 | 2.492 |
MMR是人体细胞的一种修复DNA碱基错配的安全保障体系[8,9], 由一系列特异性修复DNA 碱基错配的酶分子(错配修复基因)组成, 包括Mut H, Mut L和Mut S三大家族的蛋白, 该系统中任一基因突变都会导致细胞错配修复功能缺陷, 结果产生遗传不稳定, 表现为复制错误或微卫星不稳定, 进而导致肿瘤发生. hMLH1是MMR中重要组成部分, 定位于3p21.3-23, 基因组DNA全长约58 kb(不包括启动子), 含19个外显子, cDNA有2 268 bp的开放阅读框架, 编码蛋白质756个氨基酸, 功能主要与错配点结合并与其他修复蛋白结合复合体来进行修复, 其异常与遗传性肠癌、Ⅱ型贲门癌、白血病、Muri-Torre家族性肿瘤综合征、恶性胶质瘤Turcot综合征等相关[10,11]. Cai等[12]研究发现食管癌中有hMLH1杂合性缺失并且与微卫星不稳定有关, 正是由于hMLH1的突变或缺失使细胞碱基错配不能得以修复, 从而使DNA复制错误积累终导致肿瘤的发生; 刘复兴等[13]研究了食管癌3p杂合性丢失情况, 发现3p近hMLH1基因区域存在高频缺失, 并进一步选取MLH1基因内微卫星标志, 发现ESCC中hMLH1存在较高的等位基因丢失, hMLH1基因内标志D3S1611的LOH频率高达(66.7%), 说明食管癌hMLH1基因丢失频发, 可能是食管癌基因改变的靶点, 目前较多研究结果提示[14-18]hMLH1基因甲基化可能是多种散发性肿瘤错配修复基因失活的常见方式. 本实验采用原位杂交方法检测hMLH1 mRNA的表达, 结果显示早期患者mRNA表达明显高于中晚期患者, 该研究结果与张军航等报道相一致[19-21], 同时hMLH1的表达与肿瘤浸润深度、病理分期、肿瘤大小、淋巴结转移相关, 差异均有统计学意义(P<0.05), 提示hMLH1可能是食管癌发生的早期事件, 并且与肿瘤的发展和转移有关; Kaplan-Meier生存曲线分析结果显示, hMLH1阳性表达组生存率都高于阴性表达组, 且差异有统计学意义(P<0.05), 但多因素分析结果认为, hMLH1并不是ESCC独立的预后影响因素.
RASSF1A是Ras效应蛋白家族中的一员, 由Ras蛋白参与的Ras通路是一条高度保守的信号传递通路. 其中Ras蛋白在有活性的GTP结合构象和无活性的GDP结合构象之间转化, 通过与不同的效应物分子激活多条传递通路, 其中Ras/RASSF1/ERK通路将信号由细胞外传递到细胞内, 介导细胞分化、增殖、存活及原癌基因转化[22-24]. RASSF1A蛋白通过磷酸化ATM蛋白的激酶位点, 使之活化来发挥抑制肿瘤的作用. 武林枫等[25]采用免疫印迹方法检测48例胰腺癌组织及其癌旁(正常)组织RASSF1A基因蛋白的表达水平, 结果发现癌旁组织RASSF1A蛋白的表达量高于胰腺癌组织的表达量(P<0.05); TNM分期Ⅲ期RASSF1A蛋白的表达量低于Ⅰ, Ⅱ期(P<0.05). 周岩等[26]采用RT-PCR检测29例膀胱移行细胞癌组织及5例正常膀胱组织中RASSF1A mRNA的表达水平, 结果显示RASSF1A mRNA在所有正常膀胱组织中均呈阳性表达, 而在膀胱移行细胞癌组织中表达缺失率为79.3%(23/29), 两者比较差异有统计学意义(P<0.01); 目前也有研究证实RASSF1A基因在食管癌、胃癌组织的表达量高于癌旁对照组织[27-31]. 本实验检测RASSF1A蛋白表达阳性率随病理分期增高依次降低, 差异有统计学意义(P<0.01); 且其表达与肿瘤浸润深度、病理分期、肿瘤大小、淋巴结转移以及肿瘤分化程度相关, 差异均有统计学意义(P<0.05), 提示RASSF1A蛋白表达降低促进癌细胞的生物学行恶化, 使其侵袭和转移增强; Kaplan-Meier生存曲线分析结果显示, RASSF1A阳性表达组与阴性表达组相比, 前者5年生存率较后者高, 但差异无统计学意义(P>0.05); 进一步做Cox多因素回归分析, 结果显示, RASSF1A亦不能作为ESCC独立的预后因素. 另外, 本实验的结果还显示ESCC中RASSF1A和hMLH1的表达呈正相关, 相关系数r = 0.338(P<0.01), 二者表达在食管癌的发生发展中可能具有协同作用. 在30例汉族和30例哈萨克族ESCC中, hMLH1和RASSF1A的表达在不同民族之间无显著性差异(P>0.05), 提示在新疆的汉族和哈萨克族ESCC的发生发展中hMLH1和RASSF1A的表达具有共同性, 无民族间基因背景差异.
总之, hMLH1和RASSF1A在ESCC组织的表达均较低, 且其表达与临床病理相关, 因此我们认为, 上述生物学指标与临床病理学指标相结合为食管癌的诊断和治疗提供了崭新的思路.
食管癌是人类最常见的恶性肿瘤之一, 我国新疆哈萨克族是食管癌的最高发民族之一, 高于我国平均水平, 严重威胁着哈萨克族人民的身心健康, 因此探讨新疆哈萨克族与汉族食管癌的发病机制, 寻找有效预防及治疗的途径, 是目前迫切需要解决的问题.
李增山, 副教授, 中国人民解放军第四军医大学病理教研室
肿瘤的发生发展是个多步骤、多因素、进行性发展的过程, 涉及到多种肿瘤抑制基因失活、癌基因的激活和凋亡相关基因的变化. hMLH1是DNA错配修复系统中重要组成部分, 而RASSF1A是肿瘤发生重要的抑癌基因, 其功能缺陷均与恶性肿瘤的发生有关, 因此成为目前的研究热点.
夏頔等在对40例胃癌的研究中发现hMLH1蛋白在胃炎组织和癌旁组织中的表达显著高于胃癌组织, 推测MLH1则可能是胃癌预警组织的一种标志物. 蒋鹏程等采用RT-PCR检测胃正常组织、腺瘤组织、不典型增生组织各20例及胃腺癌组织40例中RASSF1A及Cyclin D1 mRNA的表达, 并Western blot法检测RASSF1A蛋白表达. 结果显示RASSF1A的表达低于不典型增生、良性腺瘤及正常组织组, 认为二者联合检测能为胃癌的早期临床诊断和治疗提供有利的生物学信息.
本实验运用原位杂交法和免疫组织化学法分别在转录水平和蛋白水平检测hMLH1和RASSF1A的表达情况, 探讨二者与结直肠癌各项临床病理参数之间的关系, 并应用Cox回归模型和Kaplan-Meier生存曲线分析其与患者预后的关系, 为hMLH1和 RASSF1A成为判断食管癌生物学行为及预后的重要参考指标提供理论依据.
本实验证实了hMLH1和RASSF1A基因在食管癌组织中表达均较低, 其表达水平与食管肿瘤的发生发展有一定的关系, 结合临床病理可作为判断预后的指标, 为食管癌的治疗提供新的思路及理论依据.
本文设计合理, 结论明确, 但科学性一般.
编辑: 曹丽鸥 电编:何基才
| 1. | Jenkins TD, Friedman LS. Adenocarcinoma of the esophagogastric junction. Dig Dis. 1999;17:153-162. [PubMed] [DOI] |
| 2. | Zhang H, Chen SH, Li YM. Epidemiological investigation of esophageal carcinoma. World J Gastroenterol. 2004;10:1834-1835. [PubMed] |
| 3. | Bahnassy AA, Zekri AR, Madbouly MS, El-Naggar M, El-Khelany ZF, El-Merzebany MM. The correlation between FHIT, P53 and MMR genes in human papillomavirus-associated cervical carcinoma. J Egypt Natl Canc Inst. 2006;18:191-202. [PubMed] |
| 4. | Brim H, Mokarram P, Naghibalhossaini F, Saberi-Firoozi M, Al-Mandhari M, Al-Mawaly K, Al-Mjeni R, Al-Sayegh A, Raeburn S, Lee E. Impact of BRAF, MLH1 on the incidence of microsatellite instability high colorectal cancer in populations based study. Mol Cancer. 2008;7:68. [PubMed] [DOI] |
| 5. | Dammann R, Li C, Yoon JH, Chin PL, Bates S, Pfeifer GP. Epigenetic inactivation of a RAS association domain family protein from the lung tumour suppressor locus 3p21.3. Nat Genet. 2000;25:315-319. [PubMed] [DOI] |
| 6. | Hamilton DW, Lusher ME, Lindsey JC, Ellison DW, Clifford SC. Epigenetic inactivation of the RASSF1A tumour suppressor gene in ependymoma. Cancer Lett. 2005;227:75-81. [PubMed] [DOI] |
| 7. | Hesson LB, Cooper WN, Latif F. The role of RASSF1A methylation in cancer. Dis Markers. 2007;23:73-87. [PubMed] |
| 8. | Jacob S, Praz F. DNA mismatch repair defects: role in colorectal carcinogenesis. Biochimie. 2002;84:27-47. [PubMed] [DOI] |
| 9. | Kulke MH, Thakore KS, Thomas G, Wang H, Loda M, Eng C, Odze RD. Microsatellite instability and hMLH1/hMSH2 expression in Barrett esophagus-associated adenocarcinoma. Cancer. 2001;91:1451-1457. [PubMed] [DOI] |
| 10. | Jackson T, Ahmed MA, Seth R, Jackson D, Ilyas M. MLH1 function is context dependent in colorectal cancers. J Clin Pathol. 2011;64:141-145. [PubMed] [DOI] |
| 12. | Cai YC, So CK, Nie AY, Song Y, Yang GY, Wang LD, Zhao X, Kinzy TG, Yang CS. Characterization of genetic alteration patterns in human esophageal squamous cell carcinoma using selected microsatellite markers spanning multiple loci. Int J Oncol. 2007;30:1059-1067. [PubMed] |
| 13. | 刘 复兴, 王 明荣, 徐 晰. 食管鳞癌MLH1基因杂合性丢失分析. 咸宁学院学报(医学版). 2005;19:458-460. |
| 14. | Murata H, Khattar NH, Kang Y, Gu L, Li GM. Genetic and epigenetic modification of mismatch repair genes hMSH2 and hMLH1 in sporadic breast cancer with microsatellite instability. Oncogene. 2002;21:5696-5703. [PubMed] [DOI] |
| 15. | Lu C, Xie H, Wang F, Shen H, Wang J. Diet folate, DNA methylation and genetic polymorphisms of MTHFR C677T in association with the prognosis of esophageal squamous cell carcinoma. BMC Cancer. 2011;11:91. [PubMed] [DOI] |
| 16. | Vasavi M, Kiran V, Ravishankar B, Prabhakar B, Ahuja YR, Hasan Q. Microsatellite instability analysis and its correlation with hMLH1 repair gene hypermethylation status in esophageal pathologies including cancers. Cancer Biomark. 2010;7:1-10. [PubMed] |
| 17. | 卜 献民, 赵 成海, 张 宁, 林 帅, 高 峰, 戴 显伟. 胰腺癌组织和细胞系中DNA错配修复基因的甲基化和异常表达. 世界华人消化杂志. 2008;16:1074-1077. [DOI] |
| 19. | 张 军航, 刘 顺寿, 刘 德贵, 玉 寒冰, 魏 舜, 赵 翔, 王 伟, 王 征, 黄 雁峰, 马 琳. hMLH1基因在食管癌组织中的表达及临床意义. 实用肿瘤学杂志. 2001;15:173-174. |
| 22. | Yoo YA, Na AR, Lee MS, Yoon S, Kim JS, Yoo YD. RASSF1A suppresses oncogenic H-Ras-induced c-Jun N-terminal kinase activation. Int J Oncol. 2006;29:1541-1547. [PubMed] |
| 23. | Song MS, Chang JS, Song SJ, Yang TH, Lee H, Lim DS. The centrosomal protein RAS association domain family protein 1A (RASSF1A)-binding protein 1 regulates mitotic progression by recruiting RASSF1A to spindle poles. J Biol Chem. 2005;280:3920-3927. [PubMed] [DOI] |
| 24. | Pijnenborg JM, Dam-de Veen GC, Kisters N, Delvoux B, van Engeland M, Herman JG, Groothuis PG. RASSF1A methylation and K-ras and B-raf mutations and recurrent endometrial cancer. Ann Oncol. 2007;18:491-497. [PubMed] [DOI] |
| 27. | 陈 雅慧, 兰 忠平, 惠 起源, 李 宝莉, 杨 彦玲. RASSF1A与CyclinD1在胃黏膜病变组织中表达及二者的关系. 世界华人消化杂志. 2008;16:2604-2609. [DOI] |
| 29. | Lo PH, Xie D, Chan KC, Xu FP, Kuzmin I, Lerman MI, Law S, Chua D, Sham J, Lung ML. Reduced expression of RASSF1A in esophageal and nasopharyngeal carcinomas significantly correlates with tumor stage. Cancer Lett. 2007;257:199-205. [PubMed] [DOI] |
| 30. | Zhang TW, Wang SF, Cong DG, Fu SB, Meng XN, Yu L, Wang J. [Suppression of RASSF1A gene on human esophageal carcinoma cells: experiments in vitro and in vivo]. Zhonghua Yixue Zazhi. 2007;87:1214-1216. [PubMed] |
| 31. | Cong DG, Wang SF, Zhang TW. [mRNA expression of RASSF1A in esophageal squamous cell carcinoma and clinical significance thereof]. Zhonghua Yixue Zazhi. 2006;86:1624-1627. [PubMed] |