修回日期: 2011-04-14
接受日期: 2011-04-26
在线出版日期: 2011-05-08
目的: 探讨运用RNAi技术沉默Bmi-1基因对人胰腺癌细胞恶性行为的影响, 为胰腺癌基因治疗提供新的靶点和思路.
方法: 构建反义Bmi-1真核表达载体转染人胰腺癌PANC-1细胞, 运用荧光显微镜下观察、MTT、Western blot、流式细胞术检测转染效果及细胞周期、凋亡变化.
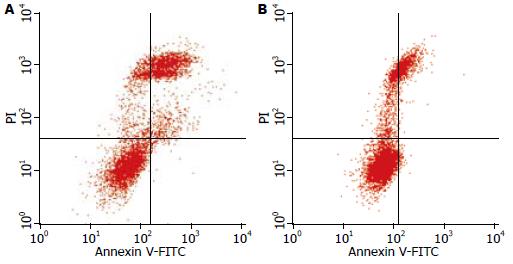
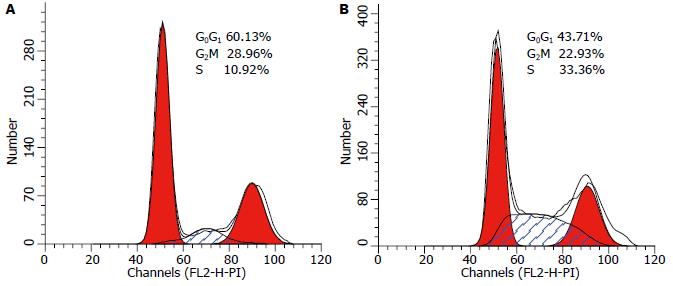
结果: 成功构建反义Bmi-1真核表达载体并且转染后细胞Bmi-1表达明显下降(175.39±1.76 vs 318.54±3.53, P<0.05), 实验组细胞与对照组相比, 增殖受到抑制, 周期出现阻滞(G0/G1: 60.480%±1.545% vs 40.520%±2.865%; S: 12.68%±2.654% vs 35.740%±2.074%, 均P<0.05), 凋亡明显增加(21.670%±2.948% vs 7.870%±0.900%, P<0.05).
结论: Bmi-1的siRNA能明显抑制Bmi-1的表达, 抑制细胞增殖, 促进细胞凋亡. Bmi-1可作为胰腺癌基因治疗的靶点.
引文著录: 冷政伟, 殷涛, 夏清华, 张万里, 王国斌, 陶凯雄. siRNA沉默Bmi-1表达对胰腺癌PANC-1细胞增殖的抑制作用. 世界华人消化杂志 2011; 19(13): 1342-1346
Revised: April 14, 2011
Accepted: April 26, 2011
Published online: May 8, 2011
AIM: To investigate the impact of knockdown of the B-cell specific Moloney leukemia virus insertion site 1 (Bmi-1) gene on the biological behavior of human pancreatic cancer cells.
METHODS: An expression vector carrying a small interference RNA (siRNA) targeting the Bmi-1 gene was constructed and transfected into human pancreatic cancer PANC-1 cells. After transfection, Bmi-1 protein expression was detected by Western blot; cell proliferation was evaluated by MTT assay; and cell cycle progression and apoptosis were examined by flow cytometry.
RESULTS: PANC-1 cells transfected with the recombinant vector had more significant cell cycle arrest (G0/G1 phase: 60.480% ± 1.545% vs 40.520% ± 2.865%; S phase: 35.740% ± 2.074% vs 12.68% ± 2.654%), increased apoptosis (21.670% ± 2.948% vs 7.870% ± 0.900%), and decreased Bmi-1 expression (175.39 ± 1.76 vs 318.54 ± 3.53, P < 0.05) compared to control cells.
CONCLUSION: SiRNA-mediated down-regulation of Bmi-1 expression induces cell cycle arrest and increases apoptosis in PANC-1 cells. Bmi-1 might serve as a target for gene therapy of pancreatic cancer.
- Citation: Leng ZW, Yin T, Xia QH, Zhang WL, Wang GB, Tao KX. SiRNA-mediated down-regulation of Bmi-1 expression inhibits proliferation of human pancreatic cancer PANC-1 cells. Shijie Huaren Xiaohua Zazhi 2011; 19(13): 1342-1346
- URL: https://www.wjgnet.com/1009-3079/full/v19/i13/1342.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i13.1342
肿瘤的发生发展是多基因多步骤参与的结果, B细胞特异性莫洛尼氏白血病毒插入位点1(B-cell specific moloney leukemia virus insertion site 1, Bmi-1)属于PcG(polycomb group)家族, 参与了细胞DNA损伤修复、细胞周期和凋亡调控等行为. 近年来研究发现Bmi-1在肝癌、肺癌、结肠癌、淋巴瘤胰腺癌等多种肿瘤中高表达, 提示Bmi-1在肿瘤发生发展以及基因治疗等方面可能具有重要作用, 而有望成为肿瘤基因治疗重要的靶点, 引起了学者的广泛关注. RNA干扰(RNA interference, RNAi)技术是近年来迅速发展起来的基因沉默技术, 通过合成与靶基因同源的小干扰RNA(small interference RNA, siRNA)并转染入细胞, 导致靶基因mRNA的降解而达到基因沉默的效果, 在肿瘤基因治疗中已被广泛运用. 我们通过该技术转染Bmi-1 siRNA入胰腺癌PANC-1细胞中, 并观察对其细胞恶性生物学行为的影响.
人胰腺癌PANC-1细胞株由本实验室提供; 细胞凋亡检测试剂盒(凯基, 中国); Mouse Bmi-1 antibody(Santa, sc-81201); Mouse GAPDH antibody(ProMab, Mab-2005079); Goat Anti Mouse IgG/HRP等.
1.2.1 siRNA的设计合成: 由上海吉凯基因技术有限公司合成; 根据Bmi-1的编码序列设计并合成靶向沉默Bmi-1的siRNA序列5'-ATGAAGAGAAGAAGGGATT-3', 5'-AATGGACATACCTAATACT-3', 将其克隆至慢病毒载体pSuper-retro, 构建编码Bmi-1 siRNA的病毒载体pSuper-retro-Bmi-1对照组为pSuper-retro-GFP载体.
1.2.2 细胞培养及转染: 取对数生长期细胞, 在生物安全柜中严格按照转染说明书操作. 取MOI = 60, 转染48 h后观察细胞无明显异常后进行后续实验.
1.2.3 MTT检测细胞增殖: 取1 000个细胞干扰48 h后每孔加入20 μL MTT溶液(5 g/L, 即0.5% MTT), 继续培养4 h. 终止培养, 小心吸去孔内培养液, 每孔加入150 μL DMSO, 使结晶物充分溶解. 在490 nm处测量各孔的A值, 分别以转染时间、A值为横、纵坐标, 绘制细胞生长曲线.
1.2.4 Western blot检测Bmi-1的蛋白表达: 用RIPA提取液提取靶细胞中的蛋白质后行SDS-PAGE电泳, 免疫印迹-转膜, 一抗与蛋白质结合, 酶标记的二抗与一抗结合, 最后化学发光得到条带.
1.2.5 流式细胞术: 消化收集细胞加入300 μL binding buffer悬浮细胞, 加入3 μL Annexin V-APC混匀后加入3 μL PI混匀, 室温避光反应15 min, 1 h内检测细胞凋亡情况. 收集细胞, 加0.6 mL PBS液重悬细胞, 再加1.4 mL冰无水乙醇涡旋, 使细胞分散, 然后置4 ℃过夜, PBS洗1次细胞后收集, 加入264 μL PBS重悬细胞, 混匀, 再加入PI(10×)30 μL以及RNA酶(50×)6 μL, 总体积为300 μL, 常温避光反应10 min, 30 min内检测细胞周期.
统计学处理 所有实验重复3次, Western blot 条带以Gel pro4.0版凝胶吸光度分析软件进行分析, 测其IA值. 所有结果用SPSS11.0软件行t检验, 取P<0.05有统计学意义.
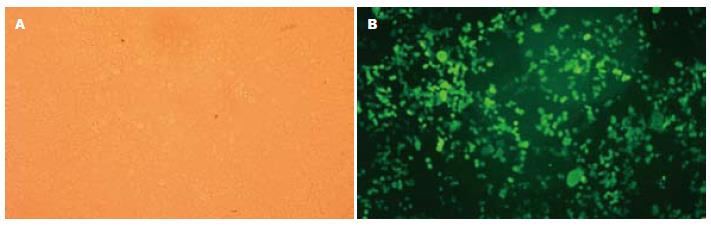
转染48 h后各组细胞形态良好, 转染后细胞没有出现明显不良反应, 细胞转染率较高, 能满足实验要求(图1).
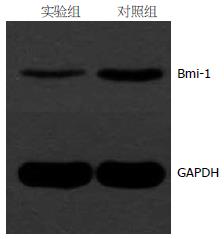
干扰后Bmi-1蛋白有明显的下降(175.39±1.76 vs 318.54±3.53, P<0.05, 图2).
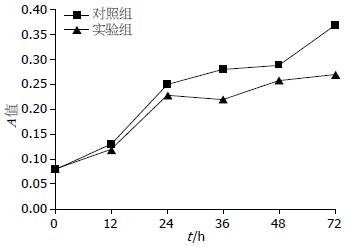
转染后PANC-1细胞在对数生长期(12-36 h)的增殖受到明显抑制, 且在36-72 h之间转染细胞的增殖仍然被抑制(图3). 提示在转染后细胞近、远期增殖能力减弱.
胰腺癌是消化系统高度恶性的肿瘤, 其5年生存率极低[1,2]. 寻求对胰腺癌的基因靶向治疗已经成为了研究热点. 随着研究的不断深入, 近年来有观点认为胰腺癌起源于肿瘤干细胞[3-5]. 干细胞在增殖、多向分化、衰老、凋亡过程中都有严格的调控机制, 在细胞生长过程中这些机制紊乱可以导致肿瘤的发生. 研究显示肿瘤细胞的增殖与干细胞的自我更新过程可能由相同的信号通路所调控[6]. 原癌基因Bmi-1参与沉默与细胞衰老、凋亡、死亡相关的基因, 参与了干细胞的增殖、分化与衰老[7], 被认为与肿瘤的发生发展有着密切的联系. 目前Bmi-1的研究主要集中在两个方面: (1)维持干细胞分化功能和抗凋亡作用: 如在造血干细胞[8]、神经干细胞中就高表达Bmi-1, 缺乏Bmi-1的鼠出生后在造血功能, 骨骼形成, 神经系统功能等方面表现出缺陷. Fasano等[9]已经证实了Bmi-1在维持神经干细胞功能方面的作用. Cordisco等[10]证实由于Bmi-1的下调细胞衰老明显增加. 研究人员发现在小鼠乳腺上皮细胞的发育过程中, Bmi-1也起非常重要的作用[11]. 以上研究显示了Bmi-1在维持干细胞正常功能中的重要作用, 则在同样属于干细胞的肿瘤干细胞中Bmi-1是否也扮演了重要角色呢? Bmi-1在肿瘤细胞中有什么作用? 与肿瘤的耐药、复发、远处转移等有何相关性? 近年来, 在该领域的研究取得了一定的进展; (2)促进肿瘤的恶性生物学行为: 最初发现Bmi-1可与c-Myc癌基因协同在鼠淋巴瘤的发生过程中发挥作用[12]. 而后, 越来越多的研究显示Bmi-1高表达于包括胰腺癌在内的诸多恶性肿瘤中. Song等[13]研究提示Bmi-1在胰腺癌手术标本及PANC-1细胞中高表达, 并且Bmi-1的高表达与淋巴转移及生存率负相关. 另一组相关研究也证实了胰腺癌高表达Bmi-1[14]. 所以我们选择在胰腺癌PANC-1细胞中靶向下调Bmi-1的表达进行进一步的研究. 有资料显示Bmi-1下调后肿瘤的分化、克隆形成能力和转移能力大大削弱[15,16]. Wang等[17]还发现Bmi-1参与了HaCaT细胞的恶性转化过程. Xiao等[18]运用RNAi技术成功下调Bmi-1表达, 而使胃癌细胞生长和侵袭能力减弱. Bmi-1还参与了鼻咽癌细胞抗凋亡的过程[19]. Becker等[20]在小鼠肺癌模型中发现由Bmi-1下调导致了P16INK4a与p19ARF(人类为P14ARF)上调, 从而影响了肿瘤中细胞的死亡和细胞周期. 我们在干扰PANC-1细胞的Bmi-1表达后发现: Bmi-1蛋白表达在该细胞中明显受到抑制(P<0.05). 基因多是通过其编码的蛋白质发挥功能, 实验显示我们已经在蛋白质水平下调了Bmi-1的表达, Bmi-1的功能已经受到抑制, 而被转染的PANC-1细胞的恶性生物学行为将被削弱, 这一观点在后续实验中得到了证实. 同时, MTT及流式细胞术结果显示: 沉默Bmi-1后细胞晚期凋亡比例由7.870%±0.900%上升到21.670%±2.948%, 具有统计学差异(P<0.05). 细胞的G0G1和S期阻滞也非常明显(P<0.05), 提示沉默Bmi-1确实能够降低肿瘤细胞恶性生物学行为, 与现有相关报道结果相符.
另外, 还有研究证实Bmi-1参与了细胞的恶性转化过程, Bmi-1的上调可以抑制P16INK4a, 延长多种细胞的生存期[21]. 过度表达Bmi-1还可以上调人端粒逆转录酶的转录水平, 导致端粒酶活性增高, 阻止细胞的衰老、凋亡使其永生化[22]. Bmi-1促进肝脏干细胞的分化, 同时又参与了他的恶性转化[23]. 还有资料表明: Bmi-1导致了人鼻咽部上皮细胞的恶性转化[24]. 已有实验表明Bmi-1与肿瘤的侵袭性、远处转移、复发等密切相关[13]. Bmi-1的临床价值已经在胃癌、卵巢癌、食管癌等多种肿瘤中得到肯定[16,25-27].
siRNA是一种双链短RNA分子, 能以同源互补序列的mRNA为目标降解特定的mRNA, 从而沉默特定基因, 这种基因沉默机制被称为RNAi[28]. 目前RNAi技术成为人为改变基因表达强有力的武器, RNA干扰技术已经广泛运用于细胞信号传导、基因功能学、抗肿瘤等方面的研究. 近年来, 运用相关技术将siRNA成功转入了活体, 人们期待该技术能够成为治疗包括肿瘤在内的多种疾病强有力的手段. 当然, 由于RNAi技术还不成熟, 有些方面还处于探索阶段, 所以目前也存在诸多挑战如安全性、转染效率、给药途径及药物载体、毒性、近期及远期负面效应等. 但是随着理论、实验技术、方法、设备的不断改进, RNAi技术必然愈加成熟, 目前已有运用该技术成功抑制多种基因表达的实验报道[29-31].
在本实验中, 我们采用RNAi技术在胰腺癌PANC-1细胞中靶向下调了Bmi-1基因的表达并观察细胞恶性生物学行为的变化, 结果显示: Bmi-1的沉默可以导致细胞增殖抑制、凋亡增加和周期阻滞, 与其他相关实验结果吻合, 也提示Bmi-1可以作为肿瘤基因治疗的靶点以及肿瘤的诊断和预后指标.
最初发现Bmi-1基因参与了胚胎发育、干细胞功能的维持和抗凋亡作用, 进一步研究显示其在多种肿瘤中高表达, 且高表达Bmi-1与肿瘤的耐药、淋巴转移、生存率负相关, 提示该基因在肿瘤的发生发展过程中发挥重要的调控作用. 以此为线索, 研究发现Bmi-1基因可以促进肿瘤细胞的耐药、增殖、克隆形成等恶性生物学行为, 并且参与了正常细胞的恶性转化. 以上研究提示Bmi-1可以作为肿瘤基因治疗的靶点以及肿瘤的诊断和预后指标.
房林, 副教授, 同济大学附属上海市第十人民医院普外科
胰腺癌是消化系统高度恶性的肿瘤, 其5年生存率极低. 寻求对胰腺癌的基因靶向治疗已经成为了研究热点.
Xiao等运用RNAi技术成功下调Bmi-1表达, 而使胃癌细胞生长和侵袭能力减弱.
Bmi-1的siRNA能明显抑制Bmi-1的表达, 抑制细胞增殖, 促进细胞凋亡. Bmi-1可作为胰腺癌基因治疗的靶点.
本文选题较好, 方法恰当, 思路清晰, 对临床有一定的实用价值.
编辑: 曹丽鸥 电编:何基才
| 1. | Jemal A, Siegel R, Ward E, Hao Y, Xu J, Murray T, Thun MJ. Cancer statistics, 2008. CA Cancer J Clin. 2008;58:71-96. [PubMed] [DOI] |
| 2. | Wang L, Yang GH, Lu XH, Huang ZJ, Li H. Pancreatic cancer mortality in China (1991-2000). World J Gastroenterol. 2003;9:1819-1823. [PubMed] |
| 4. | Rasheed Z, Wang Q, Matsui W. Isolation of stem cells from human pancreatic cancer xenografts. J Vis Exp. 2010;26:pii: 2169. [PubMed] |
| 5. | Lonardo E, Hermann PC, Heeschen C. Pancreatic cancer stem cells - update and future perspectives. Mol Oncol. 2010;4:431-442. [PubMed] [DOI] |
| 6. | Pardal R, Molofsky AV, He S, Morrison SJ. Stem cell self-renewal and cancer cell proliferation are regulated by common networks that balance the activation of proto-oncogenes and tumor suppressors. Cold Spring Harb Symp Quant Biol. 2005;70:177-185. [PubMed] [DOI] |
| 7. | Boyer LA, Plath K, Zeitlinger J, Brambrink T, Medeiros LA, Lee TI, Levine SS, Wernig M, Tajonar A, Ray MK. Polycomb complexes repress developmental regulators in murine embryonic stem cells. Nature. 2006;441:349-353. [PubMed] [DOI] |
| 8. | Gong H, Zhang YC, Liu WL. [Regulatory effects of Bmi-1 gene on self-renewal of hematopoietic stem cells--review]. Zhongguo Shiyan Xueyexue Zazhi. 2006;14:413-415. [PubMed] |
| 9. | Fasano CA, Phoenix TN, Kokovay E, Lowry N, Elkabetz Y, Dimos JT, Lemischka IR, Studer L, Temple S. Bmi-1 cooperates with Foxg1 to maintain neural stem cell self-renewal in the forebrain. Genes Dev. 2009;23:561-574. [PubMed] [DOI] |
| 10. | Cordisco S, Maurelli R, Bondanza S, Stefanini M, Zambruno G, Guerra L, Dellambra E. Bmi-1 reduction plays a key role in physiological and premature aging of primary human keratinocytes. J Invest Dermatol. 2010;130:1048-1062. [PubMed] [DOI] |
| 11. | Pietersen AM, Evers B, Prasad AA, Tanger E, Cornelissen-Steijger P, Jonkers J, van Lohuizen M. Bmi1 regulates stem cells and proliferation and differentiation of committed cells in mammary epithelium. Curr Biol. 2008;18:1094-1099. [PubMed] [DOI] |
| 12. | Jacobs JJ, Scheijen B, Voncken JW, Kieboom K, Berns A, van Lohuizen M. Bmi-1 collaborates with c-Myc in tumorigenesis by inhibiting c-Myc-induced apoptosis via INK4a/ARF. Genes Dev. 1999;13:2678-2690. [PubMed] [DOI] |
| 13. | Song W, Tao K, Li H, Jin C, Song Z, Li J, Shi H, Li X, Dang Z, Dou K. Bmi-1 is related to proliferation, survival and poor prognosis in pancreatic cancer. Cancer Sci. 2010;101:1754-1760. [PubMed] [DOI] |
| 14. | Martínez-Romero C, Rooman I, Skoudy A, Guerra C, Molero X, González A, Iglesias M, Lobato T, Bosch A, Barbacid M. The epigenetic regulators Bmi1 and Ring1B are differentially regulated in pancreatitis and pancreatic ductal adenocarcinoma. J Pathol. 2009;219:205-213. [PubMed] [DOI] |
| 15. | Jiang Y, Su B, Meng X, Liu C, Liu B, Liu D, Fan Y, Yang H. Effect of siRNA-mediated silencing of Bmi-1 gene expression on HeLa cells. Cancer Sci. 2010;101:379-386. [PubMed] [DOI] |
| 16. | Li W, Li Y, Tan Y, Ma K, Cui J. Bmi-1 is critical for the proliferation and invasiveness of gastric carcinoma cells. J Gastroenterol Hepatol. 2010;25:568-575. [PubMed] [DOI] |
| 17. | Wang Q, Li WL, You P, Su J, Zhu MH, Xie DF, Zhu HY, He ZY, Li JX, Ding XY. Oncoprotein BMI-1 induces the malignant transformation of HaCaT cells. J Cell Biochem. 2009;106:16-24. [PubMed] [DOI] |
| 18. | Xiao J, Deng C. Knockdown of Bmi-1 impairs growth and invasiveness of human gastric carcinoma cells. Oncol Res. 2009;17:613-620. [PubMed] [DOI] |
| 19. | Qin L, Zhang X, Zhang L, Feng Y, Weng GX, Li MZ, Kong QL, Qian CN, Zeng YX, Zeng MS. Downregulation of BMI-1 enhances 5-fluorouracil-induced apoptosis in nasopharyngeal carcinoma cells. Biochem Biophys Res Commun. 2008;371:531-535. [PubMed] [DOI] |
| 20. | Becker M, Korn C, Sienerth AR, Voswinckel R, Luetkenhaus K, Ceteci F, Rapp UR. Polycomb group protein Bmi1 is required for growth of RAF driven non-small-cell lung cancer. PLoS One. 2009;4:e4230. [PubMed] [DOI] |
| 21. | Haga K, Ohno S, Yugawa T, Narisawa-Saito M, Fujita M, Sakamoto M, Galloway DA, Kiyono T. Efficient immortalization of primary human cells by p16INK4a-specific short hairpin RNA or Bmi-1, combined with introduction of hTERT. Cancer Sci. 2007;98:147-154. [PubMed] [DOI] |
| 22. | Dimri GP, Martinez JL, Jacobs JJ, Keblusek P, Itahana K, Van Lohuizen M, Campisi J, Wazer DE, Band V. The Bmi-1 oncogene induces telomerase activity and immortalizes human mammary epithelial cells. Cancer Res. 2002;62:4736-4745. [PubMed] |
| 23. | Chiba T, Seki A, Aoki R, Ichikawa H, Negishi M, Miyagi S, Oguro H, Saraya A, Kamiya A, Nakauchi H. Bmi1 promotes hepatic stem cell expansion and tumorigenicity in both Ink4a/Arf-dependent and -independent manners in mice. Hepatology. 2010;52:1111-1123. [PubMed] [DOI] |
| 24. | Song LB, Zeng MS, Liao WT, Zhang L, Mo HY, Liu WL, Shao JY, Wu QL, Li MZ, Xia YF. Bmi-1 is a novel molecular marker of nasopharyngeal carcinoma progression and immortalizes primary human nasopharyngeal epithelial cells. Cancer Res. 2006;66:6225-6232. [PubMed] [DOI] |
| 25. | Liu WL, Guo XZ, Zhang LJ, Wang JY, Zhang G, Guan S, Chen YM, Kong QL, Xu LH, Li MZ. Prognostic relevance of Bmi-1 expression and autoantibodies in esophageal squamous cell carcinoma. BMC Cancer. 2010;10:467. [PubMed] [DOI] |
| 26. | Häyry V, Mäkinen LK, Atula T, Sariola H, Mäkitie A, Leivo I, Keski-Säntti H, Lundin J, Haglund C, Hagström J. Bmi-1 expression predicts prognosis in squamous cell carcinoma of the tongue. Br J Cancer. 2010;102:892-897. [PubMed] [DOI] |
| 27. | Yang GF, He WP, Cai MY, He LR, Luo JH, Deng HX, Guan XY, Zeng MS, Zeng YX, Xie D. Intensive expression of Bmi-1 is a new independent predictor of poor outcome in patients with ovarian carcinoma. BMC Cancer. 2010;10:133. [PubMed] [DOI] |
| 28. | Sibley CR, Seow Y, Wood MJ. Novel RNA-based strategies for therapeutic gene silencing. Mol Ther. 2010;18:466-476. [PubMed] [DOI] |
| 29. | Yuan W, Wu S, Guo J, Chen Z, Ge J, Yang P, Hu B, Chen Z. Silencing of TKTL1 by siRNA inhibits proliferation of human gastric cancer cells in vitro and in vivo. Cancer Biol Ther. 2010;9:710-716. [PubMed] [DOI] |
| 30. | Yu FJ, Dong PH, Fan XF, Lin Z, Chen YP, Li J. Down-regulation of angiotensin II by shRNA reduces collagen synthesis in hepatic stellate cells. Int J Mol Med. 2010;25:801-806. [PubMed] [DOI] |
| 31. | Dong P, Yu F, Fan X, Lin Z, Chen Y, Li J. Inhibition of ATIR by shRNA prevents collagen synthesis in hepatic stellate cells. Mol Cell Biochem. 2010;344:195-202. [PubMed] [DOI] |